肝细胞癌(hepatocellular carcinoma, HCC)在全球常见的癌症死亡原因中居第四位[1]。由于缺乏有效的早期检测手段和有力的治疗方案,导致肝细胞癌预后较差[2]。研究肝细胞癌的发病机制及侵袭转移过程,发现新的诊断和治疗靶点是现阶段的研究重点。
miRNA是一种具有组织特异性的、高度保守的、非蛋白质编码的小分子RNA[3]。miRNA可识别特异的靶基因, 且与其3’端非编码区(untranslated region, UTR)上结合位点结合,携带RNA诱导沉默复合物,达到抑制转录、切割或降解mRNA作用[4]。近年来,因为miRNA对基因表达的影响,在身体组织和体液中稳健存在的特性以及它们作为疾病生物标志物的潜在用途,miRNA已成为基础和转化医学研究的热门领域[5]。较多研究证明,miRNA在癌症中通过控制抑癌基因和原癌基因的表达来参与细胞增殖和凋亡的调节[6]。
上皮细胞-间充质转化(epithelial-mesenchymal transition, EMT)是上皮细胞去分化为间充质表型的一种多步骤的生物学过程。EMT是上皮细胞来源的恶性肿瘤细胞发生远处转移的重要驱动因素,而肝细胞是具有高度特化形态的上皮细胞[7]。因此,EMT在HCC肝内和肝外转移中起着关键作用[8]。在EMT期间,上皮形态的丧失表现为上皮标志物减少,这与HCC去分化一致[9]。在EMT过程中,中间细丝系统(K8、K18、K19)的黏附连接组分E-钙粘蛋白(E-cadherin)和细胞角蛋白表达减少,而间充质蛋白[如N-钙粘蛋白(N-cadherin)、α-平滑肌肌动蛋白(α-SMA)、成纤维细胞特异性蛋白(FSP-1)]和EMT转录因子(EMT-TFs)、锌指转录因子(nail)、Twist和E盒结合锌指蛋白(zinc finger E-box binding homeobox, ZEB)的表达增加[10]。
已有相关研究阐述了miR-576-5p对结直肠癌[11]、食管鳞状细胞癌[12]、胃癌细胞[13]在增殖、迁移、凋亡等恶行表型上的影响,但miR-576-5p对HCC细胞增殖、迁移和凋亡等方面的影响及其相关的分子机制尚不明确。本研究将通过检测27例肝细胞癌确诊患者的癌组织及其癌旁组织、正常人肝细胞和肝癌细胞株miR-576-5p的表达水平,统计分析miR-576-5p的表达水平和临床特征的关系。通过将SMMC-7721转染miR-576-5p inhibitor和hepG2转染miR-576-5p mimics,探讨其增殖、迁移和侵袭的影响以及对EMT的调控作用,为阐明肝细胞癌的发病机制和探索诊疗新靶点提供线索。
1 材料与方法 1.1 材料 1.1.1 临床样本从重庆医科大学附属第一医院肝胆外科2020年6月至2021年1月行肝癌切除术的27名手术患者中收集HCC样本及其配对癌旁组织,癌旁组织取肿瘤边缘>1 cm(远癌旁)范围的肝组织。所有患者病理诊断为肝细胞癌。在手术治疗前接受免疫治疗、化疗或放疗的患者被排除在外。该研究获得重庆医科大学第一附属医院伦理委员会的批准(2022-K85)。
1.1.2 试剂MiR-576-5p类似物、抑制剂及对应阴性对照均由广州锐博生物技术有限公司合成构建,TRIzol试剂、Mir-X miRNA First-Strand Synthesis和SYBR Green PCR试剂盒均购自日本TAKARA公司,CCK8试剂盒购自美国MCE公司,EDU试剂盒购自中国碧云天公司,0.8 μm Transwell小室购自美国corning公司,Matrigel(基底胶)购自美国BD公司,E-cadherin、N-cadherin和snail单克隆抗体购自中国武汉三鹰公司,胎牛血清购自以色列BI公司,DMEM培养基购自美国Gibco公司。
1.2 方法 1.2.1 细胞培养及转染所有细胞株由重庆医科大学传染病与寄生虫病学重点实验室购买和储存。细胞用90% DMEM高糖加10% FBS培养,于细胞孵箱生长(37 ℃,5% CO2)。取对数生长期细胞接种适量细胞数于6孔板,待其密度长至70%左右,按riboFECTTMCP Reagent说明书转染miRNA mimics/inhibitor和对应阴性对照。SMMC-7721转染miR-576-5p抑制剂/阴性对照(miR-576-5p inhibitor/ inhibitor NC)作为去表达组及其对照组;hepG2转染miR-576-5p类似物/阴性对照(miR-576-5p mimics/ mimics NC)作为过表达组及其对照组。
1.2.2 RT-qPCR采用TRIzol试剂提取各组细胞总RNA,取1 μg按照Mir-X miRNA First-Strand Synthesis反转录试剂盒(加尾法)操作手册反转录合成cDNA。采用SYBR Green PCR试剂盒进行RT-qPCR,U6 snRNA作为内参,反应条件为: 95 ℃ 10 min, 95 ℃ 5 s,60 ℃ 20 s,40个循环,95 ℃ 60 s,55 ℃ 30 s,95 ℃ 30 s。每个样品做3个复孔,反应结束后,采用2-ΔΔCt法计算并分析实验结果,扩增引物见表 1。
| 引物名称 | 序列(5′→3′) |
| mir-576-5p特异引物 | GCGCGATTCTAATTTCTCCACGTCTTT |
| 反向:U6 | TGGAACGCTTCACGAATTTGCG |
| 正向:U6 | GGAACGATACAGAGAAGATTAGC |
1.2.3 CCK-8
将SMMC-7721按miR-576-5p inhibitor、inhibitor NC,hepG2按mimics、mimics NC分组种入96孔板中,在37 ℃、5% CO2孵箱中培养24 h,将培养板取出,在每个孔中添加10 μL CCK-8试剂,培养1 h。在波长450 nm下,酶标仪检测每个孔的D(450)值。
1.2.4 EDU配置EDU工作液:按说明书用培养基1∶500稀释EDU试剂;在每孔中按1∶1加入原有培养基和EDU工作液。孵箱孵育2 h后,用4%多聚甲醛在常温下固定15 min;洗涤3次;加入适量通透液,室温下孵育20 min;洗涤2次;每孔加入200 μL按使用说明配制click反应液, 避光下室温孵育30 min;洗涤3次。用荧光显微镜观察拍照, Image J软件测定平均荧光强度。
1.2.5 划痕实验用记号笔在6孔板后,均匀画5条横线;将适量细胞接种至6孔板,按分组进行转染;待其长满,用10 μL枪头垂直于画线划痕;PBS液洗3次,无血清培养基继续培养,用显微镜拍照。孵箱培养24 h后再次拍照,Image J软件测量划痕面积,计算伤口愈合比。
1.2.6 Transwell法检测细胞侵袭和迁移能力Transwell迁移实验:胰酶消化已转染满24 h的细胞,离心后用无血清培养基重悬,计数,稀释细胞悬液至合适浓度。每个小室上层加入100 μL细胞悬液,下层加入600 μL完全培养基,细胞孵箱中孵育24 h。拿出小室吸干液体,在甲醛中固定30 min,0.1%结晶紫染色20 min,PBS缓冲液清洗两遍,擦净小室上层细胞。用显微镜拍照观察,Image J软件计数。
Transwell侵袭实验:无血清培养基以1∶8的比例稀释Matrigel基质胶,铺被至小室中, 其余步骤同Transwell迁移实验相同。
1.2.7 Western blot检测E-Cadherin、N-Cadherin、Snail蛋白表达加入适量RIPA裂解液处理3~5 min,细胞刮刀将细胞刮到EP管中;冰上吹打,裂解反应30 min;4 ℃ 12 000 r/min离心10 min,收集上清总蛋白液入。依照BCA蛋白测定试剂盒操作说明检测蛋白浓度。5×蛋白上样缓冲液与蛋白溶液按1∶4混合,100 ℃恒温变性15 min。制胶,上样电泳,待溴酚蓝出现终止电泳。转膜;脱脂牛奶封闭30 min;分别加入E-cadherin(1∶1 000)、N-cadherin(1∶1 000)、snail(1∶1 000) 和actin(1∶2 000)一抗,4 ℃下摇床过夜;洗膜,室温孵育稀释二抗30 min;TBST洗膜3次。避光将ECL化学发光液加入显影剂显影。Image J软件分析条带的灰度值,计算蛋白表达水平。
1.3 统计学分析计量资料均以x±s表示,采用GraphPad Prism 9.0软件进行统计学分析,两两配对比较采用配对t检验,两组间比较采用t检验,检验水准α=0.05。
2 结果 2.1 miR-576-5p在HCC组织和肝癌细胞中表达下调RT-qPCR检测发现癌旁组织较肝癌组织表达量著升高(P < 0.001,图 1)。27例患者标本的miR-576-5p表达量在年龄、性别、分化程度、有无乙肝、有无肝硬化、有无肿瘤远处转移、有无微血管管癌栓(microvascular invasion,MVI)等方面无显著性差异,但在肿瘤大小、肿瘤个数方面均有明显差异(P < 0.05,P < 0.001,表 2)。运用PCR技术检测正常人肝细胞MIHA和4种肝癌细胞株hepG2、SMMC-7721、hep3B、Huh-7中miR-576-5p的表达,miR-576-5p在MIHA中表达水平较高,肝癌细胞系中表达显著降低(P < 0.001,图 1B)。在肝癌细胞系中SMMC-7721表达量较高,hepG2表达量较低,后续体外实验将SMMC-7721去表达miR-576-5p,而hepG2过表达miR-576-5p。
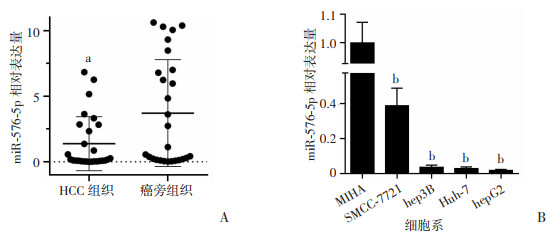
|
| A: 通过RT-qPCR检测miR-576-5p在27组成对的HCC组织中的表达(n=27);B: RT-qPCR检测miR-576-5p在MIHA细胞和HCC细胞系中的表达(n=5) a: P < 0.001,与癌旁组织组比较; b:P < 0.001,与MIHA细胞比较 图 1 miR-576-5p在HCC组织和细胞系中的表达(x±s) |
| 临床特征 | n | miR-576-5p 相对表达量 |
P |
| 组织 | 0.001 | ||
| 癌旁组织 | 27 | 3.708±4.066 | |
| 癌组织 | 27 | 1.384±2.053 | |
| 性别 | 0.686 | ||
| 男 | 23 | 1.199±1.858 | |
| 女 | 4 | 0.797±1.494 | |
| 年龄/岁 | 0.513 | ||
| ≤60 | 18 | 0.976±1.269 | |
| >60 | 9 | 1.466±2.607 | |
| 肿瘤大小/cm | 0.024 | ||
| < 5 | 15 | 1.784±2.141 | |
| ≥5 | 12 | 0.333±0.672 | |
| 分化程度 | 0.455 | ||
| 中 | 22 | 1.163±1.890 | |
| 低 | 5 | 0.197±0.164 | |
| 肿瘤数/个 | 0.000 | ||
| 1 | 21 | 1.454±1.921 | |
| ≥2 | 6 | 0.039±0.037 | |
| 乙肝 | 0.296 | ||
| 无 | 7 | 2.049±2.774 | |
| 有 | 20 | 0.821±1.240 | |
| 肝硬化 | 0.415 | ||
| 无 | 11 | 2.920±3.803 | |
| 有 | 16 | 4.250±4.272 | |
| 转移 | 0.101 | ||
| 无 | 22 | 0.658±1.101 | |
| 有 | 5 | 3.259±2.746 | |
| 微血管管癌栓 | 0.931 | ||
| 无 | 14 | 1.110±1.637 | |
| 有 | 13 | 1.171±2.006 |
2.2 miR-576-5p在肝癌细胞中抑制增殖
CCK-8实验结果表明,SMMC-7721 inhibitor组比inhibitor NC组D(450)值明显增大(P < 0.001),而hepG2 mimics组,与mimics NC组比较,D(450)值显著减低(P < 0.01,图 2A)。EDU细胞增殖实验后,荧光强度测量结果进一步验证了CCK-8的实验结果,揭示了miR-576-5p对肝癌细胞增殖的抑制作用(图 2B、C)。
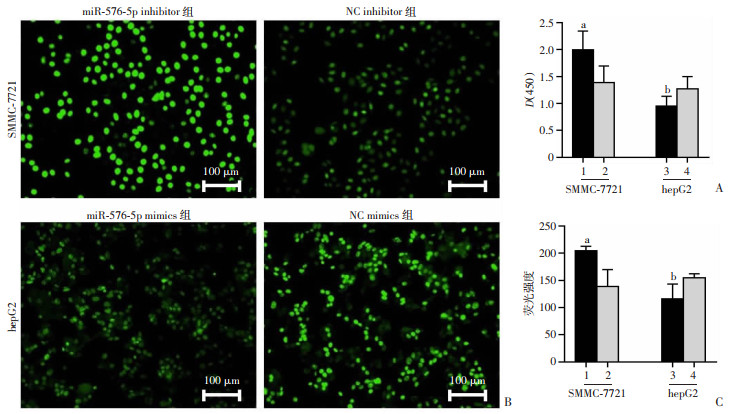
|
| A: CCK-8检测miR-576-5p对SMCC-7721和对hepG2细胞增殖能力的影响;B: EDU实验检测miR-576-5p对SMCC-7721和hepG2增殖能力的影响;C: 各组荧光强度对比 1: miR-576-5p inhibitor组; 2: inhibitor NC组; 3: miR-576-5p mimics组; 4: mimics NC组; a:P < 0.001, 与inhibitor NC组比较;b:P < 0.01,与mimics NC组比较 图 2 miR-576-5p在HCC细胞增殖中的抑制作用(n=4,x±s) |
2.3 miR-576-5p在肝癌细胞中抑制迁移和侵袭
划痕实验结果可见,划痕24 h时SMMC-7721 inhibitor组伤口愈合比显著强于inhibitor NC组(P < 0.001),同时hepG2 mimics组伤口愈合比低于mimics NC组(P < 0.01,图 3), 提示miR-576-5P对肝癌细胞迁移有抑制作用。Transwell迁移/侵袭实验中SMMC-7721 inhibitor组细胞穿孔数均明显多于inhibitor NC组(P < 0.001,P < 0.01),而hepG2 mimics组细胞穿孔数均明显少于mimics NC组(P < 0.001,P < 0.01,图 4),进一步验证了miR-576-5p对HCC细胞迁移侵袭的抑制作用。
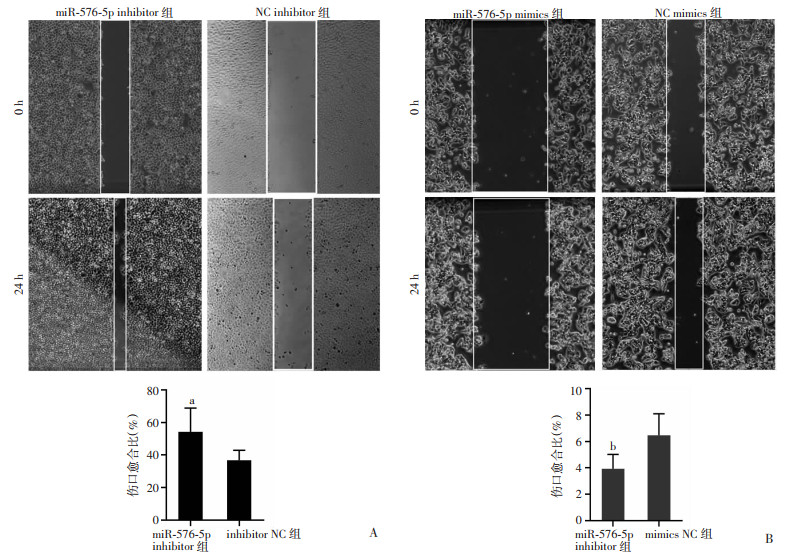
|
| A: 划痕实验检测miR-576-5p去表达对SMCC-7721细胞迁移能力的影响;B: 划痕实验检测miR-576-5p过表达对hepG2细胞迁移能力的影响 a: P < 0.001, 与inhibitor NC组比较; b: P < 0.001,与mimics NC组比较 图 3 miR-576-5p在HCC细胞迁移中的抑制作用(n=2,x±s) |
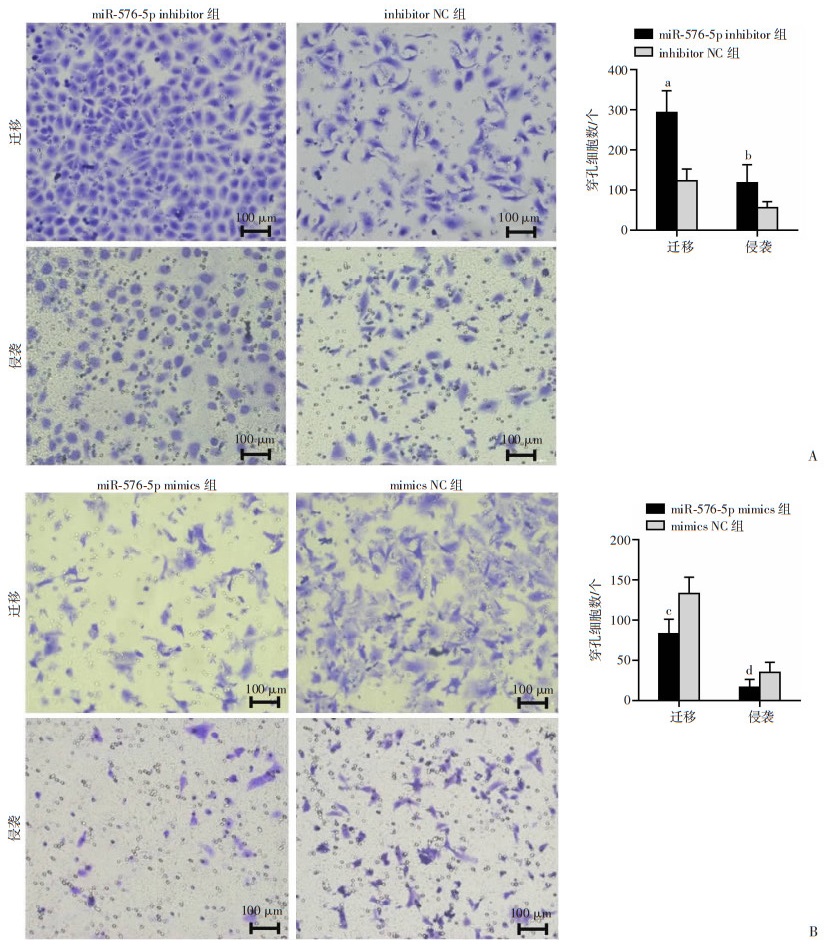
|
| A: Transwell迁移/侵袭实验检测miR-576-5p去表达对SMCC-7721细胞迁移和侵袭能力的影响;B: Transwell迁移/侵袭实验检测miR-576-5p过表达对hepG2细胞迁移和侵袭能力的影响 a:P < 0.001, b:P < 0.01,与inhibitor NC组比较;c:P < 0.001, d:P < 0.01,与mimics NC组比较 图 4 miR-576-5p在HCC细胞迁移和侵袭中的抑制作用(结晶紫染色,n=4,x±s) |
2.4 miR-576-5p对肝癌细胞EMT的影响
蛋白质印迹分析结果表明,过表达的miR-576-5p增强了上皮标志物E-cadherin的表达,但降低了间充质标志物N-cadherin和snail的表达(P < 0.01,P < 0.05,P < 0.05)。相反,miR-576-5p的去表达下调了E-cadherin的表达,但上调了N-cadherin,snail的表达(P < 0.05,P < 0.001,P < 0.01,图 5)。
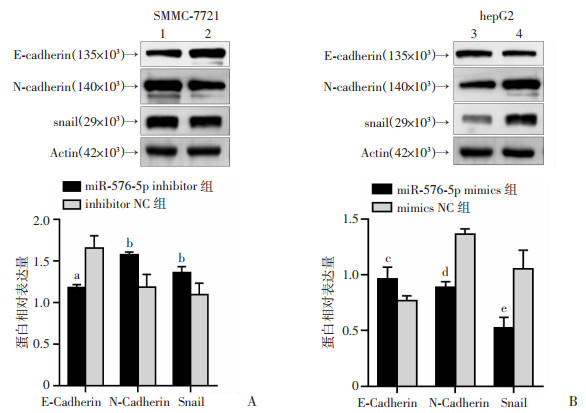
|
| A: SMCC-7721细胞去表达miR-576-5p对EMT的作用;B: hepG2细胞过表达miR-576-5p对EMT的作用 1: miR-576-5p inhibitor组; 2: inhibitor NC组; 3: miR-576-5p mimics组; 4: mimics NC组; a:P < 0.001, b:P < 0.05,与inhibitor NC组比较, c:P < 0.05, d:P < 0.001, e:P < 0.01,与mimics NC组比较 图 5 miR-576-5p在肝癌细胞中对EMT的阻碍作用 |
3 讨论
目前,HCC治疗预后较差,即使手术切除术后,复发率也居高不下,而肿瘤复发和转移是影响HCC疗效的重要因素。因此,抑制肿瘤侵袭和迁移是HCC治疗有效的策略,充分探索肿瘤细胞的侵袭转移机制,是寻找有效治疗手段的必要过程[12]。
近年来,许多研究证实miRNA在肿瘤的生长转移过程中发挥着重要的作用[14]。研究表明miRNA在肝细胞癌的发生发展中有一定的作用。已有研究者发现miR-21表达的持续失调和相关细胞功能障碍可加速肝癌的发展[15]。另有研究证实,miR-597-5p通过靶向TEAD1对肝癌细胞的恶性表型具有促进抑制作用[16]。本研究探索了miR-576-5p在肝细胞癌中的作用,通过检测27例肝细胞癌确诊患者的癌组织及其癌旁组织、正常人肝细胞和肝癌细胞株miR-576-5p的表达水平,统计分析miR-576-5p的表达水平和临床特征的关系。SMMC-7721转染miR-576-5p inhibitor和hepG2转染miR-576-5p mimics后,探讨其增殖、迁移和侵袭的影响。
EMT是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程,在此过程中,上皮细胞获得间充质细胞的特征,细胞运动性和迁移能力增强[9]。在肿瘤恶性进展过程中,肿瘤细胞劫持该过程,改变自身细胞形态,进而增加其侵袭性和转移能力[17]。EMT主要特征为上皮细胞标志物E-cadherin蛋白的丢失和间质细胞标志物N-cadherin、Vimentin蛋白和EMT转录因子(EMT-TFs)、nail、Twist和ZEB的表达增加。已有较多证据表明,miRNAs在肝癌EMT进程中发挥着重要的调节作用,能促进或抑制肿瘤细胞的侵袭与转移。有研究表明,miR-200家族能维持上皮表型,从而促进EMT和HCC细胞侵袭[18]。进一步研究表明,p53在HCC进展过程中常受损,能上调miR-200和miR-192家族成员,从而抑制ZEB1/2表达和诱导EMT[19]。MiR-148直接靶向c-Met并抑制Met/Snail信号传导,因此在HCC中充当肿瘤抑制因子[20]。同样,miR-451增加化疗和放射敏感性并通过靶向c-Myc逆转EMT[7]。本研究发现,miR-576-5p mimics组,与其对照组比较,E-cadherin蛋白表达增加,N-cadherin和snail蛋白表达明显减少,抑制了EMT的进程。去表达组相比其对照组,则产生相反的作用效果,两结果相互印证。
本研究结果证实miR-576-5p在肝癌细胞中的作用,miR-576-5p在HCC癌组织中较配对癌旁组织表达明显下降,在肝癌细胞株中低表达。SMMC-7721去表达miR-576-5p可加快SMMC-7721细胞EMT进程,促进细胞的增殖、迁移和侵袭,而hepG2过表达miR-576-5p会抑制肝癌细胞相关恶性表型,为肝细胞癌的临床靶向治疗提供新的靶点。
miR-576-5p的靶基因鉴定是后续重要的工作。miRNA主要通过与3′-UTR互补序列结合,诱导靶mRNA的降解。通过分析软件预测miRNA与mRNAs的3′-UTR区的结合位点,初步筛选出一批靶基因,其中包括原癌基因c-myc、TRIB2、asph等,还有与EMT相关基因ZEB1、TWIST1、snail等。miR-576-5p调控EMT其可能与重要肿瘤相关信号通路存在潜在联系,其机制值得进一步探索,为肝癌靶向治疗的临床实践提供新的线索。
| [1] |
SINGAL A G, LAMPERTICO P, NAHON P. Epidemiology and surveillance for hepatocellular carcinoma: new trends[J]. J Hepatol, 2020, 72(2): 250-261. |
| [2] |
FUJIWARA N, FRIEDMAN S L, GOOSSENS N, et al. Risk factors and prevention of hepatocellular carcinoma in the era of precision medicine[J]. J Hepatol, 2018, 68(3): 526-549. |
| [3] |
BERTINO G, NERI S, BRUNO C M, et al. Diagnostic and prognostic value of alpha-fetoprotein, des-γ-carboxy prothrombin and squamous cell carcinoma antigen immunoglobulin M complexes in hepatocellular carcinoma[J]. Minerva Med, 2011, 102(5): 363-371. |
| [4] |
VALINEZHAD ORANG A, SAFARALIZADEH R, KAZEMZADEH-BAVILI M. Mechanisms of miRNA-mediated gene regulation from common downregulation to mRNA-specific upregulation[J]. Int J Genomics, 2014, 2014: 970607. |
| [5] |
VASUDEVAN S. Posttranscriptional upregulation by mRNAs[J]. Wiley Interdiscip Rev RNA, 2012, 3(3): 311-330. |
| [6] |
HUANG V, PLACE R F, PORTNOY V, et al. Upregulation of Cyclin B1 by miRNA and its implications in cancer[J]. Nucleic Acids Res, 2012, 40(4): 1695-1707. |
| [7] |
HUANG J Y, ZHANG K, CHEN D Q, et al. microRNA-451: epithelial-mesenchymal transition inhibitor and prognostic biomarker of hepatocelluar carcinoma[J]. Oncotarget, 2015, 6(21): 18613-18630. |
| [8] |
NIETO M A. Epithelial plasticity: a common theme in embryonic and cancercells[J]. Science, 2013, 342(6159): 1234850. |
| [9] |
GIANNELLI G, KOUDELKOVA P, DITURI F, et al. Role of epithelial tomesenchymal transition in hepatocellular carcinoma[J]. J Hepatol, 2016, 65(4): 798-808. |
| [10] |
ÖSTERREICHER C H, PENZ-ÖSTERREICHER M, GRI-VENNIKOV S I, 等. Fibroblast-specific protein 1 identifies an inflammatory subpopulation of macrophages in theliver[J]. PNAS, 2011, 108(1): 308-313. |
| [11] |
LUO J L, LIU L Y, SHEN J W, et al. miR-576-5p promotes epithelial-to-mesenchymal transition in colorectal cancer by targeting the Wnt5a-mediated Wnt/β-catenin signaling pathway[J]. Mol Med Rep, 2021, 23(2): 94. |
| [12] |
ZHANG L Y, PAN K, ZUO Z K, et al. LINC01133 hampers the development of gastric cancer through increasing somatostatin via binding to mRNA-576-5p[J]. Epigenomics, 2021, 13(15): 1205-1219. |
| [13] |
NI X F, ZHAO L H, LI G, et al. microRNA-548-3p and microRNA-576-5p enhance the migration and invasion of esophageal squamous cell carcinoma cells via NRIP1 down-regulation[J]. Neoplasma, 2018, 65(6): 881-887. |
| [14] |
ROBERTS A P, LEWIS A P, JOPLING C L. miR-122 activates hepatitis C virus translation by a specialized mechanism requiring particular RNA components[J]. Nucleic acids research, 2011, 39(17): 7716-7729. |
| [15] |
GRAMANTIERI L, FORNARI F, FERRACIN M, et al. microRNA-221 targets bmf in hepatocellular carcinoma and correlates with tumor multifocality[J]. Clin Cancer Res, 2009, 15(16): 5073-5081. |
| [16] |
SUN X G, HOU Z Y, LI N, et al. miR-597-5p suppresses the progression of hepatocellular carcinoma via targeting transcriptional enhancer associate domain transcription factor 1(TEAD1)[J]. In Vitro Cell Dev Biol Anim, 2022, 58(2): 96-108. |
| [17] |
PONNUSAMY M P, SESHACHARYULU P, LAKSHMANAN I, et al. Emerging role of mucins in epithelial to mesenchymal transition[J]. Curr Cancer Drug Targets, 2013, 13(9): 945-956. |
| [18] |
YUAN J H, YANG F, WANG F, et al. A long noncoding RNA activated by TGF-β promotes the invasion-metastasis cascade in hepatocellular carcinoma[J]. Cancer Cell, 2014, 25(5): 666-681. |
| [19] |
KIM T, VERONESE A, PICHIORRI F, et al. P53 regulates epithelial-mesenchymal transition through microRNAs targeting ZEB1 and ZEB2[J]. J Exp Med, 2011, 208(5): 875-883. |
| [20] |
ZHANG J P, ZENG C, XU L, et al. MicroRNA-148a suppresses the epithelial-mesenchymal transition and metastasis of hepatoma cells by targeting Met/Snail signaling[J]. Oncogene, 2014, 33(31): 4069-4076. |




