高血糖是许多疾病的危险因素,包括缺血性心血管损伤[1]、肾脏疾病[2]和败血症[3],同时也被视为糖尿病患者骨改建不良的主要危险因素[4-5]。骨改建过程一般是指在力的作用下发生的一个成破骨动态循环过程,包括了骨吸收和骨形成,而成骨细胞和破骨细胞在其中发挥主要调节作用[6]。正常情况下,成骨与破骨的动态平衡是正畸治疗中牙齿发生移位的生理基础。在高糖环境下,巨噬细胞作为先天免疫细胞,首先被激活并到达骨改建区发挥免疫作用,分泌大量炎症因子[7-8]。根据活化状态、细胞表型及功能差异,巨噬细胞分为M1和M2型巨噬细胞,M1型巨噬细胞在炎症早期浸润,其释放的炎性介质或细胞因子可发挥破骨细胞分化的第二信使作用;M2型巨噬细胞则在减轻炎症、减弱抗原呈递、促进组织愈合等过程中发挥重要功能,同时释放如BMP-2、TGF-β和IGF-1等细胞因子促进骨髓间充质干细胞成骨分化[9-10]。在骨改建过程中,成骨细胞功能受到巨噬细胞的调控[11],当成骨细胞发生功能障碍时,将导致成破骨状态失衡,骨改建不良甚至失败[12]。氧化应激被认为是导致成骨细胞功能障碍的原因[13]。氧化应激是指因为活性氧(reactive oxygen species,ROS)和活性氮(reactive nitrogen species,RNS)的产生与清除之间失衡而导致细胞器、蛋白、脂质等受到氧化损伤[14]。ROS是机体产生的诱导体内发生氧化应激的一组物质,主要包括超氧阴离子(O2-)、过氧化氢(H2O2)和羟自由基(·HO)[15],在决定细胞命运中发挥重要作用。目前对高糖环境下骨改建过程的研究较少,高糖环境对成骨细胞氧化应激的影响及巨噬细胞在其中发挥的作用仍不清楚。因此,本研究将采用Transwell细胞间接共培养技术探究高糖环境下巨噬细胞对成骨细胞氧化应激、自噬及凋亡的影响。
1 材料与方法 1.1 细胞与主要试剂小鼠前成骨细胞系MC3T3-E1和小鼠单核巨噬细胞系Raw264.7来源于美国ATCC公司;胎牛血清(FBS)购自阿根廷Natcor公司;Transwell细胞小室购自美国Millipore公司;α-MEM培养基购自美国Gibco公司;ROS检测试剂盒和ECL化学发光法检测试剂盒购自上海碧云天生物科技有限公司;TRIzol Regent购自美国Invitrogen公司;RT-PCR试剂盒购自美国Promega公司;PAGE凝胶快速制备试剂盒购自上海雅酶生物科技有限公司;LC3 Rabbit mAb购自美国Cell Signalin Technology公司;SQSTM1/p62 Rabbit mAb购自英国Abcam公司。
1.2 方法 1.2.1 细胞培养将前成骨细胞MC3T3-E1和小鼠单核巨噬细胞Raw264.7分别置于含有10%胎牛血清和1%双抗的α-MEM培养基中,在37 ℃、5%CO2的细胞培养箱中培养。当MC3T3-E1增殖到密度为80%左右,用0.25%胰酶消化2 min后终止消化,并吹打、离心后去除上清,用3 mL α完全培养基重悬沉淀并以1∶3的比例进行传代培养,Raw264.7吹打离心后去除上清,用3 mL α完全培养基重悬细胞并以1∶3比例进行传代培养。
1.2.2 高糖对Raw264.7细胞M1表面抗原标志CD86表达的影响将Raw264.7细胞分别培养于含葡萄糖浓度为25、30、35 mmol/L的细胞培养基中培养24 h,其中5.5 mmol/L作为阴性对照。24 h后去除培养基并用PBS洗2次,用含3%FBS的PBS吹打并将细胞收集至15 mL离心管中,150×g离心5 min,收集细胞沉淀,去除上清并用1 mL含3%FBS的PBS重悬细胞并计数,取1×106个细胞于1.5 mL EP管中,以500×g离心5 min,去除上清,每管加入100 μL含3%FBS和1%抗CD86-PE的PBS重悬细胞,避光,4 ℃摇床孵育30 min,每5 min重悬一次,孵育完成后500×g离心5 min去除上清,用含3%FBS的PBS清洗3次后并用筛网将细胞悬液过滤至流式细胞管,上机检测,结果用FlowJo.v10软件进行作图分析。
1.2.3 不同葡萄糖浓度对Raw264.7细胞TNF-α、IL-6、iNOS、NOX2、p47phox mRNA表达的RT-qPCR检测将Raw264.7细胞分别培养于含葡萄糖浓度为25、30、35 mmol/L的细胞培养基中培养24 h。24 h后采用TRIzol试剂提取各组细胞的RNA,用Promega反转录试剂盒反转录RNA为cDNA,以GAPDH作为内参,采用2-ΔΔCt法分析目的基因表达水平。相关基因TNF-α、IL-6、iNOS、NOX2、p47phox的上下游引物序列来源于NCBI,引物序列使用生工生物工程(上海)股份有限公司合成,引物序列见表 1。
| 基因 | 正义(5′→3′) | 反义(3′→5′) |
| IL-6 | CTTCTTGGGACTGATGCTGGTGAC | AGGTCTGTTGGGAGTGGTATCCTC |
| TNF-α | GCGACGTGGAACTGGCAGAAG | GCCACAAGCAGGAATGAGAAGAGG |
| iNOS | ACTCAGCCAAGCCCTCACCTAC | TCCAATCTCTGCCTATCCGTCTCG |
| NOX2 | GAAGACAACTGGACAGGAACCTCAC | AAATCCCGACTCTGGCATTCACAC |
| p47phox | GCGAAGAAGCCTGAGACATACCTG | AACTCTTCTCGTAGTCAGCAATGGC |
| GAPDH | GGTTGTCTCCTGCGACTTCA | TGGTCCAGGGTTTCTTACTCC |
1.2.4 不同葡萄糖浓度对Raw264.7细胞iNOS表达的蛋白检测
去除培养基,将培养于25、30、35 mmol/L葡萄糖浓度的Raw264.7细胞用冰冷的PBS清洗2遍,用含有PMSF的RIPA裂解细胞,进行BCA蛋白定量检测并按4∶1的比例加入5× Loading Buffer后100 ℃煮沸5 min。加入各组蛋白样品进行凝胶电泳,转膜,封闭,一抗4 ℃孵育过夜,TBST清洗3遍后二抗常温孵育2 h,TBST清洗3遍后采用ECL化学发光显影液进行显影,通过Image J软件进行目的蛋白半定量分析。
1.2.5 细胞ROS检测细胞ROS含量用DCFH-DA法测定,将DCFH-DA探针加入不含血清的培养基中,达到终浓度为10 μmol/L,并以换液的方式加入至不同葡萄糖浓度培养的Raw264.7(25、30、35 mmol/L葡萄糖浓度)或MC3T3-E1(5.5、35 mmol/L葡萄糖浓度)细胞中,37℃细胞培养箱内孵育30 min后用不含血清的培养基清洗3次,每次5 min。通过荧光显微镜记录荧光图片。
1.2.6 高糖共培养体系的建立采用Transwell间接共培养技术模拟细胞的旁分泌过程,即将两种细胞分别接种于上室和下室,细胞之间不直接接触,但仍可通过细胞分泌的细胞因子等物质进行信息交流。本实验将Raw264.7细胞置于6孔板中细胞上室,MC3T3-E1细胞置于6孔板中细胞下室,采用含有35 mmol/L葡萄糖的培养基在37 ℃、5%CO2的细胞培养箱中进行间接共培养(图 1),共培养24 h后进行后续实验,后续实验分为正常糖单独培养组(5.5-Mono组)、高糖单独培养组(35-Mono组)、高糖共培养组(35-Co组)3组。

|
| 图 1 Transwell间接共培养体系示意图 |
1.2.7 高糖共培养下MC3T3-E1细胞透射电镜检测
去除Transwell细胞上室及Raw264.7细胞,将下室的MC3T3-E1细胞用PBS清洗后以0.25%的胰酶消化1 min使细胞形成单个细胞后用PBS缓冲液以120×g离心5 min,离心管底部形成松散团块,保留1.5 mL上清液,吸弃余下上清,重新将团块吹散后转移至1.5 mL EP管内并以120×g离心10 min,EP管底部形成细胞团块,吸弃上清并沿管壁缓慢加入戊二醛固定液,送电镜室观察。
1.2.8 高糖共培养下MC3T3-E1细胞LC3、SQSTM1/p62的蛋白检测去除Transwell细胞上室及Raw264.7细胞,将下室的MC3T3-E1细胞用冰冷的PBS清洗2遍,用含有PMSF的RIPA裂解细胞,进行BCA蛋白定量检测,并按4∶1的比例加入5×Loading Buffer后100 ℃煮沸5 min。上样后进行凝胶电泳、转膜、封闭,一抗4 ℃孵育过夜,TBST清洗3遍后加二抗常温孵育2 h,TBST清洗3遍后采用ECL化学发光显影液进行显影,蛋白堆积量为加入自噬抑制剂Bafilomycin A1前后蛋白表达量的差值。通过Image J软件进行目的蛋白半定量分析。
1.2.9 流式细胞术检测高糖共培养下MC3T3-E1细胞凋亡去除Transwell细胞上室,将下室的MC3T3-E1细胞用PBS清洗后以0.25%的胰酶消化1min使细胞形成单个细胞后用PBS缓冲液以150×g离心5 min,去除上清,重复2次后取至少1×106个细胞并用400 μL PBS重悬,加入荧光探针Annexin V和PI双重标记细胞,利用流式细胞仪快速检测细胞凋亡水平,结果用FlowJo.v10软件进行作图分析。
1.3 统计学分析数据的统计均采用3组样本取平均值,RT-qPCR数据用BioRadCFXmanager记录,Western blot数据用Bio-Rad, cat#12003154记录,流式数据用FlowJo.v10记录,均采用SPSS 19.0软件进行数据分析,以x±s表示,多组间比较采用单因素方差分析,两组间比较采用两独立样本t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 高糖促进Raw264.7细胞M1型极化为探究高糖是否会激活Raw264.7细胞并导致其M1向极化,对M1型巨噬细胞表面标志抗原CD86进行流式细胞表面抗原检测,结果发现相比于正常糖浓度组,高糖环境下,CD86阳性的Raw264.7细胞明显增加(图 2A),表明高糖促进Raw264.7细胞M1向极化。为进一步明确M1向极化的Raw264.7细胞在何种高糖浓度下产生最明显的促炎效应,采用RT-qPCR及Western blot技术检测促炎因子IL-6、TNF-α、iNOS基因及蛋白表达,RT-qPCR结果显示30、35 mmol/L高糖浓度下Raw264.7细胞促炎因子的mRNA表达显著高于25 mmol/L组(P < 0.05,图 2B)。Western blot结果显示35 mmol/L高糖浓度下iNOS蛋白表达显著高于25 mmol/L组及30 mmol/L组(P < 0.05,图 2C、D)。上述研究结果提示高糖促进Raw264.7细胞M1向极化,且35 mmol/L高糖浓度下Raw264.7产生促炎效应最明显。

|
|
a:P < 0.05,与25 mmol/L组比较;b:P < 0.05,与30 mmol/L组比较 A:流式细胞术检测各组细胞CD86表达 5.5 mmol/L作为对照组;B:RT-qPCR检测M1极化相关促炎因子基因表达;C:Western blot检测iNOS蛋白表达;D:iNOS蛋白表达半定量分析 图 2 Raw264.7细胞CD86流式细胞检测,IL-6、TNF-α和iNOS的RT-qPCR及iNOS的Western blot检测 (n=3,x±s) |
2.2 高糖促进Raw264.7细胞产生氧化应激
为探究不同葡萄糖浓度对Raw264.7细胞ROS产生、氧化应激相关基因表达的影响,采用DCFH-DA探针检测胞内ROS水平,并采用RT-qPCR对相关基因进行检测。DCFH-DA探针的荧光结果显示,高糖环境促进Raw264.7胞内ROS产生,且呈浓度依赖性,在35 mmol/L高糖浓度下ROS产生最多(图 3A)。RT-qPCR结果显示,高糖环境下Raw264.7细胞氧化应激相关基因表达明显增加,且在35 mmol/L高糖环境下增加最明显(图 3B),差异有统计学意义(P < 0.05),表明35 mmol/L高糖环境显著促进Raw264.7细胞氧化应激。
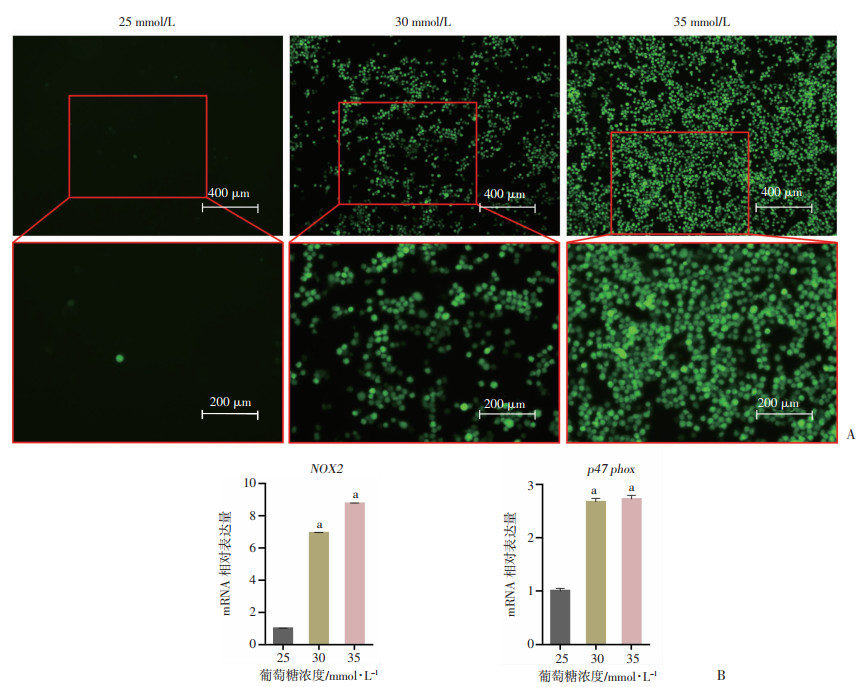
|
| A:荧光显微镜检测不同糖浓度下Raw264.7细胞ROS水平;B:RT-qPCR检测NOX2、p47phox基因表达(n=3,x±s) a:P < 0.05,与25 mmol/L组比较 图 3 Raw264.7细胞ROS检测及NOX2、p47phox的RT-qPCR检测 |
2.3 高糖共培养条件下MC3T3-E1胞内ROS增加
为探究各组MC3T3-E1细胞氧化应激水平,采用DCFH-DA探针检测MC3T3-E1细胞胞内ROS。荧光结果显示,与正常糖浓度相比,在35 mmol/L高糖环境下,MC3T3-E1细胞产生较多ROS,且与Raw264.7细胞共培养下MC3T3-E1细胞产生ROS更多,荧光最强(图 4),提示高糖共培养刺激MC3T3-E1细胞产生氧化应激。
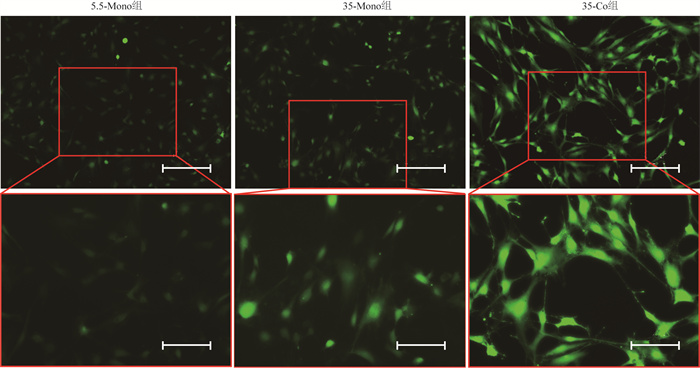
|
| 图 4 荧光显微镜检测各组MC3T3-E1细胞ROS水平 |
2.4 透射电镜结果
为进一步探究高糖共培养环境下MC3T3-E1细胞及细胞器形态学改变,本研究采用透射电镜观察高糖单独培养或与Raw264.7细胞高糖间接共培养中MC3T3-E1细胞及其细胞器形态。结果显示,35-Mono组的MC3T3-E1胞内出现线粒体肿胀,线粒体部分溶解的现象,35-Co组的MC3T3-E1胞内线粒体未见明显肿胀,但可见较多自噬溶酶体形成(图 5)。

|
| 黑色箭头示正常线粒体;绿色箭头示肿胀线粒体;红色箭头示自噬溶酶体 图 5 透射电镜观察与Raw264.7细胞高糖共培养下MC3T3-E1细胞线粒体及自噬溶酶体的形态 |
2.5 高糖共培养促进MC3T3-E1细胞自噬相关蛋白表达
为探究在高糖环境下,与Raw264.7细胞共培养的MC3T3-E1胞内自噬流是否有改变,采用自噬抑制剂Bafilomycin A1分别将3组MC3T3-E1细胞的自噬流阻断,LC3合成后在羧基末端迅速裂解产生LC3-Ⅰ,在自噬过程中LC3-Ⅰ被脂质化为LC3-Ⅱ,从而将LC3与自噬小泡结合,与SQSTM1/p62一起形成自噬体,而Bafilomycin A1阻断后自噬体无法与溶酶体融合降解(图 6A),进而LC3-Ⅱ及SQSTM1/p62等自噬相关蛋白会堆积,根据阻断后LC3-Ⅱ及SQSTM1/p62堆积的多少可以判断自噬流的强弱。根据Western blot检测MC3T3-E1细胞自噬相关蛋白LC3-Ⅱ及SQSTM1/p62表达的结果显示,在未加入Bafilomycin A1的3组中,35-Co组MC3T3-E1细胞的LC3-Ⅱ最少,但加入Bafilomycin A1将自噬流阻断后,可以发现35-Co组MC3T3-E1细胞的LC3-Ⅱ堆积最为明显,即加入自噬抑制剂Bafilomycin A1前后LC3-Ⅱ蛋白表达量的差值最大,自噬流明显强于单独培养组(图 6B、C),且差异有统计学意义(P < 0.05)。
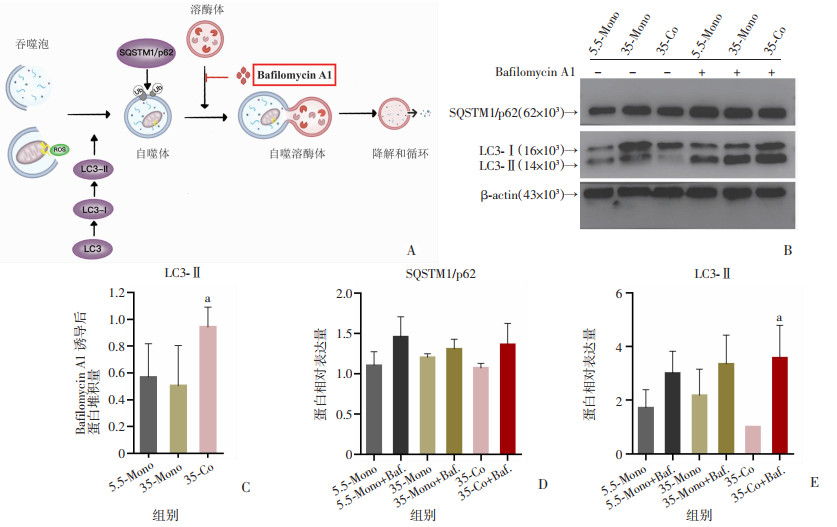
|
| A:自噬过程示意图;B:Western blot检测各组相关蛋白表达;C:经Bafilomycin A1阻断前后各组LC3-Ⅱ蛋白堆积量差值半定量分析 a:P < 0.05,与35-Mono组比较;D:各组SQSTM1/p62蛋白半定量分析;E:各组LC3-Ⅱ蛋白半定量分析 a:P < 0.05,与35-Co组比较 图 6 与Raw264.7细胞高糖共培养对MC3T3-E1细胞LC3-Ⅱ及SQSTM1/p62蛋白表达的影响 (n=3,x±s) |
2.6 高糖共培养条件减少MC3T3-E1细胞凋亡
为了探讨在高糖环境下,与Raw264.7细胞共培养的MC3T3-E1细胞ROS及自噬的增加是否影响其凋亡,通过流式细胞仪分析3组MC3T3-E1细胞的凋亡率。结果显示,在35 mmol/L高糖环境下,与Raw264.7共培养的MC3T3-E1细胞(35-Co组)的凋亡率较高糖单独培养(35-Mono组)明显增加(P < 0.05, 图 7),表明高糖共培养促进MC3T3-E1细胞凋亡。

|
| A:流式细胞术检测MC3T3-E1细胞凋亡;B:各组MC3T3-E1细胞凋亡率 a:P < 0.05,与5.5-Mono组比较;b:P < 0.05,与35-Mono组比较 图 7 高糖共培养对MC3T3-E1凋亡的影响 (n=3,x±s) |
3 讨论 3.1 高糖与骨改建
糖尿病是一种代谢紊乱,常伴随炎症状态的增加。活性氧的产生和晚期糖基化终产物的积累,会增加骨折风险,干扰骨改建,损害骨折愈合[4],但糖尿病骨改建不良的具体机制仍有待进一步阐明。巨噬细胞作为天然免疫细胞,是最先抵达并作用于牙移动区域的细胞之一[11]。根据其活化状态、细胞表型及功能差异,巨噬细胞分为M1和M2型巨噬细胞。研究表明,M1型巨噬细胞分泌炎症介质和细胞因子介导炎症反应的发生,主要供能方式为糖酵解[16],但糖酵解效率难以满足炎性反应的高ATP需求,细胞代谢方式由糖酵解转变为氧化磷酸化,M2型巨噬细胞逐渐代替M1型巨噬细胞,炎症将逐步趋于缓和甚至自限[17-18]。但在高糖环境下,过量的葡萄糖导致线粒体电子传递功能被破坏,巨噬细胞无法完成从M1到M2型的转换,炎症失去自限性,促炎因子、趋化因子和受体被大量表达,进而导致糖尿病患者体内长期处于高氧化应激和炎症状态[19]。有研究表明,高糖还伴随着巨噬细胞胞浆NADPH氧化酶(NOX)的异常激活,加剧ROS的产生和线粒体功能障碍[20-21]。NOX是一种多亚基酶复合体,是体内氧化应激的关键酶,也是巨噬细胞中ROS的主要来源之一[22]。NOX蛋白存在于胞膜上,本身几乎没有催化活性,其需要与多种调节亚基(p40phox、p47phox、p66phox等)结合形成复合物而发挥催化作用,在血红素等辅基的协助下将电子从基质转移至氧分子,形成ROS。本研究证实高糖促进Raw264.7细胞M1向极化,且随着培养环境中葡萄糖的浓度逐渐升高,Raw264.7细胞的M1型促炎效应及氧化应激更明显。
在机体的骨组织不断形成或修复过程中,成骨细胞分泌骨基质,矿化形成新骨,而来自单核造血细胞的巨噬细胞则对成骨细胞的功能起调控作用[23-24],这两种细胞类型是骨改建的主要参与者,骨改建也是一个持续影响我们骨骼健康的过程[25]。成骨细胞来源于骨髓间充质干细胞,在骨重塑中发挥重要作用,但在高糖环境下其功能发生显著改变。研究表明,高糖会导致MC3T3-E1细胞ROS产生增加,成骨能力减弱[26]。大量体内实验也表明,糖尿病大鼠骨缺损处的骨愈合速度及质量均较正常组差[27]。WHO在2006年发布的糖尿病指南中明确指出,随机血糖≥7.0 mmol/L以及餐后2 h血糖≥11.1 mmol/L可诊断为糖尿病,该指南在一项对38个前瞻性研究进行的Meta分析中,证实未达到糖尿病标准的高血糖会增加患心血管疾病的风险,并提到空腹血糖5.5 mmol/L可能为一个阈值,多项研究也表明空腹血糖>5.5 mmol/L时,心血管疾病发生风险将成倍增加[28]。因此,许多研究都将5.5 mmol/L作为正常血糖浓度,本研究也不例外。本研究通过Transwell间接共培养模型,模拟体内环境中的细胞旁分泌交流,结果证实高糖促进MC3T3-E1细胞产生ROS,而Raw264.7细胞在高糖环境下持续的氧化应激和炎症介质等的分泌对MC3T3-E1细胞产生不利影响。VOLPE等[15]表明,高糖通过直接作用于细胞表面的Toll样受体导致成骨细胞胞内ROS产生增加,而ROS可以通过激活细胞内质网应激的PERK通路或破坏自噬与凋亡的平衡而导致细胞凋亡。
3.2 氧化应激,自噬与凋亡ROS的来源分为外源性和内源性,外源性来源于辐射、药物等刺激,而内源性来源于线粒体、内质网、过氧化物酶、NADPH氧化酶体等,在大部分细胞中,线粒体氧化呼吸链中的复合体I和复合体III是产生ROS的主要部位[29]。在高糖环境下,过量的葡萄糖导致大量电子供体进入线粒体氧化呼吸链,导致电子泄露和大量ROS产生,随之线粒体电子传递功能被破坏。ROS的产生和损伤线粒体表面发出的“吃我”的信号均会激活细胞自噬,从而在一定程度上缓解细胞受到氧化应激的压力,但当这个压力持续时间过长或超过阈值时,细胞自噬也无法挽救细胞死亡的命运[15]。由于自噬是一个动态变化过程,也被称作自噬流,可以通过检测自噬关键蛋白LC3-Ⅱ和SQSTM1/p62来反映自噬的强弱,但单独检测某一时间点的自噬相关蛋白结果并不准确,使用自噬阻断剂Bafilomycin A1可以在自噬体与溶酶体融合阶段进行阻断,从而更准确的观察自噬流过程中LC3-Ⅱ和SQSTM1/p62蛋白的堆积量,反映自噬流的强弱。本研究结果发现35 mmol/L高糖环境下,与Raw264.7细胞共培养的MC3T3-E1细胞自噬被大量激活。通常在同一细胞中,自噬先于凋亡发生,这是因为压力通常会首先刺激自噬反应,尤其是在压力水平不致命的情况下。当压力超过临界持续时间或强度阈值时,凋亡和非凋亡致死程序被激活[30]。文献表明,自噬小体的形成,有助于激活caspase-8,从而激活凋亡的caspase级联过程[31],此外自噬也可能通过消耗细胞死亡途径的内源性抑制蛋白(inhibitor of apoptosis proteins,IAPs),破坏凋亡与凋亡抑制蛋白之间的平衡来刺激细胞凋亡[32]。我们的结果表明相比于35-Mono组,35-Co组MC3T3-E1细胞凋亡率明显上升,提示我们过强的ROS和自噬导致了细胞死亡的发生。
综上,本研究发现与Raw264.7细胞在高糖环境下共培养会诱导MC3T3-E1细胞产生凋亡,而该凋亡的发生可能与高糖环境下Raw264.7细胞持续氧化应激和促炎因子分泌而导致MC3T3-E1胞内产生大量ROS和过度自噬有关,然而上述结论仍需通过体内实验进一步验证。本研究有助于诠释高糖环境下正畸骨改建失败的生物学基础,高糖环境对成骨细胞氧化应激和自噬的影响及巨噬细胞在其中发挥的作用,力求探索保护成骨细胞正常生理功能的关键靶点,为临床制定针对性预防和治疗策略提供新的思路和理论依据。
| [1] |
TAN Y, ZHANG Z G, ZHENG C, et al. Mechanisms of diabetic cardiomyopathy and potential therapeutic strategies: preclinical and clinical evidence[J]. Nat Rev Cardiol, 2020, 17(9): 585-607. |
| [2] |
KIMY T, CHUNG H J, PARK B R, et al. Risk of cardiovascular disease and chronic kidney disease according to 2017 blood pressure categories in diabetes mellitus[J]. Hypertension, 2020, 76(3): 766-775. |
| [3] |
COLEJ B, FLOREZ J C. Genetics of diabetes mellitus and diabetes complications[J]. Nat Rev Nephrol, 2020, 16(7): 377-390. |
| [4] |
KHOSLA S, SAMAKKARNTHAI P, MONROED G, et al. Update on the pathogenesis and treatment of skeletal fragility in type 2 diabetes mellitus[J]. Nat Rev Endocrinol, 2021, 17(11): 685-697. |
| [5] |
CHEN Y, HU Y, YANG L, et al. Runx2 alleviates high glucose-suppressed osteogenic differentiation via PI3K/AKT/GSK3β/β-catenin pathway[J]. Cell Biol Int, 2017, 41(8): 822-832. |
| [6] |
VELLETRI T, HUANG Y, WANG Y, et al. Loss of p53 in mesenchymal stem cells promotes alteration of bone remodeling through negative regulation of osteoprotegerin[J]. Cell Death Differ, 2021, 28(1): 156-169. |
| [7] |
MUÑOZ J, AKHAVAN N S, MULLINS A P, et al. Macrophage polarization and osteoporosis: a review[J]. Nutrients, 2020, 12(10): 2999. |
| [8] |
ZHANG B, YANG Y, YI J R, et al. Hyperglycemia modulates M1/M2 macrophage polarization via reactive oxygen species overproduction in ligature-induced periodontitis[J]. J Periodontal Res, 2021, 56(5): 991-1005. |
| [9] |
CHEN K X, JIAO Y R, LIU L, et al. Communications between bone marrow macrophages and bone cells in bone remodeling[J]. Front Cell Dev Biol, 2020, 8: 598263. |
| [10] |
RIOS-ARCE N D, DAGENAIS A, FEENSTRA D, et al. Loss of interleukin-10 exacerbates early type-1 diabetes-induced bone loss[J]. J Cell Physiol, 2020, 235(3): 2350-2365. |
| [11] |
SHEN X, SHEN X, LI B, et al. Abnormal macrophage polarization impedes the healing of diabetes-associated tooth sockets[J]. Bone, 2021, 143: 115618. |
| [12] |
YE W B, WANG J Z, LIN D S, et al. The immunomodulatory role of irisin on osteogenesis via AMPK-mediated macrophage polarization[J]. Int J Biol Macromol, 2020, 146: 25-35. |
| [13] |
LIU M L, WU X, CUI Y L, et al. Mitophagy and apoptosis mediated by ROS participate in AlCl 3-induced MC3T3-E1 cell dysfunction[J]. Food Chem Toxicol, 2021, 155: 112388. |
| [14] |
YING S Q, TAN M M, FENG G, et al. Low-intensity pulsed ultrasound regulates alveolar bone homeostasis in experimental periodontitis by diminishing oxidative stress[J]. Theranostics, 2020, 10(21): 9789-9807. |
| [15] |
VOLPE C M O, VILLAR-DELFINO P H, DOS ANJOS P M F, et al. Cellular death, reactive oxygen species (ROS) and diabetic complications[J]. Cell Death Dis, 2018, 9(2): 119. |
| [16] |
YAMAUCHI T, MAKINODAN M, TORITSUKA M, et al. Tumor necrosis factor-α expression aberration of M1/M2 macrophages in adult h igh-functioning autism spectrum disorder[J]. Autism Res, 2021, 14(11): 2330-2341. |
| [17] |
KIMS J, CHANG H J, VOLIN M V, et al. Macrophages are the primary effector cells in IL-7-induced arthritis[J]. Cell Mol Immunol, 2020, 17(7): 728-740. |
| [18] |
LI X W, GAO F J, ZHU W H, et al. Pristane promotes anaerobic glycolysis to facilitate proinflammatory activation of macrophages and development of arthritis[J]. Exp Cell Res, 2021, 398(1): 112404. |
| [19] |
LIECHTY C, HU J Y, ZHANG L P, et al. Role of microRNA-21 and its underlying mechanisms in inflammatory responses in diabetic wounds[J]. Int J Mol Sci, 2020, 21(9): 3328. |
| [20] |
HEGYI B, BORST J M, BAILEY L R J, et al. Hyperglycemia regulates cardiac K+ channels via O-GlcNAc-CaMKⅡ and NOX2-ROS-PKC pathways[J]. Basic Res Cardiol, 2020, 115(6): 71. |
| [21] |
LU S, LIAO Z D, LU X Y, et al. Hyperglycemia acutely increases cytosolic reactive oxygen species via O-linked GlcNAcylation and CaMKⅡ activation in mouse ventricular myocytes[J]. Circ Res, 2020, 126(10): e80-e96. |
| [22] |
DRUMMOND G R, SELEMIDIS S, GRIENDLING K K, et al. Combating oxidative stress in vascular disease: NADPH oxidases as therapeutic targets[J]. Nat Rev Drug Discov, 2011, 10(6): 453-471. |
| [23] |
TSUKASAKI M, TAKAYANAGI H. Osteoimmunology: evolving concepts in bone-immune interactions in health and disease[J]. Nat Rev Immunol, 2019, 19(10): 626-642. |
| [24] |
XIANG G, LIU K Y, WANG T J, et al. In situ regulation of macrophage polarization to enhance osseointegration under diabetic conditions using injectable silk/sitagliptin gel scaffolds[J]. Adv Sci (Weinh), 2020, 8(3): 2002328. |
| [25] |
BORCIANI G, MONTALBANO G, BALDINI N, et al. Co-culture systems of osteoblasts and osteoclasts: Simulating in vitro bone remodeling in regenerative approaches[J]. Acta Biomater, 2020, 108: 22-45. |
| [26] |
WANG N N, XU P C, WU R J, et al. Timosaponin BⅡ improved osteoporosis caused by hyperglycemia through promoting autophagy of osteoblasts via suppressing the mTOR/NFκB signaling pathway[J]. Free Radic Biol Med, 2021, 171: 112-123. |
| [27] |
ZHENG L F, SHEN X M, YE J J, et al. Metformin alleviates hyperglycemia-induced apoptosis and differentiation suppression in osteoblasts through inhibiting the TLR4 signaling pathway[J]. Life Sci, 2019, 216: 29-38. |
| [28] |
BORGNAKKE W S. IDF Diabetes Atlas: diabetes and oral health—A two-way relationship of clinical importance[J]. Diabetes Res Clin Pract, 2019, 157: 107839. |
| [29] |
SIES H, JONES D P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents[J]. Nat Rev Mol Cell Biol, 2020, 21(7): 363-383. |
| [30] |
MARIÑO G, NISO-SANTANO M, BAEHRECKE E H, et al. Self-consumption: the interplay of autophagy and apoptosis[J]. Nat Rev Mol Cell Biol, 2014, 15(2): 81-94. |
| [31] |
YOUNG M M, TAKAHASHI Y, KHAN O, et al. Autophagosomal membrane serves as platform for intracellular death-inducing signaling complex (iDISC)-mediated caspase-8 activation and apoptosis[J]. J Biol Chem, 2012, 287(15): 12455-12468. |
| [32] |
NEZIS I P, SHRAVAGE B V, SAGONA A P, et al. Autophagic degradation of dBruce controls DNA fragmentation in nurse cells during late Drosophila melanogaster oogenesis[J]. J Cell Biol, 2010, 190(4): 523-531. |




