心房颤动(atrial fibrillation,AF)是导致心血管疾病高发病率和高死亡率的主要原因之一。目前,传统的药物疗法在AF中的疗效有限,进一步研究AF的发病机制是必要的[1-2]。泛素-蛋白酶体系统是细胞内蛋白质降解的主要途径,在维持蛋白质稳态和心脏功能方面发挥着关键作用[3]。泛素化作为主要的蛋白质翻译后修饰形式,参与调节膜运输和蛋白质降解[4]。由于去泛素化酶的存在,泛素化是一个可逆过程,去泛素化酶可以从泛素修饰的蛋白质中切割泛素。泛素C末端水解酶1(ubiquitin C-terminal hydrolase 1,UCHL1)是一种去泛素化酶,负责从靶蛋白中去除泛素或多聚泛素[5]。UCHL1失调参与多种疾病的发病机制,包括肿瘤、神经退行性疾病和肝纤维化[5-6]。最近研究发现,心肌梗死后,心肌细胞中UCHL1的表达高度上调,并与泛素表达增加有关;此外,UCHL1抑制剂通过调节成纤维细胞中的核因子-κB信号传导减弱心脏纤维化[7]。关于UCHL1是否通过诱导心脏纤维化参与AF的病理过程尚不清楚。本研究观察UCHL1在AF大鼠心脏组织中的表达情况,通过过表达或敲低UCHL1探讨其在AF中的调节作用,旨在为AF心脏纤维化的治疗提供新的靶点。
1 材料与方法 1.1 实验动物64只健康成年雄性SD大鼠(8周龄,体质量240~260 g)和10只雄性SD大鼠(1~3日龄,体质量10~14 g) 购自北京华阜康生物科技股份有限公司[SCXK(京)2019-0008]。在特定的无病原体条件下,大鼠可随意获取食物和水,并保持12 h的暗/光周期(室温20~24 ℃,相对湿度40%~70%)。将渗透性微型泵植入大鼠皮下前用2% (体积分数)异氟醚/氧气吸入麻醉。为了考察UCHL1表达在AF发病中的作用,采用随机数字表法将24只大鼠分为4组,每组6只,然后建立AF模型。①假手术(Sham)组:将不含血管紧张素(angiotensin Ⅱ, AngⅡ)的渗透性微型泵植入大鼠皮下;②AF 1周组:使用渗透性微型泵(2004型;美国Alzet公司)通过慢性AngⅡ输注1周(200 ng·kg-1·min-1,美国Sigma-Aldrich公司)诱导大鼠心房纤维化;③AF 2周组:使用渗透性微型泵通过慢性AngⅡ输注2周(200 ng·kg-1·min-1)诱导大鼠AF;④AF 4周组:使用渗透性微型泵通过慢性AngⅡ输注4周(200 ng·kg-1·min-1)诱导大鼠AF。为了考察UCHL1抑制剂(LDN)对AF大鼠的改善作用,采用随机数字表法将40只大鼠分为4组,每组10只:①Sham+DMSO组:将不含AngⅡ的渗透性微型泵植入大鼠皮下,每天尾静脉注射DMSO(1 mL/kg,美国MCE公司),持续4周;② Sham+LDN组:将不含AngⅡ的渗透性微型泵植入大鼠皮下,每天尾静脉注射UCHL1抑制剂LDN-57444(LDN;40 μg/kg,美国MCE公司),持续4周。③AF+DMSO组:参照文献[8]的方法,使用渗透性微型泵通过慢性AngⅡ输注4周(200 ng·kg-1·min-1)诱导大鼠AF,每天尾静脉注射DMSO(1 mL/kg),持续4周。④AF+LDN组:参照AF+DMSO组诱导AF 4周。每天尾静脉注射LDN(40 μg/kg),持续4周。
1.2 心电图记录与分析在AngⅡ输注结束时(4周后),大鼠用戊巴比妥钠(40 mg/kg)麻醉。将12导联心电图的肢体导联插入动物的四肢,记录心电图波形。造模成功标准:AngⅡ停药后心电图有典型的房颤波改变。房颤的持续时间定义为房颤发作后快速和不规则心房节律与第一次正常窦性心律发作之间的时间间隔。
1.3 超声心动图在AngⅡ输注结束时(4周后),大鼠用戊巴比妥钠(40 mg/kg)麻醉。使用Vevo 1100高分辨率超声成像系统(加拿大Visualsonics公司)进行超声心动图分析。分别在B模式和M模式下获得心脏的长轴和短轴视图。在两个乳头肌之间获取M模式图像。由超声心动图软件自动计算左心室射血分数(ejection fraction,EF)和缩短分数(fraction shortening,FS)。所有测量值为3个连续心动周期的平均值。
1.4 组织病理学检查取出心脏并在4%多聚甲醛(北京Solarbio公司)中固定24~48 h,然后包埋在石蜡中。将样品切成3 μm切片,并使用Masson三色染色(美国Sigma-Aldrich公司),蓝色被染区域为纤维化区域。采用随机数字表法从每个样本选取10个随机场的图像进行拍摄,并通过Image J软件进行分析。
1.5 细胞培养和分组参照文献[9]的方法,从1~3日龄的SD大鼠心脏中酶促分离新生大鼠心肌细胞(neonatal rat cardiomyocytes,NRCM)。NRCM接种在含10%胎牛血清的营养培养基F-12(美国Gibco公司)中培养18 h,用于后续实验。
实验1考察LDN对NRCM纤维化的影响。将细胞分为:对照组(control组)、LDN组、AngⅡ组、AngⅡ+LDN组。为了抑制LDN组和AngⅡ+LDN组UCHL1活性,在AngⅡ刺激前,加入5 μmol/L LDN处理6 h。AngⅡ组和AngⅡ+LDN组加入AngⅡ(100 nmol/L)刺激细胞24 h。对照组和LDN组则加入等量DMSO处理细胞。
实验2考察UCHL1敲低对NRCM纤维化的影响。将细胞分为:对照组(control组)、si-NC组和si-UCHL1组。si-NC组和si-UCHL1组在AngⅡ刺激前,分别使用Lipofectamine 2000(美国Invitrogen公司)将si-NC或si-UCHL1转染细胞24 h,然后加入AngⅡ(100 nmol/L) 刺激细胞24 h。对照组则加入等量DMSO处理细胞。
实验3考察UCHL1过表达对NRCM的钙/钙调素依赖性蛋白激酶Ⅱ(calcium/calmodulin-dependent protein kinaseⅡ,CaMKⅡ)表达影响。将细胞分为:Vector组和UCHL1组。Vector组和UCHL1组在AngⅡ刺激前,分别使用Lipofectamine 2000(美国Invitrogen公司)将Vector或UCHL1过表达质粒转染细胞24 h,然后加入AngⅡ (100 nmol/L)刺激细胞24 h。
实验4考察UCHL1对纤维化的影响是否与CaMKⅡ有关。将细胞分为:对照组(control组)、AngⅡ+si-NC+Vector组、AngⅡ+si-UCHL1组、AngⅡ+si-UCHL1+CaMKⅡ组。除对照组外,其他组在AngⅡ刺激前,分别使用Lipofectamine 2000将si-NC、Vector、si-UCHL1或CaMKⅡ转染细胞24 h,然后加入AngⅡ(100 nmol/L) 刺激细胞24 h。对照组则加入等量DMSO处理细胞。
1.6 质粒构建和寡核苷酸转染为了建立UCHL1、CaMKⅡ稳定过表达的细胞系,将UCHL1和CaMKⅡ的cDNA序列克隆到从上海Hanbio Biotech公司获得的pHBLV-CMV-crRNA质粒慢病毒载体中。用嘌呤霉素(2 μg/mL)选择转染的细胞。UCHL1特异性siRNA(si-UCHL1)及其对照(si-NC)由上海GenePharma公司设计和合成。
1.7 免疫共沉淀(co-immunoprecipitation,Co-IP)使用Pierce Classic Magnetic IP/Co-IP试剂盒(美国Thermo Fischer Scientific公司)进行Co-IP。使用裂解缓冲液从NRCM中提取样品。将样品与兔UCHL1抗体(1 ∶100,Proteintec)、兔CaMKⅡ抗体(1 ∶100,Proteintech)或兔同种型对照IgG(1 ∶250,美国ABclonal公司)在4 ℃下搅拌旋转过夜。将25 μL蛋白A/G磁珠添加到样品中,并在4 ℃下孵育4 h。用裂解缓冲液洗涤珠子3次以去除未结合的蛋白质,并使用20 μL洗脱缓冲液洗脱结合的蛋白质,并在室温下摇动10 min。使用洗脱的蛋白质进行质谱分析或蛋白质印迹分析。
1.8 蛋白质印迹分析使用RIPA缓冲液(上海Beyotime公司)从心脏组织或NRCM中提取蛋白质。使用BCA试剂盒(上海Beyotime公司)对蛋白质浓度进行量化。对等量的蛋白质(50~100 μg)进行6%~12% SDS-PAGE电泳并转移到硝酸纤维素膜上。用QuickBlock Blocking Buffer (上海Beyotime公司)封闭30 min后,将膜与针对UCHL1(1 ∶2 000,美国Proteintech公司),Collagen Ⅰ (ColⅠ,1 ∶500,英国Abcam公司),α-SMA (1 ∶1 000,美国Proteintech公司),钙调素依赖性蛋白激酶Ⅱ(Ca2+/calmodulin-dependent protein kinaseⅡ,CaMKⅡ) (1 ∶1 000,美国Proteintech公司),泛素(1 ∶1 000,英国Abcam公司)和α-微管蛋白(1 ∶1 000,美国Proteintech公司)孵育过夜。次日,将膜与各自的HRP偶联二抗(武汉Boster公司)一起孵育2 h,并使用ChemiDoc Touch Imaging System(美国Bio-Rad公司)进行可视化。使用Image J分析特定条带。
1.9 免疫沉淀质谱分析(immunoprecipitation-mass spectrometer,IP-MS)对洗脱蛋白的免疫沉淀剂进行SDS-PAGE。在考马斯亮蓝染色后切除凝胶泳道,使用Orbitrap Elite质谱仪(美国Thermo Fisher Scientific公司)进行质谱分析。
1.10 免疫荧光染色将接种NRCM的切片于室温下在QuickBlock Blocking Buffer中封闭1 h后,与抗α-SMA (1 ∶100)、UCHL1 (1 ∶200)和CaMKⅡ(1 ∶200)的一抗在4 ℃下孵育过夜。此后,在室温下使用二抗(山羊抗兔Alexa Fluor 555偶联抗体,山羊抗兔Alexa Fluor 488偶联抗体,均购自美国Cell Signaling Technology公司)进行荧光标记1 h。用DAPI (1 ∶2 000,美国Sigma-Aldrich公司)对细胞核进行复染。所有图像使用LSM800共聚焦显微镜(德国Zeiss公司)捕获。
1.11 泛素化测定NRCM用si-NC或si-UCHL1处理24 h。在收获细胞前12 h加入蛋白酶体抑制剂MG132 (10 μmol/L,英国Abcam公司)。用抗CaMKⅡ抗体免疫沉淀全细胞裂解物,然后用抗泛素(Ub)抗体进行免疫印迹以评估CaMKⅡ蛋白的泛素化水平。
1.12 统计学分析使用SPSS 22.0进行统计分析。定量资料以x±s表示,使用Student's t检验分析两个实验组之间的差异,并使用单向ANOVA分析多个组之间的差异,组间两两比较采用Tukey检验。P < 0.05认为差异具有统计学意义。
2 结果 2.1 UCHL1表达在AF发病中的作用通过向大鼠皮下注入AngⅡ诱导AF,发现大鼠在4周后心电图有典型的房颤波改变,表明大鼠AF模型建立成功(图 1A)。与Sham组相比,AF组心脏组织中UCHL1蛋白表达以时间依赖性方式增加(图 1B)。此外,在AngⅡ处理的NRCM中,UCHL1的蛋白质水平表现出时间依赖性方式增加(图 1C)。这些结果表明UCHL1上调可能在AF发病中起关键作用。
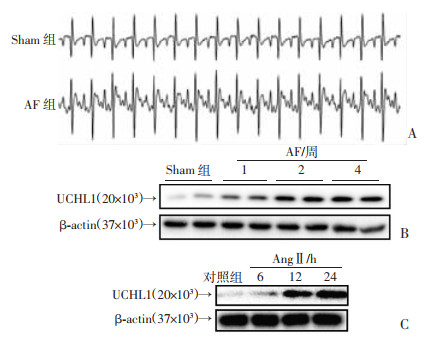
|
| A:AF模型大鼠ECG表现;B:蛋白质印迹分析AF后第1、2、4周心脏组织中UCHL1蛋白水平;C:蛋白质印迹分析不同时间点暴露于AngⅡ(100 nmol/L)的NRCM中UCHL1蛋白水平 图 1 UCHL1表达在AF发病中的作用 |
2.2 UCHL1的敲低可在体外减轻NRCM纤维化
采用LDN抑制NRCM中UCHL1的活性。与对照组比较,AngⅡ组NRCM中的促纤维化蛋白ColⅠ和α-SMA表达显著增加(P < 0.05)。AngⅡ+LDN组纤维化蛋白ColⅠ和α-SMA表达较AngⅡ组显著降低(P < 0.05,图 2A)。使用siRNA敲低NRCM中的UCHL1(图 2B),结果发现,与AngⅡ+si-NC组比较,AngⅡ+si-UCHL1组ColⅠ和α-SMA表达显著降低(P < 0.05,图 2C)。免疫荧光染色显示,AngⅡ+si-UCHL1组的α-SMA荧光强度显著低于AngⅡ+si-NC组(P < 0.05,图 2D)。结果表明UCHL1调节NRCM的纤维化反应。
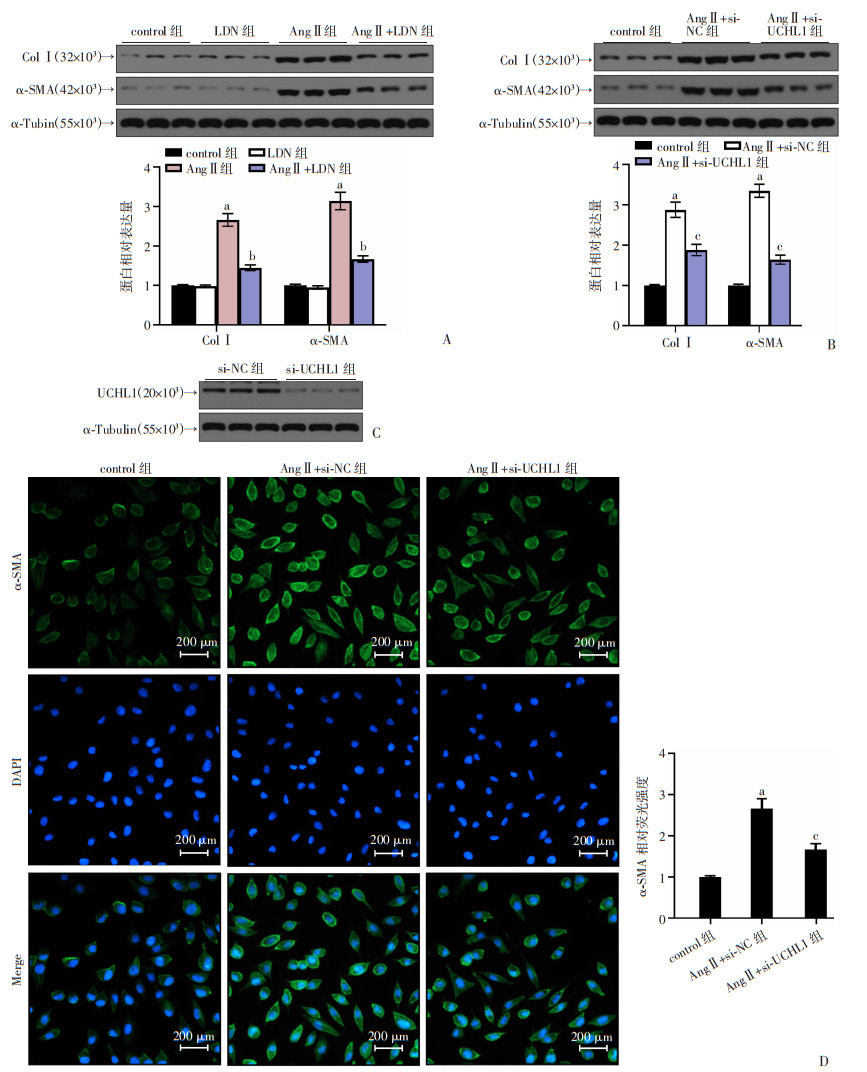
|
| A:LDN和AngⅡ处理的NRCM中ColⅠ和α-SMA蛋白水平;B:si-UCHL1敲低的NRCM中UCHL1蛋白水平;C:AngⅡ处理后si-UCHL1敲低的NRCM中ColⅠ和α-SMA蛋白水平;D:AngⅡ处理的si-UCHL1敲低的NRCM中ColⅠ和α-SMA蛋白表达 a:P < 0.05,与control组比较;b:P < 0.05,与AngⅡ组比较;c:P < 0.05,与AngⅡ+si-NC组比较 图 2 UCHL1的抑制敲低均下调AngⅡ介导的NRCM中促纤维化蛋白的表达 (x±s, n=3) |
2.3 LDN对UCHL1的抑制减轻了AF大鼠心脏纤维化并增强了心脏功能
为评估UCHL1是否在体内介导AF大鼠心脏纤维化,使用LDN抑制UCHL1。与Sham+DMSO组相比,AF+DMSO组心脏中的EF和FS显著降低(P < 0.01);间质纤维化面积和促纤维化蛋白α-SMA、ColⅠ表达显著增加(P < 0.01)。UCHL1抑制剂LDN显著抑制AF诱导的相关变化(图 3A~C)。此外,与AF+DMSO组相比,AF+LDN组AF的持续时间显著缩短(P < 0.01,图 3D)。

|
| A:超声心动图的代表性M模式图像和EF、FS定量分析实线:示突发起搏;虚线:示AF;B:Masson三色染色显示心肌边界区胶原沉积(×200);C:AF大鼠心脏中ColⅠ和α-SMA蛋白表达水平;D:AF大鼠的代表性心房电图记录和总AF持续时间 a:P < 0.01,与Sham+DMSO组比较;b:P < 0.01,与AF+DMSO组比较 图 3 LDN对UCHL1的抑制对AF大鼠心脏纤维化与心脏功能的影响 (n=10,x±s) |
2.4 UCHL1与CaMKⅡ相互作用
为确定UCHL1对AngⅡ介导的纤维化潜在机制,在AngⅡ诱导的NRCM中进行免疫沉淀质谱(IP-MS)以发现UCHL1相互作用物。通过分析MS数据,列出PSM数量>20的蛋白质作为与UCHL1发生免疫沉淀(immunoprecipitation,IP)的候选者,且CaMKⅡ位居榜首(表 1)。检测UCHL1和CaMK Ⅱ之间是否存在串扰,结果发现UCHL1与使用Co-IP的Ang Ⅱ刺激的NRCM中的CaMKⅡ相互作用(图 4A)。为确定CaMKⅡ是否受UCHL1调节,检测CaMKⅡ蛋白水平,发现NRCM中UCHL1过表达提高了CaMKⅡ蛋白水平(图 4B)。此外,UCHL1过表达降低了CaMKⅡ的多泛素化(图 4C)。结果表明UCHL1与CaMKⅡ相互作用,并通过去泛素化促进其上调。
| 与UCHL1发生IP的蛋白质 | PSMs数目 |
| 钙调素依赖性蛋白激酶Ⅱ | 30 |
| 膜联蛋白A6 | 27 |
| O-棕榈酰转移酶1 | 26 |
| 糖原磷酸化酶脑型 | 23 |
| 延伸因子Tu, 线粒体 | 22 |
| 富含半胱氨酸和甘氨酸的蛋白质3 | 22 |

|
| A:UCHL1蛋白与CaMKⅡ蛋白在AngⅡ刺激的NRCM中的Co-IP;B:UCHL1过表达的NRCM中CaMKⅡ蛋白水平的代表性免疫印迹分析;C:CaMKⅡ蛋白在AngⅡ刺激UCHL1过表达的NRCM中的泛素化水平 IB:免疫印迹(immunoblotting) 图 4 UCHL1与CaMKⅡ相互作用 |
2.5 CaMKⅡ降低了UCHL1敲低对AngⅡ刺激的NRCM中纤维化反应的抑制作用
考察UCHL1对纤维化的影响是否与CaMKⅡ有关。免疫印迹和免疫荧光共同发现NRCM中CaMKⅡ蛋白水平被AngⅡ上调(P < 0.05),并且UCHL1的敲低导致AngⅡ诱导的CaMKⅡ水平下调(P < 0.05,图 5A、图 6)。此外,与AngⅡ+si-UCHL1组相比,AngⅡ +si-UCHL1+CaMKⅡ组ColⅠ和α-SMA表达显著增加(P < 0.05,图 5B)。

|
| A:si-UCHL1敲低的NRCM中的CaMKⅡ蛋白水平;a:P < 0.01,与control组比较;b:P < 0.01,与AngⅡ+si-NC组比较;B:AngⅡ处理的si-UCHL1敲低和/或CaMKⅡ过表达的NRCM中ColⅠ和α-SMA蛋白水平 a:P < 0.01,与control组比较;b:P < 0.01,与AngⅡ+si-NC+Vector组比较;c:P < 0.05,与AngⅡ+si-UCHL1组比较 图 5 CaMKⅡ降低了UCHL1敲低对AngⅡ刺激的NRCM中纤维化反应的抑制作用 (x±s) |
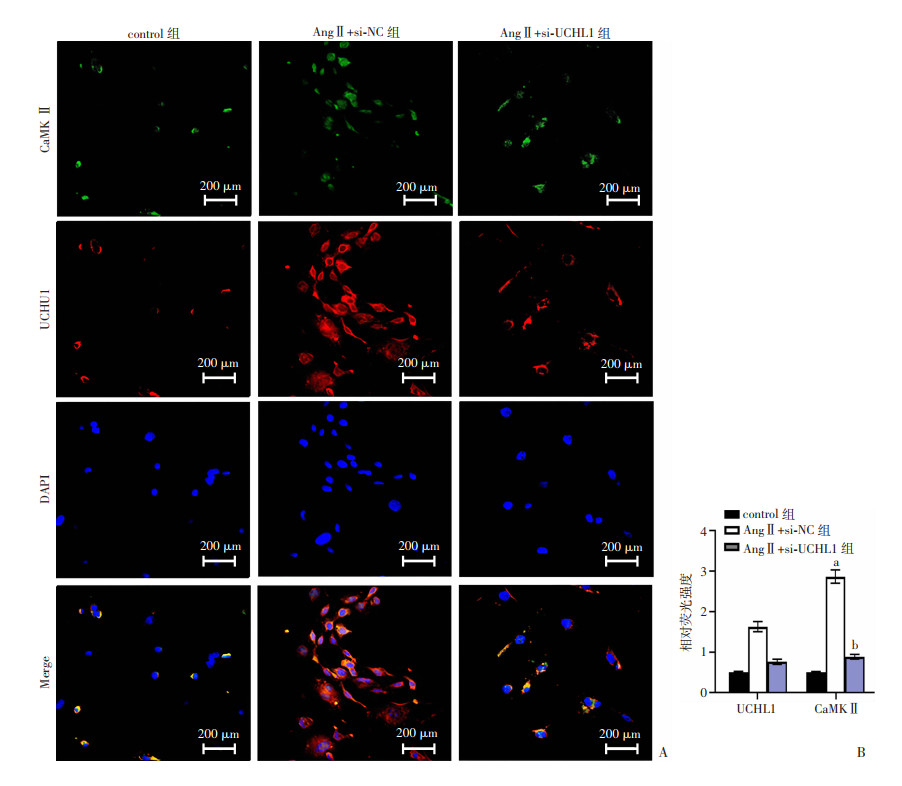
|
| a:P < 0.01,与control组比较;b:P < 0.01,与AngⅡ+si-NC组比较 图 6 免疫荧光检测AngⅡ处理的si-UCHL1敲低的NRCM中UCHL1和CaMKⅡ蛋白表达 (x±s) |
3 讨论
近来,UCHL1在心肌梗死、肥厚性心脏病、高血压等多种心血管疾病中的作用备受关注[10]。UCHL1调节AF的具体机制尚不清楚。心房纤维化是诱导AF的关键。高活性和大量的内源性AngⅡ(肾素-血管紧张素系统的一个因子)参与了心肌纤维化的机制,并且通常认为AngⅡ在心房纤维化中起重要作用[11]。ZHAN等[12]报道,用AngⅡ持续皮下刺激会导致大鼠间质心房纤维化和AF诱导率增加。有研究表明Ang Ⅱ可通过激活素A/激活素受体样激酶途径引起心房纤维化[13]。本研究发现AngⅡ治疗的大鼠心房纤维化显著增加,并且用Ang Ⅱ处理的NRCM细胞中α-SMA、ColⅠ上调。UCHL1抑制剂可减轻AF后的心功能不全、房颤持续时间和纤维化。UCHL1与CaMKⅡ相互作用,并通过去泛素化促进其上调。在AngⅡ刺激和UCHL1抑制下,CaMKⅡ过表达逆转了UCHL1敲低的抗纤维化作用。因此,UCHL1-CaMKⅡ轴可能是AF心脏纤维化治疗的新靶点。
UCHL1是一种去泛素化酶,其通过消除多种蛋白质的泛素化,包括c-Jun激活结构域结合蛋白-1、缺氧诱导因子1α和核因子κB-α,在调节癌症、神经退行性疾病和炎症反应中具有重要作用[7, 14-15]。既往研究表明,UCHL1在健康组织中的表达水平较低,但在几种形式的癌症和肺肿瘤细胞系中表达上调且可能与肺高压及成肌细胞的增殖与分化相关[6, 16-17]。此外,UCHL1与调节hIAPP-Tg小鼠的β细胞凋亡和糖尿病进展有关[18]。本研究结果显示,在AngⅡ输注后,心房中UCHL1的表达增加,表明UCHL1表达上调可能影响AF易感性。心房纤维化通常被认为是AF患者最显著的结构重塑类型,也是AF持续存在的结构基础[19]。细胞外基质蛋白过度沉积是心房纤维化相关病理变化的主要原因。本研究证明了抑制剂LDN和siRNA敲低对UCHL1活性的抑制减弱了AngⅡ诱导的心脏纤维化并增强了心脏功能,表明UCHL1在AF病理发展中的重要作用。
为了找到UCHL1的潜在机制,本研究使用IP-MS筛选了它的相互作用蛋白,并将CaMKⅡ确定为候选相互作用蛋白。这与CaMKⅡ在NRCM细胞中与UCHL1共定位的发现一致。为了确定UCHL1和CaMKⅡ之间是否存在直接相互作用,本研究通过共免疫沉淀验证了UCHL1和CaMKⅡ的相互作用。CaMKⅡ是一种多功能丝氨酸-苏氨酸蛋白激酶,在心脏中大量表达。CaMKⅡ是Ca2+连接信号传导的主要调节剂,能够调节心肌细胞膜的兴奋性[20]。CaMKⅡ激活依赖于Ca2+/CaM结合,然后诱导底物磷酸化和自磷酸化[21]。CaMKⅡ的功能障碍会增加Ca2+处理异常。LIU等[21]证明CaMKⅡ的表达和活性在起搏引起的房性心动过速的狗模型中增加。GRANDI等[22]发现CaMKⅡ表达在患有AF的山羊模型中增加。本研究还证实,用UCHL1处理的NRCM中CaMKⅡ显著增加,并且其上调是由于UCHL1过表达导致泛素化减少所致。为了解UCHL1是否通过上调CaMKⅡ在心脏纤维化过程中发挥其促纤维化作用,使用CaMKⅡ质粒过表达NRCM细胞中CaMKⅡ,并发现CaMKⅡ降低了UCHL1敲低对AngⅡ刺激的NRCM中纤维化反应的抑制作用。本研究数据表明UCHL1-CaMKⅡ复合物在AF心脏纤维化中起重要调节作用。
综上所述,UCHL1与CaMKⅡ相互作用并通过去泛素化上调CaMKⅡ,从而促进AF的心脏纤维化。针对UCHL1-CaMKⅡ相互作用的干预措施可能是针对AF心脏纤维化的潜在治疗策略。
| [1] |
李泰然, 陈桂英. 心外膜脂肪组织与心房颤动的分子机制研究进展[J]. 生物化学与生物物理进展, 2021, 48(9): 1016-1022. LI T R, CHEN G Y. Research progress on molecular mechanism of epicardial adipose tissue and atrial fibrillation[J]. Prog Biochem Biophys, 2021, 48(9): 1016-1022. |
| [2] |
JANUARY C T, WANN L S, CALKINS H, et al. 2019 AHA/ACC/HRS focused update of the 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation: a report of the American college of cardiology/American heart association task force on clinical practice guidelines and the heart rhythm society[J]. J Am Coll Cardiol, 2019, 74(1): 104-132. |
| [3] |
YUAN Y, ZHAO J, GONG Y T, et al. Autophagy exacerbates electrical remodeling in atrial fibrillation by ubiquitin-dependent degradation of L-type calcium channel[J]. Cell Death Dis, 2018, 9(9): 873. |
| [4] |
刘志浩, 倪晶宇, 郭蕊, 等. 翻译后修饰对SERCA2a的作用在心血管疾病中的研究进展[J]. 中华心血管病杂志, 2020, 48(2): 164-167. LIU Z H, NI J Y, GUO R, et al. Advances in research on the effects of post-translational modification on SERCA2a in cardiovascular diseases[J]. Chin J Cardiol, 2020, 48(2): 164-167. |
| [5] |
AHN H J, JUNG S, YOU Y, et al. The value of cerebrospinal fluid ubiquitin C-terminal hydrolase-L1 protein as a prognostic predictor of neurologic outcome in post-cardiac arrest patients treated with targeted temperature management[J]. Resuscitation, 2020, 151: 50-58. |
| [6] |
MAO R D, TAN X, XIAO Y, et al. Ubiquitin C-terminal hydrolase L1 promotes expression of programmed cell death-ligand 1 in non-small-cell lung cancer cells[J]. Cancer Sci, 2020, 111(9): 3174-3183. |
| [7] |
GONG Z, YE Q, WU J W, et al. UCHL1 inhibition attenuates cardiac fibrosis via modulation of nuclear factor-κB signaling in fibroblasts[J]. Eur J Pharmacol, 2021, 900: 174045. |
| [8] |
XIAO Z Z, REDDY D P K, XUE C Q, et al. Profiling of miR-205/P4HA3 following angiotensin Ⅱ-induced atrial fibrosis: implications for atrial fibrillation[J]. Front Cardiovasc Med, 2021, 8: 609300. |
| [9] |
USUI S, CHIKATA A, TAKATORI O, et al. Endogenous muscle atrophy F-box is involved in the development of cardiac rupture after myocardial infarction[J]. J Mol Cell Cardiol, 2019, 126: 1-12. |
| [10] |
MCMACKEN G, LOCHMVLLER H, BANSAGI B, et al. Behr syndrome and hypertrophic cardiomyopathy in a family with a novel UCHL1 deletion[J]. J Neurol, 2020, 267(12): 3643-3649. |
| [11] |
LU L, CAO L, LIU Y H, et al. Angiotensin (ang) 1-7 inhibits ang Ⅱ-induced atrial fibrosis through regulating the interaction of proto-oncogene tyrosine-protein kinase Src (c-Src) and Src homology region 2 domain-containing phosphatase-1 (SHP-1)[J]. Bioengineered, 2021, 12(2): 10823-10836. |
| [12] |
ZHAN Y G, ABE I, NAKAGAWA M, et al. A traditional herbal medicine rikkunshito prevents angiotensin Ⅱ-induced atrial fibrosis and fibrillation[J]. J Cardiol, 2020, 76(6): 626-635. |
| [13] |
WANG Q, YU Y, ZHANG P P, et al. The crucial role of activin A/ALK4 pathway in the pathogenesis of AngⅡ-induced atrial fibrosis and vulnerability to atrial fibrillation[J]. Basic Res Cardiol, 2017, 112(4): 47. |
| [14] |
LI X B, HATTORI A, TAKAHASHI S, et al. Ubiquitin carboxyl-terminal hydrolase L1 promotes hypoxia-inducible factor 1-dependent tumor cell malignancy in spheroid models[J]. Cancer Sci, 2020, 111(1): 239-252. |
| [15] |
DOWNEY A, OLCOTT M, SPECTOR D, et al. Stable knockout of lanthionine synthase C-like protein-1 (LanCL1) from HeLa cells indicates a role for LanCL1 in redox regulation of deubiquitinating enzymes[J]. Free Radic Biol Med, 2020, 161: 115-124. |
| [16] |
GAO H B, HARTNETT S, LI Y F. Ubiquitin C-terminal hydrolase L1 regulates myoblast proliferation and differentiation[J]. Biochem Biophys Res Commun, 2017, 492(1): 96-102. |
| [17] |
WADE B E, ZHAO J R, MA J, et al. Hypoxia-induced alterations in the lung ubiquitin proteasome system during pulmonary hypertension pathogenesis[J]. Pulm Circ, 2018, 8(3): 2045894018788267. |
| [18] |
COSTES S, BERTRAND G, RAVIER M A. Mechanisms of beta-cell apoptosis in type 2 diabetes-prone situations and potential protection by GLP-1-based therapies[J]. Int J Mol Sci, 2021, 22(10): 5303. |
| [19] |
李健兰, 陈灿. 心房颤动患者心房纤维化检测方式的研究进展[J]. 山东医药, 2020, 60(13): 85-88. LI J L, CHEN C. Research progress on the detection method of atrial fibrosis in patients with atrial fibrillation[J]. Shandong Med J, 2020, 60(13): 85-88. |
| [20] |
马婧, 刘晓莉, 乔德才. 钙/钙调蛋白依赖性蛋白激酶Ⅱ在突触可塑性和神经精神疾病中的作用[J]. 中国药理学通报, 2018, 34(11): 1485-1488. MA J, LIU X L, QIAO D C. Role of calcium/calmodulin-dependent protein kinase Ⅱ in synaptic plasticity and neuropsychiatric disorders[J]. Chin Pharmacol Bull, 2018, 34(11): 1485-1488. |
| [21] |
LIU T, XIONG F, QI X Y, et al. Altered calcium handling produces reentry-promoting action potential alternans in atrial fibrillation-remodeled hearts[J]. JCI Insight, 2020, 5(8): e133754. |
| [22] |
GRANDI E, DOBREV D. Non-ion channel therapeutics for heart failure and atrial fibrillation: are CaMKⅡ inhibitors ready for clinical use?[J]. J Mol Cell Cardiol, 2018, 121: 300-303. |






