2. 810007 西宁, 解放军第九四一医院超声诊断科
2. Department of Ultrasound Diagnosis, NO. 941 Hospital of the PLA Joint Logistic Support Force, Xining, Qinghai Province, 810007, China
鼻咽癌(nasopharyngeal carcinoma,NPC) 起源于鼻咽黏膜上皮,是头颈部最常见的恶性肿瘤。2020年全球新确诊NPC 13.3万例,其中超过6.2万例(46.6%)发生在中国[1]。NPC是中国地域特色的恶性肿瘤,中国NPC发病率为20/10万,高于欧美地区(1/10万)[2]。中国广东地区NPC发病率世界最高,以40~60岁为高发年龄[3]。
放疗是NPC患者主要且有效的治疗手段。早期NPC患者采取单纯根治性放疗即可获得满意的治疗效果[4]。但由于NPC早期症状和体征不明显,约70%患者初诊即为局部晚期,且易发生区域淋巴结转移,病灶侵犯广泛,单纯放疗效果欠佳[5]。NPC对化疗敏感,综合治疗成为各大指南推荐的标准方案,包括同步放化疗(concurrent chemoradiotherapy,CCRT)、诱导化疗(induction chemotherapy,IC)、辅助化疗(adjuvant chemotherapy,AC)及以上不同方案的组合。随着调强放疗(intensity modulated radiation therapy,IMRT)的普及和综合治疗的应用,该病5年总生存率(overall survival, OS)为80%~85%[6],5年局部控制率高达90%~95%[7]。
有研究显示,与单纯放疗相比,同步化疗可显著改善局部晚期鼻咽癌患者的5年OS和无进展生存期(progression-free survival, PFS),显著降低患者总体无失败生存率(在任何部位首次失败的时间)、PFS及癌症特异性死亡[8-9]。然而,局部晚期NPC患者放化疗联合治疗的最佳方式存在争议。KONG等[10]的分析证实CCRT在局部晚期NPC患者治疗中的价值,认为是最有效的放化疗联合方式。经过标准治疗后(根治性CCRT联合或不联合IC),虽然大多数患者达到完全临床缓解,但仍有10%~30%的患者出现局部复发或远处转移[11]。CCRT后强化辅助化疗可减少远处转移,改善患者生存,CCRT联合辅助化疗已在宫颈癌等多种肿瘤取得了明确的生存获益[12],而在局部晚期NPC的临床价值并不清晰。TAO等[13]研究表明,与IC+ CCRT比较,IC+CCRT后的AC可以减少N2~3期NPC的远处转移,改善OS和无病生存期(disease-free survival, DFS)。CHEN等[14]研究表明,与IC+CCRT相比,在IC+CCRT中加入节拍化疗(节拍化疗指频繁和定期地给予化疗药物,其剂量远低于通常规定的剂量,且不延长无药物休息期,有毒性低,依从性好的优点)卡培他滨作为一种辅助化疗,可显著提高高风险局部晚期NPC患者的3年无失败生存期(failure free survival, FFS),且3年OS提高4.7%,安全性可控,不影响生活质量。另有研究报道,与单纯CCRT相比,CCRT联合辅助化疗未能给局部晚期NPC患者带来生存获益[15-16],反而增加3~4级放化疗不良反应[13]。因此,对于局部晚期NPC患者,辅助化疗是否带来生存获益存在争议。本研究回顾性分析辅助化疗对局部晚期NPC患者生存结局及放化疗不良反应的影响,以期为临床提供参考。
1 资料与方法 1.1 临床资料筛选2011年4月至2019年1月就诊于陆军军医大学第二附属医院放射治疗中心的局部晚期NPC放疗患者318例,纳入标准:①经病理组织学和/或细胞学确诊的初治无远处转移的局部晚期(Ⅲ~ⅣA期)NPC患者;②接受根治性CCRT;③治疗前已行鼻咽及颈部MRI和/或CT检查;④无严重内科疾病;⑤无放射治疗史;⑥既往无恶性肿瘤病史,无第二肿瘤;⑦有放疗前、放疗后3个月详细的影像学资料;⑧有完整的病历记录和随访信息;⑨联合铂类化疗。排除标准:①全身一般情况差,不能平卧者,伴有心、肺等重要脏器功能严重障碍者;②IMRT期间出现远处转移或因其他原因不能坚持完成同步放化疗者,或中断放疗者;③初治远处转移患者。本研究已通过陆军军医大学第二附属医院伦理委员会审查(2018-研第076-01)。
1.2 治疗方案 1.2.1 放射治疗应用医用电子直线加速器(美国VARIAN公司),6 MV X线;鼻咽和颈部采用RapidArc和9野调强技术同时照射。CCRT指同时接受化疗及放疗,同步输注化疗药物以加强放射治疗效果。同步治疗中的放疗:每天接受短暂照射以累积放射剂量达到根治效果,每周一至周五进行,NPC的CCRT需要6~7周。
1.2.2 化疗所有患者采用含铂化疗方案:①IC,是指同步放化疗前的化疗, 包括1~4个周期,化疗方案:亚叶酸钙(200 mg/m2,1~5 d,静脉滴注)+氟尿嘧啶(500 mg/m2,1~5 d,静脉滴注)+奈达铂/顺铂(75 mg/m2,1~3 d,静脉滴注),每周期21天;或紫杉醇(135 mg/m2,1 d,静脉滴注)+奈达铂/顺铂(75 mg/m2,1~3 d,静脉滴注),每周期21天。②辅助化疗,是指同步放化疗后的化疗,其化疗周期及用药方案与IC相同。③CCRT,是指在放射治疗期间同步化疗,同步化疗方案:顺铂(40 mg/m2,1 d,静脉滴注),放疗期间每1周同步化疗1次, 共化疗6~7次;或奈达铂/顺铂(100 mg/m2,1 d,静脉滴注),放疗期间每3周化疗1次。
1.3 数据收集和随访收集患者基线临床指标,包括:年龄、性别、病理类型、吸烟情况、基础疾病、体力状况评分(performance status,PS)、疼痛评分、EBV、治疗方案、TNM分期(参考AJCC第八版)。所有患者治疗结束后,3年内每3个月复查1次,4~5年每半年复查1次,5年后每年复查1次。共纳入318例患者资料,随访截止时间为2021年1月,随访中位时间为56.43个月。随访中有58例患者失访,58例患者出现局部复发和/或区域淋巴结复发,23例患者出现远处转移,1例患者出现局部复发和/或区域淋巴结复发合并远处转移,53例患者死亡。
1.4 疗效及毒副反应评价主要观察指标:OS为确诊时间至任何原因死亡时间;PFS为确诊时间至疾病进展时间或任何原因死亡时间;DMFS为确诊时间至远处转移时间;RFS为确诊时间至疾病复发时间。次要观察指标为放化疗不良反应,其评分采用国际常见不良反应标准RTOG急性放射损伤分级标准,由临床主管医师判断。
将318例患者按照是否联合辅助化疗分为2组,以OS、PFS、DMFS、RFS为终点作生存曲线;比较318例患者数据中行单纯CCRT与CCRT+AC、IC+CCRT与IC+CCRT+AC治疗的生存差异;通过生存分析结果,分层选出适宜辅助化疗人群;在各项临床指标中分层分析辅助化疗与OS、PFS、DMFS、RFS的关系。分层分析前检测辅助组与未辅助组数据基线是否一致,不一致时用倾向匹配评分进行配对。
1.5 统计学分析采用SPSS 25.0统计软件进行分析,连续变量以中位数划分范围,分类变量以例数和百分比表示。临床特征基线比较,计数资料采用χ2检验及Fisher确切概率法,等级资料采用非参数检验。应用Kaplan-Meier法评估患者生存,倾向匹配评分进行配对。组间比较采用log-rank检验,显著性检验均为双侧检验。P < 0.05表示差异有统计学意义。
2 结果 2.1 患者临床特征318例患者年龄17~78岁,中位年龄47岁,男性215例(67.61%),女性103例(32.39%)。根据NPC第八版AJCC TNM分期标准,Ⅲ期患者251例(78.93%),ⅣA期者67例(21.07%)。未辅助组116例(36.48%),包含单纯CCRT 13例(4.09%),IC+CCRT 103例(32.39%);辅助组202例(63.52%),包含CCRT+AC 8例(2.52%),IC+CCRT+AC 194例(61.01%)。放化疗不良反应主要是急性放射性黏膜炎,骨髓抑制、急性放射性咽炎和食管炎。在318例患者中,根据两组基线数据比较发现,仅年龄、性别、EBV分布存在差异(P < 0.05), 见表 1;为了使两组数据具有可比性(即满足均衡性原则), 按照比例1∶1、0.02的匹配容差进行配对,获得99组配对数据;匹配后两组数据基线之间无差异,见表 1。
| 配对前 | 配对后 | ||||||
| 辅助组(n=202) | 未辅助组(n=116) | P | 辅助组(n=99) | 未辅助组(n=99) | P | ||
| 年龄/岁 | 0.028 | 0.776 | |||||
| < 47 | 84(41.58) | 63(54.31) | 52(52.53) | 50(50.51) | |||
| ≥47 | 118(58.42) | 53(45.69) | 47(47.47) | 49(49.50) | |||
| 性别 | 0.004 | 0.881 | |||||
| 男 | 147(72.77) | 68(58.62) | 65(65.66) | 66(66.67) | |||
| 女 | 55(27.23) | 48(41.38) | 34(34.34) | 33(33.33) | |||
| 病理类型 | 0.090 | 0.372 | |||||
| 非角化 | 144(71.29) | 72(62.07) | 61(61.62) | 67(67.68) | |||
| 其他 | 58(28.71) | 44(37.93) | 38(38.38) | 32(32.32) | |||
| 基础疾病 | 0.356 | 0.416 | |||||
| 无 | 154(76.24) | 83(71.55) | 76(76.77) | 71(71.72) | |||
| 有 | 48(23.76) | 33(28.45) | 23(23.23) | 28(28.28) | |||
| 吸烟情况 | 0.068 | 0.392 | |||||
| 不吸烟 | 104(51.49) | 72(62.07) | 51(51.52) | 57(57.58) | |||
| 吸烟 | 98(48.51) | 44(37.93) | 48(48.48) | 42(42.42) | |||
| PS评分 | 0.711 | 0.540 | |||||
| 0分 | 65(32.18) | 35(30.17) | 29(29.29) | 33(33.33) | |||
| ≥1分 | 137(67.82) | 81(69.83) | 70(70.71) | 66(66.67) | |||
| 疼痛评分 | 0.116 | 0.644 | |||||
| 0分 | 153(75.74) | 74(63.79) | 67(67.68) | 70(70.71) | |||
| ≥1分 | 49(24.26) | 42(36.21) | 32(32.32) | 29(29.30) | |||
| T分期 | 0.721 | 0.687 | |||||
| T1 | 2(0.99) | 3(2.59) | 1(1.01) | 3(3.03) | |||
| T2 | 111(54.95) | 59(50.86) | 53(53.54) | 52(52.53) | |||
| T3 | 75(37.13) | 44(37.93) | 38(38.38) | 39(39.39) | |||
| T4 | 14(6.93) | 10(8.62) | 7(7.07) | 5(5.05) | |||
| N分期 | 0.739 | 0.636 | |||||
| N0 | 5(2.48) | 2(1.72) | 2(2.02) | 2(2.02) | |||
| N1 | 6(2.97) | 4(3.45) | 3(3.03) | 4(4.04) | |||
| N2 | 161(79.70) | 95(81.90) | 78(78.79) | 79(79.80) | |||
| N3 | 30(14.85) | 15(12.93) | 16(16.16) | 14(14.14) | |||
| 临床分期 | 0.249 | 0.288 | |||||
| Ⅲ | 158(78.22) | 93(80.17) | 76(76.77) | 82(82.83) | |||
| ⅣA | 44(21.78) | 23(19.83) | 23(23.23) | 17(17.17) | |||
| EBV | 0.017 | 0.875 | |||||
| 阴性 | 50(24.75) | 20(17.24) | 23(23.23) | 20(20.20) | |||
| 阳性 | 112(55.45) | 57(49.14) | 51(51.52) | 53(53.54) | |||
| 未知 | 40(19.80) | 39(33.62) | 25(25.25) | 26(26.26) | |||
| 急性放射性黏膜炎 | 0.776 | ||||||
| 0级 | 3(1.49) | 2(1.72) | |||||
| 1级 | 6(2.97) | 2(1.72) | |||||
| 2级 | 27(13.37) | 16(13.79) | |||||
| 3级 | 138(68.32) | 83(71.55) | |||||
| 4级 | 28(13.86) | 13(11.21) | |||||
| 骨髓抑制 | 0.001 | ||||||
| 0级 | 18(8.91) | 24(20.69) | |||||
| 1级 | 40(19.80) | 27(23.28) | |||||
| 2级 | 75(37.13) | 39(33.62) | |||||
| 3级 | 41(20.30) | 20(17.24) | |||||
| 4级 | 28(13.86) | 6(5.17) | |||||
| 急性放射性咽炎和食管炎 | 0.051 | ||||||
| 0级 | 7(3.47) | 2(1.72) | |||||
| 1级 | 11(5.45) | 7(6.03) | |||||
| 2级 | 152(75.25) | 77(66.38) | |||||
| 3级 | 32(15.84) | 29(25.00) | |||||
| 4级 | 0 | 1(0.86) | |||||
2.2 生存分析
分析318例患者数据中治疗方案与生存的关系,结果显示:辅助组与未辅助组患者3年OS(88.95% vs 84.56%)、PFS(85.55% vs 80.38%)、DMFS(87.05% vs 82.55%)、RFS(88.58% vs 83.58%)无明显差异,见图 1。
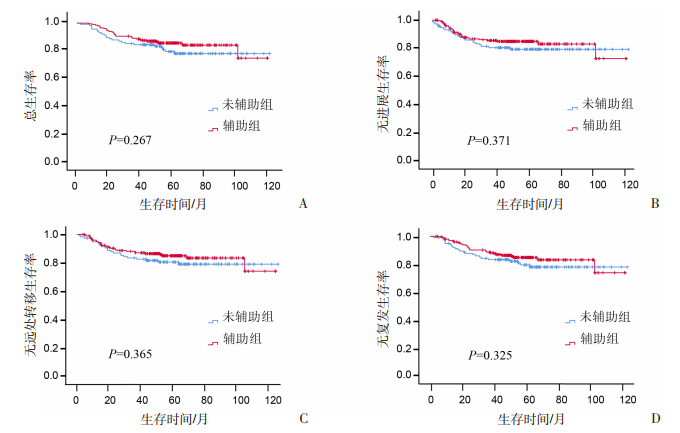
|
| 图 1 配对前辅助组与未辅助组患者的生存分析 |
分析配对后99对患者治疗方案与生存的关系,结果显示:辅助组与未辅助组患者3年OS (89.86% vs 86.86%)、PFS(83.26% vs 83.26%)、DMFS (86.24 % vs 84.86%)、RFS (89.25 % vs 85.44%)无明显差异,见图 2。
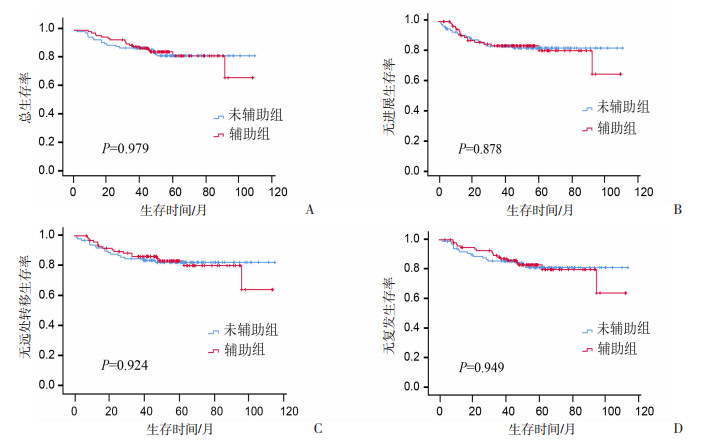
|
| 图 2 配对后辅助组与未辅助组患者的生存分析 |
2.3 分层分析 2.3.1 单纯CCRT与CCRT+AC
结果显示:318例患者中,辅助化疗有明显提高患者3年OS(61.25% vs 100.00%)、PFS(61.75% vs 85.75%)、DMFS(61.55% vs 87.55%)、RFS(61.55% vs 85.75%)的趋势,但未达到统计学意义,见图 3。
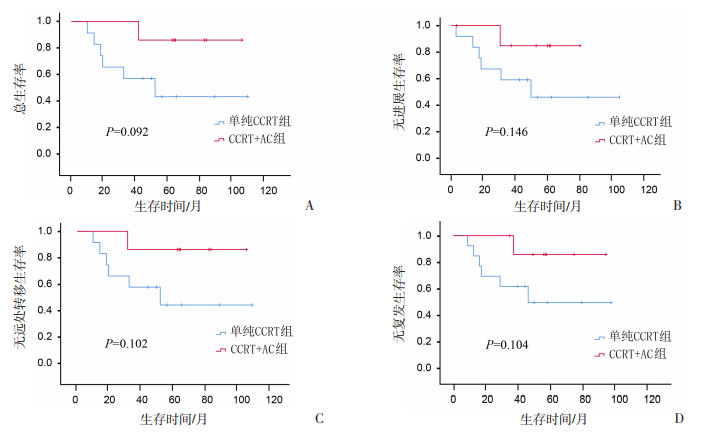
|
| 图 3 318例患者采用单纯CCRT与CCRT+AC治疗后的生存分析 |
2.3.2 IC+CCRT与IC+CCRT+AC
结果显示:在318例患者中,与IC+CCRT相比,辅助化疗有降低患者3年OS(89.05% vs 83.25%)、PFS(83.85% vs 80.15%)、DMFS(86.55% vs 82.55%)、RFS(87.55% vs 82.65%)的趋势,但未达到统计学意义。见图 4。
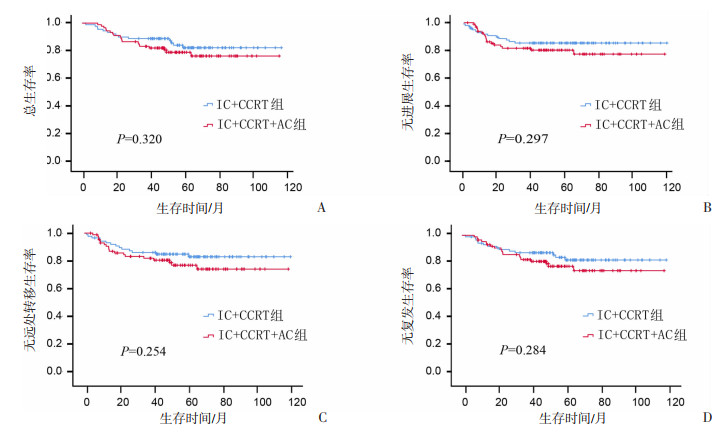
|
| 图 4 318例患者采用IC+CCRT与IC+CCRT+AC治疗后的生存分析 |
2.3.3 临床指标分层分析
在配对的99对患者中,辅助组与未辅助组在不同年龄(< 47岁、≥47岁)、性别(男性、女性)、病理类型(非角化型鳞癌、其他类型)、吸烟(吸烟、不吸烟)、基础疾病(有基础疾病、无基础疾病)、体力状态评分(PS=0分、PS≥1分)、疼痛评分(疼痛评分0分、疼痛评分≥1分)、EBV(EBV阴性、EBV未知)、T分期(T1~2期、T3期)、N分期(N0~2期)、临床分期(Ⅲ期)的OS、PFS、DMFS、RFS差异均无统计学意义。辅助化疗有提高EBV阳性患者3年OS(92.15% vs 85.15%)、PFS(86.66% vs 78.88%)、DMFS(87.55% vs 80.75%)、RFS(91.45% vs 82.95%)的趋势,但未达到统计学意义,见图 5。
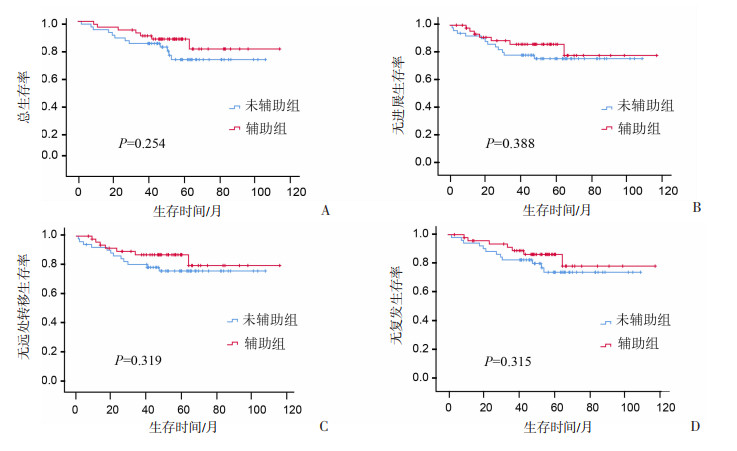
|
| 图 5 配对后EBV阳性患者辅助组与未辅助组的生存分析 |
T4期:分析配对后的99对数据中,T4期患者辅助组与未辅助组的生存差异,结果显示:辅助化疗有提高T4期患者中位RFS(99.87个月vs 54.00个月)的趋势,但未达到统计学意义,见图 6。N3期:分析配对后99对数据中N3期辅助组与未辅助组的生存比较,结果显示:辅助化疗有明显提高N3期患者3年OS(87.55% vs 50.25%)、PFS(61.45% vs 42.75%)、DMFS(67.45% vs 42.75%)、RFS(87.55% vs 50.25%,P=0.110)的趋势,但未达到统计学意义,见图 7。ⅣA期:分析配对后99对数据中ⅣA期辅助组与未辅助组的生存比较,结果显示:辅助化疗有明显提高ⅣA期患者中位OS(60.33个月vs 99.87个月)、中位PFS(27.95个月vs 99.87个月)、中位DMFS(60.33个月vs 99.87个月)、中位RFS(54.90个月vs 99.87个月)的趋势,但未达到统计学意义,见图 8。
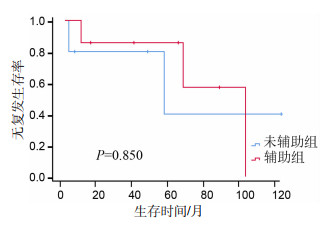
|
| 图 6 配对后T4期患者辅助组与未辅助组的生存分析 |
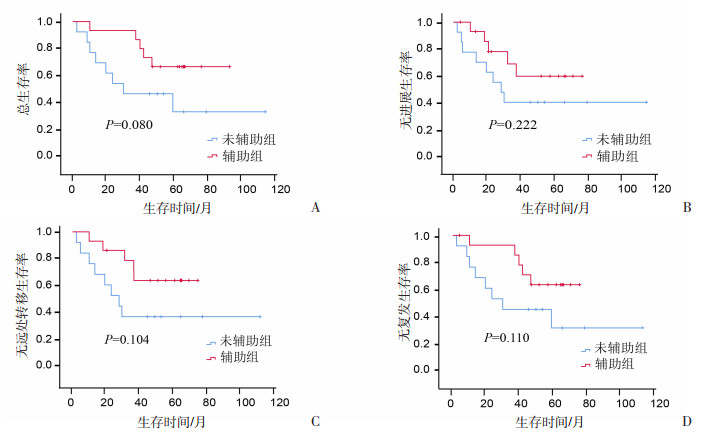
|
| 图 7 配对后N3期患者辅助组与未辅助组的生存分析 |
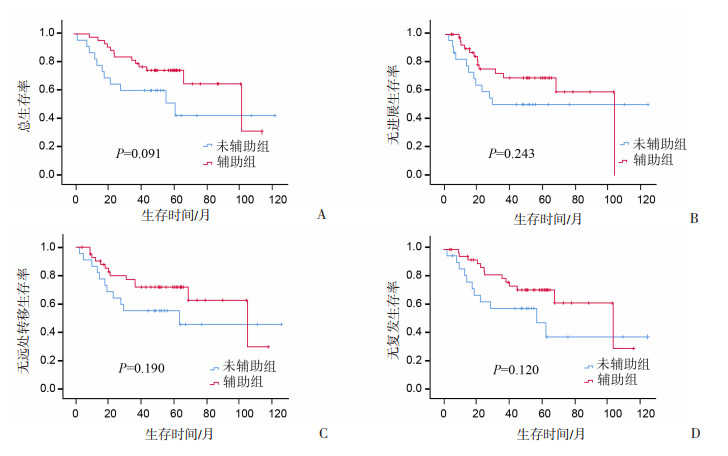
|
| 图 8 配对后IVA期患者辅助组与未辅助组的生存分析 |
2.4 治疗相关不良反应
分析配对后的99对数据放化疗不良反应,结果显示辅助组2级以上骨髓抑制发生率高于未辅助组(68% vs 55%,P=0.020);其余不良反应差异无统计学意义(表 3)。在分层分析时,各临床变量之间放化疗不良反应(急性放射性黏膜炎、骨髓抑制、急性放射性咽炎和食管炎)差异均无统计学意义。
| 变量 | 辅助组 | 未辅助组 | P |
| 急性放射性黏膜炎 | 0.200 | ||
| 0级 | 2(2.02) | 2(2.02) | |
| 1级 | 3(3.03) | 2(2.02) | |
| 2级 | 10(10.10) | 15(15.15) | |
| 3级 | 70(70.71) | 70(70.71) | |
| 4级 | 14(14.14) | 10(10.10) | |
| 骨髓抑制 | 0.024 | ||
| 0级 | 12(12.12) | 21(21.21) | |
| 1级 | 19(19.19) | 23(23.23) | |
| 2级 | 36(36.36) | 33(33.33) | |
| 3级 | 19(19.19) | 16(16.16) | |
| 4级 | 13(13.13) | 6(6.06) | |
| 急性放射性咽炎和食管炎 | 0.725 | ||
| 0级 | 6(6.06) | 2(2.02) | |
| 1级 | 4(4.04) | 7(7.07) | |
| 2级 | 69(69.70) | 67(67.68) | |
| 3级 | 20(20.20) | 22(22.22) | |
| 4级 | 0 | 1(1.01) |
3 讨论
对于辅助化疗对局部晚期NPC患者的临床价值,国内外尚没有国际公认的指南推荐。《中国鼻咽癌放射治疗指南》(2020版)推荐,在放疗的基础上联合铂类同步化疗是其主要治疗模式,即在CCRT的基础上进一步增加化疗强度(如联合诱导化疗或辅助化疗)[4]。然而CCRT联合辅助化疗是否能给局部晚期NPC患者带来生存获益并无定论。HUI等[17]研究结果显示,与单独使用CCRT相比,CCRT后辅助化疗的获益尚不确定。LIU等[18]的研究认为,与单纯的根治性放疗相比,辅助化疗可以减少NPC患者的远处转移,并延长高危NPC患者(N3、T4)的OS。
本研究结果显示:无论在318例总体数据中,还是在99组配对数据中,辅助组与未辅助组对OS、PFS、DMFS、RFS等指标均没有显著差异。分层结果显示,单纯CCRT与CCRT+AC的生存时间比较虽然有很明显的数值差异,但未达到统计学意义,可能与样本量较少有关。同时,与IC+CCRT相比,IC+CCRT+AC有降低患者OS、PFS、DMFS、RFS的趋势,具体原因不详。辅助化疗对于EBV阳性、N3期患者有OS、PFS、DMFS、RFS的获益趋势,对于T4期患者有RFS获益趋势,对于ⅣA期患者有中位OS、中位PFS、中位DMFS、中位RFS的获益趋势。由此推论:并非所有的局部晚期NPC患者都能从CCRT后联合辅助化疗取得生存获益。对于部分患者,如EBV阳性、N3期患者,在CCRT后联合辅助化疗能带来一定的生存获益。ZONG等[19]研究表明,在CCRT后,对N3期NPC患者使用MC-S1(一种新型口服氟嘧啶药物)可获得优于CCRT非MC(维持化疗)患者的生存率,该结果可支持本研究结论。
本研究中EBV检测包括EBV-DNA、EBV抗体(EBV-IgG、EBV-IgA)、病理组织(EBER、EBV)等多种检测方式,整合分析显示EBV阳性可能作为鼻咽癌辅助化疗的潜在生物标记物。LIU等[20]的Meta分析发现,高EBV-DNA表达水平表明新诊断的鼻咽癌患者的预后不良和长期生存率降低。因此,EBV-DNA表达水平对鼻咽癌患者的生存具有高度预后性。
辅助化疗旨在预防远处转移。远处转移的高风险因素包括T、N分期偏晚[21-22]、EBV阳性[22-23]的患者。本研究表明,NPC辅助化疗的未来研究应集中在高风险患者群体,并结合有效的生物标记物筛选出该类人群。LIU等[24]研究报道,与EBV-DNA阴性患者相比,术前血浆EBV-DNA阳性患者的预后较差,需要更积极的治疗策略。因此,NPC同步放化疗后的辅助化疗可能会降低局部复发或远处转移发生率,放疗后血浆EBV-DNA未清除的患者可能是潜在的目标人群[25]。
本研究存在一定的不足:回顾性研究分析筛选剔除部分资料不全的病例后,样本量较少,导致有明显数值差异的统计指标未达到统计学意义;OS成熟度偏低使得有获益趋势的临床指标需要前瞻性研究来证实。
综上所述,局部晚期NPC患者CCRT后接受辅助化疗相比未接受辅助化疗,虽在OS、PFS、DMFS、RFS未见显著临床获益,但对于EBV阳性、N3期、ⅣA期患者有获益的趋势,对于T4期患者RFS有获益的趋势;两组人群在放化疗不良反应上骨髓抑制有差异,急性放射性黏膜炎、急性放射性咽炎和食管炎无差异;局部晚期NPC同步放化疗后的辅助化疗的潜在获益人群值得深入研究。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. |
| [2] |
LEE H M, OKUDA K S, GONZÁLEZ F E, et al. Current perspectives on nasopharyngeal carcinoma[J]. Adv Exp Med Biol, 2019, 1164: 11-34. |
| [3] |
YE W M, CHANG E T, LIU Z W, et al. Development of a population-based cancer case-control study in Southern China[J]. Oncotarget, 2017, 8(50): 87073-87085. |
| [4] |
康敏. 中国鼻咽癌放射治疗指南(2020版)[J]. 中华肿瘤防治杂志, 2021, 28(3): 167-177. KANG M. Chinese guideline for radiotherapy of nasopharyngeal carcinoma (2020 edition)[J]. Chin J Cancer Prev Treat, 2021, 28(3): 167-177. |
| [5] |
李赓, 游雁, 高健全. 尼妥珠单抗联合同步放、化疗治疗局部晚期鼻咽癌的近期疗效观察[J]. 医学理论与实践, 2019, 32(1): 56-58. LI G, YOU Y, GAO J Q. Recent observation of the efficacy of nituzumab combined with concurrent radiotherapy and chemotherapy for locally advanced NPC[J]. J Med Theory Pract, 2019, 32(1): 56-58. |
| [6] |
WU M Y, OU D, HU C S, et al. Comparing long-term survival and late toxicities of different sequential chemotherapy regimens with intensity-modulated radiotherapy in locore gionally advanced nasopharyngeal carcinoma[J]. Transl Oncol, 2020, 13(7): 100765. |
| [7] |
邱慧芝, 王琳婧, 莫浩元, 等. 905例鼻咽癌远期疗效及失败模式的探讨[J]. 肿瘤学杂志, 2018, 24(6): 555-561. QIU H Z, WANG L J, MO H Y, et al. Long-term outcomes and treatment failure of 905 nasopharyngeal carcinoma patients treated with radio therapy[J]. Chin Clin Oncol, 2018, 24(6): 555-561. |
| [8] |
RIBASSIN-MAJED L, MARGUET S, LEE A W M, et al. What is the best treatment of locally advanced nasopharyngeal carcinoma? an individual patient data network meta-analysis[J]. J Clin Oncol, 2017, 35(5): 498-505. |
| [9] |
LEE A W M, TUNG S Y, NG W T, et al. A multicenter, phase 3, randomized trial of concurrent chemoradiotherapy plus adjuvant chemotherapy versus radiotherapy alone in patients with regionally advanced nasopharyngeal carcinoma: 10-year outcomes for efficacy and toxicity[J]. Cancer, 2017, 123(21): 4147-4157. |
| [10] |
KONG M, LIM Y J, KIM Y. Concurrent chemoradiotherapy for loco-regionally advanced nasopharyngeal carcinoma: treatment outcomes and prognostic factors[J]. Asian Pac J Cancer Prev, 2018, 19(6): 1591-1599. |
| [11] |
WANG L J, GUO Y S, XU J H, et al. Clinical analysis of recurrence patterns in patients with nasopharyngeal carcinoma treated with intensity-modulated radiotherapy[J]. Ann Otol Rhinol Laryngol, 2017, 126(12): 789-797. |
| [12] |
TOMIC' K, BERIC' JOZIC' G, PARIC' A, et al. Chemobrachy radio therapy and consolidation chemotherapy in treatment of locally advanced cervical cancer: a retrospective single institution study[J]. Wien Klin Wochenschr, 2021, 133(21/22): 1155-1161. |
| [13] |
TAO H Y, LIU H, HE F, et al. Adjuvant chemotherapy following combined induction chemotherapy and concurrent chemoradiotherapy improves survival in N2-3-positive nasopharyngeal carcinoma patients[J]. J Cancer Res Clin Oncol, 2021. [Online ahead of print]. DOI: 10.1007/s00432-021-03846-6.
|
| [14] |
CHEN Y P, LIU X, ZHOU Q, et al. Metronomic capecitabine as adjuvant therapy in locoregionally advanced nasopharyngeal carcinoma: a multicentre, open-label, parallel-group, randomised, controlled, phase 3 trial[J]. Lancet, 2021, 398(10297): 303-313. |
| [15] |
CHEN L, HU C S, CHEN X Z, et al. Adjuvant chemo-therapy in patients with locoregionally advanced nasopharyngeal carcinoma: long-term results of a phase 3 multicentre randomised controlled trial[J]. Eur J Cancer, 2017, 75: 150-158. |
| [16] |
SU L, SHE L, SHEN L F. The current role of adjuvant chemotherapy in locally advanced nasopharyngeal carcinoma[J]. Front Oncol, 2021, 10: 585046. |
| [17] |
HUI E P, MA B B Y, CHAN A T C. The emerging data on choice of optimal therapy for locally advanced nasopharyngeal carcinoma[J]. Curr Opin Oncol, 2020, 32(3): 187-195. |
| [18] |
LIU Y C, WANG W Y, TWU C W, et al. Prognostic impact of adjuvant chemotherapy in high-risk nasopharyngeal carcinoma patients[J]. Oral Oncol, 2017, 64: 15-21. |
| [19] |
ZONG J F, XU H C, CHEN B J, et al. Maintenance chemo-therapy using S-1 following definitive chemoradio-therapy in patients with N3 nasopharyngeal carcinoma[J]. Radiat Oncol, 2019, 14(1): 182. |
| [20] |
LIU T B, ZHENG Z H, PAN J, et al. Prognostic role of plasma Epstein-Barr virus DNA load for nasopharyngeal carcinoma: a meta-analysis[J]. Clin Invest Med, 2017, 40(1): E1-E12. |
| [21] |
XUE F, HU C S, HE X Y. Long-term patterns of regional failure for nasopharyngeal carcinoma following intensity-modulated radiation therapy[J]. J Cancer, 2017, 8(6): 993-999. |
| [22] |
王惠丽. 头颈部肿瘤的临床特征及预后影响因素研究[D]. 北京: 北京协和医学院, 2020. WANG H L. Study on clinical features and prognostic factors of head and neck carcinomas[D]. Beijing: Peking Union Medical College, 2020. |
| [23] |
LI W F, ZHANG Y, HUANG X B, et al. Prognostic value of plasma Epstein-Barr virus DNA level during posttreatment follow-up in the patients with nasopharyngeal carcinoma having undergone intensity-modulated radiotherapy[J]. Chin J Cancer, 2017, 36(1): 87. |
| [24] |
LIU S L, SUN X S, LI X Y, et al. The diagnostic and pro-gnostic values of plasma Epstein-Barr virus DNA for residual cervical lymphadenopathy in nasopharyngeal carcinoma patients: a retrospective study[J]. Cancer Commun (Lond), 2019, 39(1): 14. |
| [25] |
HUI E P, MA B B Y, LAM W K J, et al. Dynamic changes of post-radiotherapy plasma Epstein-Barr virus DNA in a randomized trial of adjuvant chemotherapy versus observation in nasopharyngeal cancer[J]. Clin Cancer Res, 2021, 27(10): 2827-2836. |




