2. 400038 重庆,陆军军医大学(第三军医大学)基础医学院神经生物学教研室,重庆市神经生物学重点实验室
2. Department of Neurobiology, Chongqing Municipal Key Laboratory of Neurobiology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038, China
阿尔茨海默病(Alzheimer's disease,AD)是一种常见的神经退行性疾病,临床上主要表现为神经炎症伴随的认知障碍,其神经系统变化主要为海马区神经元的凋亡及神经胶质细胞的过度活化[1]。神经元的凋亡将导致神经信号的丢失,产生认知障碍[2],而神经胶质细胞的过度活化将增加促炎因子的表达,降低海马突触的稳定性,减弱患者的空间记忆能力[3]。研究表明,包括AD在内的多数中枢神经系统疾病均可能与神经炎症相关,且在AD形成过程中,β淀粉样蛋白(amyloid β,Aβ)的形成被公认为是最重要的病理特征之一[1]。脂多糖(lipopolysaccharide,LPS)可能是引起神经炎症反应的非特异性免疫刺激物质[4],且腹腔注射LPS诱导神经炎症过程中产生的炎症因子可能参与上调星形胶质细胞中淀粉样前体蛋白β位剪切酶1(β-site amyloid precursor cleaving enzyme 1,BACE1) 的表达[5],促进Aβ和tau蛋白聚集。这表明LPS可能与可聚集蛋白协同作用产生神经退行性疾病,使AD患者产生认知障碍[6]。腹腔注射LPS能够较好地构造神经认知障碍模型,且保留脑组织的完整性[7]。
随着脑部刺激治疗手段的发展,通过直接控制脑回路动力学修复神经功能障碍治疗神经退行性疾病的研究也更加深入[8]。非侵入式静电场刺激(noninvasive electrostatic field stimulation, NEFS)通过施加合理的颅外静电场,在组织表面形成电势差,进而实现带电阴阳离子的定向移动。NEFS具备非接触、无物理性损伤等优点,可较大程度上减少被刺激者受到脑组织损伤的风险[8]。生物模型的研究表明:电场刺激可以使神经元的膜电位产生极化现象,从而影响神经元的兴奋性[9],并且从细胞形态学的角度可以发现,细胞的生长和增殖、迁移和凋亡等都能够被电场调控[10]。因此,NEFS为无创治疗神经退行性疾病提供了新的方向[8]。
目前NEFS被应用于改善神经退行性疾病相关的认知障碍研究鲜有报道,且NEFS对神经系统影响的有效性和安全性尚需研究。为此,本研究通过建立LPS诱导神经认知障碍的模型小鼠,观察并分析该模型经过NEFS治疗后的空间探索和识别记忆能力以及海马区神经细胞的变化,以期为NEFS治疗小鼠认知障碍并提高海马区神经可塑性提供相关的证据。
1 材料与方法 1.1 实验动物及分组、主要试剂和仪器健康雌性C57小鼠48只,8~12周,体质量(17±0.3)g,由陆军军医大学实验动物中心提供,适应性饲养1周后开始实验。动物实验经陆军军医大学实验动物护理与使用伦理委员会批准[SYXK(渝)20170002]。NEFS实验将48只小鼠分为LPS+NEFS组、LPS+SHAM组、NaCl+NEFS组和CTL组,每组12只。实验流程如图 1所示。
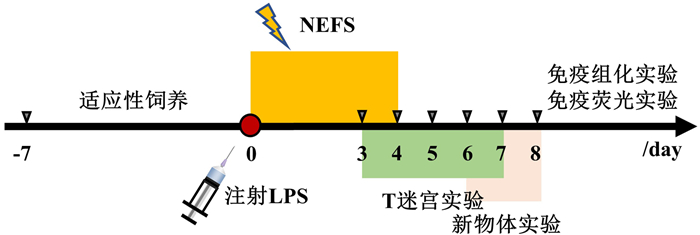
|
| 图 1 NEFS实验流程图 |
本实验采用的主要试剂和仪器有:LPS(北京索莱宝科技有限公司);兔来源NeuN多克隆抗体(美国Millipore公司);鼠来源GFAP多克隆抗体(武汉博士德生物工程有限公司);辣根过氧化物酶标记山羊抗兔IgG(北京中杉金桥生物技术有限公司);抗鼠荧光二抗(美国Cell Signaling Technology公司);封闭用正常羊血清(北京中杉金桥生物技术有限公司);DAB显色试剂盒(北京中杉金桥生物技术有限公司);DAPI染色液(北京百奥莱博科技有限公司);PBS (北京博奥森生物技术有限公司);幅值范围为0 kV/m~160 kV/m、频率为40 Hz的NEFS刺激仪(自制)[11];T迷宫箱及新物体识别测试箱(上海欣软信息科技有限公司)。
1.2 方法 1.2.1 神经认知障碍模型的建立使用腹腔注射不同剂量的LPS诱导认知障碍小鼠作为预实验。预实验采用与后续NEFS治疗实验同样要求的C57小鼠30只,分为3组,每组10只,分别为注射2 mg/kg LPS的高剂量组[7]、0.2 mg/kg LPS的低剂量组和等量生理盐水的对照组。现有研究表明:2 mg/kg LPS作用1 h后,海马区炎症因子呈现一过性上调;1 d后,海马组织生成一氧化氮及活性氧簇并导致3-硝基酪氨酸(3-nitrotyrosine,3-NT)形成,该过程是蛋白质氧化的标志,与AD发病密切相关;4 d后,BACE1酶活力显著上调并达到峰值;7 d后,海马组织凋亡相关蛋白表达上调[5]。基于此,本实验通过新物体(new object recognition,NOR)实验观察LPS注射7 d后,不同浓度LPS对小鼠认知水平的影响,选择效果更佳的剂量建立LPS诱导神经认知障碍小鼠模型。
1.2.2 NEFS实验电场对生物体作用的机制较复杂,当前技术难以直接测量达到颅内的电场,对其内部电场分布也未知。因此,通过有限元仿真建立电场模型,进而确定有效电场参数,可为NEFS刺激仪的设计及实验提供参数依据。本研究选择在有限元分析中应用广泛的COMSOL Multiphysics 5.4版本仿真软件进行建模,该款软件将有限元法还原到数学层面,能便捷地进行仿真。依据有限元仿真理论构建5层同心球的鼠头模型,仿真分析小鼠颅内各层组织的电场分布,得到海马区域的电场利用率约为6.1%[12]。研究表明,产生生物效应的最低电场强度范围在8.32 kV/m~9.86 kV/m。当场强低于8.32 kV/m作用时,海马细胞无明显变化;而场强超过9.86 kV/m时,离体海马细胞坏死率明显增加,活细胞率明显减小[13]。因此,本实验NEFS刺激仪场强参数设置为160 kV/m。此外,根据低频段的电场对神经元网络活动有较大影响[9],将频率参数设置为40 Hz。最终根据参数的选择,自制符合实验需求的NEFS刺激仪(图 2),设备分为静电场生成器(fo控制电场强度,vo控制频率)、铜制平行电极板、小鼠体态固定管3个部分。
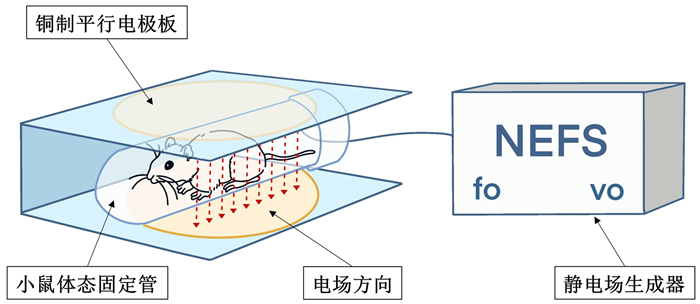
|
| 图 2 NEFS刺激仪 |
研究表明LPS可致BACE1酶活力显著上调,并于致炎后4 d达峰值[5]。本实验在神经认知障碍模型建成后对小鼠连续进行4 d的NEFS治疗:LPS+NEFS组接受160 kV/m的静电场刺激(30 min/d),NaCL+ NEFS组注射等量0.9%生理盐水代替LPS进行160 kV/m的静电场刺激(30 min/d),而LPS+SHAM组只接受0 kV/m的假刺激(3 s/d),即开通电场刺激仪3 s后立即关闭电源,其他的条件完全一致。每只小鼠刺激完后对小鼠体态固定管进行清理。
1.2.2.1 行为学实验NEFS后,通过T迷宫(T-maze)实验和NOR实验分别测试小鼠的空间探索和识别记忆能力。在实验期间保持测试环境安静且光线均匀,每只小鼠测试结束后用酒精擦拭实验箱和物体,排除小鼠的气味残留对实验结果的影响。
T-maze实验包含3 d的训练期和1 d的测试期。训练期:每只小鼠每天进行5次实验,每次间隔15 min,每次实验包括强制次和选择次[14]。强制次用隔板挡住新颖臂入口,不让小鼠进入,当小鼠到达另一臂尽头时立即将其取出;15 s后,撤去隔板进行选择次,并记录小鼠选择新颖臂的次数计算训练期每天的正确率。测试期:每只小鼠连续重复10次实验,实验在小鼠到达新颖臂或5 min后完成。记录小鼠选择新颖臂的次数计算正确率,正确率越高说明实验小鼠的空间探索能力越好。
NOR实验共分为3个阶段(适应期、熟悉期和认知期)。适应期和熟悉期用两个黄色正方体A,认知期用同宽高的蓝色圆柱B替换其中1个A作为新物体[15]。适应期从实验箱正中心放入小鼠,放置10 min以适应环境;次日进行熟悉期,将两个A固定在测试框中,每只小鼠自由探索5 min;认知期在熟悉期后1 h开始,同样探索5 min,并记录小鼠接近任一物体2 cm以内的时间作为探索时间,用认知期小鼠探索B的时间比作为识别率来评价小鼠的识别记忆能力。
1.2.2.2 形态学观察行为学实验完成后,小鼠经心灌注取脑。将脑组织置于4%多聚甲醛固定48 h后采用10%、15%、20%的多聚甲醛蔗糖溶液梯度脱水,并在冷冻切片机上获得30 μm海马区域的大脑冠状切片。完成以上操作后,进行免疫组化实验标记成熟的神经元(NeuN-IHC),免疫荧光实验标记活化的星形胶质细胞(GFAP-IF),所得数据用于后期阳性细胞的平均光密度(average optical density,AOD)分析。
神经元核抗原(neuronal nuclei,NeuN)是成熟神经元标记物,可以直观表示神经元细胞形态和凋亡程度。利用兔来源的NeuN多克隆抗体作为一抗和辣根过氧化物酶标记山羊抗兔IgG作为二抗,进行免疫组化实验(immunohistochemistry,IHC)。NeuN-IHC主要步骤如下:筛选切片后使用0.01 mol/L,pH值为7.2~7.4的PBS漂洗;用过氧化物酶封闭液浸泡30 min后PBS漂洗;置入10%的封闭用正常羊血清,恒温37 ℃封闭30 min;置入一抗,恒温37 ℃孵育1 h;恒温4 ℃孵育过夜后PBS漂洗;置入二抗,恒温37 ℃孵育1 h后PBS漂洗;在DAB中孵育显色后PBS漂洗;将脑切片固定在载玻片上,待切片风干后,在乙醇中梯度(浓度:80%、90%、95%、100%)脱水,在二甲苯中澄清2次,中性树脂封片,置于阴凉通风处保存。
神经胶质酸性蛋白(glial fibrillary acidic protein,GFAP)是星形胶质细胞的特异性标志物。利用鼠来源的GFAP多克隆抗体作为一抗和抗鼠荧光二抗进行免疫荧光实验(immunofluorescence,IF)。GFAP-IF主要步骤如下:筛选切片后PBS漂洗;置入10%的封闭用正常羊血清,恒温37 ℃封闭30 min;置入一抗,恒温37 ℃孵育1 h;恒温4 ℃孵育过夜后PBS漂洗;置入二抗,恒温37 ℃孵育1 h后PBS漂洗;按1 ∶2 000的比例配置DAPI,室温环境浸泡组织切片10 min后PBS漂洗,封片。
1.3 统计学分析 1.3.1 细胞图像分析免疫化学实验标记后,使用Olympus显微镜,在40倍光镜下拍摄各组小鼠海马CA1区、CA3区、DG区图像。使用Image J软件对所获得的图像进行阳性细胞的AOD分析。
1.3.2 数据处理数据结果用x±s表示,应用IBM SPSS Statistics 19软件处理,并用GraphPad Prism 8绘图软件呈现实验结果。T-maze训练期结果采用单因素重复测量方差分析,NOR测试期结果及其他实验结果分析采用单因素方差分析,组间比较采用Tukey法。P < 0.05表示差异具有统计学意义。所有实验数据是在双盲原则下获取。
2 结果 2.1 神经认知障碍小鼠模型的建立在NOR实验中,熟悉期小鼠方位偏向度均在50%左右,3组间差异无统计学意义(P>0.05,图 3A),可排除位置对测试结果的影响。在认知期,与对照组相比,高剂量组和低剂量组的小鼠的识别率更低,这表明被注射LPS的小鼠忘记了旧物体的形状特征,出现了认知障碍;且与对照组相比,高剂量组识别率显著降低(P < 0.05),而低剂量组识别率已趋向于正常水平(P>0.05,图 3B),这表明腹腔注射2 mg/kg的LPS更具有统计学意义。
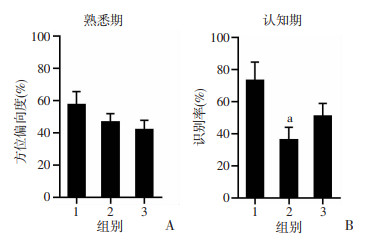
|
| A:熟悉期小鼠方位偏向度;B:认知期小鼠的识别率 1:对照组(n=6);2:高剂量组(n=10);3:低剂量组(n=10) a:P < 0.05,与对照组比较 图 3 NOR实验观察不同浓度LPS对小鼠认知水平的影响 (x±s) |
因此,在后续的NEFS治疗实验中,选取剂量2 mg/kg的LPS建立认知障碍小鼠模型。
2.2 NEFS可改善认知障碍小鼠的空间探索及识别记忆水平 2.2.1 空间探索能力采用T-maze实验比较小鼠在训练期和测试期选择新颖臂的正确率。在训练期,各组小鼠的正确率逐渐上升,所有小鼠具备一定的空间探索能力;无论是训练期还是测试期,LPS+SHAM组的正确率均显著低于其他3组(P < 0.05),而LPS+NEFS组与CTL组的差异无统计学意义(表 1)。
| 组别 | 训练期 | 测试期(第4天) | ||
| 第1天 | 第2天 | 第3天 | ||
| CTL组 | 68.33±6.26a | 71.67±6.72a | 83.33±4.14a | 67.50±3.92a |
| NaCl+NEFS组 | 73.33±3.76a | 78.33±5.20a | 86.67±4.49a | 61.67±2.41a |
| LPS+SHAM组 | 51.67±2.97 | 61.67±5.20 | 70.00±3.89 | 44.17±5.29 |
| LPS+NEFS组 | 65.00±3.60a | 68.33±5.75a | 78.33±4.58a | 57.50±3.51a |
| a:P < 0.05,与LPS+SHAM组比较 | ||||
2.2.2 识别记忆能力
采用NOR实验观察小鼠识别新物体的正确率。在熟悉期,各组小鼠方位偏度均在50%左右,组间差异无统计学意义(图 4A),可以排除物体位置带来的干扰;在认知期,LPS+SHAM组识别率低于50%且显著低于其他3组(P < 0.05),而LPS+NEFS组的小鼠识别率与CTL组的差异无统计学意义(图 4B)。以上行为学结果提示,LPS可较好地诱导认知障碍,且NEFS可以安全有效地改善相关症状。
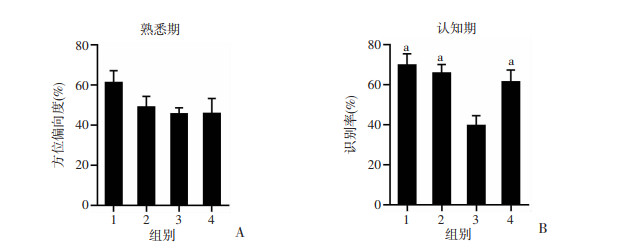
|
| A:熟悉期小鼠识别的偏度;B:认知期小鼠的识别率 1:CTL组;2:NaCl+NEFS组;3:LPS+SHAM组;4:LPS+NEFS组 a:P < 0.05,与LPS+SHAM组比较 图 4 NOR实验观察NEFS对小鼠认知水平的影响 (x±s, n=10~12) |
2.3 NEFS可以改善LPS导致的海马神经元和星形胶质细胞表达异常 2.3.1 海马区成熟神经元的数量
采用NeuN-IHC分别对小鼠海马的3个区域(CA1、CA3、DG)的NeuN进行染色,以确定成熟神经元的数量。与CTL组和NaCl+NEFS组相比,LPS+SHAM组在这3个区域的阳性细胞的形态更稀疏离散(图 5A),且阳性细胞的数量均显著减少(CA1、CA3、DG:P < 0.05),这表明注射LPS后海马各区域神经元均受损。除CA3区外,LPS+NEFS组阳性细胞的数量显著多于LPS+SHAM组(CA1、DG:P < 0.05,图 5B),表明NEFS可以促进海马不同区域受损神经元的修复。
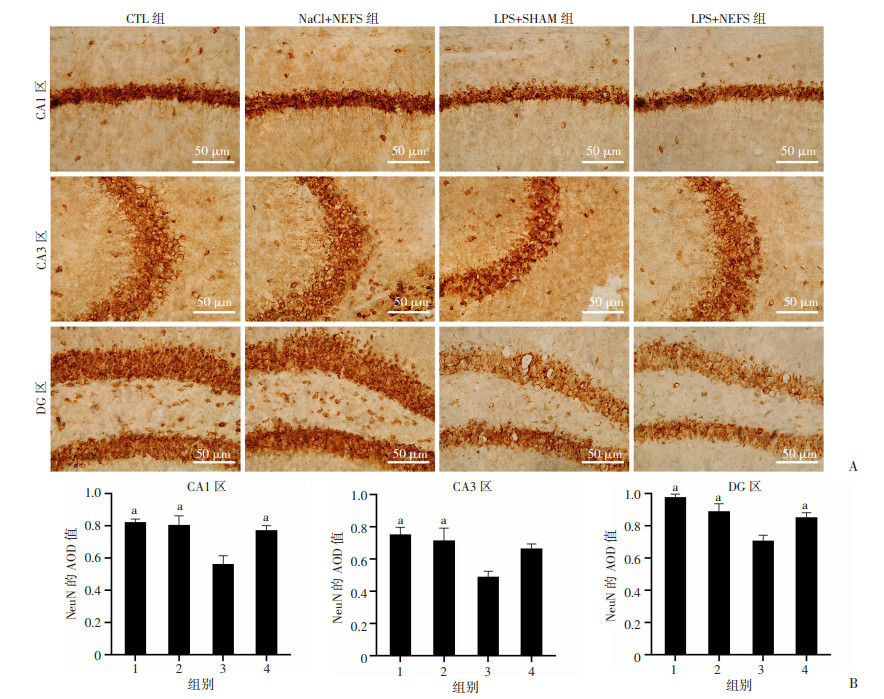
|
| A:NeuN-IHC观察4组小鼠海马各区成熟神经元细胞的形态;B:4组小鼠海马各区NeuN的AOD值 1:CTL组;2:NaCl+NEFS组;3:LPS+SHAM组;4:LPS+NEFS组 a:P < 0.05,与LPS+SHAM组比较 图 5 4组小鼠海马各区NeuN-IHC染色情况及数量的比较 (x±s, n=9~12) |
2.3.2 海马区星形胶质细胞的数量
采用GFAP-IF分别对小鼠海马的3个区域(CA1、CA3、DG)的GFAP进行染色以确定星形胶质细胞的数量。与其他3组相比,LPS+SHAM组在海马区的GFAP表达水平明显升高,表明注射LPS导致海马区域星形胶质细胞大量激活(图 6A)。与CTL组和NaCl+NEFS组相比,LPS+SHAM组在海马各子区域阳性细胞的数量均显著增多(CA1、CA3、DG:P < 0.05)。除CA3区外,LPS+NEFS组阳性细胞的数量显著少于LPS+SHAM组(CA1、DG:P < 0.05,图 6B)。这表明NEFS可以调节海马不同区域过度激活的星形胶质细胞。

|
| A:GFAP-IF观察4组小鼠海马各区星形胶质细胞的形态;B:4组小鼠海马各区GFAP的AOD值 1:CTL组;2:NaCl+NEFS组;3:LPS+SHAM组;4:LPS+NEFS组 a:P < 0.05,与LPS+SHAM组比较 图 6 4组小鼠海马各区GFAP-IF染色情况及数量的比较 (x±s, n=7~8) |
3 讨论
本研究采用NOR实验证明单次腹腔注射2 mg/kg LPS比0.2 mg/kg LPS建立的神经认知障碍模型效果更好。采用T-maze实验和NOR实验分析NEFS的治疗效果,发现连续进行4 d的160 kV/m的NEFS治疗可以改善LPS诱导神经认知障碍小鼠的空间探索和识别记忆能力,且不会造成显著性生理损伤。根据免疫化学实验结果推测,NEFS的神经保护机制可能主要通过抑制星形胶质细胞过度激活,减少神经炎症反应,使小鼠的海马区免受神经毒性作用,从而保护海马区神经元发挥效应,进而改善LPS导致的神经元损伤和炎症反应,最终提高患者的认知水平。
LPS是革兰阴性菌的主要细胞壁成分,可以诱导海马神经元及其突触的损伤,减弱小鼠学习记忆能力[16]。张艺瀚等[7]发现腹腔注射2 mg/kg的LPS可引发大鼠学习记忆损伤,其主要损伤海马特定区域的锥体神经元,且该损伤可在形态上修复。而且,LPS诱导的神经炎症与神经退行性疾病病理相似。LEE等[17]发现,LPS诱导的神经炎症通过增强Aβ的生成导致认知障碍;张翔南等[5]发现注射LPS可激活星形胶质细胞并诱导海马区AD相关的病理改变。结合测试小鼠识别记忆能力的NOR实验,本研究成功验证了腹腔注射2 mg/kg LPS建立神经认知障碍小鼠模型的效果比0.2 mg/kg LPS建模效果更好。
研究表明:非侵入性脑部刺激具有累积效应,如5 d的重复经颅直流电刺激可能比单次更有效[18],且LPS可致BACE1酶活力于致炎后4 d达到峰值[5]。因此,结合COMSOL Multiphysics仿真结果,推算出连续进行4 d的160 kV/m的NEFS治疗效果可能达到最佳。T-maze实验验证了未经NEFS治疗的小鼠空间探索能力显著下降,且NOR实验同样验证了未经NEFS治疗的小鼠识别记忆能力显著下降。NIEH等[19]研究表明海马神经元具有协调产生认知过程,存储陈述性记忆和生成认知地图等功能。海马神经元的丢失是神经退行性疾病的主要病因之一,也是造成认知障碍的主要原因之一[20]。与LEE等[17]研究结果一致,NeuN-IHC结果显示神经认知障碍小鼠海马区成熟神经元的数量显著减少。此外,研究表明星形胶质细胞分泌的细胞因子对维持神经元的生存、发育、再生和分化均有重要作用[21]。星形胶质细胞是中枢神经系统稳态、防御和再生的基础,能够通过自身功能、代谢和形态改变,影响神经元功能和活动[21]。在LPS诱导的神经炎症反应中,反应性星形胶质细胞将活化,细胞体变得肥大,突起增多和延长,GFAP免疫染色表达增强,并分泌大量促炎因子,损害神经组织的防御能力,导致神经炎症[22]。与张翔南等[5]研究结果一致,GFAP-IF结果显示神经认知障碍小鼠海马区星形胶质细胞的数量显著增加。
既往研究表明,除了传统的药物治疗以外,电或磁等物理脑部刺激技术也可以提高认知水平,其中经颅磁刺激[23]和经颅直流电刺激[24]为应用最为广泛的非侵入式脑部刺激。其治疗原理都是利用电场或磁场的作用影响特定脑区中大量离子的迁移。与之相比,NEFS不仅具有相同的疗效,且NEFS具备非接触、广泛调控神经系统的优势。与使用植入式电极进行深部脑刺激相比,NEFS不仅可以影响小鼠整体的神经系统,而且操作更为便捷、无创[25]。NEFS实验中两个行为学实验结果都表明经过NEFS治疗后的模型小鼠已经表现出和正常小鼠类似的空间探索和识别记忆能力。此外,NeuN-IHC结果发现经过NEFS治疗后的小鼠海马各子区域(除CA3区以外)的神经元排列紧致有序,且数量均显著高于未经NEFS治疗的小鼠,这表明NEFS有效改善了神经认知障碍模型小鼠海马区神经元的丢失。GFAP-IF结果表明,经过NEFS治疗后的小鼠海马各子区域(除CA3区以外)的星形胶质细胞的过表达被显著抑制,可能引起促炎因子的释放减少,使LPS诱导的炎症反应得到缓解,起到了保护神经细胞的作用。本研究中NEFS的治疗效果与国内外的研究结果具有一致性:KANTAR等[26]研制的35 kV/m的极低频电场发生系统可以保护脑组织免受氧化损伤;DI等[27]研究发现35 kV/m的工频电场能够显著提高小鼠的学习记忆能力。
此外,NEFS刺激仪选择160 kV/m的电场强度是具有安全性的:NaCl+NEFS组与CTL组各项数据的差异均无统计学意义。然而,现有NEFS刺激仪大多应用于治疗软组织损伤及骨折等病症,用于治疗神经类疾病的研究尚未得到验证,因此探索NEFS的疗效是有必要的。由于神经系统的复杂性,NEFS效果判定经常以现象学的方式呈现[8]。因此,为了更深入理解NEFS的作用机制,后续还需研究NEFS对患者海马区离子水平的影响及其分子机制。此外,本研究检测的特定脑区为与认知学习相关的海马区[19],但NEFS的作用范围为整个小鼠的身体,NEFS对其他部位的影响有待进一步研究。虽然NEFS用于治疗神经退行性患者仍需要大量的临床研究,不过,本研究结果表明NEFS可以改善LPS诱导神经炎症小鼠的认知障碍,这可能为非侵入式治疗认知障碍相关的神经退行性疾病提供理论支撑。
| [1] |
KWON H S, KOH S H. Neuroinflammation in neurodegenerative disorders: the roles of microglia and astrocytes[J]. Transl Neurodegener, 2020, 9(1): 42. |
| [2] |
CHOI S H, BYLYKBASHI E, CHATILA Z K, et al. Combined adult neurogenesis and BDNF mimic exercise effects on cognition in an Alzheimer's mouse model[J]. Science, 2018, 361(6406). |
| [3] |
LIDDELOW S A, GUTTENPLAN K A, CLARKE L E, et al. Neurotoxic reactive astrocytes are induced by activated microglia[J]. Nature, 2017, 541(7638): 481-487. |
| [4] |
BATISTA C R A, GOMES G F, CANDELARIO-JALIL E, et al. Lipopolysaccharide-induced neuroinflammation as a bridge to underst and neurodegeneration[J]. Int J Mol Sci, 2019, 20(9). |
| [5] |
张翔南. LPS腹腔注射诱发大鼠脑内炎症致皮层与海马病理改变及相关机制研究[D]. 浙江大学, 2010. ZHANG X N. Pathological changes and related mechanisms in rat cortex and hippocampus after intraperitoneal injection of LPS-induced brain inflammation[D]. Hangzhou: Zhejiang University, 2010. |
| [6] |
BROWN G C. The endotoxin hypothesis of neurodegeneration[J]. J Neuroinflammation, 2019, 16(1): 180. |
| [7] |
张艺瀚, 葛立军, 徐申瑶, 等. 腹腔注射脂多糖致大鼠炎症模型海马区损伤表征[C]. 中国毒理学会第七次全国毒理学大会暨第八届湖北科技论坛论文集. 2015. ZHANG Y H, GE L J, XU S Y, et al. Characterization of hippocampal damage induced by intraperitoneal injection of lipopoly saccharide in an inflammatory rat model[C]. The 7th National Congress of Toxicology, Chinese Society of Toxic ology (CSOT-VⅡ) and the 8th Hubei Science and Technology Forum. 2015. |
| [8] |
GROSSMAN N, BONO D, DEDIC N, et al. Noninvasive deep brain stimulation via temporally interfering electric fields[J]. Cell, 2017, 169(6): 1029-1041. |
| [9] |
BERZHANSKAYA J, CHERNYY N, GLUCKMAN B J, et al. Modulation of hippocampal rhythms by subthreshold electric fields and network topology[J]. J Comput Neurosci, 2013, 34(3): 369-389. |
| [10] |
梁媛媛, 涂晔, 安晓强, 等. 静电场调控p53合成对成纤维细胞增殖周期的影响[J]. 解剖学杂志, 2021, 44(02): 114-117+135. LIANG Y Y, TU Y, AN X Q, et al. Effect of regulating p53 synthesis by electrostatic field on proliferation cycle of fibroblast[J]. Chin J Anat, 2021, 44(02): 114-117+135. |
| [11] |
于凯, 王江, 邓斌, 等. 外电场作用下神经元网络同步特性[J]. 计算机应用研究, 2014, 31(1): 70-75. YU K, WANG J, DENG B, et al. Synchronization characteristics of neural network subject to external electric field[J]. App Res of Comput, 2014, 31(1): 70-75. |
| [12] |
DENG Z D, LISANBY S H, PETERCHEV A V. Electric field strength and focality in electroconvulsive therapy and magnetic seizure therapy: a finite element simulation study[J]. J Neural Eng, 2011, 8(1): 016007. |
| [13] |
王连坤. 高功率脉冲微波辐照大鼠体内电场分布的数值模拟和实验验证[D]. 华东师范大学, 2010. WANG L K. The numerical simulation and experimental verifi cation of electric field distribution in rat by high power pulse microwave irradiation[D]. Shanghai: East China Normal University, 2010. |
| [14] |
CARRATALA-ROS C, OLIVARES-GARCIA R, MARTINEZ-VERDU A, et al. Energizing effects of bupropion on effortful behaviors in mice under positive and negative test conditions: modulation of DARPP-32 phosphorylation patterns[J]. Psychopharmacology (Berl), 2021, 238(12): 3357-3373. |
| [15] |
ZHANG R, XUE G, WANG S, et al. Novel object recognition as a facile behavior test for evaluating drug effects in A beta PP/PS1 Alzheimer's disease mouse model[J]. J Alzheimers Dis, 2012, 31(4): 801-812. |
| [16] |
XIN Y R, JIANG J X, HU Y, et al. The immune system drives synapse loss during lipopolysaccharide-induced learning and memory impairment in mice[J]. Front Aging Neurosci, 2019, 11: 279. |
| [17] |
LEE J, LEE Y, YUK D, et al. Neuro-inflammation induced by lipopolysaccharide causes cognitive impairment through enhancement of beta-amyloid generation[J]. J Neuroinflamm, 2008, 5: 37. |
| [18] |
SHARIATIRAD S, VAZIRI A, HASSANI-ABHARIAN P, et al. Cumulative and booster effects of tDCS sessions on drug cravings, lapse, and cognitive impairment in methamphetamine use disorder: A case study report[J]. Am J Addict, 2016, 25(4): 264-266. |
| [19] |
NIEH E H, SCHOTTDORF M, FREEMAN N W, et al. Geometry of abstract learned knowledge in the hippocampus[J]. Nature, 2021, 595(7865): 80-84. |
| [20] |
GIGUERE N, NANNI S B, TRUDEAU L E. On cell loss and selective vulnerability of neuronal populations in Parkinson's disease[J]. Front Neurol, 2018, 9: 455. |
| [21] |
GONZALEZ-REYES R E, NAVA-MESA M O, VARGAS-SANCHEZ K, et al. Involvement of astrocytes in Alzheimer's disease from a neuroinflammatory and oxidative stress perspective[J]. Front Mol Neurosci, 2017, 10: 427. |
| [22] |
RODRIGUEZ-ARELLANO JJ, PARPURA V, ZOREC R, et al. Astrocytes in physiological aging and Alzheimer's disease[J]. Neuroscience, 2016, 323: 170-182. |
| [23] |
ESTRADA C, FERNANDEZ-GOMEZ F J, LOPEZ D, et al. Transcranial magnetic stimulation and aging: effects on spatial learning and memory after sleep deprivation in Octodon degus[J]. Neurobiol Learn Mem, 2015, 125: 274-281. |
| [24] |
ZHANG K Y, RUI G, ZHANG J P, et al. Cathodal tDCS exerts neuroprotective effect in rat brain after acute ischemic stroke[J]. BMC Neurosci, 2020, 21(1): 21. |
| [25] |
孟凡刚, 张建国. 自适应脑深部电刺激术治疗运动障碍性疾病研究进展[J]. 中国现代神经疾病杂志, 2022, 22(04): 217-223. MENG F G, ZHANG J G. Adaptive deep brain stimulation for motor disorders[J]. Chin J Contemp Neurol Neurosurg, 2022, 22(04): 217-223. |
| [26] |
KANTAR G D, AKPINAR D, YARGICOGLU P, et al. Effects of extremely low-frequency electric fields at different intensities and exposure durations on mismatch negativity[J]. Neuroscience, 2014, 272: 154-166. |
| [27] |
DI G Q, KIM H, XU Y Q, et al. A comparative study on influences of static electric field and power frequency electric field on cognition in mice[J]. Environ Toxicol Pharmacol, 2019, 66: 91-95. |




