2. 400030 重庆,重庆大学附属肿瘤医院:重症医学科;
3. 400030 重庆,重庆大学附属肿瘤医院:消化内科
2. Department of Critical Care Medicine, Affiliated Cancer Hospital of Chongqing University, Chongqing, 400030, China;
3. Department of Gastroenterology, Affiliated Cancer Hospital of Chongqing University, Chongqing, 400030, China
感染性休克是一种由宿主对感染反应失调引起的危及生命的多器官系统功能障碍疾病[1]。急性肾损伤(acute kidney injury,AKI)是感染性休克早期最常见的合并疾病[2]。AKI发生在51%的感染性休克患者中,导致死亡率增加高达41%[3]。更重要的是,严重AKI构成了中度残疾事件的独立危险因素,并进一步与感染性休克幸存者的功能结局较差相关[4]。尽管目前针对感染性休克合并AKI的治疗有了更多的了解,但AKI的诊断标准仍然基于血清肌酐(serum creatinine,Scr)水平的升高或尿量的减少[2]。然而,Scr缺乏敏感性和特异性,并且与尿量水平相关的准确性较低。此外,感染性休克合并AKI的病理生理学不仅涉及促炎和抗炎反应的早期激活,还涉及代谢紊乱[5]。因此,使用当前标准诊断感染性AKI是不够的。进一步了解感染性休克合并AKI的早期代谢改变具有重要的临床意义。代谢组学研究调查细胞和有机体代谢的状态,提供宿主疾病的实时代谢分析[6]。这种分析允许识别生物流体(例如尿液和血液)中生物标志物变化的模式。本研究对患者尿液进行了非靶向代谢分析,并比较了重症监护病房(ICU)中患有和未患有AKI的感染性休克患者的差异。本研究的目的是利用代谢组学方法来识别感染性休克患者AKI的生物标志物,这可能有助于诊断和识别相关代谢途径。
1 资料与方法 1.1 一般资料本研究招募了2020年3月至2022年3月本院ICU收治且诊断为感染性休克的所有符合条件的患者。感染性休克的定义根据第三个国际共识定义(Sepsis-3)[7]。脓毒症被确定为感染后序贯器官衰竭评估评分≥2分的急性变化。当持续性低血压患者需要血管升压药以维持平均动脉压≥65 mmHg,并且即使进行了足够的容量复苏后,血清乳酸水平>2 mmol/L,则诊断为感染性休克。AKI的诊断基于改善全球肾脏病预后组织(KDIGO)标准[3],定义为48 h内Scr增加≥26.5 mol/L,或Scr增加超过基线水平的1.5倍,或6 h内尿量<0.5 mL/(kg·h)。纳入标准包括年龄≥18岁、在ICU住院至少24 h、临床资料完整的患者。排除标准:①研究开始时已使用肾脏替代疗法;②有肾移植史;③在ICU多日的继发感染患者;④怀孕和哺乳期的妇女;⑤在进入ICU前至少1周接触过放射性造影剂或肾毒性药物;⑥急性心脑血管事件、恶性肿瘤、严重血液病患者;⑦其他导致淋巴细胞减少的合并症,如恶性肿瘤、营养不良、HIV感染、自身免疫性疾病、免疫抑制剂、细胞毒剂等。从所有患者或其近亲处获得参与研究的书面知情同意书。本研究经过本院伦理委员会批准(2020-062)。
1.2 样品采集和制备根据进入ICU后48 h内是否发生AKI将感染性休克患者分为有AKI(AKI组)和无AKI(NAKI组)。为了检查不同代谢物的动态变化,在感染性休克诊断后12 h和24 h收集尿液进行代谢组学分析。从患者导尿管中抽取5~6 mL尿液。在采集过程中采取严格的无菌技术,通过两种方法留取标本:一种是严格外阴消毒以后留取的中段尿标本,另一种是留置导尿管以后留取的中段尿标本。然后立即在4 ℃下以2 000 r/min的速度将整个样本离心20 min。收集上清液并添加叠氮化钠至1/100(质量体积分数)以抑制细菌生长。然后将混合物以每管1 mL分配,并储存在-80 ℃的冰箱中以供分析。对于测定,尿液样本在4 ℃下解冻,每个样本取100 μL与400 μL冷甲醇/乙腈(1 ∶1,体积分数)混合,涡旋60 s,然后置于20 ℃ 1 h,以去除蛋白质。随后将样品在4 ℃下以14 000 r/min离心20 min,将上清液冷冻干燥并在-80 ℃下保存。为了检查该分析平台的稳定性和可重复性,通过从每个样品中汇集10 μL来制备质量控制样品。
1.3 超高效液相色谱-四极杆飞行时间质谱分析使用Agilent 1290 Infinity UPLC亲水相互作用色谱(HILIC),在25 ℃下以0.3 mL/min的流速分离样品。流动相A和B分别是0.1%甲酸水溶液和0.1%甲酸乙腈溶液。梯度洗脱条件如下:0~1 min,95%流动相B;1~14 min,流动相B从95%线性变化到65%;14~16 min,流动相B从65%线性变化到40%;16~18 min,流动相B为40%;18 ~18.1 min,流动相B从40%线性变化到95%;18.1~23 min,流动相B为95%。在整个过程中将样品保存在4 ℃的自动进样器中。在连续分析过程中使用随机序列以避免仪器信号波动的干扰。使用电喷雾电离(ESI)的正离子和负离子模式来检测信号。使用UPLC分离收集样品的成分,并使用Triple TOF 5600质谱仪(美国AB SCIEX公司)分析数据。HILIC色谱分离后ESI的源条件如下:离子源气体1,60 psi;离子源气体2,60 psi;气帘,30 psi;源温度,600 ℃;离子喷雾电压浮动,5 000 V(+)和-5 000 V(-)。TOF MS扫描m/z范围为60~1 000 Da,子离子扫描m/z范围为25~1 000 Da,TOF MS扫描累积时间为0.2 s/谱,子离子扫描累积时间为0.05 s/谱。检出限按信噪比3/1计算。使用信息相关采集(IDA)来检测和识别MS/MS光谱,并使用高灵敏度模型,其去簇电位为60 V(+)和-60 V(-),碰撞能量为(35±15)eV。
1.4 代谢组学数据分析使用ProteoWizard将原始超高效液相色谱-四极杆飞行时间质谱(UPLC-QTOF/MS)数据转换为mzXML格式,然后使用XCMS进行峰对齐、保留时间校正和峰面积提取程序。使用MaxQuant-Andromeda软件套件(版本1.6.3.4)和大多数默认参数进行蛋白质鉴定和定量。从UniProt数据库(https://www.uniprot.org/)下载的人标数据库(17 038个序列;仅审查;2020年3月版)用于数据库搜索。对于全局蛋白质组分析,应用以下参数:前体和片段的质量公差分别为10×106和20×106;肽长度至少为7个氨基酸。蛋白质和肽的错误发现率(FDR)设定为1%。对于全局蛋白质组定量,首先过滤MaxQuant输出结果(proteinGroups.txt)以排除那些“仅由站点识别”、“潜在污染物”和“反向命中”,然后进行log2转换。在Perseus环境中使用默认参数(版本1.6.1.3)执行下游数据分析,例如缺失值插补、层次聚类、主成分分析(PCA)、t检验、相关性和火山图。使用DAVID Bioinformatics Resources 6.8 (https://david.ncifcrf.gov/home.jsp)进行基因本体论(GO)和京都基因和基因组百科全书(KEGG) 通路分析。对于蛋白质网络分析,StringApp用于Cytoscape环境(版本3.8.0)。交互得分设置为0.9,即最高置信度截止值,以检索潜在的交互。在此过程中启用“加载丰富数据”选项以检索STRING网络的功能丰富(最小显著性阈值FDR为0.05)。
1.5 ELISA实验按ELISA试剂盒[赛默飞世尔科技(中国)有限公司]说明书稀释标准品,加入抗体、显色剂、终止液,得到吸光度值,并以标准品浓度为横坐标,以吸光度值为纵坐标绘制标准曲线,计算尿液样品中中性粒细胞明胶酶相关脂质运载蛋白(neutrophil gelatinaseassociated lipocalin,NGAL)、几丁质酶样蛋白3(chitinase-like protein 3,Chil3)、S100钙结合蛋白A8(S100 calcium binding protein A8,S100A8)和铜蓝蛋白(ceruloplasmin,CP) 含量。
1.6 数据处理连续变量数据以x±s或中位数M(P25~P75)表示,分类变量以例数(百分比)表示。配对t检验或Mann- Whitney检验和卡方检验分别用于比较连续变量和分类变量。通过Pearson相关性系数分析NGAL、Chil3、S100A8和CP在AKI和NAKI中的表达与SCr的相关性。通过绘制受试者操作特征曲线(ROC),并计算ROC曲线下面积(AUC)的值来量化模型性能。使用SPSS 20.0软件对临床和代谢组学数据进行统计学分析。
2 结果 2.1 参与者的临床特征在100名患者中,42例感染性休克合并AKI(AKI组),58例没有AKI(NAKI组)。在感染性休克诊断后12 h,两组患者均收集尿液样本(分别为AKI1和NAKI1);而感染性休克诊断后24 h,AKI和NAKI组中分别收集32例和48例患者尿液样本(分别为AKI2和NAKI2)。由于两组在12 h和24 h收集的尿液蛋白质组学特征相似,因此在24 h时两组减少10例患者进行分析。入组患者的人口统计学和临床特征见表 1。与NAKI组相比,AKI组患者入组时SCr、乳酸和全因死亡率显著增加(P<0.05),eGFR显著降低(P<0.001)。
| 指标 | AKI组 | NAKI组 | P值a | |||
| AKI1(n=42) | AKI2(n=32) | NAKI1(n=58) | NAKI2(n=48) | |||
| 年龄/岁 | 68.8±16.1 | 68.5±15.8 | 68.3±15.5 | 68.6±15.7 | 0.788 | |
| 男性 | 27 | 24 | 36 | 32 | 0.659 | |
| 合并症 | ||||||
| 高血压 | 22 | 18 | 34 | 31 | 0.833 | |
| 糖尿病 | 22 | 20 | 26 | 23 | 0.109 | |
| 肝病 | 9 | 8 | 7 | 6 | 0.121 | |
| 左心衰竭 | 6 | 6 | 8 | 6 | 0.638 | |
| 冠状动脉疾病 | 4 | 4 | 8 | 7 | 0.219 | |
| 贫血 | 30 | 28 | 42 | 36 | 0.682 | |
| 卒中 | 7 | 6 | 13 | 11 | 0.299 | |
| 实验室结果 | ||||||
| 入组时SCr/μmol·L-1 | 110.0±58.7 | 82.9±37.3 | 34.3±14.0 | 33.1±12.0 | <0.001 | |
| 入组时eGFR/mL·min-1·1.73 m-2 | 81.71±26.02 | 80.13±25.34 | 100.11±27.66 | 99.42±27.11 | <0.001 | |
| 入组时乳酸/mmol·L-1 | 3.25(2.17~5.58) | 3.10(2.02~5.63) | 2.63(2.10~3.96) | 2.60(2.04~3.88) | 0.044 | |
| 全因死亡数 | 29 | 26 | 12 | 10 | <0.001 | |
| a:为AKI1与NAKI1组相比 | ||||||
2.2 感染性休克合并AKI的代谢组学分析
为了表征感染性休克合并AKI的分子变化,对患者的尿液进行定量无标记蛋白质组学分析,并鉴定了超过3 500种蛋白质。使用欧几里得距离的层次聚类,发现NAKI和AKI肾脏之间有明显的分离(图 1A)。在主成分分析中,NAKI和AKI样本可以清楚地区分。相比之下,NAKI1和NAKI2肾的蛋白质组学特征相似(图 1B)。基因本体术语富集分析显示,AKI患者中与细胞外基质和急性期反应相关的蛋白质在感染性休克诊断后增加,与影响组织中炎症、纤维化反应和细胞内反应机制一致;相反,与离子、氨基酸和代谢物排泄相关的蛋白质以及与线粒体相关的蛋白质减少(图 1C)。
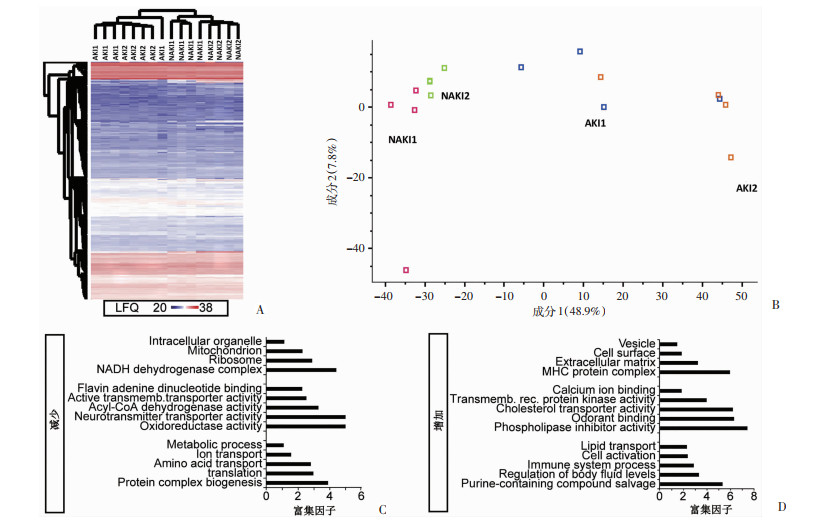
|
| A:热图 示两组尿液中发现的蛋白质的表达模式;LFQ:非标记定量强度;B:主成分分析 NAKI组和AKI组尿液中的蛋白质组学特征;C、D:NAKI组和AKI组尿液中蛋白质增加和减少的基因本体术语富集分析(Fisher精确检验,FDR=0.02) 图 1 感染性休克合并AKI的代谢组学分析 |
2.3 比较聚类分析识别与AKI损伤程度相关的全局蛋白质组模式
进行层次聚类分析,将全局蛋白质组学变化定义为6个主要簇,每个簇具有超过10种蛋白质。3个簇(簇1、2、3)的蛋白质模式随着损伤程度的增加而增加(蛋白质表达NAKI1<NAKI2<AKI1<AKI2)。这些簇在补体、细胞外基质生成和趋化性等几个不同的过程中显著富集(图 2A、B),表明这些蛋白质的诱导可能与AKI有关。在分析中发现一类重要的蛋白质是溶质载体(solute carrier,SLC)蛋白,它们调节离子运输、废物清除和许多其他基本生理功能。然而,它们在感染性休克损伤中的作用尚未得到很好的研究。在全局蛋白质组学研究中,鉴定了72个SLC蛋白,大多数SLC蛋白在感染性休克损伤时没有显示出显著差异,即使改变,倍数差异也很小(图 2C)。SLC蛋白和/或其磷酸化形式的显著变化如图 2D所示。这些结果表明,在感染性休克合并AKI诱导后,肾脏中离子和小分子的稳态发生了广泛的改变。
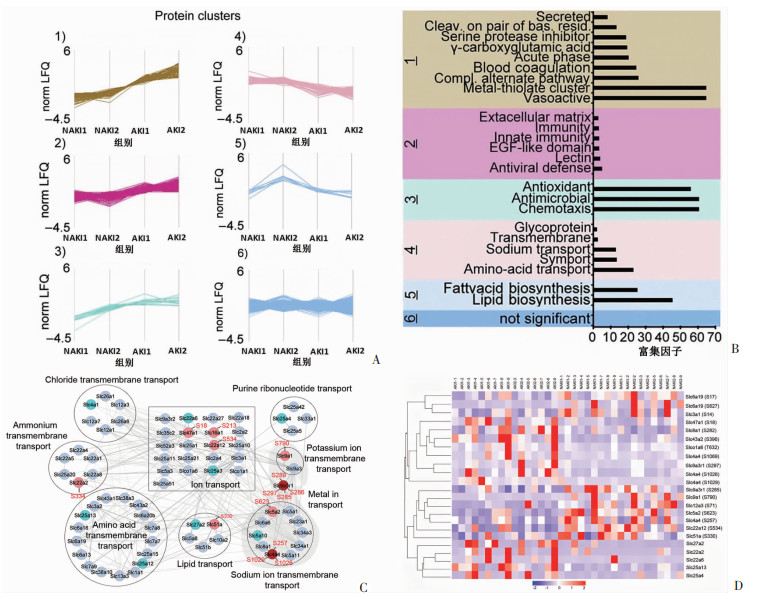
|
| A:层次聚类分析 将全局蛋白质组学变化定义为6个主要簇;B:每个聚类中的基因本体术语富集分析(Fisher精确检验,FDR<0.02) 1~6:分别表示簇1~簇6;C:使用Cytoscape软件中的String App对72种已识别的SLC蛋白构建蛋白质网络和功能富集簇 浅蓝色为非差异(FC<1.5)蛋白质;青色为显著差异的蛋白质;粉红色和红色为差异磷蛋白;基于富集数据(Cytoscape中的嵌入功能)对蛋白质簇进行注释,4组中代表性SLC蛋白谱,红线为磷酸盐强度,黑色为未修饰形式;D:热图 示ANOVA显著差异(P<0.05)的蛋白质和磷酸位点 图 2 比较聚类分析识别与损伤程度相关的全局蛋白质组模式 |
2.4 感染性休克合并AKI的早期生物学标志物
检查与感染性休克合并AKI的早期相关的特征蛋白。分别在第12小时或第24小时对感染性休克合并AKI和感染性休克NAKI进行了成对比较,以突出显著的标记蛋白(图 3A、B)。在这些数据中,与感染性休克NAKI患者相比,感染性休克合并AKI患者的NGAL、Chil3、S100A8和CP均显著增加(P<0.05,图 3C~F)。此外,通过ELISA法验证了感染性休克合并AKI患者的NGAL、Chil3、S100A8和CP显著高于NAKI(P<0.05,表 2)。相关性分析显示,NGAL、Chil3、S100A8和CP表达与SCr呈显著正相关(r=0.276、0.391、0.789、0.721,均P<0.001),见图 4。
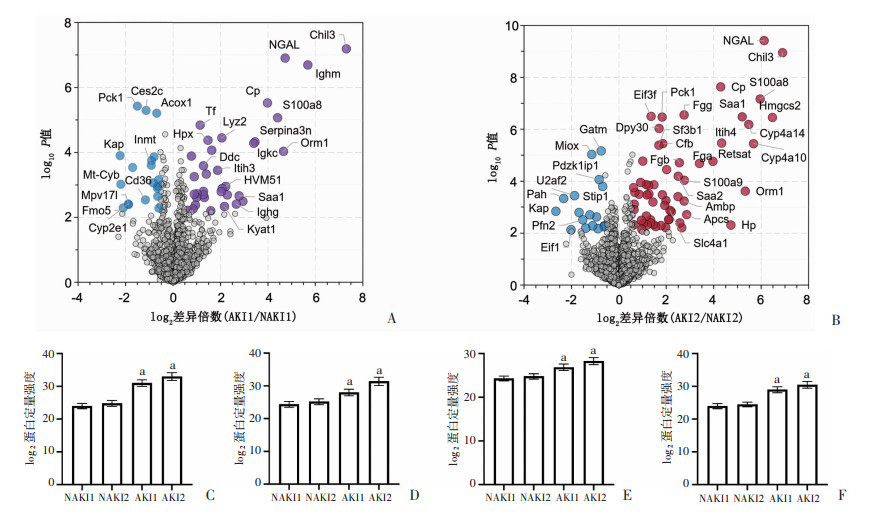
|
| A、B:成对比较火山图确定感染性休克合并AKI后第12小时或第24小时与感染性休克NAKI之间的差异变化蛋白 上调和下调1.5倍的蛋白质分别以红色/紫色和蓝色表示;C~F:分别为Chil3、NGAL、S100A8和CP的蛋白质丰度图 a: P<0.05,与对应NAKI组比较 图 3 感染性休克合并AKI的早期生物学标志物的动力学变化 |
| 组别 | n | NGAL | Chil3 | S100A8 | CP |
| NAKI1 | 58 | 1.57±0.13 | 2.01±0.22 | 0.68±0.05 | 2.65±0.18 |
| NAKI2 | 48 | 1.44±0.11 | 2.06±0.20 | 0.70±0.04 | 2.89±0.15 |
| AKI1 | 42 | 2.56±0.16 | 4.26±0.30 | 1.88±0.17 | 5.29±0.22 |
| AKI2 | 32 | 2.88±0.20 | 6.84±0.33 | 2.37±0.19 | 7.42±0.28 |
| P值 | 0.013 | 0.002 | 0.018 | 0.024 |
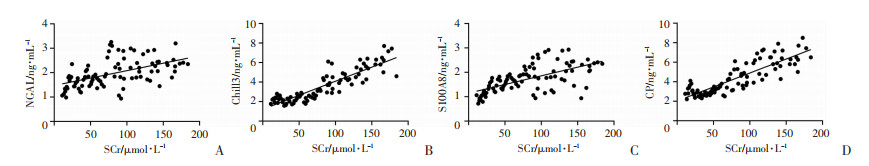
|
| 图 4 NGAL(A)、Chil3(B)、S100A8(C)和CP(D)的表达与SCr的相关性分析 |
2.5 生物标志物的鉴定
基于4种单一和组合生物标志物在12 h和24 h的ROC分析结果见表 3、图 5。标志物组合在诊断感染性休克合并AKI具有较大诊断性能,在12 h和24 h的AUC分别为0.901和0.958。
| 标志物 | 敏感度 | 特异度 | AUC(95%CI) |
| AKI1 vs NAKI1 | |||
| NGAL | 59.3% | 86.7% | 0.723(0.586~0.861) |
| Chil3 | 80.0% | 70.4% | 0.732(0.598~0.866) |
| S100A8 | 55.6% | 80.0% | 0.673(0.529~0.817) |
| CP | 59.3% | 76.7% | 0.694(0.555~0.832) |
| 组合 | 81.5% | 90.0% | 0.901(0.829~0.980) |
| AKI2 vs NAKI2 | |||
| NGAL | 75.0% | 73.7% | 0.714(0.528~0.900) |
| Chil3 | 77.4% | 76.7% | 0.724(0.555~0.892) |
| S100A8 | 62.3% | 86.0% | 0.760(0.588~0.932) |
| CP | 63.5% | 78.4% | 0.776(0.603~0.950) |
| 组合 | 93.8% | 89.5% | 0.958(0.924~1.000) |
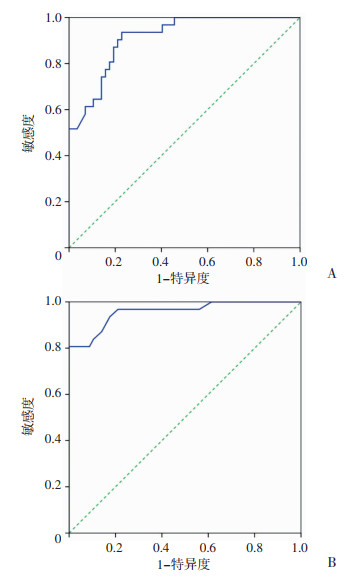
|
| 图 5 感染性休克合并AKI患者12 h(A)和24 h(B)联合标志物诊断性能的ROC分析 |
3 讨论 3.1 蛋白质组学在识别潜在的感染性休克合并AKI标志物中的应用
感染性休克合并AKI可以在没有明显的低灌注迹象或没有血流动力学不稳定的临床迹象的情况下发生[8]。因此,迫切需要早期生物标志物来及时诊断和预测损伤严重程度。感染性休克通常与多器官损伤相关,而源自血浆和尿液的传统感染性休克标志物(例如肌酐、尿液浓缩能力)易受非肾脏因素的干扰,因此敏感性和特异性不高[9]。近年来,蛋白质组学在肾脏疾病的研究中有广阔的前景;不但可能发现不同肾脏疾病的早期信号和生物标志物,而且也可能对不同肾脏疾病的预后判定起指导性的作用[5-6]。在本实验中,使用UPLC-QTOF/MS研究感染性休克合并AKI患者尿液中代谢物的变化,以识别潜在的代谢组学生物标志物。全局蛋白质组数据与之前在许多已知AKI标志物(如NGAL)背景下的尿液发现大体一致[10]。此外,验证了几种新的和/或研究较少的感染性休克合并AKI标记蛋白,包括S100A8、Chil3和CP。全局蛋白质组分析显示,在感染性休克早期阶段,与细胞外基质和急性期反应相关的蛋白质和与跨膜受体蛋白激酶活性相关的蛋白质增加,与离子、氨基酸和代谢物排泄相关的蛋白质以及与线粒体相关的蛋白质减少。这些变化与组织中的炎症和纤维化反应一致。
3.2 蛋白质组学鉴定的生物标志物诊断感染性休克合并AKI的性能NGAL是一种经过验证的肾损伤预测因子。在缺血性、脓毒性或移植后AKI下,尿液中NGAL水平迅速增加[11]。本研究中,感染性休克合并AKI患者的尿液NGAL水平较感染性休克NAKI患者显著增加,表明AKI患者的肾脏出现了明确的损伤。CP是一种含铜的亚铁氧化物酶,可将Fe2+氧化为其无毒的Fe3+形式。它的表达在衰老小鼠或消耗高热量饮食的小鼠中显示增加[12],表明这些小鼠中氧化损伤量的增加,需要增强其抗氧化活性。尿CP水平被认为是镰状细胞病患者合并慢性肾脏病(chronic kidney disease, CKD)的生物标志物[13]。本研究中,感染性休克合并AKI患者的尿液CP水平较感染性休克NAKI患者显著增加,表明脓毒症后肾脏的氧化应激增加。S100A8通过与TLR4结合介导促炎反应损伤相关的分子模式(damage-associated molecular pattern, DAMP) [14],先前研究表明S100A8尿液水平增加与感染性休克有关[15]。在蛋白质组分析中,S100A8在两个时间点均显著增加,表明在感染性休克损伤后肾脏中活性钙卫蛋白的形成逐渐增加[16]。Chil3是哺乳动物几丁质酶家族的成员,尽管它由巨噬细胞和中性粒细胞高度分泌,但缺乏几丁质酶活性[17]。Chil3被证明是多种疾病模型(如哮喘和肺纤维化)中炎症和抗菌反应的介质,并参与组织重塑和伤口愈合[18-19]。在之前的肾脏疾病模型研究中,一项尿蛋白质组学研究表明,几丁质酶样蛋白可能是脓毒症AKI的候选生物标志物[20]。最近,已证明临床AKI患者的尿液中几丁质酶样蛋白大量增加[21]。另一项研究表明,在小鼠腹腔注射LPS后6 h和24 h,肾脏Chil3上调[22]。总之,本研究概括了之前描述的与脓毒症相关的调节蛋白,并为未来的脓毒症诊断和治疗研究提供了有价值的候选靶点资源。
本研究采用非靶向代谢组学初步评估了患有和未患有AKI的感染性休克个体代谢物和代谢途径的代谢变化,确定了12 h和24 h发生变化的4种潜在标志物。对于这些患者,标志物组合作为诊断标志物比单个标志物更有效。本研究结果为探索感染性休克合并AKI患者的潜在生物标志物和病理机制提供了可行的方法。然而,本结果仅对用尿蛋白组学方法探讨感染性休克合并AKI的早期生物学标志物的识别提供了新的思路,未来还需要通过大样本前瞻性研究来验证这些标志物的诊断效能。
| [1] |
张晓蕾, 李莉, 彭倩宜, 等. 感染性休克患者舌下微循环障碍分型及与预后的研究初探[J]. 中华内科杂志, 2021, 60(10): 898-903. ZHANG X L, LI L, PENG Q Y, et al. A preliminary study on the classification and prognosis of microcirculation alterations in patients with septic shock[J]. Chin J Intern Med, 2021, 60(10): 898-903. |
| [2] |
李燕, 黄庆生, 方明星, 等. 黏附因子联合肾阻力指数对早期预测脓毒症患者发生急性肾损伤的价值[J]. 中华医院感染学杂志, 2020, 30(24): 3711-3715. LI Y, HUANG Q S, FANG M X, et al. Value of renal resistance index and serum cell adhesion molecules for prediction of acute kidney injury in patients with sepsis[J]. Chin J Nosocomiol, 2020, 30(24): 3711-3715. |
| [3] |
何力, 苏连久, 张婧, 等. ICU内脓毒性休克急性肾损伤患者肾功能恢复的影响因素分析[J]. 中华危重病急救医学, 2020(2): 199-203. HE L, SU L J, ZHANG J, et al. Analysis of factors influencing recovery of renal functions in septic shock patients in intensive care unit with acute kidney injury[J]. Chin Crit Care Med, 2020(2): 199-203. |
| [4] |
付优, 何聪, 白银箱, 等. 肾阻力指数联合中心静脉压预测脓毒性休克患者发生急性肾损伤的价值[J]. 中华危重病急救医学, 2020(4): 473-477. FU Y, HE C, BAI Y X, et al. Value of the combination of renal resistive index and central venous pressure to predict septic shock induced acute kidney injury[J]. Chin Crit Care Med, 2020(4): 473-477. |
| [5] |
LI Y M, LONG J K, CHEN J Q, et al. Analysis of spatiotemporal urine protein dynamics to identify new biomarkers for sepsis-induced acute kidney injury[J]. Front Physiol, 2020, 11: 139. |
| [6] |
ANDRIANOVA N V, POPKOV V A, KLIMENKO N S, et al. Microbiome-metabolome signature of acute kidney injury[J]. Metabolites, 2020, 10(4): 142. |
| [7] |
SINGER M, DEUTSCHMAN C S, SEYMOUR C W, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. |
| [8] |
陈丽娟, 吴晓丽, 秦海艳, 等. 腹腔感染引起的脓毒性休克患者发生急性肾损伤的危险因素分析[J]. 实用医学杂志, 2021, 37(4): 477-481. CHEN L J, WU X L, QIN H Y, et al. Analysis of risk factors for acute kidney injury in patients with septic shock caused by intra-abdominal infection[J]. J Pract Med, 2021, 37(4): 477-481. |
| [9] |
SRISAWAT N, KELLUM J A. The role of biomarkers in acute kidney injury[J]. Crit Care Clin, 2020, 36(1): 125-140. |
| [10] |
刘立志, 曾梦君, 蒋继贫. NGAL、KIM-1和PCT在脓毒症AKI中的标志物作用[J]. 基因组学与应用生物学, 2020, 39(3): 1408-1413. LIU L Z, ZENG M J, JIANG J P. Role of NGAL, KIM-1 and PCT markers in acute renal injury of sepsis[J]. Genom Appl Biol, 2020, 39(3): 1408-1413. |
| [11] |
LEE C C, CHANG C H, CHEN S W, et al. Preoperative risk assessment improves biomarker detection for predicting acute kidney injury after cardiac surgery[J]. PLoS One, 2018, 13(9): e0203447. |
| [12] |
SUN P C, FENG S J, GUAN Q N, et al. Clusterin deficiency predisposes C57BL/6j mice to cationic bovine serum albumin-induced glomerular inflammation[J]. J Inflamm Res, 2020, 13: 969-983. |
| [13] |
SARAF S L, LIN X H, LEE G, et al. Urinary ceruloplasmin concentration predicts development of kidney disease in sickle cell disease patients[J]. Blood, 2016, 128(22): 4865. |
| [14] |
KOVAČIĆ M, MITROVIĆ-AJTIĆ O, BELESLIN-ČOKIĆ B, et al. TLR4 and RAGE conversely mediate pro-inflammatory S100A8/9-mediated inhibition of proliferation-linked signaling in myeloproliferative neoplasms[J]. Cell Oncol, 2018, 41(5): 541-553. |
| [15] |
WANG S W, SONG R, WANG Z Y, et al. S100A8/A9 in inflammation[J]. Front Immunol, 2018, 9: 1298. |
| [16] |
DUBOIS C, PAYEN D, SIMON S, et al. Top-down and bottom-up proteomics of circulating S100A8/S100A9 in plasma of septic shock patients[J]. J Proteome Res, 2020, 19(2): 914-925. |
| [17] |
PRZYSUCHA N, GÓRSKA K, KRENKE R. Chitinases and chitinase-like proteins in obstructive lung diseases-current concepts and potential applications[J]. Int J Chron Obstruct Pulmon Dis, 2020, 15: 885-899. |
| [18] |
LIU L, ZHANG X, LIU Y, et al. Chitinase-like protein YKL-40 correlates with inflammatory phenotypes, anti-asthma responsiveness and future exacerbations[J]. Respir Res, 2019, 20(1): 95. |
| [19] |
SUTHERLAND T E. Chitinase-like proteins as regulators of innate immunity and tissue repair: helpful lessons for asthma?[J]. Biochem Soc Trans, 2018, 46(1): 141-151. |
| [20] |
DE LOOR J, DECRUYENAERE J, DEMEYERE K, et al. Urinary chitinase 3-like protein 1 for early diagnosis of acute kidney injury: a prospective cohort study in adult critically ill patients[J]. Crit Care, 2016, 20: 38. |
| [21] |
ALBELTAGY E S, ABDUL-MOHYMEN A M, TAHA D R A. Early diagnosis of acute kidney injury by urinary YKL-40 in critically ill patients in ICU: a pilot study[J]. IntUrol Nephrol, 2020, 52(2): 351-361. |
| [22] |
RÓKA B, TOD P, KAUCSÁR T, et al. The acute phase response is a prominent renal proteome change in sepsis in mice[J]. Int J Mol Sci, 2019, 21(1): 200. |




