2. 400016 重庆,重庆医科大学检验医学院,临床检验诊断学教育部重点实验室
2. Key Laboratory of Clinical Laboratory and Diagnostics of Ministry of Education, College of Laboratory Medicine, Chongqing Medical University, Chongqing, 400016, China
肿瘤细胞多药耐药性是化疗失败的主要原因,细胞内谷胱甘肽(glutathione, GSH)系统是造成细胞毒性药物作用失效的主要因素[1-2]。谷胱甘肽-S-转移酶(glutathione-S-transferase, GST)是利用GSH对各种内源性和外源性非营养物质(包括细胞毒性抗肿瘤药物)进行生物转化的关键二相代谢酶,当其活性增强时药物的代谢和排泄也随之增加从而引发耐药性[3]。人胞质GSTs有多种同工酶,分为π、μ(Mu)、α、ω、θ、ζ 6大类。GSTs已被证明在化疗耐药肿瘤细胞中过表达,其中谷胱甘肽S-转移酶Mu(Glutathione-S-transferase Mu, GSTM)与卵巢癌、肺癌等耐药密切相关[4]。GSTs作为肿瘤耐药逆转药物的作用靶点,其抑制剂可逆转肿瘤耐药而提高肿瘤化疗药物治疗指数[5-6]。
已报道多种GST抑制剂,如依他尼酸、肉桂醛、谷胱甘肽类似物等[7-9]。HANSSON等[10]发现在耐苯丙酸氮芥的人黑色素瘤细胞中GST水平升高,依他尼酸可以逆转对苯丙酸氮芥的耐药。黄玲萍等[11]研究证实依他尼酸可通过抑制GST活性和β-catenin水平,发挥抑制肺癌A549细胞球增殖和干性,促进其凋亡。依他尼酸与替塞派合用治疗晚期肿瘤曾进入Ⅰ期临床,因其严重的耳毒性,并伴随高血糖、低钙和低镁血症等副作用,制约了其临床应用[12]。GST是具有2个亚基的同二聚体结构,每个亚基含有1个活性中心,由可结合还原型谷胱甘肽的G位点和结合疏水底物的H位点组成[13];2个H位点通过狭缝相连。GST的G位点只能结合GSH,H位点可结合多种疏水底物或配体[14]。当1个化合物与酶的1个活性中心相结合发挥抑制作用,称为单价抑制剂,若同时与二聚体酶两个活性中心结合发挥抑制作用,则为二价抑制剂;理论上二价抑制剂亲和力比单价抑制剂高。同样,当一个疏水底物可与GSH反应且生成的产物能同时结合到G位点和H位点时,产物的亲和力比疏水底物的亲和力高,此时疏水底物称为潜抑制剂,而产物称为抑制剂。因此,针对GST二聚体,设计潜抑制剂和二价抑制剂是提高抑制剂亲和力的有效策略,同时也要尽可能降低化合物的细胞毒性。前期本课题组利用依他尼酸合成的GST抑制剂双依他尼酰丁二胺、双依他尼酸乙醇胺等,对GSTM的抑制常数可达到纳摩尔(nmol/L)级[15-16]。细胞实验显示,双依他尼酰己二胺对耐顺铂卵巢癌有明显逆转作用,但对正常细胞有较大毒性,该毒性可能来自于依他尼酸的α, β-不饱和酮结构及其2, 3-二氯苯酚结构[17-18]。因此,本研究以依他尼酸为先导化合物,保留或不保留α, β-不饱和酮结构、去掉氯取代基,设计合成苯氧乙酸类系列化合物,通过表征其对GSTM的抑制能力,揭示其与GSTM之间的构效关系,为肿瘤化疗药物增敏剂的开发奠定基础。
1 材料与方法 1.1 主要试剂和仪器苯氧乙酸、N-羟基琥珀酰亚胺(N-hydroxysuccinimide, NHS)、N, N’-二环己基碳二亚胺(dicyclohexylcarbodiimide, DCC)、70%乙胺水溶液、1, 4-丁二胺、丙酰氯、丙烯酰氯、无水三氯化铝购自上海阿拉丁生化科技股份有限公司;还原型GSH购自北京鼎国昌盛生物技术有限责任公司;2, 4-二硝基氯苯(2, 4-dinitrochlorobenzene, CDNB)购自美国ICN Biomedicals公司。Esquire 6000型液相色谱/质谱联用仪(德国,Bruker公司);Avance DRX-500MHz型核磁谱仪(德国,Bruker公司);UV-1600型紫外可见分光光度计(日本,岛津公司);Agilent Cary Eclipse型荧光分光光度计(美国,安捷伦公司);Agilent 1260型高效液相色谱仪(美国,安捷伦公司)。
1.2 苯氧乙酸类系列化合物的合成按照图 1路线合成对丙烯酰苯氧乙酰乙胺(Ⅰ a)、对丙酰苯氧乙酰乙胺(Ⅰb)、N, N’-(4-(丙烯酰基)苯氧乙酰基)丁二胺(Ⅱa)、N, N’-(4-(丙酰基)苯氧乙酰基)丁二胺(Ⅱb),对化合物结构进行鉴定。使用高效液相色谱法测定化合物纯度,色谱柱:Thermo Sycronis C18柱(150 mm×4.6 mm, 5 μm);保护柱:Agilent Zorbax C18填料(12.5 mm×4.6 mm, 5 μm);流动相A:纯化水,流动相B:甲醇;A∶B=10∶90;检测波长:265 nm;柱温:30 ℃。

|
| 图 1 苯氧乙酸系列化合物的合成路线 |
1.2.1 化合物Ⅰa、Ⅰb的合成
将丙烯酰基苯氧乙酸(0.70 g, 3.3 mmol)和NHS(0.40 g, 3.4 mmol)溶于四氢呋喃(70 mL),冰浴下滴加完含有DCC(0.75 g, 3.5 mmol)的四氢呋喃(10 mL)后室温搅拌过夜,滤去不溶物后缓慢鼓入过量的干燥乙胺气体(乙胺水溶液加热,过氢氧化钠干燥管),反应4 h后真空旋干溶剂得白色固体。用30 mL二氯甲烷溶解后依次用5%碳酸氢钠溶液(2次)、0.5 mol/L盐酸溶液(2次)和饱和食盐水洗涤,真空浓缩后得粗品0.56 g。用硅胶柱(乙酸乙酯∶石油醚=3∶2)纯化,得到浅黄色固体Ⅰa 0.31 g (34%),纯度为94.5%。用对丙酰基苯氧乙酸为原料同法可得化合物Ⅰb (41%),纯度为98.6%。化合物Ⅰa:1H NMR (500 MHz, DMSO-d6) δ 8.19 (s, 1H), 8.01 (d, J=8.5 Hz, 2H), 7.40 (dd, J=16.9, 10.4 Hz, 1H), 7.08 (d, J=8.7 Hz, 2H), 6.31 (d, J=16.9 Hz, 1H), 5.92 (d, J=10.5 Hz, 1H), 4.57 (s, 2H), 3.15 (p, J=6.9 Hz, 3H), 1.03 (t, J=7.2 Hz, 4H); 13C NMR (125 MHz, DMSO-d6) δ 188.17, 166.86, 161.83, 132.18, 130.95, 130.16, 129.58, 114.94, 67.04, 33.35, 14.79. HRMS[M+H]+: C13H16NO3, 理论分子量为234.1130, 实测分子量为234.1133。化合物Ⅰ b:1H NMR (400 MHz, DMSO-d6) δ 8.15 (s, 1H), 7.99-7.83(m, 2H), 7.10-6.88 (m, 2H), 4.52 (s, 2H), 3.12 (d, J=6.8 Hz, 2H), 2.95 (q, J=7.2 Hz, 2H), 1.02 (dt, J=10.2, 7.2 Hz, 6H); 13C NMR (100 MHz, DMSO-d6) δ 199.29, 167.18, 161.76, 130.43, 114.96, 67.34, 33.63, 31.26, 15.18, 8.69. HRMS[M+H]+: C13H18NO3, 理论分子量为236.128 7, 实测分子量为236.128 2。
1.2.2 化合物Ⅱa、Ⅱb的合成将对丙烯酰基苯氧乙酸(0.70 g, 3.3 mmol)和NHS(0.40 g, 3.4 mmol)溶于四氢呋喃(10 mL),冰浴下滴加完含有DCC(0.70 g, 3.4 mmol)的四氢呋喃(10 mL)后室温搅拌过夜,滤去不溶物后室温下慢速逐滴加入已用四氢呋喃(5 mL) 稀释的1, 4-丁二胺(0.16 g, 1.8 mmol),期间用薄层色谱板监测。室温反应完后,旋转蒸发除去溶剂,得浅黄色固体。用二氯甲烷溶解此固体后依次用5%碳酸氢钠水溶液、0.5 mol/L盐酸水溶液和饱和食盐水反复洗涤,无水硫酸钠干燥,减压旋干,得到白色固体用硅胶柱(乙酸乙酯∶三乙胺=20∶1) 纯化即得Ⅱa 0.43 g (28%),纯度为95.5%。用对丙酰基苯氧乙酸为原料同法可得化合物Ⅱb (35%),纯度为97.2%。化合物Ⅱa:1H NMR (500 MHz, DMSO-d6) δ 8.18 (t, J=5.9 Hz, 2H), 8.02 (d, J = 7.6 Hz, 4H), 7.41 (dd, J=16.9, 10.4 Hz, 2H), 7.08 (d, J=7.7 Hz, 4H), 6.31 (d, J=16.9 Hz, 2H), 5.92 (s, 2H), 4.59 (s, 4H), 3.13 (q, J=5.7 Hz, 4H), 1.42 (s, 4H); 13C NMR (125 MHz, DMSO-d6) δ 187.96, 166.87, 161.76, 132.10, 130.83, 130.05, 129.39, 114.82, 66.95, 38.02, 26.50. HRMS [M+H]+: C26H29N2O6, 理论分子量为465.202 6, 实测分子量为465.201 4。化合物Ⅱb:1H NMR (400 MHz, DMSO-d6) δ 8.15 (t, J=5.9 Hz, 2H), 8.00-7.83 (m, 4H), 7.11-6.94 (m, 4H), 4.53 (s, 4H), 3.09 (d, J=5.7 Hz, 4H), 2.95 (q, J=7.2 Hz, 4H), 1.03 (t, J=7.2 Hz, 6H); 13C NMR (100 MHz, DMSO-d6) δ 199.30, 167.38, 161.77, 130.43, 114.96, 67.32, 38.43, 31.27, 26.95, 8.70. HRMS [M+H]+: C26H33N2O6, 理论分子量为469.233 9, 实测分子量为469.234 5。
1.3 紫外光谱法表征苯氧乙酸系列化合物对GSTM的抑制能力 1.3.1 GSTM的表达纯化及表征根据之前的方法[15]进行GSTM的制备。用Bradford法[19]测定蛋白含量。按照Habig法[20]连续跟踪GSTM催化显色底物CDNB和GSH反应测定活性。初速度法[21]测定GSTM对底物CDNB和GSH的米氏常数(Michaelis constant, Km)。
1.3.2 监测化合物Ⅰa、Ⅱa与GSH反应生成产物过程在1.0 mL反应体系中,加入终浓度为60.0 μmol/L的化合物Ⅱa和150.0 μmol/L的GSH,每间隔1.5 min扫描200~500 nm波长范围内的吸收光谱变化。在最大吸收峰272 nm波长下监测60.0 μmol/L的Ⅱa与150.0 μmol/L的GSH分别同0、50.0、100.0 nmol/L 3个浓度GSTM作用下吸光度随时间的变化。用Ⅰa与过量GSH反应,经处理后得到GSH加合物,利用高分辨质谱验证GSH加合物结构。
1.3.3 初速度法表征苯氧乙酸类系列化合物对GSTM的半数抑制浓度(50% inhibiting concentration, IC50)直接测定苯氧乙酸类系列化合物IC50:在1.2 mL的反应体系中,先加入终浓度为4.0 nmol/L GSTM、1.0 mmol/L CDNB和不同浓度梯度的苯氧乙酸类化合物到反应体系中,然后加入终浓度为1.0 mmol/L GSH启动反应,测定在340 nm波长下紫外光吸收随时间的变化曲线。苯氧乙酸类系列化合物与GSH预孵育测定产物IC50:在1.2 mL的反应体系中,将终浓度为4.0 nmol/L GSTM、1.0 mmol/L GSH和不同浓度梯度的苯氧乙酸类化合物孵育10 min,再加入终浓度为1.0 mmol/L CDNB到反应体系中,测定340 nm波长下紫外光吸收随时间的变化曲线。设不加抑制剂为对照组。根据初速度确定抑制率,公式为IC50=(对照组-处理组)/(对照组) ×100%。
1.3.4 测定苯氧乙酸类系列化合物对GSTM的抑制常数(inhibition constant, Ki)初速度法测定在不同浓度抑制剂下GSTM对底物GSH、CDNB的表观Km。配制不同梯度浓度苯氧乙酸类系列化合物的N, N-二甲基亚酰胺储备液,为减少有机试剂的干扰,应使N, N-二甲基亚酰胺在反应体系的终浓度 < 2%。在25 ℃条件下将GSTM、GSH和苯氧乙酸类化合物孵育10 min后加入CDNB启动反应,延迟15 s后每10秒间隔记录监测340 nm吸收变化,共记录2 min。固定GSH浓度为1.0 mmol/L,变化CDNB浓度(变化范围是此抑制剂浓度作用下表观Km(CDNB)的0.4~2.5倍),双倒数作图得到在不同抑制剂浓度下的Km和最大反应速率Vm。以抑制剂浓度为横坐标,分别以1/Km、1/Vm为纵坐标作图,计算截距与斜率的比值即得抑制剂对GSTM的Kik(CDNB)和Kiv(CDNB);固定CDNB浓度为1.0 mmol/L,变化GSH浓度(变化范围是此抑制剂浓度作用下表观Km(GSH)的0.4~2.5倍),双倒数作图后,利用上述方法判断抑制剂相对于底物GSH对GSTM的Kik(GSH)和Kiv(GSH)。通过Kik与Kiv比值可判断抑制剂对GSTM的抑制类型[22]:当比值< 2时判定为反竞争性抑制剂,当比值介于2~5时判定为混合性抑制剂,当比值>5时判定为竞争性或非竞争性抑制剂。
1.4 荧光光谱法表征目标化合物对GSTM的亲和力采用Agilent荧光分光光度计扫描发射光谱图:在3.0 mL pH 7.4浓度为100 mmol/L的磷酸盐缓冲液中,固定GSTM浓度为0.5 μmol/L,加入不同浓度梯度的Ⅱa,280 nm激发,扫描发射光谱图,观察荧光信号的变化,其中激发和发射狭缝/带宽设置为10 nm,光电倍增管的电压调节到“中”;在同样狭缝、电压条件下,280 nm激发测定340 nm荧光信号:固定GSTM浓度为0.5 μmol/L,分别加入不同浓度梯度的苯氧乙酸类系列化合物,测定各化合物的荧光滴定曲线,按静态荧光猝灭模型公式Eq.1计算化合物与GSTM的结合常数Ka及解离常数(dissociation constant, Kd)。Eq.1推导如下:GST酶(E)与抑制剂(I)之间形成不发光的基态配合物可表示为E+I ⇌EI;配合物的结合常数Ka= [EI]/[E][I],解离常数Kd=1/Ka;荧光强度和抑制剂浓度之间的关系:[E]0=[E]+[EI],(F0-F)/F=([E]0-[E])/[E]=[EI]/[E]=Ka[I],Eq.1即F0/F=1+Ka[I]。
1.5 数据处理方法每个实验重复≥2次,数据以x±s表示;采用GraphPad Prism 8.0非配对t检验行统计学差异分析,P < 0.05表示差异具有统计学意义。
2 结果 2.1 苯氧乙酸类化合物与GSH反应形成加合物的过程监测苯氧乙酸类化合物Ⅰa、Ⅱa均含有烯酮式结构,可自发地与GSH的巯基发生麦克尔加成反应。通过紫外分光光度法可监测Ⅱa与GSH形成加合物的反应过程。Ⅱa在286 nm处有最大吸收峰,随着反应的进行,最大吸收峰蓝移至272 nm处,吸收增大(图 2A)。虽然Ⅱa与GSH可自发反应,但GSTM可催化该反应。272 nm波长下自发反应16 min内的吸光度变化为,0.081在100 nmol/L GSTM催化下吸光度变化达到0.120(图 2B)。然而Ⅱb与GSH孵育,未监测到吸收光谱的变化。同样,Ⅰa也可与GSH发生反应,最终形成GSH加合物,HRMS[M+H]+: C23H33N4O9S, 理论分子量为541.196 8, 实测分子量为541.194 4 (图 2C)。
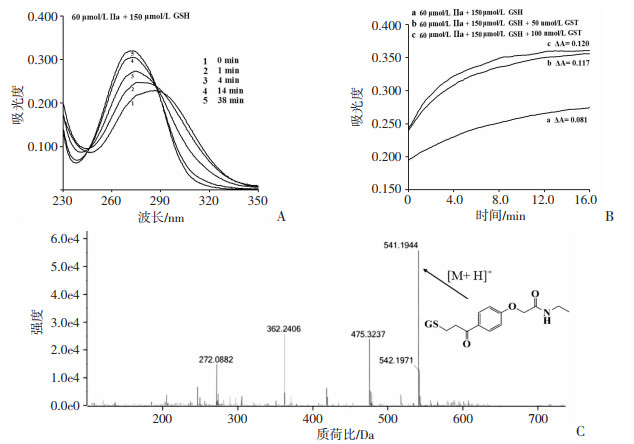
|
| A:化合物Ⅱa(60 μmol/L)与GSH(150 μmol/L)反应光谱变化图;B:在272 nm波长下监测化合物Ⅱa(60 μmol/L) 与GSH(150 μmol/L)被梯度浓度GSTM(0、50、100 nmol/L)催化的吸收变化;C:化合物Ⅰa与GSH形成加合物的高分辨质谱图 图 2 化合物Ⅰa、Ⅱa与GSH形成加合物的反应监测 |
2.2 苯氧乙酸类系列化合物对GSTM的IC50值
在GSTM催化下,不同浓度化合物Ⅰa、Ⅱa与过量GSH 10 min内可基本反应完全(图 2B)。如图 3所示,经GSH预孵育前后,测得Ⅱa的IC50值分别为(0.21±0.03) μmol/L、(0.10±0.02) μmol/L,结果存在明显的差异(P < 0.05),即初步说明GSH预孵育后生成的产物有较强的抑制作用,所以Ⅰa和Ⅱa是潜抑制剂。但因GSH也是GSTM的底物,可与Ⅰa和Ⅱa形成加合物,所以未孵育直接测定Ⅰa、Ⅱa自身对GSTM的IC50值会被产物所干扰。为消除干扰,我们测定了不含烯酮式结构的Ⅰb、Ⅱb对GSTM的IC50值,结果如表 1所示,在可溶解范围内Ⅰb、Ⅱb对GSTM无明显抑制作用。
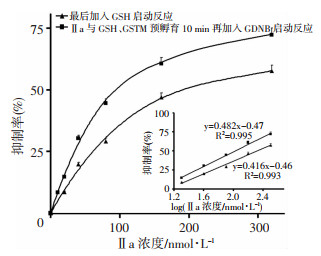
|
| 图 3 化合物Ⅱa与GSH孵育前后对GSTM半抑制浓度比较 |
| 化合物 | 半数抑制浓度IC50(μmol/L) | 抑制常数Ki(μmol/L) | 解离常数Kd (μmol/L) | |||
| 未孵育直接测定 | GSH预孵育 | Kik(GSH) | Kik(CDNB) | |||
| Ⅰa | 161±15 | 67±6a | 19.9±1.6 | 9.1±0.7 | 41.5±1.8e | |
| Ⅱa | 0.21±0.03 | 0.10±0.02b | 0.063±0.005c | 0.079±0.006d | 18.0±0.9f, g | |
| Ⅰb | >500 | >500 | >500 | >500 | 38.9±1.7 | |
| Ⅱb | >500 | >500 | >500 | >500 | 19.5±1.0h | |
| CDNB | / | / | / | / | 67.6±2.9 | |
| a: P < 0.05,与Ⅰa的未孵育直接测定IC50值比较; b: P < 0.05,与Ⅱa的未孵育直接测定IC50值比较;c: P < 0.05,与Ⅰa的Kik(GSH)比较; d: P < 0.05,与Ⅰa的Kik(CDNB)比较; e: P>0.05,与Ⅰb的Kd比较; f: P>0.05,与Ⅱ b的Kd比较; g: P < 0.05,与Ⅰa的Kd比较; h: P < 0.05,与Ⅰb的Kd比较 | ||||||
2.3 苯氧乙酸类系列化合物对GSTM的Ki值
由于Ⅰa、Ⅱa是具有烯醇式结构的潜抑制剂,与GSH形成加合物之后才具有更强抑制作用,因此在测定抑制常数时采用了将Ⅰa、Ⅱa与GSH、GSTM预孵育10 min再加入CDNB启动反应的方法。如图 4所示,固定CDNB浓度、改变GSH浓度时,Ⅰ a对GSTM的Kik和Kiv分别为(19.9±1.6) μmol/L和超过150 μmol/L,Kiv/Kik值>5,相对于GSH为竞争性抑制剂[22];Ⅱa对GSTM的Kik和Kiv分别为(0.063±0.005) μmol/L和(0.028±0.002) μmol/L,Kik/Kiv值介于2~5,相对于GSH为混合性抑制剂。固定GSH浓度、改变CDNB浓度时,Ⅰ a对GSTM的Kik和Kiv分别为(9.1±0.7) μmol/L和超过100 μmol/L,Kiv/Kik值>5,相对CDNB为竞争性抑制剂;Ⅱa对GSTM的Kik和Kiv分别为(0.079±0.006) μmol/L和超过0.5 μmol/L,Kiv/Kik值>5,相对CDNB为竞争性抑制剂。可见Ⅱa较Ⅰa的Ki值低(P < 0.05)。同法测定了Ⅰb、Ⅱb对GSTM的抑制常数,在化合物可溶解范围内无法测出。
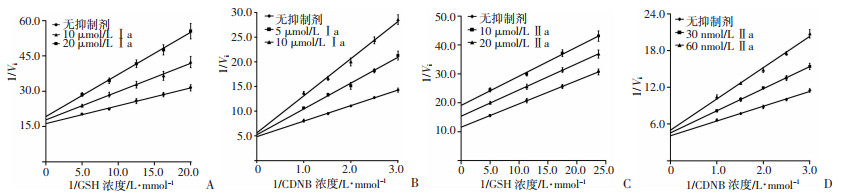
|
| A:固定CDNB浓度,测定Ⅰa相对GSH的Ki;B:固定GSH浓度,测定Ⅰa相对CDNB的Ki;C:固定CDNB浓度,测定Ⅱa相对GSH的Ki;D:固定GSH浓度,测定Ⅱa相对CDNB的Ki 图 4 双倒数作图法测定化合物Ⅰa、Ⅱa对GSTM的Ki值 |
2.4 苯氧乙酸类系列化合物对GSTM的Kd值
当化合物结合到GSTM的活性位点,可静态猝灭GSTM中色氨酸在340 nm荧光[11]。如图 5A所示,在280 nm激发下,随着Ⅱa浓度增加,GSTM的荧光响应曲线逐渐下降。为考察各化合物对GSTM的荧光猝灭能力,我们检测了Ⅰa、Ⅰb、Ⅱa、Ⅱb、CDNB、GSH对GSTM在340 nm的猝灭作用。根据结果(图 5B)可知,除GSH无猝灭作用外,其他疏水化合物均能不同程度猝灭GSTM的荧光。对各化合物的荧光滴定曲线按静态荧光猝灭模型公式Eq.1作图(图 5C),可得各化合物对GSTM的解离常数Kd[23]。计算可知Ⅰa、Ⅰb、Ⅱa、Ⅱb、CDNB的Kd分别为(41.5±1.8) μmol/L、(38.9±1.7) μmol/L、(18.0±0.9) μmol/L、(19.5±1.0) μmol/L、(67.6±2.9) μmol/L。可见Ⅰa与Ⅰb、Ⅱa与Ⅱb之间的Kd无显著差异(P>0.05),而Ⅱa较Ⅰa、Ⅱb较Ⅰb的Kd低(P < 0.05)。
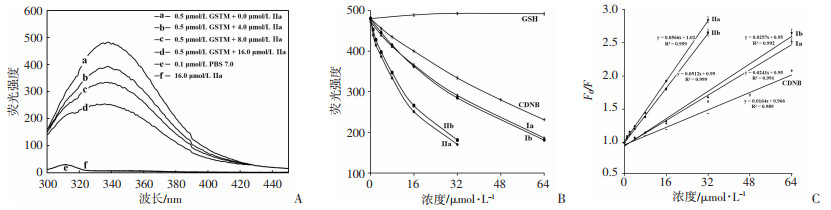
|
| A:在280 nm的激发光下扫描不同浓度梯度的Ⅱa对GSTM的荧光发射光谱图;B:在280 nm激发光下滴定各化合物对GSTM在340 nm发射光的荧光淬灭信号;C:以化合物浓度为横坐标,F0/F为纵坐标作图,按Eq.1公式计算各化合物的Kd 图 5 荧光光谱法表征化合物与GSTM的亲和力 |
3 讨论
以依他尼酸为先导化合物、以苯氧乙酸为基本母核设计合成了4个化合物,主要考察丙烯酮结构对GSTM抑制作用的影响,以及单价抑制剂与二价抑制剂对酶抑制能力的差异。Ⅰa、Ⅱa结构中的α, β-不饱和酮可与GSH自发地发生亲电加成反应,并可被GSTM催化。事实上,依他尼酸也可在GSTM催化下与GSH发生亲电加成反应,但难以自发发生反应[10]。说明经过结构改造后,Ⅰa、Ⅱa的丙烯酮结构受到的空间位阻较依他尼酸的更低,使得Ⅰa、Ⅱa的丙烯酮结构更加活泼。
我们用紫外光谱法分别测定了化合物对GSTM的IC50值和表观抑制常数。数据显示不同的加样方法对IC50值测定结果有显著的影响:将Ⅰa、Ⅱa与GSTM、GSH预孵后测得的IC50值更低,表明Ⅰa、Ⅱa为潜抑制剂,与GSH形成加合物具有更强的抑制作用;而Ⅰb、Ⅱb在可溶解范围内对GSTM均无抑制作用,验证了丙烯酮结构是必须官能团。与GSH预孵育后Ⅱa的IC50值较Ⅰa的IC50值低约670倍,且表观抑制常数低三个数量级。所以二价抑制剂比单价抑制剂的抑制作用更强。在GST的活性中心,G位点对GSH亲和力通常比H位点对其常见的疏水底物的亲和力更强,使潜抑制剂生成产物亲和力大大提高;二价抑制剂可结合两个活性位点使亲和力进一步提高。
为了进一步解释Ⅰa和Ⅱa的亲和力和抑制作用差异,参照文献[24],采用Discovery Studio 2019将靶蛋白GSTM(PDB:1XW5) 分别对Ⅰa和Ⅱa进行对接发现,Ⅱa容易达到经二聚体狭缝与两个活性中心的H位点的结合状态(图 6A),而Ⅰa则在一个亚基的H位点但结合取向可变(图 6B)。当生成产物后,可以明显地看到Ⅰa和Ⅱa都存在GS部分与G位点的锚定结合,且Ⅱa是两个活性中心的结合(图 6C、D)。
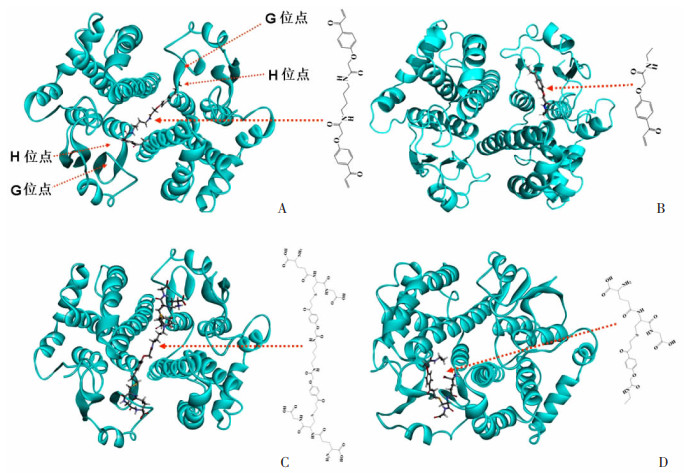
|
| A:对接在GSTM中的Ⅱ a的结合模式;B:对接在GSTM中的Ⅰa的结合模式;C:对接在GSTM中的Ⅱ a与GSH加合产物的结合模式;D:对接在GSTM中的Ⅰa与GSH加合产物的结合模式 图 6 Ⅰa、Ⅱa及其GSH加合物与GSTM结合模式对比 |
由于紫外光谱法表征化合物抑制性能需要依赖底物,而GSTM的双底物模式和化合物的产物型抑制特点大大增加了紫外光谱法的表征难度和效率。因此,我们使用了不依赖底物的荧光光谱法对化合物进行表征。结果显示,结构类似的Ⅰa、Ⅰb以及Ⅱa、Ⅱb表现出对GSTM无差异的解离常数;二价的Ⅱa、Ⅱb较单价的Ⅰa、Ⅰb具有更低的解离常数。说明将丙烯酮结构取代为丙酮结构之后并不影响化合物与GSTM的亲和力,而对称的二价结构可以使亲和力明显提高。该方法可不依赖酶底物快速测定化合物对酶的亲和力,为潜抑制剂的亲和力表征提供方法。
本研究结果表明,针对GSTM的苯氧乙酸类二价潜抑制剂可经与GSH生成产物有效提高亲和力。然而该类抑制剂是否较依他尼酸类抑制剂具有更低的细胞毒性还需要进一步实验验证。
| [1] |
AYBEK H, TEMEL Y, AHMEDB M, et al. Deciphering of the effect of chemotherapeutic agents on human glutathione S-transferase enzyme and MCF-7 cell line[J]. Protein Pept Lett, 2020, 27(9): 888-894. |
| [2] |
刘芳, 宋玉芳, 张学辉, 等. 多药耐药基因表达与上皮性卵巢癌化疗耐药的相关性[J]. 中国医刊, 2021, 56(5): 561-564. LIU F, SONG Y F, ZHANG X H, et al. Correlation between multidrug resistance gene expression and chemoresistance in epithelial ovarian cancer[J]. Chin J Med, 2021, 56(5): 561-564. |
| [3] |
WANG C H, WU H T, CHENG H M, et al. Inhibition of glutathione S-transferase M1 by new gabosine analogues is essential for overcoming cisplatin resistance in lung cancer cells[J]. J Med Chem, 2011, 54(24): 8574-8581. |
| [4] |
CARLSTEN C, SAGOO G S, FRODSHAM A J, et al. Glutathione S-transferase M1 (GSTM1) polymorphisms and lung cancer: a literature-based systematic HuGE review and meta-analysis[J]. Am J Epidemiol, 2008, 167(7): 759-774. |
| [5] |
DI PAOLO V, FULCI C, ROTILI D, et al. Characterization of water-soluble esters of nitrobenzoxadiazole-based GSTP1-1 inhibitors for cancer treatment[J]. Biochem Pharmacol, 2020, 178: 114060. |
| [6] |
SINGH R R, REINDL K M. Glutathione S-transferases in cancer[J]. Antioxidants (Basel), 2021, 10(5): 701. |
| [7] |
IERSEL M L, PLOEMEN J P, STRUIK I, et al. Inhibition of glutathione S-transferase activity in human melanoma cells by alpha, beta-unsaturated carbonyl derivatives. Effects of acrolein, cinnamaldehyde, citral, crotonaldehyde, curcumin, ethacrynic acid, and trans-2-hexenal[J]. Chem Biol Interact, 1996, 102(2): 117-132. |
| [8] |
XIA C, LU J P, XU B T, et al. Design and characterization of a labeling reagent for covalent immobilization of glutathione-S-transferase[J]. Nanosci Nanotechnol Lett, 2019, 11(11): 1547-1560. |
| [9] |
AYNA A, KHOSNAW L, TEMEL Y, et al. Antibiotics as inhibitor of glutathione S-transferase: biological evaluation and molecular structure studies[J]. Curr Drug Metab, 2021, 22(4): 308-314. |
| [10] |
HANSSON J, BERHANE K, CASTRO V M, et al. Sensitization of human melanoma cells to the cytotoxic effect of melphalan by the glutathione transferase inhibitor ethacrynic acid[J]. Cancer Res, 1991, 51(1): 94-98. |
| [11] |
黄玲萍, 谢丽霞, 邱钰超, 等. 依他尼酸联合顺铂化疗促肺癌A549细胞凋亡的作用及机制研究[J]. 第三军医大学学报, 2017, 39(17): 1720-1727. HUANG L P, XIE L X, QIU Y C, et al. Ethacrynic acid promotes apoptosis in lung cancer A549 cells when combined with cisplatin chemotherapy[J]. J Third Mil Med Univ, 2017, 39(17): 1720-1727. |
| [12] |
PLOEMEN J H, VAN OMMEN B, VAN BLADEREN P J. Inhibition of rat and human glutathione S-transferase isoenzymes by ethacrynic acid and its glutathione conjugate[J]. Biochem Pharmacol, 1990, 40(7): 1631-1635. |
| [13] |
TARS K, OLIN B, MANNERVIK B. Structural basis for featuring of steroid isomerase activity in alpha class glutathione transferases[J]. J Mol Biol, 2010, 397(1): 332-340. |
| [14] |
杨宪峰, 张灵, 杨晓兰, 等. 融合标签谷胱甘肽S-转硫酶高亲和配体的设计与筛选[J]. 重庆医科大学学报, 2012, 37(9): 791-795. YANG X F, ZHANG L, YANG X L, et al. Design and screening of high-affinity ligands for glutathione S-transferase as fusion tag[J]. J Chongqing Med Univ, 2012, 37(9): 791-795. |
| [15] |
许榜田, 赵语, 龙友琦, 等. 两种依他尼酸衍生物对人类谷胱甘肽-S-转移酶Mu的抑制动力学研究[J]. 重庆医科大学学报, 2020, 45(8): 1144-1150. XU B T, ZHAO Y, LONG Y Q, et al. A study of the inhibition kinetics of human glutathione-S-transferase Mu by two ethacrynic acid derivatives[J]. J Chongqing Med Univ, 2020, 45(8): 1144-1150. |
| [16] |
同婷婷, 段昌园, 李欣蓬, 等. 双依他尼酸乙醇胺对谷胱甘肽S-转硫酶mu的选择性抑制作用[J]. 基因组学与应用生物学, 2021, 40(1): 406-413. TONG T T, DUAN C Y, LI X P, et al. Characterization of aminoethanol di-ethacrynic acid as a selective divalent potent inhibitor of glutathione S-transferase mu[J]. Genom Appl Biol, 2021, 40(1): 406-413. |
| [17] |
刘芳, 杨晓兰, 廖飞. GSTM潜抑制剂双依他尼酰乙二胺对人耐顺铂卵巢癌细胞COC1/DDP的抗肿瘤活性[J]. 基因组学与应用生物学, 2016, 35(6): 1266-1271. LIU F, YANG X L, LIAO F. Anti-tumor activity of short divalent ethacrynic amide on human ovarian cancer cell line COC1/DDP[J]. Genom Appl Biol, 2016, 35(6): 1266-1271. |
| [18] |
HOU J F, LIU F X, WU N, et al. Efficient biodegradation of chlorophenols in aqueous phase by magnetically immobilized aniline-degrading Rhodococcus rhodochrous strain[J]. J Nanobiotechnology, 2016, 14: 5. |
| [19] |
BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal Biochem, 1976, 72: 248-254. |
| [20] |
HABIG W H, PABST M J, JAKOBY W B. Glutathione S-transferases. The first enzymatic step in mercapturic acid formation[J]. J Biol Chem, 1974, 249(22): 7130-7139. |
| [21] |
LIAO F, LI J C, KANG G F, et al. Measurement of mouse liver glutathione S-transferase activity by the integrated method[J]. J Med Coll PLA, 2003, 18(5): 295-300. |
| [22] |
YANG X L, DU Z Y, PU J, et al. Classification of difference between inhibition constants of an inhibitor to facilitate identifying the inhibition type[J]. J Enzyme Inhib Med Chem, 2013, 28(1): 205-213. |
| [23] |
许金钩, 王尊本. 荧光分析法[M]. 第3版. 北京: 科学出版社, 2006: 68-69. XU J G, WANG Z B. Fluorescence analysis[M]. 3rd ed. Beijing: Science Press, 2006: 68-69. |
| [24] |
XU B T, TONG T T, WANG X, et al. Short divalent ethacrynic amides as pro-inhibitors of glutathione S-transferase isozyme Mu and potent sensitisers of cisplatin-resistant ovarian cancers[J]. J Enzyme Inhib Med Chem, 2022, 37(1): 728-742. |




