2. 832000 新疆 石河子,石河子大学医学院第一附属医院重症二科
2. Second Department of Intensive Care Medicine, First Affiliated Hospital, Medical College of Shihezi University, Shihezi, Xinjiang Uygur Autonomous Region, 832000, China
脓毒症作为一种高致死疾病,是导致重症监护室(ICU)患者死亡的主要原因之一[1]。最新的脓毒症和感染性休克管理国际指南强调脓毒症所致的多器官功能障碍,同时规范了脓毒症诊疗方面的临床实践[2]。心肌损伤是脓毒症的严重并发症之一,与脓毒症的高死亡率直接相关[3]。其复杂发病机制包括炎症介质失调、线粒体功能障碍、氧化应激、钙调节紊乱、自主神经系统失调和内皮功能障碍、内质网应激、自噬等[4]。铁死亡是一种新型依赖活性氧和铁的调节性细胞死亡形式,其本质是由于细胞内的脂质氧化物自身代谢发生障碍,在器官损伤和肿瘤靶向治疗中发挥重要作用[5]。NCOA4是铁蛋白选择性自噬周转的选择性货物受体,通过促进铁蛋白的储存或释放来维持细胞内铁稳态[6]。
铁死亡已被证实参与各种病理生理过程,包括急性肾功能衰竭、肝损伤、心脏病以及脓毒症等[7-9]。然而,其在脓毒症心肌细胞损伤中的具体作用机制尚不清楚,NCOA4介导的铁蛋白自噬是否参与其中亦尚未被阐述。本研究采用脂多糖(lipopolysaccharide,LPS)刺激H9c2大鼠心肌细胞的方法,建立脓毒症心肌损伤细胞模型,探讨NCOA4介导的铁蛋白自噬是否参与LPS诱导的脓毒症心肌细胞铁死亡的发生,为脓毒症心肌损伤的诊断与治疗开拓新的方向。
1 材料与方法 1.1 材料与试剂H9c2大鼠心肌细胞购自武汉普诺赛生命科技有限公司(CL-0089);DMEM培养基购自美国Gibcog公司;胎牛血清购自以色列BI公司;青霉素-链霉素购自美国HyClone公司;大肠杆菌内毒素LPS购自美国sigma公司;CCK-8细胞活力检测试剂盒购自东仁化学科技(上海)有限公司;铁离子比色法检测试剂盒E1042购自北京普利莱基因技术有限公司;乳酸脱氢酶(lactate dehydrogenase, LDH)试剂盒、肌酸激酶同工酶(creatine kinase isoenzymes, CK-MB)测试盒、还原型谷胱甘肽(glutathione, GSH)测定试剂盒、细胞丙二醛(MDA)测定试剂盒均购自南京建成生物工程研究所有限公司;DCFH-DA活性氧(ROS)荧光探针、JC-1线粒体荧光探针、蛋白抽提试剂盒均购自北京索莱宝科技有限公司;DAPI染液、抗荧光淬灭封片剂均购自武汉赛维尔生物科技有限公司;兔抗NCOA4、Ferritin、SLC7A11、GPX4、LC3-Ⅱ抗体购自艾比玛特医药科技(上海)有限公司;β-actin抗体、山羊抗鼠和山羊抗兔二抗购自北京中杉金桥生物技术有限公司。本研究经石河子大学医学院第一附属医院实验动物伦理委员会审批(A2022-104-01)。
1.2 细胞培养和处理将H9c2大鼠心肌细胞接种在DMEM完全培养基(含10%胎牛血清、1%青霉素-链霉素双抗)、37 ℃、5% CO2的培养瓶中,将大肠杆菌LPS溶解于双蒸水中,浓度分别为5、10、20 μg/mL。将H9c2细胞分为4组:Control组、LPS 5 μg/mL组、LPS 10 μg/mL组、LPS 20 μg/mL组。根据图 1结果以及文献[10],在后续荧光实验中使用10 μg/mL的LPS,干预24 h。
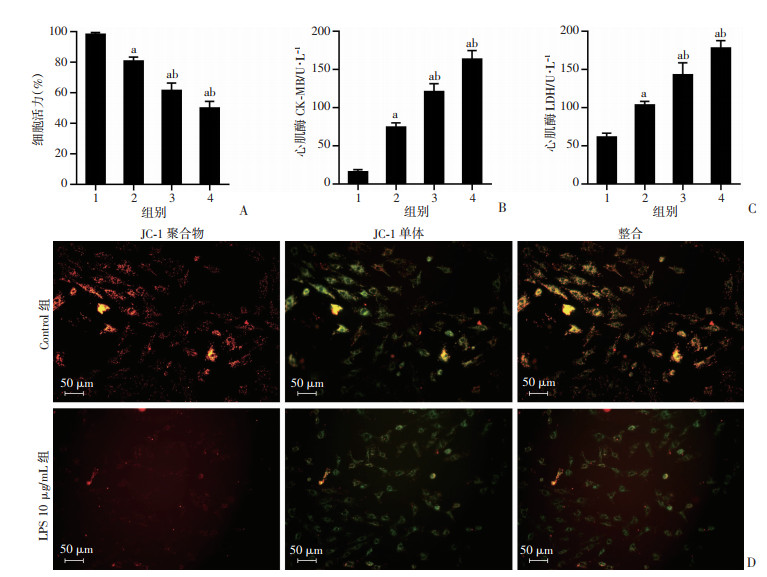
|
| A:各组心肌细胞活力变化;B:各组细胞心肌酶CK-MB释放变化;C:各组细胞心肌酶LDH释放变化;D:Control组与LPS 10 μg/mL组线粒体膜电位变化 1:Control组;2:LPS 5 μg/mL组;3:LPS 10 μg/mL组;4:LPS 20 μg/mL组;a: P<0.05,与Control组比较;b: P<0.05,与LPS 5 μg/mL组比较 图 1 LPS诱导H9c2细胞损伤并抑制细胞活力 |
1.3 H9c2心肌细胞活力、Fe2+检测
采用CCK-8试剂盒检测心肌细胞活力,采用铁离子比色法检测心肌细胞Fe2+变化。将H9c2细接种于96孔板中过夜培养,然后用不同浓度LPS处理24 h后,按照试剂盒说明书向每个孔中加入对应试剂。最后使用酶标仪测量细胞活力、Fe2+浓度变化。
1.4 H9c2心肌细胞损伤、氧化应激、脂质过氧化检测采用检测试剂盒检测心肌细胞LDH、CK-MB、GSH、MDA释放变化;采用DCFH-DA荧光探针测定心肌细胞ROS水平。H9c2细胞接种于96孔板中过夜培养,再用不同浓度LPS处理24 h后,根据各操作手册,加入相关检测工作液,最后使用酶标仪测定上清液中的心肌酶、氧化应激变化水平;根据荧光探针操作手册处理后,加入相应检测工作液,37 ℃下孵育30 min后洗涤细胞2次,最后在荧光显微镜观察并分析。其中绿色荧光强度变化代表心肌细胞内ROS的水平。
1.5 NCOA4小干扰RNA(NCOA4 siRNA)转染为了产生NCOA4基因敲除细胞,首先构建NCOA4片段和突变体,然后进行慢病毒生产和稳定转染。H9c2细胞用5μL/孔的NCOA4 siRNA转染48 h以降低基因表达。然后用10 μg/mL LPS刺激H9c2细胞24 h。慢病毒转导后,用5 μg/mL嘌呤霉素筛选细胞,将H9c2细胞分为4组:Control siRNA组、NCOA4 siRNA组、Control siRNA+LPS 10 μg/mL组、NCOA4 siRNA+LPS 10 μg/mL组。最后采用铁离子比色法检测心肌细胞Fe2+变化、Western bolt法检测各组蛋白表达变化。
1.6 免疫荧光将H9c2细胞种于6孔板,细胞爬片,细胞用4%多聚甲醛固定,在含1%BSA的PBS中于室温封闭1 h,孵育一抗4 ℃过夜然后洗涤3次和孵育二抗,室温孵育50 min。用DAPI染液对细胞核进行染色,避光室温孵育10 min,洗涤3次,每次5 min。玻片稍甩干后用抗荧光淬灭封片剂进行封片。荧光显微镜下观察并采集图像分析。
1.7 Western bolt测定心肌细胞铁死亡相关蛋白表达细胞蛋白提取采用RIPA裂解液,用超微量分光光度计对细胞提取物的浓度进行定量。Ferritin、LC3-Ⅱ、GPX4蛋白在12%的SDS-PAG凝胶中电泳,其余蛋白在10%的SDS-PAG凝胶中电泳。然后转移到PVDF膜上。电转后用牛血清白蛋白在室温下封闭膜2 h,与一抗在4 ℃孵育过夜。一抗NCOA4、Ferritin、LC3-Ⅱ、GPX4、SLC7A11和β-actin抗体稀释度均为1 ∶1 000。洗膜后,二抗室温孵育1 h。二抗山羊抗鼠和山羊抗兔抗体稀释度均为1 ∶10 000,洗膜,根据生产说明书用高敏ECL化学发光试剂盒1 ∶1配制显影液,曝光,获取图像并使用Image Lab软件对每个波段的强度进行量化分析。
1.8 统计学分析采用SPSS 26.0统计软件对实验数据进行分析,Image J 1.8.0软件分析NCOA4、Ferritin、LC3-Ⅱ、GPX4、SLC7A11的表达定量及Ferritin-NCOA4免疫荧光阳性染色区域,计量资料用x±s表示,两个样本均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果 2.1 LPS诱导H9c2细胞损伤并抑制细胞活力分别用等剂量双蒸水、5 μg/mL LPS、10 μg/mL LPS、20 μg/mL LPS进行干预后,实验结果如图 1所示,与Control组相比,LPS 5 μg/mL组、LPS 10 μg/mL组、LPS 20 μg/mL组H9c2细胞的活力随LPS浓度梯度刺激的增加而降低。相比于LPS 5 μg/mL组,LPS 10 μg/mL组和LPS 20 μg/mL组细胞活力降低更为明显(P<0.05)。同时发现,与Control组相比,LPS干预各组心肌酶CK-MB和LDH释放量升高(P<0.05),心肌细胞损伤加重。相比于LPS 5 μg/mL组,LPS 10 μg/mL组和LPS 20 μg/mL组心肌酶增多更为明显(P<0.05)。提示脓毒症心肌细胞活力与LPS浓度存在一定依赖性。铁死亡发生有不同于凋亡等死亡方式的典型形态学改变,线粒体膜电位的异常改变不仅是线粒体损伤的重要标志,也是铁死亡发生的早期预警。采用10 μg/mL的LPS浓度进行进荧光探针实验,测量各组细胞的线粒体膜电位改变情况。如图 1所示,JC-1染色表明,与Control组相比,LPS 10 μg/mL组细胞线粒体JC-1聚合物降低, 红色荧光减弱(P<0.05),线粒体膜电位降低。结果表明LPS可导致H9c2细胞的线粒体损伤和细胞活力下降。
2.2 LPS诱导H9c2细胞铁死亡如图 2所示,与Control组相比,不同浓度的LPS干预后脂质过氧化物MDA的释放增加(P<0.05)、Fe2+浓度增加(P<0.05)、ROS荧光增强(P<0.05),GSH的释放有所下降(P<0.05),细胞铁死亡标记物水平升高。相比于LPS 5 μg/mL组,LPS 10 μg/mL组和LPS 20 μg/mL组细胞氧化应激水平明显增强(P<0.05),脂质过氧化物MDA水平增加更为明显(P<0.05)。MDA、ROS等铁死亡标记物水平与LPS剂量浓度存在一定依赖性(P<0.05)。提示LPS可在体外上调脓毒症心肌细胞Fe2+浓度,引起氧化应激并激活铁死亡。
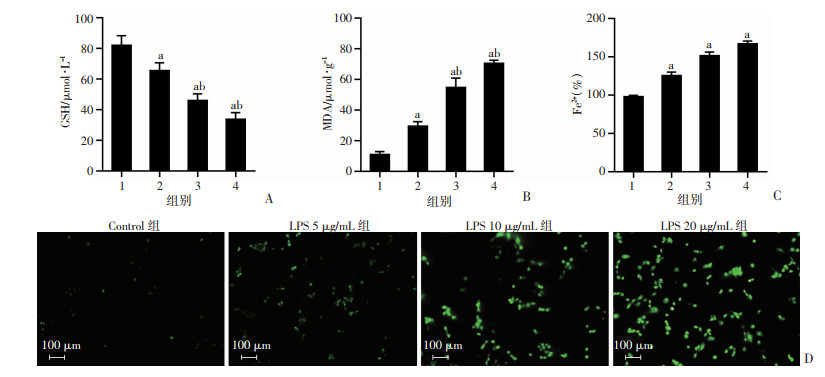
|
| A:各组心肌细胞GSH活性变化;B:各组心肌细胞MDA含量变化;C:各组心肌细胞Fe2+浓度变化;D:各组心肌细胞ROS水平变化 1:Control组;2:LPS 5 μg/mL组;3:LPS 10 μg/mL组;4:LPS 20 μg/mL组;a: P<0.05,与Control组比较;b: P<0.05,与LPS 5 μg/mL组比较 图 2 LPS诱导H9c2细胞铁死亡 |
2.3 LPS通过促进铁蛋白自噬诱导H9c2细胞铁死亡
通过Western blot检测Control组、LPS 5 μg/mL组、LPS 10 μg/mL组、LPS 20 μg/mL组铁死亡、自噬标志蛋白相对表达量。与Control组相比,不同浓度的LPS干预后细胞NCOA4、LC3-Ⅱ表达升高(P<0.05),Ferritin、SLC7A11和GPX4表达降低(P<0.05)。相比于LPS 5 μg/mL组,LPS 10 μg/mL组和LPS 20 μg/mL组细胞铁死亡调控蛋白SLC7A11和GPX4表达水平明显降低(P<0.05)。NCOA4介导的铁蛋白自噬参与了多种疾病的发病机制,为验证LPS对铁蛋白自噬的影响,使用了荧光共聚焦显微镜观察NCOA4与Ferritin在LPS诱导的细胞中的改变。如图 3所示,荧光镜下观察,与Control组相比,LPS 10 μg/ml组中NCOA4与Ferritin共定位表达明显,荧光斑增加,表明LPS可引发H9c2细胞铁蛋白自噬。提示脓毒症心肌细胞铁死亡的水平与LPS剂量浓度存在一定依赖性(P<0.05),LPS可通过激活铁蛋白自噬促进H9c2细胞铁死亡。
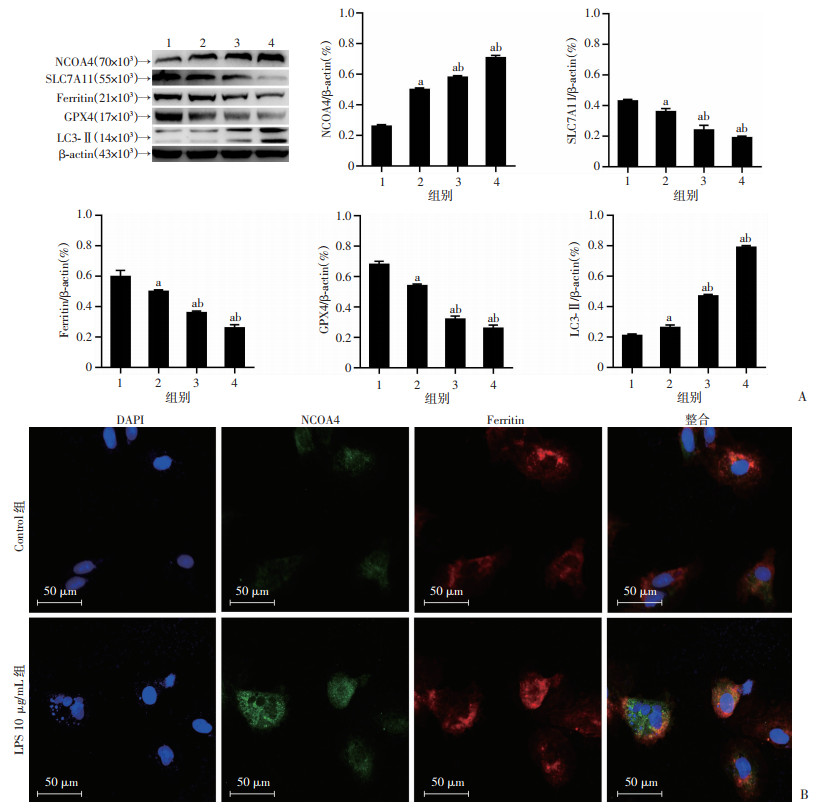
|
| A:Western blot检测各组铁死亡、自噬蛋白表达变化;B:Control组和LPS 10 μg/mL组Ferritin和NCOA4荧光共定位表达; 1:Control组;2:LPS 5 μg/mL组;3:LPS 10 μg/mL组;4:LPS 20 μg/mL组;a: P<0.05,与Control组比较;b: P<0.05,与LPS 5 μg/mL组比较 图 3 LPS通过促进铁蛋白自噬诱导H9c2细胞铁死亡 |
2.4 NCOA4介导的铁蛋白自噬参与脓毒症心肌细胞铁死亡
NCOA4作为选择性自噬货物受体,通过与铁蛋白结合将NCOA4铁蛋白复合物转移到溶酶体,介导铁蛋白的降解,并将铁蛋白结合的铁转化为游离铁,从而诱导铁死亡。为了产生NCOA4基因敲除细胞并验证转染效果,使用NCOA4 siRNA稳定转染H9c2细胞,结果表明NCOA4 siRNA组细胞中NCOA4蛋白表达较Control siRNA组明显降低(P<0.05)。在前期实验发现LPS刺激诱导NCOA4上调,下调铁蛋白水平,促进Fe2+的释放(P<0.05)。为进一步探索LPS促进心肌细胞铁死亡的分子机制,使用siRNA抑制NCOA4的表达,采用LPS 10 μg/mL建立脓毒症心肌铁死亡模型。结果如图 4所示,抑制NCOA4可显著改变LPS诱导的铁蛋白下调及LC3-Ⅱ上调(P<0.05)。此外,慢病毒敲低NCOA4表达后,铁死亡相关蛋白SLC7A11和GPX4表达降低(P<0.05)。上述实验结果表明,NCOA4促进LPS诱导的H9c2细胞铁蛋白自噬,抑制NCOA4介导的铁蛋白自噬可减轻细胞铁死亡。
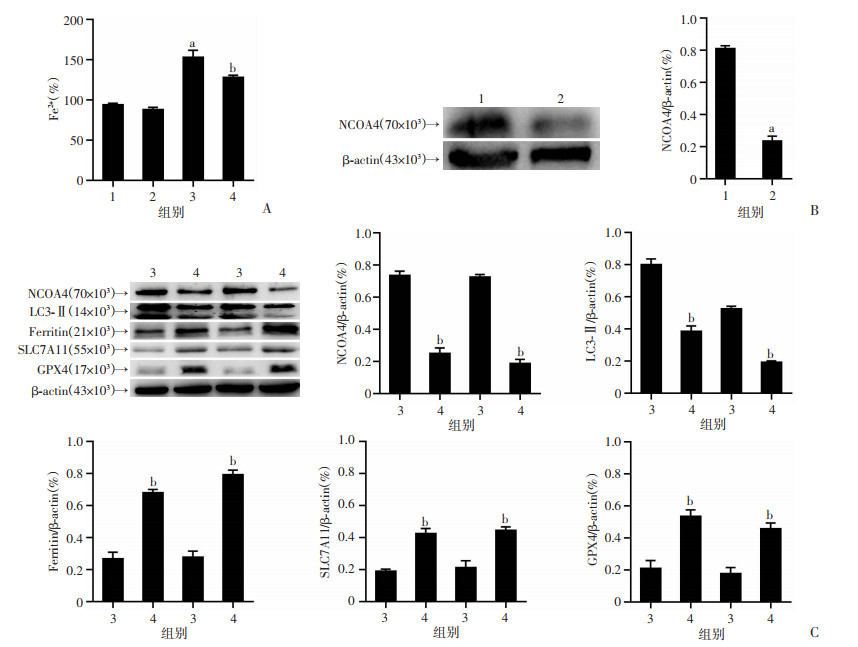
|
| A:各组心肌细胞Fe2+浓度变化;B:Western blot检测慢病毒敲低后NCOA4表达变化;C:Western blot检测慢病毒敲低NCOA4,10 μg/ml LPS刺激后铁死亡、自噬蛋白表达变化 1:Control siRNA组;2: NCOA4 siRNA组;3:Control siRNA+LPS 10 μg/mL组;4: NCOA4 siRNA+LPS 10 μg/mL组;a: P<0.05,与Control siRNA组比较;b: P<0.05,与Control siRNA+LPS 10 μg/mL组比较 图 4 NCOA4介导的铁蛋白自噬参与脓毒症心肌细胞铁死亡 |
3 讨论
脓毒症目前被定义为由于宿主对感染的反应失调进而危及生命的全身器官损伤和功能障碍[11]。脓毒症引起的心肌功能障碍是脓毒症患者最常见的并发症之一,当患者出现休克时,心肌损伤将会进一步加重[12]。LPS是革兰阴性细菌的主要结构组成部分,可诱发脓毒症,其中心肌功能障碍是公认的主要表现之一,已广泛用于脓毒症模型的制备[13]。本研究通过LPS刺激H9c2心肌细胞诱导脓毒症心肌细胞损伤模型,研究发现心肌细胞活力、心肌酶释放量均与LPS存在一定浓度依赖性。
ROS的过度积聚在脓毒症心肌细胞损伤的发病机制中起着至关重要的作用[14]。其中脂质过氧化物MDA的水平间接反映了ROS的产生和细胞损伤的严重程度。与此同时,机体会分泌GSH等以此防御和减轻ROS所致损伤[15]。因此,在本研究中,通过检测细胞中GSH、ROS和相关蛋白的水平来检测铁死亡和氧化应激。结果表明,随着LPS浓度增加,抗氧化物GSH的活性明显减少,MDA水平升高,同时荧光显微镜下观察不同浓度的LPS干预后心肌细胞ROS呈递增趋势。这些结果提示LPS可能通过刺激ROS的产生、MDA的堆积从而导致脓毒症相关的心肌细胞损伤和氧化应激。
胱氨酸/谷氨酸逆向转运体(System Xc-)受阻、铁代谢障碍、脂质过氧化物的积累在铁死亡的发生和发展过程中扮演着关键角色[16]。目前,李浩甲等[17]的研究发现去铁胺(deferoxamine,DFO)处理1周可降低糖尿病大鼠血糖水平,降低心肌肌钙蛋白(cardiac troponin,cTn)浓度,抑制心肌细胞内铁蛋白重链(Ferritin heavy, FTH)和NCOA4的表达,抑制铁死亡通路,改善心肌细胞损伤。本课题组前期的研究发现[18]H2S缓释型供体GYY4137可以通过改善脓毒症所致小鼠肺组织病理改变,减轻氧化应激,增加肺组织GPX4和SLC7A11的表达来减轻脓毒症症所致的急性肺损伤的铁死亡,由此可见Xc-系统活性即SLC7A11和GPX4可能是铁死亡发生的关键调控者。已有研究表明[19],LPS刺激可引起肾小管细胞内Fe2+和脂质过氧化积聚、降低GPX4、Xc-和NCOA4蛋白的表达,增加肾小管线粒体损伤,表现为线粒体形态变小,膜密度增加,线粒体嵴功能或破坏。这与本实验结果是相似的,本课题组在体外用LPS诱导H9c2大鼠心肌细胞铁死亡的模型中也同样发现了LPS干预后H9c2细胞活力下降,心肌酶释放增加,细胞中Fe2+浓度升高,脂质过氧化物MDA增加,线粒体膜电位异常变化,JC-1单体显著增加,铁死亡关键调控蛋白SLC7A11和GPX4表达降低,提示铁死亡参与了LPS诱导的心肌细胞损伤过程。
自噬是一种进化上保守的降解途径,可维持体内平衡[20]。HOU等[21]证明自噬通过降解成纤维细胞和癌细胞中的铁蛋白而导致铁死亡,敲除自噬基因限制了铁死亡诱导剂伊拉斯汀(Erastin)诱导的铁死亡,细胞内亚铁水平降低,脂质过氧化减轻。ITO等[22]在心力衰竭小鼠模型中的研究发现小鼠心脏中NCOA4的缺失降低了铁蛋白噬体介导的铁死亡,保护了心脏免受血流动力学应激,显著缓解压力超负荷诱导的野生型小鼠扩张型心肌病的发展。总而言之,这些发现为自噬和铁死亡之间的相互作用提供了新的见解。在本实验中也出现了相同的现象,随着LPS干预后H9c2细胞浓度的增加,NCOA4、LC3-Ⅱ蛋白表达水平逐渐升高,Ferritin表达水平降低,镜下发现NCOA4-Ferritin荧光共定位表达增强。抑制NCOA4的表达减轻了铁蛋白降解,抑制了LPS诱导的心肌细胞铁死亡。以上实验表明NCOA4介导的铁蛋白自噬在LPS诱导的心肌细胞铁死亡这一过程中起关键作用。
综上所述,本研究发现,脓毒症心肌细胞损伤中,氧化应激指标升高,脂质过氧化物堆积,抗氧化物成分活性降低,自噬相关蛋白表达水平升高,铁死亡调控蛋白表达水平降低。基于以上结果,本研究推测NCOA4介导的铁蛋白自噬-铁死亡参与了脓毒症心肌细胞损伤的形成,靶向干预心肌细胞铁死亡可能是未来预防脓毒症心肌细胞损伤的一种治疗策略,但其具体作用机制有待进一步研究。
| [1] |
EVANS L, RHODES A, ALHAZZANI W, et al. Surviving Sepsis campaign: international guidelines for management of Sepsis and septic shock 2021[J]. Intensive Care Med, 2021, 47(11): 1181-1247. |
| [2] |
FLEISCHMANN-STRUZEK C, MELLHAMMAR L, ROSE N, et al. Incidence and mortality of hospital- and ICU-treated Sepsis: results from an updated and expanded systematic review and meta-analysis[J]. Intensive Care Med, 2020, 46(8): 1552-1562. |
| [3] |
赵鹏, 寿松涛, 李晨, 等. 脓毒症患者合并心肌损伤的危险因素及其生存分析[J]. 中华医院感染学杂志, 2022, 32(7): 961-965. ZHAO P, SHOU S T, LI C, et al. Risk factors for myocardial injury in Sepsis patients and survival analysis[J]. Chin J Nosocomiology, 2022, 32(7): 961-965. |
| [4] |
HOLLENBERG S M, SINGER M. Pathophysiology of Sepsis-induced cardiomyopathy[J]. Nat Rev Cardiol, 2021, 18(6): 424-434. |
| [5] |
ZHENG J S, CONRAD M. The metabolic underpinnings of ferroptosis[J]. Cell Metab, 2020, 32(6): 920-937. |
| [6] |
SANTANA-CODINA N, GIKANDI A, MANCIAS J D. The role of NCOA4-mediated ferritinophagy in ferroptosis[J]. Adv Exp Med Biol, 2021, 1301: 41-57. |
| [7] |
QIU Y M, CAO Y, CAO W J, et al. The application of ferroptosis in diseases[J]. Pharmacol Res, 2020, 159: 104919. |
| [8] |
WU X G, LI Y, ZHANG S C, et al. Ferroptosis as a novel therapeutic target for cardiovascular disease[J]. Theranostics, 2021, 11(7): 3052-3059. |
| [9] |
LIU Y T, TAN S C, WU Y B, et al. The emerging role of ferroptosis in Sepsis[J]. DNA Cell Biol, 2022, 41(4): 368-380. |
| [10] |
REN Q, ZHAO S J, REN C J, et al. Astragalus polysaccharide alleviates LPS-induced inflammation injury by regulating miR-127 in H9c2 cardiomyoblasts[J]. Int J Immunopathol Pharmacol, 2018, 32: 2058738418759180. |
| [11] |
FONT M D, THYAGARAJAN B, KHANNA A K. Sepsis and Septic Shock-Basics of diagnosis, pathophysiology and clinical decision making[J]. Med Clin North Am, 2020, 104(4): 573-585. |
| [12] |
慕婉晴, 韩奕, 顾国嵘, 等. 脓毒症患者的预后危险因素及脓毒症相关性心肌损伤患者的临床特征研究[J]. 中华危重病急救医学, 2021(7): 809-814. MU W Q, HAN Y, GU G R, et al. Prognostic risk factors of patients with Sepsis and the clinical characteristics of patients with septic myocardial injury[J]. Chin Crit Care Med, 2021(7): 809-814. |
| [13] |
DICKSON K, LEHMANN C. Inflammatory response to different toxins in experimental Sepsis models[J]. Int J Mol Sci, 2019, 20(18): E4341. |
| [14] |
LU J Q, LIU J Y, LI A. Roles of neutrophil reactive oxygen species (ROS) generation in organ function impairment in Sepsis[J]. J Zhejiang Univ Sci B, 2022, 23(6): 437-450. |
| [15] |
LIU T, SUN L, ZHANG Y B, et al. Imbalanced GSH/ROS and sequential cell death[J]. J Biochem Mol Toxicol, 2022, 36(1): e22942. |
| [16] |
SUN Y T, CHEN P, ZHAI B T, et al. The emerging role of ferroptosis in inflammation[J]. Biomedecine Pharmacother, 2020, 127: 110108. |
| [17] |
李浩甲, 杨文曲, 韩冲芳, 等. 去铁胺对糖尿病大鼠心肌细胞铁死亡通路的影响[J]. 医学研究杂志, 2020, 49(9): 116-119. LI H J, YANG W Q, HAN C F, et al. Effect of deferoxamine on ferroptosis of myocardial cell in diabetic rats[J]. J Med Res, 2020, 49(9): 116-119. |
| [18] |
LI J H, LI M Y, LI L, et al. Hydrogen sulfide attenuates ferroptosis and stimulates autophagy by blocking mTOR signaling in Sepsis-induced acute lung injury[J]. Mol Immunol, 2022, 141: 318-327. |
| [19] |
CHEN Y H, JIN S, TENG X, et al. Hydrogen sulfide attenuates LPS-induced acute kidney injury by inhibiting inflammation and oxidative stress[J]. Oxid Med Cell Longev, 2018, 2018: 6717212. |
| [20] |
梁译丹, 覃王, 黄豪, 等. 自噬通过降解铁蛋白促进神经元铁死亡参与蛛网膜下腔出血后早期脑损伤[J]. 第三军医大学学报, 2019, 41(15): 1407-1414. LIANG Y D, QIN W, HUANG H, et al. Autophagy promotes neuronal ferroptosis by degrading ferritin and induces early brain injury after subarachnoid hemorrhage in rats[J]. J Third Mil Med Univ, 2019, 41(15): 1407-1414. |
| [21] |
HOU W, XIE Y C, SONG X X, et al. Autophagy promotes ferroptosis by degradation of ferritin[J]. Autophagy, 2016, 12(8): 1425-1428. |
| [22] |
ITO J, OMIYA S, RUSU M C, et al. Iron derived from autophagy-mediated ferritin degradation induces cardiomyocyte death and heart failure in mice[J]. Elife, 2021, 10: e62174. |




