人腺病毒(human adenovirus,HAdV)是引起儿童重症肺炎的最重要的病毒病原之一[1],感染后易并发急性呼吸窘迫综合征[2]、中枢神经系统功能障碍[3-4]等急性危重疾病,致死率达50%以上[5],严重危害儿童生命健康。目前,人腺病毒已发现至少100个基因型(http://hadvwg.gmu.edu/),分为7个亚属(A~G)。其中,HAdV-7是引起全球范围内儿童重症腺病毒肺炎最常见的基因型[5-7]。课题组前期研究发现在急性呼吸道感染患儿中B亚属HAdV-7检出率约45%,其中31.3%患儿发生重症肺炎,27.5%并发呼吸衰竭[8]。然而,临床上缺乏特异性的抗腺病毒药物,且HAdV-7感染引起严重肺损伤的分子机制尚不清楚。而肺泡上皮细胞是外界环境与肺组织的界面,在屏障保护、产生黏液和表面活性剂、启动免疫反应、肺损伤及修复等方面发挥重要作用[9-11]。由于HAdV-7通过空气传播,肺泡上皮细胞很容易受到感染而成为HAdV-7主要的靶细胞和效应细胞。肺泡上皮细胞的活性对维持肺泡结构完整性至关重要,其正常活性丧失和功能紊乱是急性肺损伤发展的主要驱动因素[12]。已有研究显示,肺泡上皮细胞的凋亡、坏死性凋亡等多种死亡方式参与了流感病毒感染、脂多糖等引起的肺损伤[13-16]。铁死亡(ferroptosis)是一种全新的可调节的细胞死亡形式,其实质是大量铁累积和脂质过氧化[17]。铁死亡已被证实参与了多种急慢性疾病的发生发展过程,抑制铁死亡逐渐成为多种疾病治疗和干预的重要靶点[18-21]。然而,HAdV感染所致肺损伤中肺泡上皮细胞死亡启动方式和作用机制尚不清楚。本研究拟探讨HAdV-7感染是否导致肺泡上皮细胞铁累积、脂质氧化物增加,并诱导肺泡上皮细胞发生铁死亡,初步明确铁死亡参与HAdV-7感染所致肺损伤的过程,以期为临床治疗重症腺病毒感染提供一种新的思路和干预途径。
1 材料与方法 1.1 实验材料肿瘤性肺泡上皮细胞(A549)和正常人肺泡Ⅱ型上皮细胞(HPAEpiC)均购自ATCC,由重庆医科大学附属儿童医院儿科研究所儿童呼吸病学研究室稳定传代后保存提供。CD46人源化小鼠设计和繁殖购自赛业生物科技有限公司。DMEM培养基、胎牛血清(FBS)、胰酶、青霉素、链霉素购自美国Gibco公司。氯化铯购自默克公司,氯化铯离心柱购自伯乐(Bio-Rad)公司。CCK-8试剂盒、Deferoxamine(DFO)、Ferrostatin-1(Fer-1)和细胞内活性氧(ROS)的探针(H2DCFDA)均购自MCE公司。BCA蛋白浓度测定试剂盒和脂质氧化(MDA)检测试剂盒购自碧云天生物公司。电镜专用戊二醛固定液(2.5%)和胞内亚铁离子荧光探针FerroOrange分别购自森贝伽生物科技和东仁化学科技公司,RNA快速提取试剂盒购自奕杉生物,反转录试剂盒购自TaKaRa公司,SYBR qPCR Master Mix购自南京诺唯赞生物公司。全蛋白提取试剂盒购自江苏凯基生物公司,一抗稀释液、快速转膜液及快速封闭液均购自新赛美公司。预制胶和MOPS-SDS Running Buffer购自ACE公司。一抗Anti-xCT rabbit antibody购自Abcam公司,Anti-GPX4 rabbit antibody、Western blot二抗(山羊抗兔)和直标内参GAPDH、β-actin购自成都正能生物公司,超敏ECL发光液购自美伦生物公司。普鲁士蓝染色液(DAB增强法)试剂盒购自北京索莱宝科技有限公司。
1.2 病毒分离与纯化从重庆医科大学附属儿童医院呼吸科1名确诊腺病毒感染的住院患儿的鼻咽抽吸物(nasopharyngeal aspirates, NPAs)中分离HAdV-7(CQ45), 体外培养扩增,采用氯化铯密度梯度离心法纯化病毒[22],按照FU等[5]和CHIKHALYA等[23]的计算方法,最终得到的病毒浓度为3×1011 vp/mL。
1.3 细胞培养A549和HPAEpiC细胞在添加10%FBS和1%青霉素/链霉素的DMEM高糖培养基培养,待细胞长至80%~90%时,做传代和铺板等处理。如进行病毒感染,则使用含2%FBS和1%青霉素/链霉素的DMEM培养基培养,根据实验设计的时间点进行感染后的实验。细胞均放置于37 ℃、5% CO2的孵箱进行培养。
1.4 细胞活性检测实验细胞以2 000个/孔,100 μL/孔的培养基铺96孔板。待细胞汇合度达70%~80%,将腺病毒按10感染复数(multiplicity of infection,MOI)感染细胞。根据实验设计(DFO工作浓度为50 μmol/L),在各时间点向每孔加入含10% CCK-8溶液的培养基;将培养板置于培养箱内孵育0.5~2 h;用酶标仪测定在450 nm处的光密度值。按公式计算细胞存活率: 细胞存活率= [(As-Ab)/(Ac-Ab)]×100%;As: 实验孔光密度值(含细胞、培养基、CCK-8溶液和腺病毒处理);Ac: 对照孔光密度值(含细胞、培养基、CCK-8溶液,无腺病毒);Ab: 空白孔吸光度值(含培养基、CCK-8溶液,不含细胞和腺病毒)。
1.5 透射电镜观察细胞的线粒体结构按3 ×105/孔接种细胞于6孔板,培养24 h后,以10 MOI感染A549和HPAEpiC细胞, 感染后48 h观察到细胞发生腺病毒感染的典型病变后才用胰酶消化并收集于离心管中,1 000 r/min,5 min离心。然后弃去上清液,用吸管沿管壁缓慢加入1 ∶5(2.5%戊二醛∶0.01 mol/L PBS缓冲液)稀释的固定液,重悬细胞。4 ℃,静置5 min。将细胞悬液转移至1.5 mL尖底离心管中,12 000 r/min离心10 min,轻轻弃去上清液,高速离心后的样品体积不小于半颗绿豆大小。用吸管沿管壁缓慢加入2.5% 戊二醛固定液,放置于4 ℃环境中,用装有冰袋的泡沫盒运送至成都里来生物医学实验中心进行投射电镜扫描。
1.6 ROS水平检测细胞按照3×105/孔接种于6孔板,24 h后以10 MOI HAdV-7病毒感染细胞,感染后48 h, 对照组和腺病毒感染组均添加含H2DCFDA (终浓度10 μmol/L)的培养基,37 ℃避光孵育30 min。然后用0.05%胰蛋白酶消化,含2%胎牛血清培养基中和后收集,2 500 r/min离心5 min。最后重悬于新鲜培养基中,立即用流式细胞仪分析。
1.7 MDA水平检测首先配制TBA储存液:25 mg TBA用6.76 mL TBA配制液配制,最终浓度即为0.37%。金属浴加热到70 ℃,再剧烈震荡以促进溶解。然后配制MDA检测工作液: 根据待测定的样品数(含对照),在临检测前新鲜配制适量的MDA检测工作液(一次加样量:150 μL TBA稀释液,50 μL TBA储存液,3 μL抗氧化剂)。再取适量标准品用蒸馏水稀释标准品至1、2、5、10、20、50 μmol/L,于各1.5 mL离心管中加入0.1 mL稀释成不同浓度的标准品和待测样品,随后加入0.2 mL MDA检测工作液。混匀后,99 ℃金属浴加热15 min后,水浴冷却至室温,1 000×g室温离心10 min。取200 μL上清加入到96孔板中,酶标仪在532 nm测定吸光度。通过标曲计算出样品溶液中的MDA含量后,以单位重量的蛋白含量(BCA法)来表示最初样品中的MDA含量(μmol/mg)。
1.8 细胞二价铁离子检测HPAEpiC细胞以1×105/mL接种在35 mm激光共聚焦培养皿中,在37 ℃,5%CO2培养箱中孵育过夜。HAdV-7以10 MOI感染48 h后, 将含有FerroOrange (1 μmol/L) 的HBSS溶液添加到细胞中,37 ℃,5%CO2培养箱中孵育30 min。在荧光共聚焦显微镜下观察细胞。
1.9 细胞总RNA提取及实时荧光定量PCR按照奕杉生物RNA快速提取试剂盒说明书提取细胞总的RNA, 使用Nano Drop one超微量分光光度计测定所提取的RNA浓度,然后以1 000 ng总量按照TaKaRa反转录试剂盒说明将RNA逆转录为cDNA。使用CFX96 Touch荧光定量PCR仪进行实时荧光定量PCR,以GAPDH为内参,2-ΔΔCt法分析各目的基因mRNA相对表达水平。具体的引物序列见表 1。
| 引物名称 | 引物序列(5′→3′) | 最适温度 |
| SLC7A11 | 上游:AAGGTGCCACTGTTCATCCC 下游:ATGACGAAGCCAATCCCTGT |
59 ℃ |
| GPX4 | 上游:ACAAGAACGGCTGCGTGGTGAA 下游:GCCACACACTTGTGGAGCTAGA |
59 ℃ |
| HAMP | 上游:CTGACCAGTGGCTCTGTTTTCC 下游:AAGTGGGTGTCTCGCCTCCTTC |
65 ℃ |
| SLC40A1 | 上游:GAGACAAGTCCTGAATCTGTGCC 下游:TTCTTGCAGCAACTGTGTCACAG |
59 ℃ |
| FTH1 | 上游:TCCTACGTTTACCTGTCCATGT 下游:GTTTGTGCAGTTCCAGTAGTGA |
59 ℃ |
| GAPDH | 上游:ATCAAGAAGGTGGTGAAGCAGGC 下游:TCAAAGGTGGAGGAGTGGGTGTC |
59 ℃ |
1.10 细胞蛋白提取及Western blot检测
实验细胞(3×105/孔)铺于6孔板,感染HAdV-7后24、48、72 h后,用全蛋白提取试剂盒提取各组细胞总蛋白,并以BCA蛋白浓度检测试剂盒检测各组总蛋白浓度。蛋白质在4%~20% 预制胶浓缩分离,然后转移到聚偏二氟乙烯(PVDF)膜上,快速封闭液封闭15 min后,孵育一抗(GPX4,1 ∶5 000;xCT,1 ∶2 000)于4 ℃过夜,取出膜以1×TBST洗脱后,室温孵育二抗(GAPDH,1 ∶10 000),使用化学发光(ECL)法获得蛋白条带, 用于比较分析。
1.11 动物实验 1.11.1 腺病毒感染动物模型建立将6~8周龄的12只CD46人源化小鼠[赛业(苏州)生物科技有限公司]按完全随机分组分为对照组(Control)、腺病毒感染组(HAdV-7)、铁死亡抑制剂组(Fer-1)和铁死亡抑制剂预处理后腺病毒感染组(HAdV-7+Fer-1)。称量小鼠质量后,Fer-1组和HAdV-7+Fer-1组腹腔注射Fer-1(10 mg/kg),1 h后予以10%水合氯醛溶液3~5 μL/g腹腔注射麻醉小鼠,HAdV-7组和HAdV-7+Fer-1组予以80 μL (20 μL/次×4次)含3×1011vp/mL病毒工作液滴鼻接毒,Control组和Fer-1组则以同等体积的病毒液溶剂滴鼻。
1.11.2 肺组织石蜡切片制备及HE染色感染3 d后,10%水合氯醛溶液麻醉处死小鼠,摘取眼球取血后取出上述实验小鼠左肺组织放入的4%多聚甲醛中,固定24 h以上。脱水后以肺门朝下将肺组织包埋成组织蜡块,4 μm切片,然后进行肺组织HE染色,封片后于显微镜下采集图像。
1.11.3 肺组织普鲁士蓝染色石蜡切片脱蜡至水(同肺组织HE染色), 按照1 ∶1的比例配置Perls染色工作液,滴加到切片上至完全覆盖组织,湿盒内37 ℃孵育20 min后,蒸馏水轻轻冲洗3次,每次10 s。按照1 ∶9配置孵育工作液,覆盖组织后盒内37 ℃孵育10~20 min;1×PBS轻轻浸洗3次,每次1 min。按照19 ∶1的比例配置增强工作液, 滴加至完全覆盖组织,置于湿盒内37 ℃孵育10~20 min,再1×PBS轻轻浸洗3次,每次5 s,滴加复染液染色3~5 min,蒸馏水浸洗10 min。最后,脱水封片(同HE染色)。
1.11.4 肺组织蛋白提取及Western blot检测称取适量的肺组织按照凯基生物的全蛋白提取试剂盒说明书提蛋白,根据标本数以1 mL ∶5 μL ∶5 μL ∶1 μL的比例依次取Lysis Buffer、磷酸酶抑制剂、100 mmol/L PMSF和蛋白酶抑制剂配置蛋白裂解液。每个肺组织标本中按0.1 g/1 mL蛋白裂解液, 电动匀浆器研磨肺组织(冰上低温操作),然后冰水中超声5 min×2次后,4 ℃,14 000 r/min,离心20 min,取上清转移至1.5 mL离心管。使用赛默飞NanoDrop one超微量分光光度计测定所提取的蛋白浓度,以计算蛋白上样量。根据蛋白液加入5×loading buffer,离心、震荡、离心混匀,99 ℃加热10 min后瞬时离心,分装后保存于-80 ℃冰箱。Western blot步骤同细胞实验。
1.11.5 肺组织炎症病理评分光学显微镜下,主要评估气管、细支气管、血管周围及肺间质的炎症,炎症病理评分参照DENG等[24]使用的方法,采用0~3分制,具体评分标准见表 2。
| 肺组织部位及炎症情况 | 评分 |
| 气管、细支气管:以套囊样炎症浸润厚度表示炎症程度,每张切片计数若干个管腔,取平均值 | |
| 无浸润 | 0分 |
| ≤2个细胞厚度 | 1分 |
| 3~5个细胞厚度 | 2分 |
| >5个细胞厚度 | 3分 |
| 血管周围:以套囊样炎症浸润厚度表示炎症程度,每张切片计数若干个管腔,取平均值 | |
| 无浸润 | 0分 |
| ≤4个细胞厚度 | 1分 |
| 5~7个细胞厚度 | 2分 |
| >7个细胞厚度 | 3分 |
| 肺间质:肺泡间隔的炎症浸润,每张切片计数若干个视野,取平均值 | |
| 无浸润 | 0分 |
| 炎症浸润但无增厚 | 1分 |
| 明显炎症浸润及轻度增厚 | 2分 |
| 明显炎症浸润及显著增厚 | 3分 |
1.11.6 肺组织损伤评分
根据HONG等[25]和TANAKA等[26]标准进行肺组织损伤评分,在光学显微镜下随机选取10个视野,采用0~4分制,平均得分为肺损伤病理评分,具体评分标准见表 3。
| 评估项目 | 损伤程度 | 评分 |
| 肺泡充血 | 无损伤 | 0分 |
| 出血 | 轻度损伤 | 1分 |
| 炎症细胞浸润或聚集 | 中度损伤 | 2分 |
| 肺泡间隔增厚或透明膜形成 | 重度损伤 | 3分 |
| 极重度损伤/弥漫性损伤 | 4分 |
1.12 统计学分析
数据用Graphpad Prism 8.0软件进行统计分析,计量资料以x±s表示;多组间比较采用单因素方差分析,两组间比较采用t检验, 以P < 0.05为差异有统计学意义。
2 结果 2.1 HAdV-7感染对肺泡上皮细胞活性的影响采用CCK-8法检测各组细胞活性,结果显示,HAdV-7感染A549和HPAEpiC细胞后24、48、72 h,两种细胞的细胞活性均明显降低,且随着感染时间延长细胞活性降低更明显(图 1)。
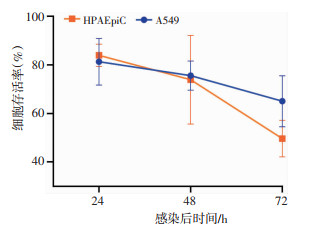
|
| 图 1 HAdV-7感染后不同时间两种细胞活性变化 |
2.2 HAdV-7感染肺泡上皮细胞后细胞线粒体改变
透射电镜下观察,HAdV-7感染A549和HPAEpiC细胞后,与对照组比较,感染组的线粒体体积变小,嵴减少甚至消失, 外膜破裂,出现了铁死亡特征性形态改变(图 2), 提示HAdV-7感染可能诱导了肺泡上皮细胞发生了铁死亡。
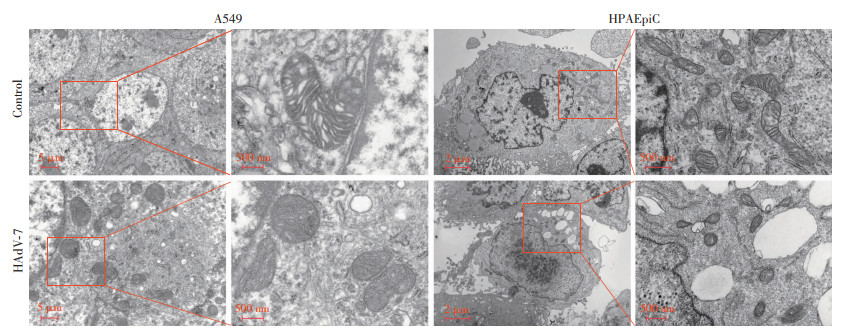
|
| 图 2 透射电镜观察HAdV-7感染前后肺泡上皮细胞形态 |
2.3 HAdV-7感染肺泡上皮细胞后ROS和MDA水平
HAdV-7感染A549细胞后,ROS水平较对照组升高,感染后48 h和72 h时差异均有统计学意义(P < 0.01,图 3A)。ROS化学性质活泼,极易攻击胞膜、核酸、蛋白质等多种细胞成分,对细胞造成致命损伤,ROS与细胞膜的多不饱和脂肪酸发生过氧化反应生成脂质过氧化物(MDA)。HAdV-7感染A549细胞后48 h, MDA水平显著增加(P < 0.05,图 3C)。在HPAEpiC细胞中,HAdV-7感染同样增加了胞内ROS累积(48、72 h, P < 0.01,图 3B)以及MDA水平(P < 0.05,图 3D)。
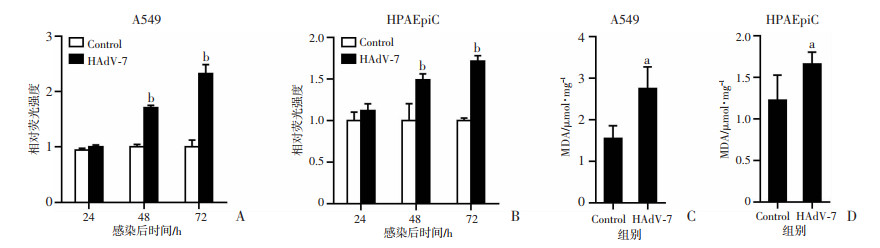
|
|
a: P < 0.05,b: P < 0.01, 与Control组比较 A、B:各组细胞的ROS水平;C、D:各组细胞的MDA水平 图 3 HAdV-7感染后不同时间各组A549和HPAEpiC细胞的ROS和MDA水平 |
2.4 HAdV-7感染肺泡上皮细胞后胞内二价铁离子水平
运用胞内亚铁离子荧光探针FerroOrange检测HPAEpiC细胞中的Fe2+水平, 发现感染组较对照组细胞内FerroOrange荧光强度增加(P < 0.01,图 4),说明HAdV-7感染细胞导致胞内Fe2+累积。
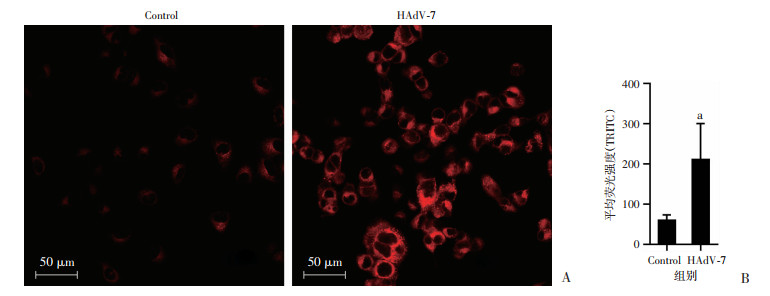
|
| A: FerroOrange检测细胞内Fe2+的荧光图;B: 各组细胞的平均荧光强度 a: P < 0.01, 与Control组比较 图 4 FerroOrange检测细胞内Fe2+水平 |
2.5 HAdV-7感染肺泡上皮细胞后铁死亡相关分子的基因表达水平
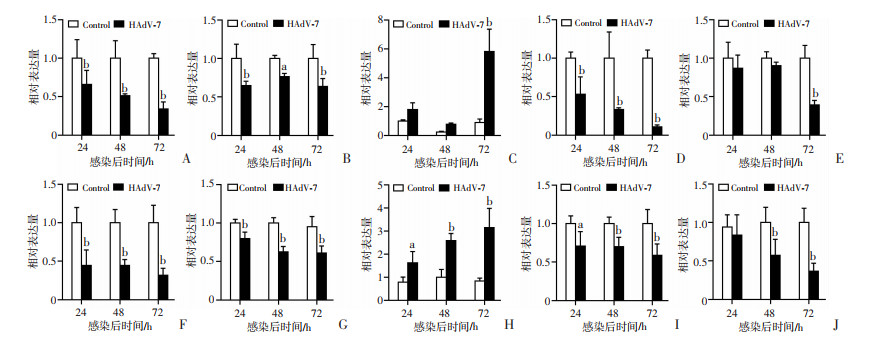
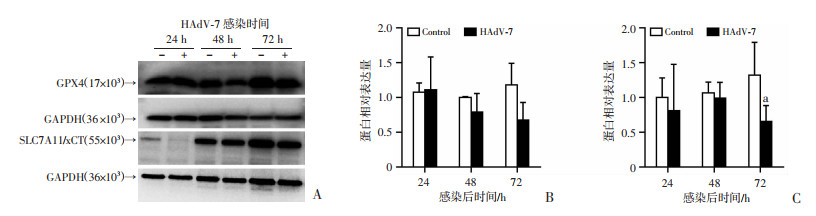
实时荧光定量PCR的检测结果(图 5A、F)显示,与非感染组相比,A549和HPAEpiC细胞感染HAdV-7后,SLC7A11/xCT的mRNA表达水平显著降低(A549和HPAEpiC: 24、48、72 h,P < 0.01)。如图 5B、G所示,HAdV-7感染同时降低了GPX4的mRNA表达水平(A549: 24、72 h, P < 0.01, 48 h, P < 0.05; HPAEpiC: 24、48、72 h,P < 0.01)。由此可见,HAdV-7感染致使宿主细胞的SLC7A11/xCT和GPX4在转录水平受到抑制而出现表达下调。同时,Western blot检测结果显示,HPAEpiC细胞感染HAdV-7后SLC7A11/xCT和GPX4蛋白表达水平降低(图 6)。此外,两种细胞感染后,铁调素(HAMP)表达上调(A549: 72 h, P < 0.01; HPAEpiC: 24 h, P < 0.05, 48、72 h,P < 0.01,图 5C、H),说明HAdV-7感染上皮细胞后,胞内铁动员增加。膜铁转运蛋白(SLC40A1)是负责细胞铁输出,然而,HAdV-7感染后24、48、72 h, 两种细胞的编码膜铁转运蛋白的基因表达下调(A549: 24、48、72 h, P < 0.01; HPAEpiC: 24 h, P < 0.05, 48、72 h, P < 0.01,图 5D、I)。另一方面,感染组的铁蛋白重链1(FTH1)的mRNA水平较对照组降低(A549: 72 h, P < 0.01; HPAEpiC: 48、72 h, P < 0.01,图 5E、J),提示HAdV-7感染后肺泡上皮细胞阻止铁参与Fenton反应,抗细胞氧化损伤的能力减低。
|
|
a:P < 0.05,b:P < 0.01,与Control组比较 A~E: 分别为A549细胞中SLC7A11/xCT、GPX4、HAMP、SLC40A1和FTH1 mRNA的相对表达水平;F~J:分别为HPAEpiC细胞中SLC7A11/xCT、GPX4、HAMP、SLC40A1和FTH1 mRNA的相对表达水平 图 5 HAdV-7感染后不同时间各组细胞铁死亡相关基因的表达水平 |
|
| A: Western blot检测GPX4和SLC7A11/xCT蛋白的表达;B、C: GPX4(B)和SLC7A11/xCT(C)蛋白的表达水平 a:P < 0.05,与Control组比较 图 6 HAdV-7感染HPAEpiC细胞后各组铁死亡相关分子的蛋白表达水平 |
2.6 HAdV-7感染CD46人源化小鼠后肺组织铁染色和铁死亡关键蛋白的表达水平
肺组织普鲁士蓝染色结果显示,与对照组相比,HAdV-7感染小鼠的肺组织有更多的非血红素铁沉积(图 7A)。HAdV-7感染小鼠后肺组织谷胱甘肽过氧化物酶4(GPX4)(P < 0.05)与胱氨酸/谷氨酸逆向转运蛋白溶质载体家族7成员11(SLC7A11)(P < 0.01) 表达水平较非感染组均降低(图 7B~D),提示HAdV-7感染可能抑制谷氨酸-胱氨酸反向转运体(System Xc-),致使直接失活GPX4且表达降低,从而导致宿主氧化防御能力降低并导致铁死亡。

|
|
a:P < 0.05,b: P < 0.01,与Control组比较 A: 肺组织普鲁士蓝染色(×200);B: Western blot检测GPX4和SLC7A11/xCT蛋白的表达; C、D: GPX4(C)和SLC7A11/xCT(D)蛋白的表达水平 图 7 HAdV-7感染CD46人源化小鼠后肺组织铁染色和铁死亡关键蛋白表达水平 |
2.7 予铁死亡抑制剂后,HAdV-7感染的肺泡上皮细胞存活情况和CD46人源化小鼠肺组织病理情况
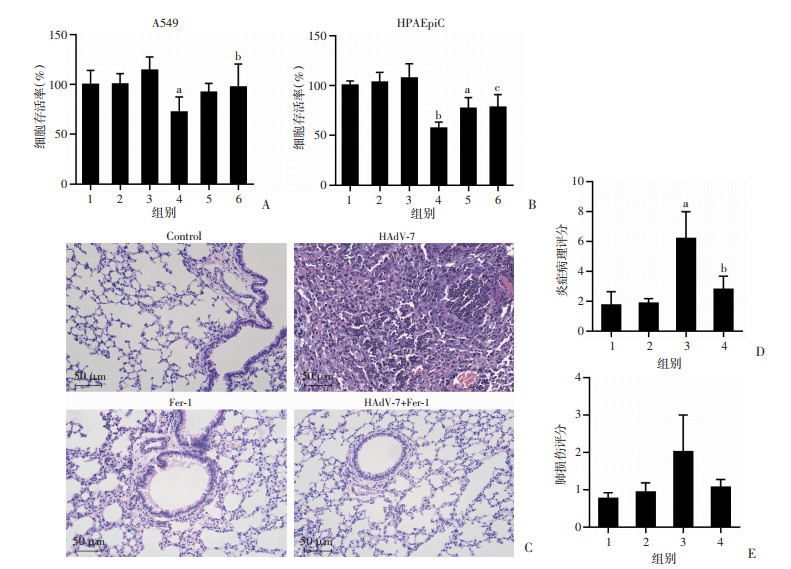
为进一步证实铁死亡在腺病毒感染中的作用,在体外实验中引入铁死亡特异性抑制剂DFO和Fer-1,观察抑制铁死亡后细胞的活性变化(图 8A、B)。DFO能够抑制HAdV-7诱导的肺泡上皮细胞死亡,在HPAEpiC中差异具有统计学意义(P < 0.01)。同样地,HAdV-7+Fer-1组的细胞活性显著高于HAdV-7组(A549: P < 0.05; HPAEpiC: P < 0.01)。CD46人源化小鼠肺组织HE染色结果显示,与对照组相比,HAdV-7感染小鼠后,细支气管周围和管腔、血管周围出现明显炎症细胞浸润,主要以中性粒细胞浸润为主(图 8C),提示HAdV-7感染引起了严重的肺损伤;进一步在体内予以Fer-1后,HAdV-7感染后肺组织病理炎症明显减轻,且肺损伤有所改善,见图 8C~E。
|
| A、B: 予以铁死亡抑制剂后各组细胞存活情况 1:Control组;2:DFO组;3:Fer-1组;4:HAdV-7组;5:HAdV-7+DFO组;6:HAdV-7+Fer-1组;a:P < 0.01,与Control组比较;b: P < 0.05,c:P < 0.01,与HAdV-7组比较;C: HE染色观察各组肺组织形态变化(×200);D、E: 肺组织炎症病理评分和肺损伤评分 1:Control组;2:Fer-1组;3:HAdV-7组;4:HAdV-7+Fer-1组;a:P < 0.01,与Control组比较;b: P < 0.05,与HAdV-7组比较 图 8 铁死亡抑制剂对各组细胞活性及小鼠肺组织病理情况的影响 |
3 讨论
人腺病毒是儿童病毒性肺炎的主要原因,占儿童肺炎的4%~10%[7, 27],腺病毒感染后不仅引起急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS)等急性危重症,还会导致闭塞性细支气管炎等慢性肺部疾病[28],给患儿家庭和社会造成沉重的负担。由于目前还没有针对腺病毒感染的特异性治疗药物[29],对于腺病毒引发重症肺炎和多种并发症的机制亟待深入研究。
HAdV-7引发的下呼吸道感染常伴有严重的肺部炎症和肺损伤。急性肺损伤(ALI)以弥漫性肺泡损伤为特征,可导致肺泡上皮细胞和血管内皮的损伤和死亡,激活炎症细胞[15, 30-31]。本研究结果显示,HAdV-7感染导致了肺泡上皮细胞系A549、HPAEpiC细胞活性降低,提示HAdV-7诱导肺泡上皮细胞死亡,进而导致肺损伤。既往对肺损伤的研究多关注肺部炎症细胞的死亡,如在脓毒症所致肺损伤小鼠实验模型中,抑制中性粒细胞凋亡可促进肺损伤[32];川芎嗪可通过抑制肺泡巨噬细胞焦亡和凋亡减轻急性肺损伤等[33]。肺泡上皮细胞作为肺损伤的重要靶细胞,其死亡方式在肺损伤中的研究较少,但仍有研究报道,肺泡上皮细胞的凋亡[15]、坏死[34]等参与了肺损伤的病理生理,而铁死亡作为一种新的死亡方式则鲜有报道。有临床研究报道,ARDS的严重程度与铁以及铁相关蛋白的水平有关[35]。本研究中HAdV-7感染肺上皮细胞系,细胞线粒体均发生铁死亡特征性形态变化,MDA、ROS以及胞内亚铁离子增加,同时铁死亡通路中的关键基因表达水平改变,提示HAdV-7感染引起了肺泡上皮细胞的铁死亡,但HAdV-7诱导铁死亡的机制仍待深入研究。最近研究报道,SARS-CoV-2诱导免疫激活的同时会引发炎症因子风暴,尤其是IL-6的大量增加,刺激HAMP,进而阻断SLC40A1编码的膜铁转运蛋白,导致细胞内铁过载,而诱导铁自噬触发不稳定铁池的增加,最终通过多聚多不饱和脂肪酸(PL-PUFA)过氧化促进铁死亡的发生[36]。本研究结果中,HAdV-7感染后HAMP表达上调,SLC40A1表达上调,表明HAdV-7感染与SARS-CoV-2类似,增加胞内铁动员而铁输出受到抑制。同时,肺泡上皮细胞感染HAdV-7后,FTH1表达降低,提示胞内维持机体铁离子的可溶和非毒性状态的贮铁蛋白减少。由此可见,HAdV-7感染触发了铁代谢紊乱,过多的铁通过Fenton反应产生大量的活性氧致使肺泡上皮细胞损伤甚至死亡,这也与油酸所致肺损伤小鼠模型中报道的铁超载结果一致[37]。此外,研究报道氧葡萄糖剥夺/再灌注(OGD/R)通过抑制SLC7A11和GPX4,导致神经元发生铁死亡[38],本研究也得到类似的结果,HAdV-7感染降低xCT的表达而抑制半胱氨酸的输入,导致谷胱甘肽的消耗,从而导致抗氧化酶GPX4的失活,ROS累积使细胞内的抗氧化能力不足促进靶细胞铁死亡发生。总之,HAdV-7感染可引起细胞内铁离子过载、xCT-GPX4轴耗竭所致的ROS过量产生和抗氧化系统障碍。
予以铁死亡抑制剂,HAdV-7感染所致的细胞死亡和肺部损伤明显改善,这与抑制铁死亡可以减轻脓毒症模型中的肺损伤、心脏损伤和肝脏损伤等[20, 39-41]研究报道一致,从而提示靶向肺泡上皮细胞的铁死亡可能是治疗HAdV-7感染所致肺损伤的新策略,而抑制铁死亡可能是临床治疗HAdV-7重症感染的重要靶点。因此,亟需更多的科学探索以确认铁死亡在HAdV-7感染相关疾病发病机制中的作用。本研究显示,A549和HPAEpiC两种细胞在HAdV-7感染后铁死亡相关分子表达量及应用铁死亡抑制剂的效应等方面略有差异,可能是由于两种细胞的来源不同。A549是一种肿瘤性细胞,主要用于肺腺癌的研究,其本身的死亡方式与正常肺泡上皮就有所不同,用A549研究肺损伤模型中的铁死亡,可能存在偏倚。于是本研究采用正常的人肺泡上皮细胞进行了平行试验,两种细胞所得结果在腺病毒感染与非感染组之间的趋势是一致的。
目前,对于铁死亡的研究仍处于初级阶段,还需要在不同实验模型以及临床实验中进一步研究探索。例如,铁死亡主要通过炎症和氧化应激引起细胞损伤,而在本实验还未涉及HAdV-7感染后续炎症反应与铁死亡的关系;在HAdV-7感染模型中可能会存在其他死亡方式,而其他形式的细胞死亡方式与铁死亡的相互作用以及这种相互作用在肺损伤的作用尚不明确,仍待进一步探究。
综上,本研究结果显示,HAdV-7感染导致肺泡上皮细胞铁累积、抗氧化系统破坏,从而引起肺泡上皮细胞发生铁死亡;阻断铁死亡能够减轻HAdV-7感染所致肺部损伤,这可能为临床重症腺病毒感染的治疗提供新的思路。
| [1] |
XIE L Y, ZENG S Z, YU T, et al. Viral loads in nasopharyngeal aspirates and tracheal aspirates among children hospitalized with invasive ventilation for human adenovirus pneumonia[J]. Virol J, 2021, 18(1): 238. |
| [2] |
ALCAMO A M, WOLF M S, ALESSI L J, et al. Successful use of cidofovir in an immunocompetent child with severe adenoviral sepsis[J]. Pediatrics, 2020, 145(1): e20191632. |
| [3] |
LU G L, PENG X M, LI R Q, et al. An outbreak of acute respiratory infection at a training base in Beijing, China due to human adenovirus type B55[J]. BMC Infect Dis, 2020, 20(1): 537. |
| [4] |
TAKAHASHI K, GONZALEZ G, KOBAYASHI M, et al. Pediatric infections by Human mastadenovirus C types 2, 89, and a recombinant type detected in Japan between 2011 and 2018[J]. Viruses, 2019, 11(12): E1131. |
| [5] |
FU Y X, TANG Z Z, YE Z X, et al. Human adenovirus type 7 infection causes a more severe disease than type 3[J]. BMC Infect Dis, 2019, 19(1): 36. |
| [6] |
SHEN C F, WANG S M, HO T S, et al. Clinical features of community acquired adenovirus pneumonia during the 2011 community outbreak in Southern Taiwan: role of host immune response[J]. BMC Infect Dis, 2017, 17(1): 196. |
| [7] |
XIE L Y, ZHANG B, ZHOU J Y, et al. Human adenovirus load in respiratory tract secretions are predictors for disease severity in children with human adenovirus pneumonia[J]. Virol J, 2018, 15(1): 123. |
| [8] |
FU Y. The mechanism of different pathogenicity caused by fiber of HAdV-3 and HAdV-7[D]. Chongqing: Chongqing Medical University, 2019.
|
| [9] |
FANG M X, XU T L, FAN S J, et al. SOX11 and FAK participate in the stretch-induced mechanical injury to alveolar type 2 epithelial cells[J]. Int J Mol Med, 2021, 47(1): 361-373. |
| [10] |
WATERS C M, ROAN E, NAVAJAS D. Mechanobiology in lung epithelial cells: measurements, perturbations, and responses[J]. Compr Physiol, 2012, 2(1): 1-29. |
| [11] |
WEBER J, RAJAN S, SCHREMMER C, et al. TRPV4 channels are essential for alveolar epithelial barrier function as protection from lung edema[J]. JCI Insight, 2020, 5(20): 134464. |
| [12] |
GROPPER M A, WIENER-KRONISH J. The epithelium in acute lung injury/acute respiratory distress syndrome[J]. Curr Opin Crit Care, 2008, 14(1): 11-15. |
| [13] |
JIA X H, LIU B, BAO L L, et al. Delayed oseltamivir plus sirolimus treatment attenuates H1N1 virus-induced severe lung injury correlated with repressed NLRP3 inflammasome activation and inflammatory cell infiltration[J]. PLoS Pathog, 2018, 14(11): E1007428. |
| [14] |
SIMPSON J, LOH Z, ULLAH M A, et al. Respiratory syncytial virus infection promotes necroptosis and HMGB1 release by airway epithelial cells[J]. Am J Respir Crit Care Med, 2020, 201(11): 1358-1371. |
| [15] |
XIAO K, HE W X, GUAN W, et al. Mesenchymal stem cells reverse EMT process through blocking the activation of NF-κB and Hedgehog pathways in LPS-induced acute lung injury[J]. Cell Death Dis, 2020, 11(10): 863. |
| [16] |
XIE W, LU Q C, WANG K L, et al. MiR-34b-5p inhibition attenuates lung inflammation and apoptosis in an LPS-induced acute lung injury mouse model by targeting progranulin[J]. J Cell Physiol, 2018, 233(9): 6615-6631. |
| [17] |
BEATTY A, SINGH T, TYURINA Y Y, et al. Ferroptotic cell death triggered by conjugated linolenic acids is mediated by ACSL1[J]. Nat Commun, 2021, 12(1): 2244. |
| [18] |
CHEN X, KANG R, KROEMER G, et al. Broadening horizons: the role of ferroptosis in cancer[J]. Nat Rev Clin Oncol, 2021, 18(5): 280-296. |
| [19] |
CHEN X, KANG R, KROEMER G, et al. Ferroptosis in infection, inflammation, and immunity[J]. J Exp Med, 2021, 218(6): e20210518. |
| [20] |
LIU P F, FENG Y T, LI H W, et al. Ferrostatin-1 alleviates lipopolysaccharide-induced acute lung injury via inhibiting ferroptosis[J]. Cell Mol Biol Lett, 2020, 25: 10. |
| [21] |
XU W T, DENG H M, HU S, et al. Role of ferroptosis in lung diseases[J]. J Inflamm Res, 2021, 14: 2079-2090. |
| [22] |
KANEGAE Y, MAKIMURA M, SAITO I. A simple and efficient method for purification of infectious recombinant adenovirus[J]. Jpn J Med Sci Biol, 1994, 47(3): 157-166. |
| [23] |
CHIKHALYA A, DITTMANN M, ZHENG Y T, et al. Human IFIT3 protein induces interferon signaling and inhibits adenovirus immediate early gene expression[J]. mBio, 2021, 12(6): e0282921. |
| [24] |
DENG Y, CHEN W C, ZANG N, et al. The antiasthma effect of neonatal BCG vaccination does not depend on the Th17/Th1 but IL-17/IFN-γ balance in a BALB/c mouse asthma model[J]. J Clin Immunol, 2011, 31(3): 419-429. |
| [25] |
HONG S B, KOH Y, LEE I C, et al. Induced hypothermia as a new approach to lung rest for the acutely injured lung[J]. Crit Care Med, 2005, 33(9): 2049-2055. |
| [26] |
TANAKA A, MINOGUCHI K, CHEN X Y, et al. Activated protein C attenuates leukocyte elastase-induced lung injury in mice[J]. Shock, 2008, 30(2): 153-158. |
| [27] |
GAO J J, XU L L, XU B P, et al. Human adenovirus Coinfection aggravates the severity of Mycoplasma pneumoniae pneumonia in children[J]. BMC Infect Dis, 2020, 20(1): 420. |
| [28] |
IONS R, NARAYANAN M, BROWNING M, et al. Case presentation: persistent adenovirus B3 infections associated with bronchiolitis obliterans treated with cidofovir in a child with mosaic tetrasomy 9p[J]. BMC Infect Dis, 2018, 18(1): 529. |
| [29] |
ZHANG S Y, ZHAN L, ZHU Y Y, et al. Tumor necrosis factor alpha gene polymorphisms increase susceptibility to adenovirus infection in children and are correlated with severity of adenovirus-associated pneumonia[J]. Genet Test Mol Biomarkers, 2020, 24(12): 761-770. |
| [30] |
WANG N A, SU Y, CHE X M, et al. Penehyclidine ameliorates acute lung injury by inhibiting Toll-like receptor 2/4 expression and nuclear factor-κB activation[J]. Exp Ther Med, 2016, 11(5): 1827-1832. |
| [31] |
ENDESFELDER S, STRAUẞ E, BENDIX I, et al. Prevention of oxygen-induced inflammatory lung injury by caffeine in neonatal rats[J]. Oxid Med Cell Longev, 2020, 2020: 3840124. |
| [32] |
WANG J F, WANG Y P, XIE J, et al. Upregulated PD-L1 delays human neutrophil apoptosis and promotes lung injury in an experimental mouse model of sepsis[J]. Blood, 2021, 138(9): 806-810. |
| [33] |
JIANG R D, XU J Q, ZHANG Y Z, et al. Ligustrazine alleviate acute lung injury through suppressing pyroptosis and apoptosis of alveolar macrophages[J]. Front Pharmacol, 2021, 12: 680512. |
| [34] |
WOHLRAB P, KRAFT F, TRETTER V, et al. Recent advances in understanding acute respiratory distress syndrome[J]. F1000Res, 2018, 7: F1000FacultyRev-F1000Faculty263. DOI: 10.12688/f1000research.11148.1.
|
| [35] |
ZHANG V, NEMETH E, KIM A. Iron in lung pathology[J]. Pharmaceuticals (Basel), 2019, 12(1): E30. |
| [36] |
FRATTA PASINI A M, STRANIERI C, GIRELLI D, et al. Is ferroptosis a key component of the process leading to multiorgan damage in COVID-19?[J]. Antioxidants (Basel), 2021, 10(11): 1677. |
| [37] |
ZHOU H, LI F, NIU J Y, et al. Ferroptosis was involved in the oleic acid-induced acute lung injury in mice[J]. ActaPhysiol Sin, 2019, 71(5): 689-697. |
| [38] |
YUAN Y, ZHAI Y Y, CHEN J J, et al. Kaempferol ameliorates oxygen-glucose deprivation/reoxygenation-induced neuronal ferroptosis by activating Nrf2/SLC7A11/GPX4 axis[J]. Biomolecules, 2021, 11(7): 923. |
| [39] |
LI N, WANG W, ZHOU H, et al. Ferritinophagy-mediated ferroptosis is involved in sepsis-induced cardiac injury[J]. Free Radic Biol Med, 2020, 160: 303-318. |
| [40] |
LI J C, LU K M, SUN F L, et al. Panaxydol attenuates ferroptosis against LPS-induced acute lung injury in mice by Keap1-Nrf2/HO-1 pathway[J]. J Transl Med, 2021, 19(1): 96. |
| [41] |
WEI S S, BI J B, YANG L F, et al. Serum irisin levels are decreased in patients with sepsis, and exogenous irisin suppresses ferroptosis in the liver of septic mice[J]. Clin Transl Med, 2020, 10(5): e173. |




