乳腺癌(breast cancer,BC)是常见的女性恶性肿瘤,约占全球女性恶性肿瘤的30%[1]。据统计,BC在女性肿瘤疾病中的发病率居全球首位,同时还是女性癌症死亡的主要原因[2]。目前,尽管提高了乳腺癌的早期确诊率,并具备较为完善的系统性治疗方案,但进一步研究乳腺癌的发病机制并为临床提供诊断治疗依据仍然具有重要意义。
环状RNA(circular RNA,circRNA)呈闭合环状结构,具有比线性RNA更高的稳定性且不易被核酸外切酶降解[3]。circRNA的序列在进化中存在一定的保守性,其表达模式具有组织和不同发育阶段的特异性[4]。此外,circRNA在生物学功能调节上有着较大的潜力,可以应用于多种临床疾病的诊断[5]。研究表明circRNA在多种癌症中表达异常,且与肿瘤的增殖、迁移和侵袭等过程密切相关,有望成为肿瘤治疗的新靶点[5-6]。在结直肠癌中,hsa_circ_0000231敲低后可以通过结合miR-502-5p下调MYO6的表达来抑制结直肠癌的进展和糖酵解作用[7]。在三阴乳腺癌中,NFIB可以激活RNA结合蛋白FUS的转录,从而促进circHIF1A的生物发生,circHIF1A通过调节NFIB的表达和亚细胞定位促进三阴乳腺癌的生长和转移[8]。在乳腺癌中,患者的预后与hsa_circ001783的表达水平相关[9]。
核内不均一性核糖核蛋白K(heterogeneous nuclear ribonucleoprotein K,HnRNPK)是一种保守的RNA结合蛋白,参与信号转导和基因表达[10]。HnRNPK与多种癌症相关基因的激活有关,如HnRNPK与c-Myc启动子的CT元件结合,促进原癌基因c-Myc的转录[11]。c-Myc在控制细胞增殖、凋亡和耐药性方面起着重要作用[12]。有研究表明c-Myc与乳腺癌发生、淋巴转移相关[13]。
然而,目前hsa_circ_0000231在乳腺癌中的表达和机制尚不清楚。本研究敲低hsa_circ_0000231,观察其在乳腺癌增殖、迁移、侵袭、细胞凋亡和周期中的作用,并初步探索hsa_circ_0000231与HnRNPK的分子机制,以期为乳腺癌临床早期诊断和治疗提供线索。
1 材料与方法 1.1 材料 1.1.1 组织标本和细胞收集2019年9月至2021年1月在重庆医科大学附属第一医院未进行放化疗治疗的女性乳腺癌患者35例,经乳腺切除术获取组织标本,于术前签署知情同意书。标本切除后经病理科诊断确认后立刻置于液氮长期保存。重庆医科大学伦理委员会已批准该研究中所有标本的收集[2022年科研伦理(2022-K228)]。人乳腺上皮细胞MCF-10A、乳腺癌细胞MCF-7和SK-BR-3由重庆医科大学分子医学与肿瘤研究中心保存。
1.1.2 主要试剂DMEM培养基和RPMI 1640培养基购自美国Gibco公司,FBS购自浙江天杭生物科技股份有限公司;Cy3标记的hsa_circ_0000231探针、hsa_circ_0000231干扰质粒以及对照质粒由广州吉赛生物科技股份有限公司设计与合成,探针序列为Cy3-5′-CACATTTAAACCCTTATCTGTTCAG-3′-Cy3,Si-circ#1的序列为5′-GATAAGGGTTTAAATGTGATA-3′,Si-circ#2的序列为5′-CAGATAAGGGTTTAAATGTGA-3′,Si-NC的序列为5′-GCAUAGGCUUUUCUAGAGCCT-3′;转染试剂Lipofectamine2000购自美国Invitrogen公司;TRIzol试剂和qRT-PCR相关试剂购自日本TaKaRa公司;逆转录试剂盒购自南京诺唯赞生物科技股份有限公司;qRT-PCR引物与EdU试剂盒购自广州锐搏生物技术有限公司;TUNEL和Hoechst33342试剂盒购自上海碧云天生物技术有限公司;CCK-8试剂盒购自美国Genview生物科技公司;结晶紫染液购自Biosharp生物科技公司;基质胶和transwell小室购自美国Corning生物科技公司;抗体Bcl-2、Bax、Caspase-3、CCND2、CCND1、CDK4和GAPDH购自美国Cell Signaling Technology公司,免疫组化中的抗体CCND2和CDK4购自Bioworlde公司。汉恒生物工程有限公司将Si-NC和Si-circ#1序列进行慢病毒载体(pHBLV-U6-MCS-CMV-ZsGreen-PGK-PURO)构建。由武汉金开瑞生物工程有限公司构建的Pull-down探针序列为5′-ACCA-GTATCACATTTAAACCCTTATCTGTTCAGTGGAGC-3′。10只4周龄BALB/c雌性裸鼠购自重庆腾鑫生物科技有限公司[许可证号:SCXK(京)2019-0010]。
1.2 方法 1.2.1 微阵列分析选取4对临床术后乳腺癌组织和癌旁组织,提取并检测每个样本总RNA的浓度和纯度,随后每个样本总RNA使用RnaseR处理,富集circRNA,质检合格后进行后续实验。分析上海康成生物科技有限公司提供的4对临床术后乳腺癌组织和对应癌旁组织的circRNA差异表达谱,以差异倍数>2、P < 0.05为条件筛选出乳腺癌组织和癌旁组织中显著差异表达的hsa_ circ_0000231。
1.2.2 细胞培养与转染人乳腺上皮细胞株MCF-10A使用DMEM培养基(内含5%HS、20 ng/mL EGF、0.5 μg/mL Hydrocortisone、10 μg/mL Insulin、1%NEAA和1%P/S),使用含有12%胎牛血清的DMEM和RPMI 1640培养基分别培养乳腺癌细胞MCF-7和SK-BR-3,均于37 ℃、5%CO2条件下培养。将细胞接种至6孔板,使用Lipofectamine2000按照转染步骤对乳腺癌细胞MCF-7和SK-BR-3进行转染,其中MCF-7和SK-BR-3细胞均分为3组:Si-NC、Si-circ#1和Si-circ#2组,分别转染对应质粒。
1.2.3 总RNA提取、逆转录以及qRT-PCR检测TRIzol法提取总RNA,检测其纯度及浓度后按说明书将其逆转录为cDNA。hsa_circ_0000231在临床乳腺癌组织、正常乳腺上皮细胞、乳腺癌细胞和转染质粒后的乳腺癌细胞中的表达水平由美国Bio-Rad公司qRT-PCR仪检测。计算方法均使用2-ΔΔCt法。qRT-PCR引物序列见表 1。
| 基因名称 | 序列(5′→3′) | 产物大小/bp |
| hsa_circ_0000231 | 上游: TGAACTTAGCAGCAGCTCCAC | 170 |
| 下游: TTCCCACTTCTGTCAGCCATT | ||
| c-Myc | 上游: CGACGAGACCTTCATCAAAAA | 85 |
| 下游: CTTCTCTGAGACGAGCTTGG | ||
| GAPDH | 上游: GCACCGTCAAGGCTGAGAAC | 267 |
| 下游: TGGTGAAGACGCCAGTGGA |
1.2.4 FISH实验
固定细胞后PBS洗,然后按照说明书滴加预杂交液,置于55 ℃孵育1 h。杂交液与has_circ_0000231探针轻柔混合,于PCR仪中85 ℃/5 min变性,滴加杂交液探针混合液体,42 ℃过夜。次日用2×SSC溶液清洗爬片,随后滴加DAPI染色液,室温下染色20 min,PBS清洗后封片。
1.2.5 划痕实验将转染后MCF-7和SK-BR-3细胞均匀铺至6孔板,用200 μL枪头进行划痕,显微镜拍摄即刻的划痕状态并记录0 h划痕距离。继续培养24 h后,显微镜下观察并拍摄各组细胞划痕状态,记录24 h划痕距离。
1.2.6 Transwell实验侵袭实验按基质胶∶无血清培养基=1 ∶9的比例准备基质胶稀释液,铺于Transwell小室的上室面,冰箱4 ℃过夜;迁移实验无需铺基质胶。第2天,将各组细胞稀释成2.5×104/mL的细胞悬液,每孔上室面加入200 μL,对应的DMEM、RPMI 1640完全培养基各500 μL加至下室中。继续培养24 h,弃培养基,甲醇固定15 min,PBS清洗3 min/2次,结晶紫染色20 min,用棉棒轻轻擦拭上室面,显微镜下拍照。
1.2.7 CCK-8实验分别将MCF-7和SK-BR-3细胞接种至96孔板,贴壁后加入CCK-8试剂孵育,在450 nm波长下检测各组每孔的光密度值[D (450)]。随后连续96 h观察测量,细胞增殖曲线由连续5 d测得的D (450)值绘制而成。
1.2.8 EdU实验将各组MCF-7和SK-BR-3细胞接种到带有爬片的24孔板中,根据说明书制备EdU培养基,加至24孔板中。温箱中孵育2 h后,PBS清洗5 min,细胞固定液和0.5% TritonX-100分别处理25 min,按EdU试剂盒说明书进行后续操作,最后在荧光显微镜下拍照。
1.2.9 克隆形成实验将各组MCF-7和SK-BR-3细胞制成细胞悬液(1×104/mL),按200 μL/孔加至6孔板,再加入完全培养基1.8 mL,继续培养,培养10 d后用PBS洗涤,细胞固定液和0.5%结晶紫染液分别处理15 min,自然晾干后拍照。
1.2.10 Hoechst33342染色实验首先将各组MCF-7和SK-BR-3细胞接种于24孔板(含爬片),待细胞贴壁后PBS清洗, 细胞固定液固定20 min,PBS清洗3次,0.5%TritonX-100溶液冰上通透15 min,再用PBS清洗3次。然后将200 μL Hoechst33342染液滴加至爬片上,37 ℃避光孵育30 min。抗淬灭剂封片,于荧光显微镜下观察。
1.2.11 TUNEL实验将转染48 h后各组MCF-7和SK-BR-3细胞均匀铺于24孔板(含爬片),培养过夜。弃培养基,PBS清洗5 min/3次,细胞固定液固定30 min,4 ℃条件下使用0.5%TritonX-100溶液通透20 min。按200 μL/孔加入TUNEL检测溶液,避光条件下37 ℃/1 h。抗淬灭剂封片,荧光显微镜下观察。
1.2.12 流式细胞仪检测细胞周期及凋亡在6孔板中转染48 h后,对各组MCF-7和SK-BR-3细胞胰酶消化,800 r/min离心5 min后PBS清洗。检测细胞周期前加入70%乙醇轻柔混合,4 ℃条件下过夜。离心后弃乙醇,再次用PBS清洗。加50 μg/mL聚酰亚胺溶液,室温下避光孵育30 min。检测细胞凋亡前用Annexin结合液使细胞重悬,再加入10 μL Annexin V-PE,避光孵育15 min。使用流式细胞仪检测各组细胞周期和细胞凋亡。
1.2.13 Western blot检测提取各组MCF-7和SK-BR-3细胞总蛋白并测定蛋白浓度,将蛋白上样缓冲液(5×)按1 ∶4的比例将入到蛋白样品中,100 ℃金属浴10 min后于-80 ℃保存蛋白。提取到的蛋白经SDS-PAGE电泳;冰水浴条件下转膜;5%的脱脂奶粉封闭3 h;4 ℃摇床孵育一抗(兔抗GAPDH抗体1 ∶4 000,兔抗CCND2抗体1 ∶2 000,兔抗CCND1抗体1 ∶2 000,兔抗CDK4抗体1 ∶2 000,鼠抗Caspase-3抗体1 ∶2 000,鼠抗Bcl-2抗体1 ∶2 000,鼠抗Bax抗体1 ∶2 500,兔抗c-Myc抗体1 ∶1 000)12 h;室温下孵育二抗(羊抗兔抗体1 ∶4 000,羊抗鼠抗体1 ∶4 000)。ECL化学发光显色,使用凝胶成像仪拍照。
1.2.14 免疫组化检测完成脱蜡脱水的石蜡切片放入抗原修复液加热20 min,冷却后用PBS清洗;分别滴加阻断剂和封闭液反应后,滴加一抗(兔抗CCND2抗体1 ∶100,兔抗CCND1抗体1 ∶50,兔抗CDK4抗体1 ∶100)孵育过夜。滴加生物素标记二抗反应20 min;加链霉卵白素孵育20 min;DAB显色液和苏木精染色液各染色5 min,使用适宜浓度的盐酸酒精分化;把切片放入梯度酒精和二甲苯中浸泡,最后用中性树胶封片。
1.2.15 RNA pull down实验先分别用NaOH溶液、生理盐水和Tris缓冲液清洗磁珠;收集细胞,PBS清洗2次后加入裂解液对细胞进行裂解处理。加入探针重悬磁珠,于4 ℃旋转孵育35 min,收集磁珠。取Capture Buffer 100 μL重悬磁珠;再加入200 μL细胞裂解液,于4 ℃条件下旋转孵育1 h,收集磁珠。用Wash Buffer涡旋清洗磁珠弃5次。加入40 μL RNA Capture Buffer和10 μL 5×Loading Buffer,涡旋混匀。100 ℃金属浴10 min后置于-80 ℃保存。运用蛋白印迹和质谱仪检测产物。
1.2.16 免疫荧光实验PBS清洗细胞后,使用4%多聚甲醛固定25 min;将细胞置于冰上,0.5%Triton X-100处理25 min,用滤纸将孔板内残余液体吸干。滴加3%BSA,于37 ℃孵箱中封闭。再加入用3%BSA稀释的HnRNPK(1 ∶100)至完全覆盖爬片,4 ℃条件下过夜孵育。次日加入荧光二抗(1 ∶100),37 ℃避光条件孵育30 min;避光条件下加入适量DAPI染色液,室温染色10 min。封片后在荧光显微镜下观察拍照。
1.2.17 裸鼠移植瘤实验将干扰质粒hsa_circ_0000231(Si-circ组)和对照质粒Si-NC(Si-NC组)转染进乳腺癌细胞MCF-7中,转染4 h后,将培养基补足。48 h换液后,滴加终浓度为1 mg/L的嘌呤霉素筛选稳定株,此后持续筛选15 d,获得稳转细胞株。收集Si-NC组和Si-circ组稳转细胞,分别对4周龄的雌性裸鼠左侧肩胛进行皮下注射,注射细胞浓度为2×108/mL,每只裸鼠注射体积为50 μL,每组5只裸鼠,从注射当天起每周观察并测量肿瘤体积。4周后收集移植瘤,拍照称量,制备成石蜡切片,进行免疫组化(IHC)实验。
1.3 统计学分析采用SPSS 21.0和GraphPad Prism 8.0统计分析软件,两组均数采用配对t检验,多组均数采用单因素方差分析,定性变量相关性分析采用卡方检验,P < 0.05视作差异具有统计学意义。
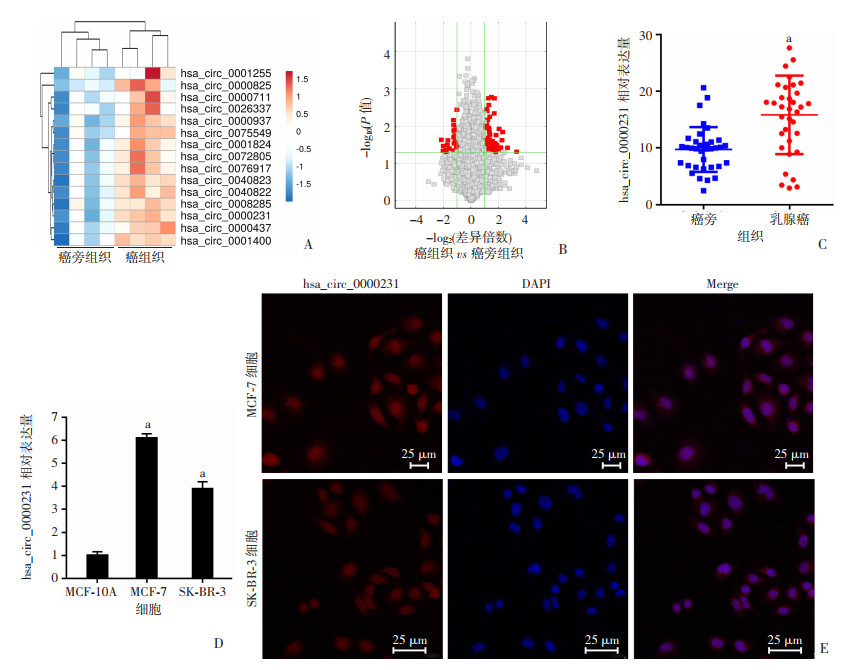
2 结果 2.1 hsa_circ_0000231在临床标本和乳腺癌细胞中高表达采用微阵列分析技术对4对临床乳腺癌组织及对应癌旁组织的circRNA表达谱进行分析,结果显示hsa_circ_0000231在乳腺癌组织中上调较为显著(图 1A、B)。qRT-PCR检测hsa_circ_0000231在35对临床组织、正常人乳腺上皮细胞和乳腺癌细胞中的表达,结果显示hsa_circ_0000231在乳腺癌组织和乳腺癌细胞中的表达均上调(P < 0.01,图 1C、D)。在35例临床乳腺癌标本中,有9例组织hsa_circ_0000231相对表达量低于癌旁组织,为低表达;有26例组织hsa_circ_0000231的相对表达量高于癌旁组织,为高表达,结果显示hsa_circ_0000231的表达与乳腺癌的T分期(P=0.049)、N分期(P=0.004)和TNM分期(P=0.026)呈正相关,与年龄、分级等临床病理参数无关(表 2)。FISH实验检测hsa_circ_0000231在乳腺癌细胞中的表达及定位,结果显示hsa_circ_0000231在乳腺癌细胞中表达且主要定位于细胞核(图 1E)。
|
| A:微阵列分析中差异表达的circRNA热图;B:微阵列分析结果火山图;C:qRT-PCR检测35对临床标本中hsa_circ_0000231的表达 a:P < 0.01,与癌旁组织比较;D:qRT-PCR检测hsa_circ_0000231在正常乳腺上皮细胞和乳腺癌细胞中的表达(n=3) a:P < 0.01,与正常乳腺上皮细胞MCF-10A比较;E:FISH实验检测hsa_circ_0000231在乳腺癌细胞中的表达及定位(n=3) 图 1 差异表达的circRNA热图以及hsa_circ_0000231的相对表达量 |
| 临床病理特征 | n | Hsa_circ_0000231相对表达量 | χ2值 | P值 | ||
| 低表达(n=9) | 高表达(n=26) | |||||
| 年龄/岁 | < 53 | 21 | 7 | 14 | 1.595 | 0.385 |
| ≥53 | 14 | 2 | 12 | |||
| 病理分级 | Ⅱ | 11 | 5 | 6 | 3.272 | 0.164 |
| Ⅲ | 24 | 4 | 20 | |||
| T分期 | T1 | 12 | 6 | 6 | 5.638 | 0.049 |
| T2~T3 | 23 | 3 | 20 | |||
| N分期 | N0 | 15 | 8 | 7 | 10.483 | 0.004 |
| N1~N3 | 20 | 1 | 19 | |||
| TNM分期 | Ⅰ | 11 | 6 | 5 | 6.981 | 0.026 |
| Ⅱ/Ⅲ | 24 | 3 | 21 | |||
2.2 Hsa_circ_0000231干扰质粒效率验证
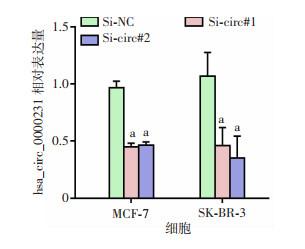
将干扰质粒和对照质粒分别转染两株乳腺癌细胞后,通过qRT-PCR验证hsa_circ_0000231的相对表达量。结果显示: 在两株乳腺癌细胞中,相对于转染对照质粒Si-NC,转染了干扰质粒Si-circ#1和Si-circ#2的细胞中hsa_circ_0000231的表达水平显著降低(P < 0.01,图 2)。
|
| a:P < 0.01,与Si-NC组比较 图 2 qRT-PCR检测干扰质粒效率 (n=3) |
2.3 敲低hsa_circ_0000231抑制乳腺癌细胞迁移和侵袭
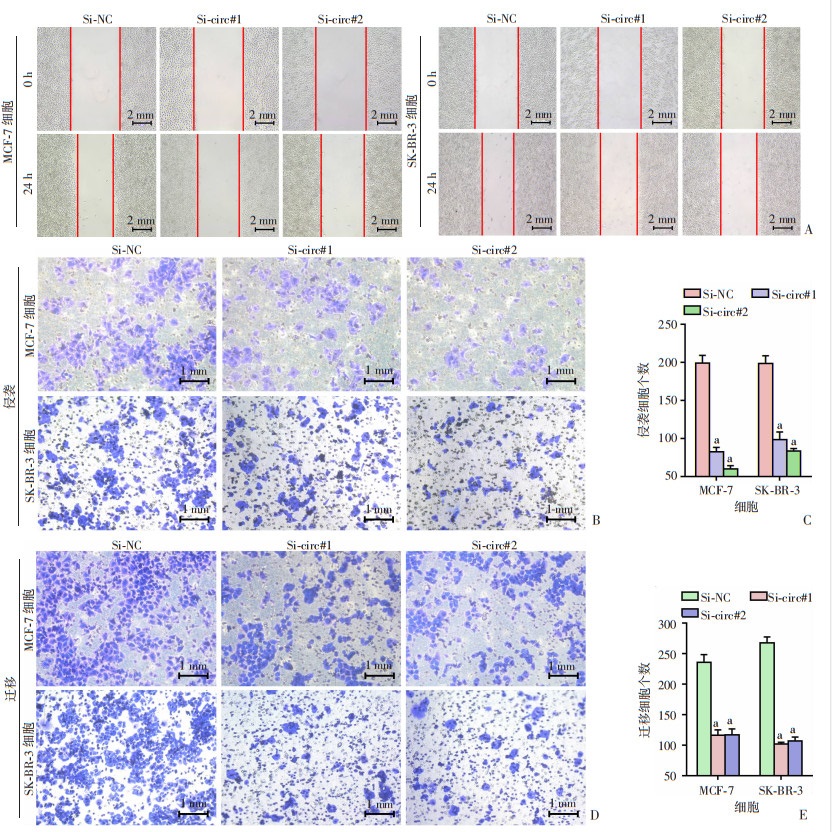
敲低hsa_circ_0000231后通过划痕实验和Transwell实验检测乳腺癌细胞迁移和侵袭能力。划痕实验中,MCF-7细胞Si-NC组迁移距离为(2.84±0.12)mm,Si-circ#1组的迁移距离为(1.53±0.08)mm,Si-circ#2组的迁移距离为(1.59±0.09)mm,与Si-NC组比较,Si-circ#1组的相对迁移率减少1.31倍,Si-circ#2组的相对迁移率减少1.25倍;SK-BR-3细胞Si-NC组迁移距离为(2.7±0.13)mm,Si-circ#1组的迁移距离为(1.7±0.15)mm,Si-circ#2组的迁移距离为(1.59±0.11)mm,与Si-NC组比较,Si-circ#1组的相对迁移率减少1.00倍,Si-circ#2组的相对迁移率减少1.11倍(P < 0.01,图 3A)。Transwell实验结果显示:Si-circ#1和Si-circ#2组的细胞侵袭和迁移能力显著低于Si-NC组(P < 0.01,图 3B~E)。
|
|
a:P < 0.01,与Si-NC组比较 A:划痕实验;B:Transwell侵袭实验;C:侵袭细胞数分析(n=3);D:Transwell迁移实验;E:迁移细胞数分析(n=3) 图 3 下调hsa_circ_0000231对乳腺癌细胞迁移和侵袭能力的影响 |
2.4 敲低hsa_circ_0000231抑制乳腺癌细胞的增殖
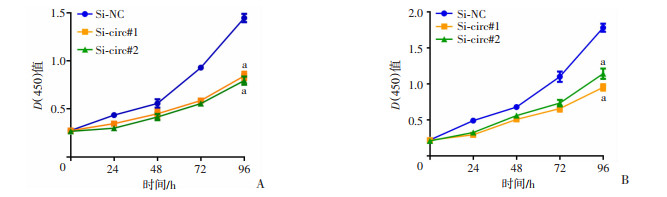
CCK-8、EdU和克隆形成实验检测敲低hsa_circ_0000231对细胞增殖能力的影响。连续观测96 h后,MCF-7细胞和SK-BR-3细胞的Si-circ#1组和Si-circ#2组细胞活性显著低于Si-NC组(P < 0.01,图 4);EdU实验显示:与Si-NC组比较,Si-circ#1组和Si-circ#2组MCF-7细胞和SK-BR-3细胞的增殖能力显著降低(P < 0.05,图 5A~D);克隆形成实验结果显示:MCF-7细胞和SK-BR-3细胞的Si-circ#1组和Si-circ#2组克隆形成能力显著低于Si-NC组(P < 0.05,图 5E、F)。
|
| a:P < 0.01,与Si-NC组比较 图 4 CCK-8检测MCF-7细胞(A)、SK-BR-3细胞(B)活性 (n=3) |

|
|
a:P < 0.01,b:P < 0.05,与Si-NC组比较 A:EdU实验检测MCF-7细胞增殖;B:MCF-7细胞增殖率分析(n=3);C:EdU实验检测SK-BR-3细胞增殖;D:SK-BR-3细胞增殖率分析(n=3);E:细胞克隆形成实验;F:克隆形成数量分析(n=3) 图 5 下调hsa_circ_0000231对乳腺癌细胞增殖能力的影响 |
2.5 敲低hsa_circ_0000231可诱导乳腺癌细胞凋亡
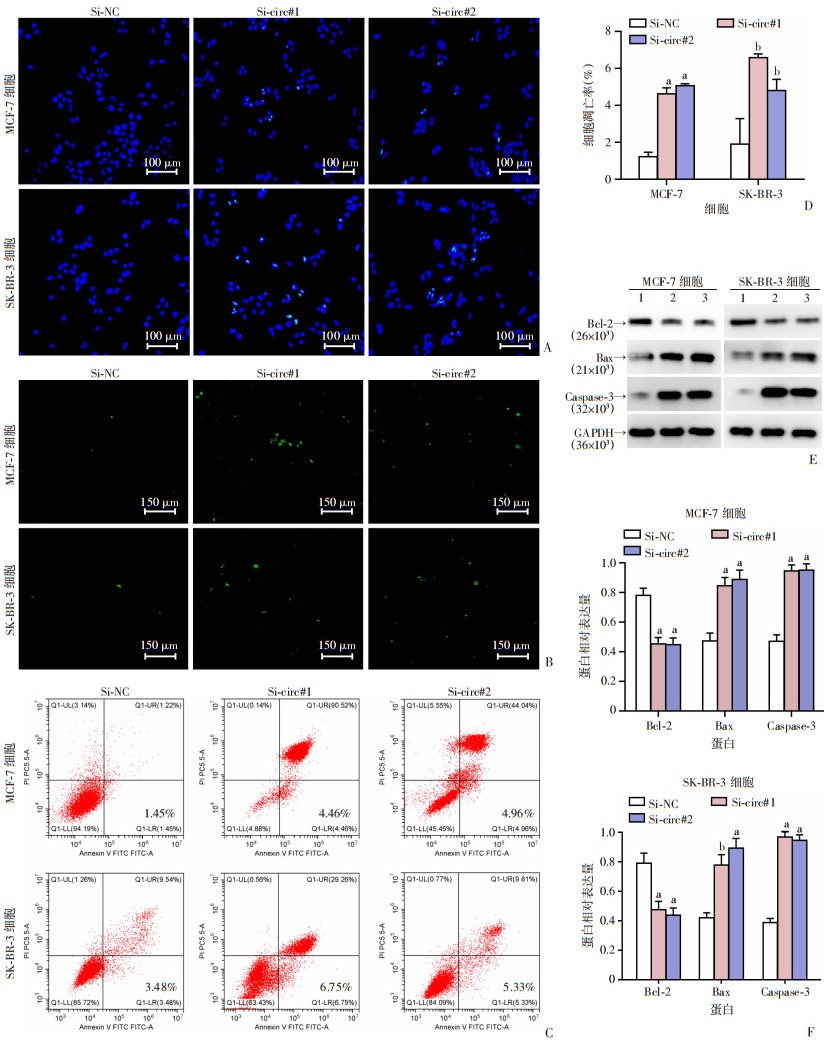
分别采用Hoechst33342和TUNEL实验检测敲低hsa_circ_0000231对细胞凋亡的影响。Hoechst33342实验结果显示:Si-circ#1和Si-circ#2组的MCF-7细胞的凋亡特征较Si-NC组更明显, 形态学上表现为细胞核碎裂,荧光显微镜下呈明亮荧光(图 6A);TUNEL实验结果显示:Si-circ#1和Si-circ#2组较Si-NC组出现更多呈明亮绿色荧光的凋亡细胞(图 6B);流式细胞仪检测沉默hsa_circ_0000231对细胞凋亡的影响,结果显示:与Si-NC组比较,Si-circ#1和Si-circ#2组细胞凋亡率显著增加(P < 0.05,图 6C、D);收集转染Si-circ#1、Si-circ#2和Si-NC质粒48 h后的MCF-7细胞和SK-BR-3细胞,提取总蛋白,Western blot检测凋亡相关蛋白Caspase-3、Bcl-2和Bax的表达变化,结果显示:与Si-NC组比较,Si-circ#1和Si-circ#2组Bcl-2蛋白表达水平下降,而Bax和Caspase-3蛋白表达水平显著增高(P < 0.05,图 6E、F)。
|
|
a:P < 0.01,b:P < 0.05,与Si-NC组比较 A:Hoechst33342实验;B:TUNEL实验;C、D:流式细胞仪检测各组细胞凋亡及凋亡率分析(n=3);E、F:Western blot检测Bax、Bcl-2和Caspase-3蛋白表达及半定量分析(n=3) 1: Si-NC, 2: Si-circ#1, 3: Si-circ#2 图 6 下调hsa_circ_0000231可诱导乳腺癌细胞凋亡 |
2.6 敲低hsa_circ_0000231对细胞周期的影响
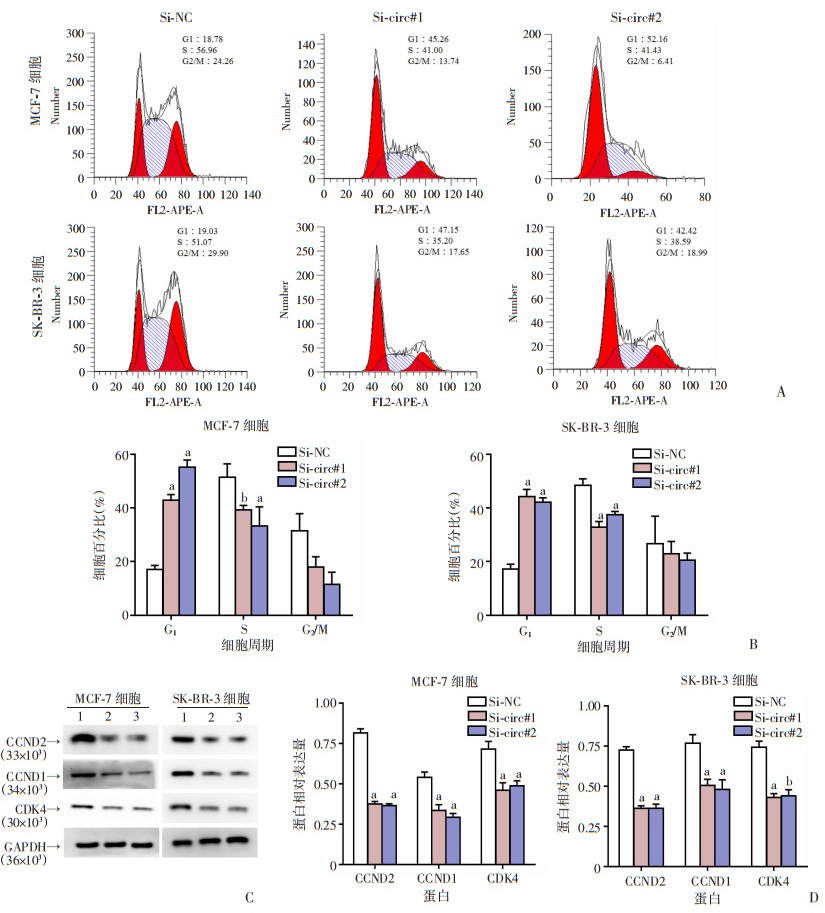
采用流式细胞仪和Western blot检测敲低hsa_circ_0000231对乳腺癌细胞周期的影响。与Si-NC组比较,Si-circ#1和Si-circ#2组的细胞在G1期增多,在S期减少,表明敲低hsa_circ_0000231后细胞周期阻滞在G1期(P < 0.05,图 7A、B)。Western blot检测细胞周期相关蛋白CCND2、CCND1和CDK4的表达,结果显示,与Si-NC组比较,Si-circ#1和Si-circ#2组CCND2、CCND1和CDK4蛋白表达水平明显下降(P < 0.05,图 7C、D)。
|
|
a:P < 0.01,b:P < 0.05,与Si-NC组比较 A:流式细胞仪检测细胞周期;B:各组细胞周期分布情况(n=3);C:Western blot检测蛋白CCND2、CCND1和CDK4的表达;D:各组蛋白表达半定量分析(n=3) 图 7 下调hsa_circ_0000231对乳腺癌细胞周期的影响 |
2.7 敲低hsa_circ_0000231抑制移植瘤生长
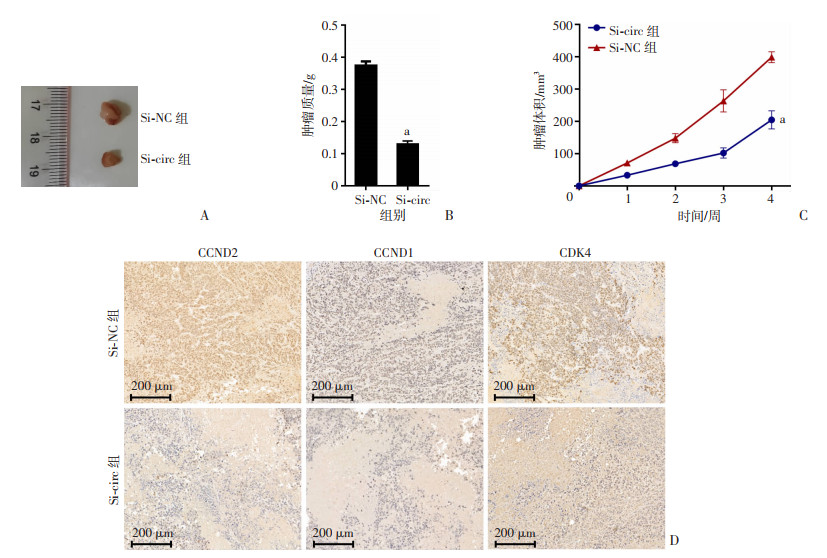
为了探究has_circ_0000231在体内对肿瘤生长的影响,将has_circ_0000231稳定低表达的乳腺癌细胞株分别接种到雌性裸鼠皮下以构建裸鼠移植瘤生长模型。结果表明:Si-circ组的肿瘤质量显著低于Si-NC组(P < 0.01,图 8A、B)。根据肿瘤生长曲线,发现Si-circ组移植瘤生长速度明显慢于Si-NC组(P < 0.01,图 8C)。IHC染色实验结果显示:敲低has_circ_0000231后,CCND2、CCND1和CDK4蛋白的表达显著降低(图 8D)。
|
|
a:P < 0.01,与Si-NC组比较 A: 移植瘤观察;B: 移植瘤质量;C: 移植瘤生长曲线;D: IHC染色观察(S-P) 图 8 敲低hsa_circ_0000231抑制移植瘤的生长 (n=5) |
2.8 hsa_circ_0000231与HnRNPK相互作用增强c-Myc的表达
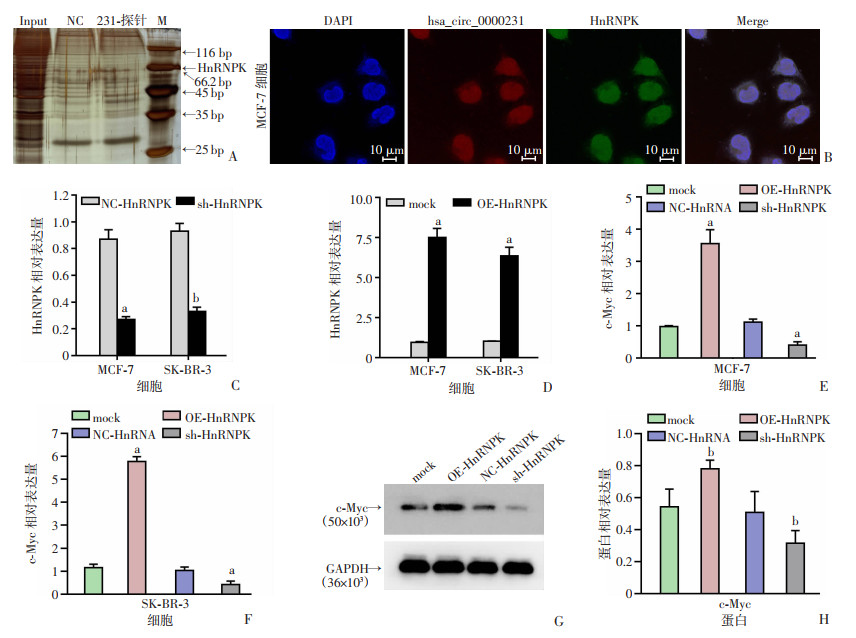
通过hsa_circ_0000231特异性探针进行RNA pull down实验,采用银染和质谱分析检测与hsa_circ_0000231结合的蛋白,发现HnRNPK富集在hsa_circ_0000231上(图 9A);FISH-IF实验结果显示:hsa_circ_0000231与HnRNPK共定位于细胞核(图 9B);随后构建HnRNPK的过表达质粒,敲低质粒和对照质粒并在细胞中验证效率(P < 0.05,图 9C、D);采用qRT-PCR检测过表达和敲低HnRNPK后,c-Myc在mRNA水平的表达变化,结果表明:HnRNPK过表达时,c-Myc的表达量升高,而敲低HnRNPK时,c-Myc的表达量降低(P < 0.01,图 9E、F);Western blot检测c-Myc蛋白的表达变化,结果显示:HnRNPK过表达时,c-Myc蛋白表达增高,而敲低HnRNPK时,c-Myc蛋白表达降低(P < 0.05,图 9G、H)。
|
|
a:P < 0.01,b:P < 0.05,与NC-HnRNPK或mock比较 A: RNA pull down实验;B: FISH-IF实验检测hsa_circ_0000231与HnRNPK亚细胞定位(n=3);C、D: HnRNPK过表达和敲低效率验证(n=3);E、F: qRT-PCR检测两种细胞中过表达和敲低HnRNPK后c-Myc的相对表达量(n=3);G: Western blot检测c-Myc的蛋白表达;H: c-Myc蛋白表达半定量分析(n=3) 图 9 hsa_circ_0000231与HnRNPK相互作用增强c-Myc的表达 |
3 讨论
乳腺癌影响全球女性健康,随着对乳腺癌的研究进展,虽然早期确诊率和生存期得到了提高,但乳腺癌仍然是影响女性健康的主要原因之一。到2020年,乳腺癌的发病率已超过肺癌,成为最常见的癌症[2]。尽管部分患者有良好的预后,但乳腺癌仍是全球癌症主要死亡原因,对公众健康构成威胁[2, 14]。因此,寻找诊断和治疗乳腺癌的新靶点具有重要意义。
circRNA被认为是一类特殊的无5′端帽和3′端尾的非编码RNA,是由mRNA前体反向剪接产生的共价封闭RNA分子[15]。circRNA是丰富、稳定和保守的RNA剪接产物,具有疾病特异性和稳定性的优点,可以在转录后和转录水平上调节基因表达[16-17]。circRNA作为非编码RNA,除了在肿瘤细胞中能够检测到,在唾液和血浆中也发现了丰富的circRNA存在[18]。研究表明circRNA作为功能性RNA直接参与各种生物过程[15]。circRNA作为miRNA海绵、RNA结合蛋白海绵、基因转录和表达调节剂以及蛋白质编码基因发挥着重要作用[19]。随着检测方法的改进,circRNA可能成为潜在的生物标志物或治疗靶点[20]。因此,研究circRNA在乳腺癌中的机制作用,为临床的诊断治疗提供候选标志物具有重要意义。
本研究采用微阵列芯片技术分析获得差异表达的circRNA。qRT-PCR检测hsa_circ_0000231在临床组织标本和乳腺癌细胞中的表达均显著升高。为进一步探究hsa_circ_0000231在乳腺癌中的作用,将hsa_circ_0000231干扰质粒和对照质粒分别转染至乳腺癌细胞MCF-7和SK-BR-3中,并利用qRT-PCR技术验证干扰效率。细胞功能实验结果显示敲低hsa_circ_0000231能够抑制乳腺癌细胞的增殖、迁移和侵袭,诱导细胞凋亡。最后采用Western blot和移植瘤实验证实hsa_circ_0000231可调节CCND2、CCND1和CDK4蛋白的表达。研究表明:CCND2和CCND1属于D型细胞周期蛋白,通过结合并激活细胞周期蛋白依赖性激酶CDK4和CDK6,促进从G1期到S期的进展,这对细胞增殖和发育至关重要[21-22]。CCND1的高表达驱动细胞增殖,促进肿瘤生长,因此CCND1在癌症的发病机制中发挥着重要作用[23]。本研究敲低hsa_circ_0000231后,CCND2、CCND1和CDK4蛋白表达均显著降低,表明hsa_circ_0000231可以通过影响周期相关蛋白的表达调节乳腺癌细胞周期进程,从而调控乳腺癌的发生、发展。研究表明:在乳腺癌细胞中HnRNPK的过度表达显著增加c-Myc启动子和c-Myc蛋白的活性,促进乳腺癌细胞的增殖和生长[11]。本研究发现hnRNPK可以与hsa_circ_0000231相互作用增强c-Myc的表达。而c-Myc是参与人类癌变的原癌基因之一,调节多种癌细胞功能,包括细胞周期、细胞存活、细胞增殖和代谢重编程[24]。
综上所述,hsa_circ_0000231在乳腺癌组织和细胞中显著高表达,敲低hsa_circ_0000231能够抑制细胞增殖、迁移和侵袭,诱导细胞凋亡,hsa_circ_0000231能与HnRNPK相互作用增强c-Myc的表达,提示其与乳腺癌的发生、发展密切相关,有望成为临床上乳腺癌诊断和治疗的新生物标志物。但hsa_circ_0000231调控乳腺癌发生、发展的分子机制仍需进一步探究。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2020[J]. CA Cancer J Clin, 2020, 70(1): 7-30. |
| [2] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. |
| [3] |
ZHANG Y, LIANG W, ZHANG P, et al. Circular RNAs: emerging cancer biomarkers and targets[J]. J Exp Clin Cancer Res, 2017, 36(1): 152. |
| [4] |
SU M, XIAO Y H, MA J L, et al. Circular RNAs in cancer: emerging functions in hallmarks, stemness, resistance and roles as potential biomarkers[J]. Mol Cancer, 2019, 18(1): 90. |
| [5] |
ZHANG H D, JIANG L H, SUN D W, et al. CircRNA: a novel type of biomarker for cancer[J]. Breast Cancer, 2018, 25(1): 1-7. |
| [6] |
YU T, WANG Y F, FAN Y, et al. CircRNAs in cancer metabolism: a review[J]. J Hematol Oncol, 2019, 12(1): 90. |
| [7] |
LIU Y H, LI H, YE X Y, et al. Hsa_circ_0000231 knockdown inhibits the glycolysis and progression of colorectal cancer cells by regulating miR-502-5p/MYO6 axis[J]. World J Surg Oncol, 2020, 18(1): 255. |
| [8] |
CHEN T, WANG X L, LI C, et al. CircHIF1A regulated by FUS accelerates triple-negative breast cancer progression by modulating NFIB expression and translocation[J]. Oncogene, 2021, 40(15): 2756-2771. |
| [9] |
LIU Z H, ZHOU Y, LIANG G H, et al. Circular RNA hsa_circ_001783 regulates breast cancer progression via sponging miR-200c-3p[J]. Cell Death Dis, 2019, 10(2): 55. |
| [10] |
XU Y J, WU W, HAN Q, et al. Post-translational modification control of RNA-binding protein hnRNPK function[J]. Open Biol, 2019, 9(3): 180239. |
| [11] |
BARBORO P, FERRARI N, BALBI C. Emerging roles of heterogeneous nuclear ribonucleoprotein K (hnRNP K) in cancer progression[J]. Cancer Lett, 2014, 352(2): 152-159. |
| [12] |
JI W F, ZHANG W W, WANG X, et al. c-Myc regulates the sensitivity of breast cancer cells to palbociclib via c-Myc/miR-29b-3p/CDK6 axis[J]. Cell Death Dis, 2020, 11(9): 760. |
| [13] |
林莉, 侯俊明, 田博, 等. 乳腺癌Wnt信号通路关键因子β-catenin的突变和表达[J]. 中国肿瘤临床与康复, 2018, 25(5): 513-516. LIN L, HOU J M, TIAN B, et al. Mutation and expression of key factor β-catenin in Wnt signaling pathway in breast cancer[J]. Chin J Clin Oncol Rehabilit, 2018, 25(5): 513-516. |
| [14] |
FERLAY J, COLOMBET M, SOERJOMATARAM I, et al. Estimating the global cancer incidence and mortality in 2018:GLOBOCAN sources and methods[J]. Int J Cancer, 2019, 144(8): 1941-1953. |
| [15] |
SHI Y, JIA X, XU J. The new function of circRNA: translation[J]. Clin Transl Oncol, 2020, 22(12): 2162-2169. |
| [16] |
牛亚倩, 常钰玲, 刘芳, 等. 环状RNA作为微小RNA海绵在肿瘤进展中的作用[J]. 中国生物制品学杂志, 2022, 35(1): 119-122. NIU Y Q, CHANG Y L, LIU F, et al. Role of circular RNA as miRNA sponges in tumor progression[J]. Chin J Biol, 2022, 35(1): 119-122. |
| [17] |
潘大维, 赵源, 梁佳卉, 等. 环状RNA翻译在癌症中的研究进展[J]. 生命科学, 2021, 33(9): 1153-1160. PAN D W, ZHAO Y, LIANG J H, et al. Advances in circular RNAs translation in cancers[J]. Chin Bull Life Sci, 2021, 33(9): 1153-1160. |
| [18] |
VROMMAN M, VANDESOMPELE J, VOLDERS P J. Closing the circle: current state and perspectives of circular RNA databases[J]. Brief Bioinform, 2021, 22(1): 288-297. |
| [19] |
HAN B, CHAO J, YAO H H. Circular RNA and its mechanisms in disease: from the bench to the clinic[J]. Pharmacol Ther, 2018, 187: 31-44. |
| [20] |
VO J N, CIESLIK M, ZHANG Y J, et al. The landscape of circular RNA in cancer[J]. Cell, 2019, 176(4): 869-881.e13. |
| [21] |
TCHAKARSKA G, SOLA B. The double dealing of cyclin D1[J]. Cell Cycle, 2020, 19(2): 163-178. |
| [22] |
PIROZZI F, LEE B, HORSLEY N, et al. Proximal variants in CCND2 associated with microcephaly, short stature, and developmental delay: a case series and review of inverse brain growth phenotypes[J]. Am J Med Genet A, 2021, 185(9): 2719-2738. |
| [23] |
MONTALTO F I, DE AMICIS F. Cyclin D1 in cancer: a molecular connection for cell cycle control, adhesion and invasion in tumor and stroma[J]. Cells, 2020, 9(12): 2648. |
| [24] |
YOSHIDA G J. Emerging roles of Myc in stem cell biology and novel tumor therapies[J]. J Exp Clin Cancer Res, 2018, 37(1): 173. |




