非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)以肝细胞中过量的甘油三酯(triglyceride,TG)积累为特征, 可从单纯性脂肪变性发展为非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、肝纤维化、肝硬化,甚至肝细胞癌,影响着全球大约25%的人口,已成为一个日益严重的公共卫生问题[1]。核因子κB(nuclear factor kappa-B,NF-κB)通路的持续激活可促进肿瘤坏死因子-α(tumor necrosis factor-alpha,TNF-α)、白细胞介素-6(interleukin-6,IL-6)等炎症因子的释放,引起慢性炎症状态和胰岛素抵抗(insulin resistance,IR),进而促进NAFLD的发展。NF-κB及其下游信号通路受雌激素信号通路的抑制,因而雌激素缺乏会增加机体的炎症因子水平[2]。绝经后女性由于雌激素水平降低, 导致其NAFLD发病率远高于绝经前妇女, 激素替代疗法(hormone replacement therapy, HRT)可有效改善绝经后NAFLD的肝脏炎症和脂肪变性,但可能增加乳腺癌发生风险限制了其临床应用[3]。
大豆异黄酮(soy isoflavones,SIF)是一种天然的植物化合物, 其分子结构和生物活性与体内合成的雌激素相似,在豆类植物中含量较为丰富,具有抗炎、抗氧化、改善IR、缓解脂质代谢紊乱等多种生物学效应,SIF作为植物雌激素并没有合成雌激素的副作用[4-7]。人群调查研究发现,膳食SIF摄入水平与NAFLD发病率呈负相关[8-9]。SIF的生物学效应与其肠道代谢产物雌马酚(equol,Eq)密切相关,Eq比其前体更稳定,清除率更低,具有更高的雌激素活性,表现出很强的抗炎、抗氧化作用,在缓解女性更年期症状,以及预防心血管疾病、骨质疏松、慢性肾病、恶性肿瘤等方面显示出良好的效果[10]。然而, 目前国内外关于Eq干预对绝经后NAFLD的作用研究甚少。本研究通过高脂饮食(high-fat diet,HFD)喂养去卵巢大鼠建立绝经后NAFLD模型, 观察Eq干预对绝经后NAFLD的影响, 并探讨其中的可能作用机制。
1 材料与方法 1.1 试剂和材料Eq购自上海大赛璐药物手性技术有限公司,17β- 雌二醇(estradiol,E2)、游离脂肪酸(free fatty acid,FFA)检测试剂盒购自北京Solarbio公司。TG、总胆固醇(total cholesterol,TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-c)、低密度脂蛋白(low density lipoprotein cholesterol,LDL-c)、丙氨酸氨基转移酶(alanine transaminase,ALT),天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)检测试剂盒厂家为南京建成生物工程研究所。TNF-α、IL-6、雌激素和胰岛素检测ELISA试剂盒购自厦门惠佳生物科技有限公司。总RNA提取试剂盒、反转录试剂盒、qRT-PCR试剂盒、引物、GAPDH一抗、过氧化物酶偶联的二抗购自上海生工生物技术有限公司。RIPA裂解缓冲液、BCA蛋白检测试剂盒购自上海碧云天生物科技。NF-κB p-p65一抗购自上海艾比玛特生物医药有限公司。大鼠高脂饲料购自北京华富康生物科技公司。
1.2 实验及分组实验按照陆军军医大学动物保护与使用委员会批准的程序进行。5周龄雌性SD大鼠60只,购自北京华富康生物科技公司。将大鼠置于温度[(21±2)℃]和湿度[(50±10)%]条件下,标准光照(12 h光/暗)循环,自由摄入标准饮食和水。大鼠腹腔注射戊巴比妥钠400 mg/kg麻醉,进行假手术或卵巢切除(ovariectomized, OVX)。7 d后选取10只假手术大鼠作为假手术组, 喂普通饲料;50只OVX大鼠按随机数字表法分为:OVX+HFD组,OVX+HFD+低、中、高剂量[20、40、80 mg/(kg·d)] Eq干预组,OVX+HFD+E2[0.25 mg/(kg·d)]干预组, 每组10只, 喂高脂饲料。Eq和E2以灌胃方式给药, 其余组给予等量生理盐水, 每日1次, 连续12周。12周后大鼠存活51只(死亡原因均为灌胃后窒息所致),大鼠禁食12 h,麻醉后称量、采血,处死、取肝组织样品。
1.3 大鼠肝脏组织形态学观察所有大鼠取肝脏相同部位,4%多聚甲醛固定、脱水、石蜡包埋,常规切片5 μm厚,HE染色后使用奥林巴斯显微镜观察肝脏组织形态学变化,以超过5%的肝细胞出现大泡性脂肪变性作为NAFLD的病理诊断标准[11]。
1.4 称量大鼠肝脏湿质量, 计算肝指数处死大鼠后迅速去除肝脏周围组织, 称量肝脏湿质量并计算肝指数(肝脏湿质量/体质量×100%)。
1.5 血清雌激素、FPG、FINS水平及HOMA-IR检测血液样本4 ℃、4 000 r/min离心10 min,收集血清,采用全自动临床化学分析仪测定空腹血糖(fasting plasma glucose, FPG)水平。ELISA试剂盒检测血清雌激素、空腹胰岛素(fasting insulin,FINS)水平,计算稳态模型胰岛素抵抗指数(homeostasis model assessment-IR, HOMA-IR),HOMA-IR=FPG×FINS÷22.6。
1.6 血清和肝脏脂质水平检测按照试剂盒说明书检测血清TG、TC、LDL-C、HDL-C、FFA水平;肝脏匀浆于生理盐水中,采用试剂盒测定匀浆中TG、TC水平。
1.7 肝损伤血清生化指标检测按照试剂盒说明书检测血清ALT、AST水平。
1.8 血清和肝脏炎症因子水平检测按照试剂盒说明书检测血清TNF-α、IL-6水平;肝脏匀浆于生理盐水中,采用试剂盒测定匀浆中TNF-α、IL-6水平。
1.9 实时聚合酶链反应(qRT-PCR)按照试剂盒的说明,用TRIzol试剂提取肝组织总RNA。测定RNA浓度,用逆转录酶试剂盒将RNA转录为cDNA。利用NCBI网站设计大鼠TNF-α、IL-6和GAPDH序列特异性引物, 见表 1。Bio-Rad PCR仪进行qRT-PCR, 采用比较周期阈值(Ct) (2-ΔΔCt)方法定量RNA的相对量。
| 基因名称 | 引物序列 |
| TNF-α | 上游: 5′-TAGCCCACGTCGTAGCAAA-3′ 下游: 5′-GCAGCCTTGTCCCTTGAAG-3′ |
| IL-6 | 上游: 5′-TGGTCTTCTGGAGTTCCGTT-3′ 下游: 5′-GGATGGTCTTGGTCCTTAGC-3′ |
| GAPDH | 上游: 5′-CCATGTTTGTGATGGGTGTG-3′ 下游: 5′-GGATGCAGGGATGATGTTCT-3′ |
1.10 Western blot检测
肝组织用含有蛋白酶抑制剂的RIPA裂解液匀浆,在10 000×g转速下4 ℃离心10 min。按试剂盒说明测定上清液中的蛋白浓度后采用Western blot检测肝组织等量蛋白中NF-κB p-p65、GAPDH的表达情况,显影后用Image J软件计算灰度值进行统计分析。
1.11 统计学分析使用SPSS 20.0软件进行统计分析,数据以x±s表示。结果采用单因素方差分析,然后进行Tukey事后检验。P < 0.05被认为差异具有统计学意义。
2 结果 2.1 Eq对大鼠肝脏组织学改变的影响肝组织HE染色可见: 假手术组大鼠肝细胞结构及排列正常; OVX+HFD组大鼠肝细胞结构及排列紊乱, 汇管区出现炎症细胞浸润, 出现大量脂滴空泡, 符合NAFLD的诊断标准;经Eq或E2干预后,肝细胞结构及排列紊乱有所改善,炎症细胞浸润和脂滴空泡减少, 且随着Eq干预剂量增加,其对脂肪肝病理变化的改善效应有增强趋势,见图 1。
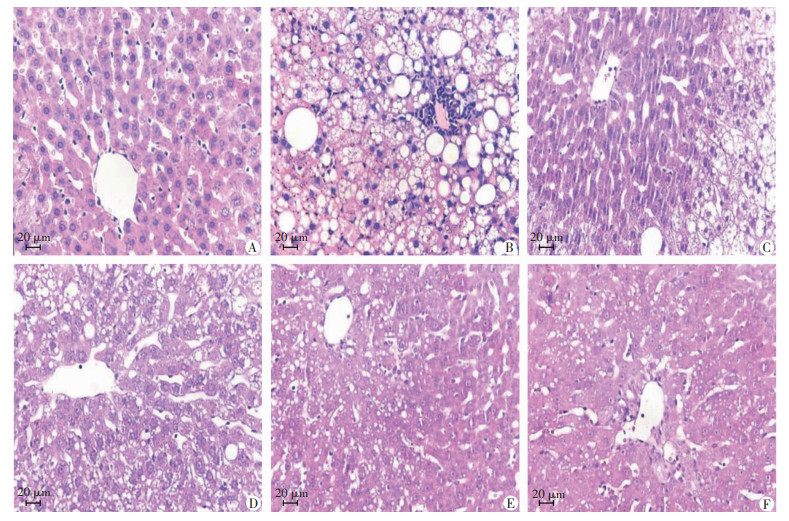
|
| A: 假手术组; B: OVX+HFD组; C: OVX+HFD+低剂量Eq干预组; D: OVX+HFD+中剂量Eq干预组; E: OVX+HFD+高剂量Eq干预组; F: OVX+HFD+E2干预组 图 1 HE染色观察各组大鼠肝脏组织学变化 |
2.2 Eq对大鼠体质量、肝脏湿质量、肝指数的影响
与假手术组比较,OVX+HFD组大鼠体质量、肝脏湿质量及肝指数显著升高(P < 0.05);与OVX+HFD组比较,Eq干预后大鼠肝脏湿质量及肝指数均显著降低(P < 0.05),其中Eq中、高剂量组显著降低大鼠体质量(P < 0.05),与E2具有相似的作用效果,干预效应随Eq剂量增加而增强,见图 2。
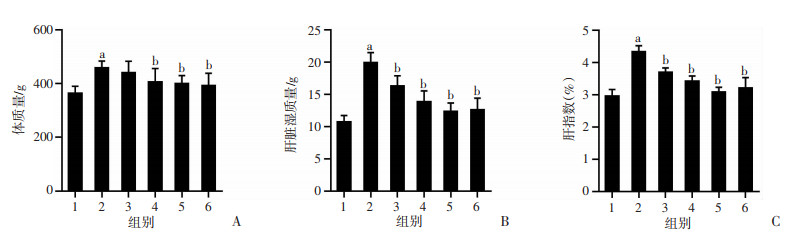
|
|
1:假手术组(n=10); 2:OVX+HFD组(n=8); 3:OVX+HFD+低剂量Eq干预组(n=8); 4:OVX+HFD+中剂量Eq干预组(n=8); 5:OVX+HFD+高剂量Eq干预组(n=8); 6:OVX+HFD+E2干预组(n=9);a: P < 0.05,与假手术组比较; b: P < 0.05,与OVX+HFD组比较 A: 体质量; B: 肝脏湿质量; C: 肝指数 图 2 各组大鼠体质量、肝脏湿质量、肝指数比较 |
2.3 Eq对大鼠血清雌激素、FPG、FINS水平及HOMA-IR的影响
与假手术组比较,OVX+HFD组大鼠血清雌激素水平显著下降(P < 0.05), 血清FPG、FINS水平,HOMA-IR显著升高(P < 0.05);与OVX+HFD组比较,经Eq或E2干预后,大鼠血清雌激素水平显著升高(P < 0.05), 血清FPG、FINS水平,HOMA-IR显著降低(P < 0.05),Eq干预效果呈现一定剂量依赖效应,见图 3。
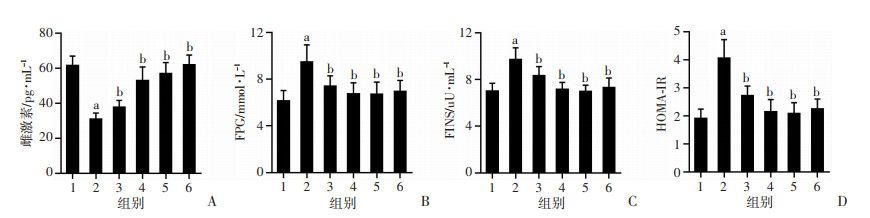
|
|
1:假手术组(n=10); 2:OVX+HFD组(n=8); 3:OVX+HFD+低剂量Eq干预组(n=8); 4:OVX+HFD+中剂量Eq干预组(n=8); 5:OVX+HFD+高剂量Eq干预组(n=8); 6:OVX+HFD+E2干预组(n=9);a: P < 0.05,与假手术组比较; b: P < 0.05,与OVX+HFD组比较 A: 雌激素; B: FPG; C: FINS; D: HOMA-IR 图 3 各组大鼠雌激素、FPG、FINS水平及HOMA-IR比较 |
2.4 Eq对大鼠血清脂质水平的影响
与假手术组比较,OVX+HFD组大鼠血清HDL-c水平显著降低(P < 0.05),血清TG、TC、LDL-c、FFA水平显著升高(P < 0.05);Eq干预后,OVX+HFD大鼠血清TG、TC、LDL-c、FFA水平显著降低(p < 0.05),血清HDL-c水平显著升高(P < 0.05),与E2具有相似的作用效果,随着干预剂量增加, Eq的效应更加明显, 见图 4。
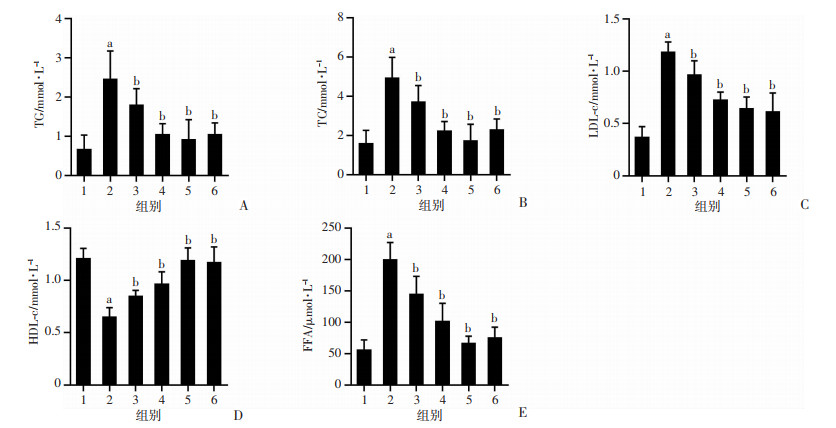
|
|
1:假手术组(n=10); 2:OVX+HFD组(n=8); 3:OVX+HFD+低剂量Eq干预组(n=8); 4:OVX+HFD+中剂量Eq干预组(n=8); 5:OVX+HFD+高剂量Eq干预组(n=8); 6:OVX+HFD+E2干预组(n=9);a: P < 0.05,与假手术组比较; b: P < 0.05,与OVX+HFD组比较 A: TG; B: TC; C: LDL-c; D: HDL-c; E: FFA 图 4 各组大鼠血清脂质水平比较 |
2.5 Eq对大鼠肝脏脂质水平的影响
与假手术组比较,OVX+HFD组大鼠肝脏TG、TC水平显著升高(P < 0.05),与OVX+HFD组比较, Eq干预后OVX+HFD大鼠肝脏TG、TC水平显著降低(P < 0.05),与E2具有相似的作用效果, Eq干预效果呈现一定剂量依赖效应,见图 5。
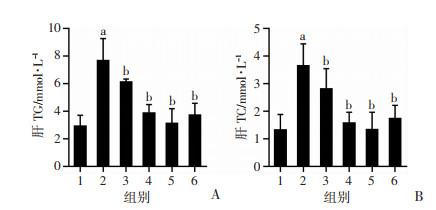
|
|
1:假手术组(n=10); 2:OVX+HFD组(n=8); 3:OVX+HFD+低剂量Eq干预组(n=8); 4:OVX+HFD+中剂量Eq干预组(n=8); 5:OVX+HFD+高剂量Eq干预组(n=8); 6:OVX+HFD+E2干预组(n=9);a: P < 0.05,与假手术组比较; b: P < 0.05,与OVX+HFD组比较 A: 肝TG; B: 肝TC 图 5 各组大鼠肝脏脂质水平比较 |
2.6 Eq对大鼠ALT和AST水平的影响
与假手术组比较,OVX+HFD组大鼠血清ALT、AST水平显著升高(P < 0.05),与OVX+HFD组比较,Eq或E2干预后大鼠血清ALT、AST水平显著降低(P < 0.05),Eq干预效果呈现一定剂量依赖效应,见图 6。

|
|
1:假手术组(n=10); 2:OVX+HFD组(n=8); 3:OVX+HFD+低剂量Eq干预组(n=8); 4:OVX+HFD+中剂量Eq干预组(n=8); 5:OVX+HFD+高剂量Eq干预组(n=8); 6:OVX+HFD+E2干预组(n=9);a: P < 0.05,与假手术组比较; b: P < 0.05,与OVX+HFD组比较 A: ALT; B: AST 图 6 各组大鼠血清ALT和AST水平比较 |
2.7 Eq对大鼠血清和肝脏炎症因子水平的影响
与假手术组比较,OVX+HFD组大鼠血清和肝脏炎症因子TNF-α、IL-6水平显著升高(P < 0.05),与OVX+HFD组比较,Eq干预后大鼠血清和肝脏TNF-α、IL-6水平显著降低(P < 0.05),与E2具有相似的作用效果,随着干预剂量增加,Eq的效应增强,见图 7。
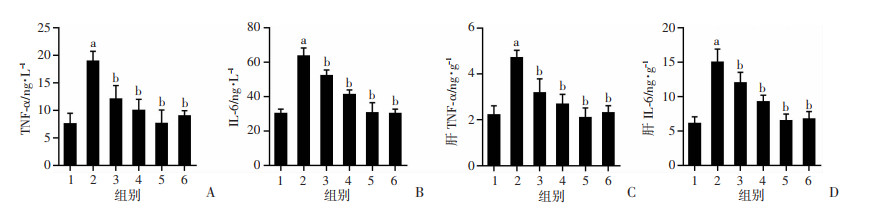
|
|
1:假手术组(n=10); 2:OVX+HFD组(n=8); 3:OVX+HFD+低剂量Eq干预组(n=8); 4:OVX+HFD+中剂量Eq干预组(n=8); 5:OVX+HFD+高剂量Eq干预组(n=8); 6:OVX+HFD+E2干预组(n=9);a: P < 0.05,与假手术组比较; b: P < 0.05,与OVX+HFD组比较 A: 血TNF-α; B: 血IL-6; C: 肝TNF-α; D: 肝IL-6 图 7 各组大鼠血清和肝脏炎症因子水平比较 |
2.8 Eq对大鼠肝脏TNF-α、IL-6 mRNA表达的影响
与假手术组比较,OVX+HFD组肝组织炎症因子TNF-α、IL-6 mRNA表达水平均显著升高(P < 0.05);Eq或E2干预后肝组织TNF-α、IL-6 mRNA表达水平显著降低(P < 0.05),见图 8。
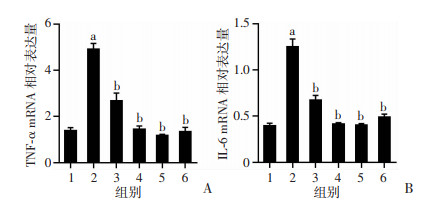
|
|
1:假手术组(n=10); 2:OVX+HFD组(n=8); 3:OVX+HFD+低剂量Eq干预组(n=8); 4:OVX+HFD+中剂量Eq干预组(n=8); 5:OVX+HFD+高剂量Eq干预组(n=8); 6:OVX+HFD+E2干预组(n=9);a: P < 0.05,与假手术组比较; b: P < 0.05,与OVX+HFD组比较 A: TNF-α; B: IL-6 图 8 各组大鼠肝组织炎症因子mRNA表达水平比较 |
2.9 Eq对大鼠肝脏NF-κB p-p65蛋白表达的影响
与假手术组比较,OVX+HFD组肝组织NF-κB p-p65蛋白表达水平均显著升高(P < 0.05);Eq干预后肝组织TNF-κB p-p65蛋白表达水平显著降低(P < 0.05),见图 9。

|
|
1:假手术组(n=10); 2:OVX+HFD组(n=8); 3:OVX+HFD+低剂量Eq干预组(n=8); 4:OVX+HFD+中剂量Eq干预组(n=8); 5:OVX+HFD+高剂量Eq干预组(n=8); 6:OVX+HFD+E2干预组(n=9) A: Western blot检测结果; B: 蛋白相对表达量分析a: P < 0.05,与假手术组比较; b: P < 0.05,与OVX+HFD组比较 图 9 各组大鼠肝组织NF-κB p-p65蛋白表达水平比较 |
3 讨论
NAFLD发病机制复杂, “多重打击”假说认为胰岛素抵抗(IR)、脂质过氧化、炎症因子、肠道微环境等多种因素作用于易感个体,共同促进NAFLD的发生、发展[12]。NF-κB是一种参与先天和适应性免疫反应的转录因子, 在肝脏炎症信号通路的调节中发挥重要作用, 在NAFLD动物模型和NASH患者中显示了持续的NF-κB通路激活[2, 12]。正常情况下,NF-κB通过与抑制蛋白结合被隔离在细胞质中,在低雌激素、高脂等条件下, NF-κB抑制蛋白磷酸化降解允许NF-κB转移到细胞核, 诱导编码TNF-α和IL-6等炎症因子的靶基因表达, 引起炎症反应和肝损伤[13]。雌激素是女性最重要的激素, 绝经前主要由卵巢合成, 绝经后由于卵巢功能减退导致其浓度急剧降低[14], NF-κB及其下游信号通路受雌激素信号通路的抑制, 这一调控作用解释了与绝经相关的肝脏炎症的过度调节, 并导致NAFLD向更有害的NASH、纤维化和肝癌等情况发展[2]。
饮食和生活方式的改变以及寿命的延长使绝经后妇女NAFLD的发病率呈逐年上升趋势。NAFLD与心血管疾病、骨质疏松、恶性肿瘤、各种内分泌疾病紧密相关, 这种疾病的日益流行及其可能造成的严重并发症给患者带来巨大的经济负担和较差的生活质量[1]。然而, 目前针对NAFLD的治疗并不理想, 缺乏有效的药物治疗手段。尽管有研究显示,接受激素替代疗法(HRT)可降低绝经后妇女NAFLD患病风险, 但妇女健康倡议的评估结果认为HRT的总体风险超过了它的益处, 不推荐把HRT作为一种长期治疗手段[15-16]。因此探索一种安全有效、易于长期坚持的治疗方法很有意义。近年来,植物雌激素在脂肪肝治疗中的作用开始受到密切关注,本研究通过切除大鼠卵巢加高脂饮食诱导NAFLD模型, 模拟绝经后妇女NAFLD病变, 探讨Eq对NAFLD大鼠的作用、炎症因子的表达的影响及可能的机制。
NF-κB活化伴有NF-κB p65蛋白磷酸化的增多, p65蛋白磷酸化可作为NF-κB通路激活的标志[17]。TNF-α在与肝损伤相关的细胞因子网络中具有关键作用, 一方面TNF-α表达受NF-κB信号的调控, 另一方面TNF-α可通过磷酸化NF-κB抑制因子来激活NF-κB, 进一步促进TNF-α转录, 形成了一个炎症性的正反馈回路[18]。TNF-α和IL-6是机体的重要炎症细胞因子, 一方面可以促进机体炎症的发生, 另一方面可通过抑制胰岛素受体底物磷酸化, 损害胰岛素信号诱发IR[19]。IR是NAFLD的一个主要特征, 对脂肪毒性、氧化应激和炎症级联激活的建立至关重要[12]。在IR状态下, 肝胰岛素不能抑制肝脏葡萄糖生成但能促进脂质合成, 导致高血糖、高甘油三酯血症和肝脏脂肪变性[20]。此外, 胰岛素具有抑制脂肪组织脂解的作用,在IR状态下, 这种抑制受损, 导致FFA向肝脏的外排增加, 肝细胞中的FFA一方面通过丝氨酸激酶的激活来诱导胰岛素信号通路的缺陷, 另一方面FFA增多会导致脂质的异常堆积, 促进TNF-α、IL-6等炎症介质的增多, 造成炎症、IR的恶性循环, 加速NAFLD的进展[12, 19]。从单纯性肝脂肪变性到NASH或从NASH到肝硬化的分子机制尚不完全清楚, 但肝组织炎症细胞聚集和IR是其中的关键步骤[21]。
本研究干预结束时, 与假手术组比较, OVX+HFD大鼠雌激素水平显著降低, 肝脏组织学检查可见大面积的脂肪变性, 成功诱导低雌激素高脂饮食环境下的NAFLD。OVX+HFD大鼠血清HDL-c水平降低, 血清TG、TC、LDL-c、FFA和肝脏TG、TC水平升高, 出现高脂血症、肝脏脂质异常沉积等脂质代谢紊乱; 血清和肝脏TNF-α、IL-6水平增高, 出现明显的炎症反应;同时FPG、FINS和HOMA-IR升高。AST和ALT是反应肝功能常用指标, 在出现肝损伤和炎症等条件下, AST和ALT的水平会显著升高[22], 本研究中OVX+HFD大鼠血清AST和ALT水平较假手术组显著升高, 说明大鼠出现了明显的肝功能的异常。通过qRT-PCR和Western blot检测发现肝组织TNF-α、IL-6 mRNA及NF-κB p-p65蛋白表达水平增高。研究显示, Eq可通过抗炎作用发挥生物学效应[23-25], SUBEDI等[23]发现Eq可有效抑制NF-κB活性, 降低TNF-α、IL-6等炎症因子表达, 保护小胶质细胞介导的神经炎症损伤。LU等[24]的研究也发现, Eq可通过抑制NF-κB活性, 减少TNF-α、IL-6的表达减轻神经炎症反应, 有效改善小鼠全身注射脂多糖引起的抑郁样行为。BANDARA等[25]发现,Eq可以剂量依赖性降低TNF-α、IL-6的表达,减轻大鼠皮肤炎症。本研究显示, Eq干预后大鼠血清雌激素维持在更高水平, 有效减轻了OVX+HFD大鼠体质量、肝指数、HOMA-IR、炎症反应水平和肝脏脂肪病变程度,改善了大鼠肝功能和脂质代谢紊乱,下调了肝组织TNF-α和IL-6 mRNA和NF-κB p-p65蛋白水平, 随着干预剂量增加, Eq的效应更加明显, 与E2具有相似的作用效果。
综上所述,Eq能有效改善高脂饮食去卵巢诱导的大鼠非酒精性脂肪肝, 其部分机制可能是Eq通过抑制NF-κB信号,减少炎症因子TNF-α、IL-6表达, 减轻大鼠炎症和IR水平, 最终有效减轻了大鼠脂质代谢紊乱和肝功能的异常。本研究为揭示Eq临床防治绝经后妇女NAFLD提供了新的科学依据,但Eq调控NF-κB信号通路的具体机制尚需进一步深入研究。值得注意的是, 由于饮食习惯和肠道微环境的差异, 并不是所有人都能代谢SIF产生Eq而从中获益[26], 而经常性食用含SIF食物可以提高肠道中代谢SIF产生Eq菌群的丰度, 使非Eq产生者向Eq产生者转变[10], 因此, 对于有发展成为NAFLD倾向的绝经后女性, 如没有特殊禁忌, 可适当增加饮食中富含SIF食物而从中获益。
| [1] |
YOUNOSSI Z M. Non-alcoholic fatty liver disease-A global public health perspective[J]. J Hepatol, 2019, 70(3): 531-544. |
| [2] |
DELLA T S. Non-alcoholic fatty liver disease as a canonical example of metabolic inflammatory-based liver disease showing a sex-specific prevalence: relevance of estrogen signaling[J]. Front Endocrinol (Lausanne), 2020, 11: 572490. |
| [3] |
LEE C B, KIM J, JUNG Y. Potential therapeutic application of estrogen in gender disparity of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J]. Cells, 2019, 8(10): 1259. |
| [4] |
LI H, JIA E N, JIAO J. Phytoestrogens in NAFLD: potential mechanisms of action[J]. Horm Metab Res, 2020, 52(2): 77-84. |
| [5] |
PANNEERSELVAM S, PACKIRISAMY R M. Protective effect of soy isoflavones (from Glycine max) on adipose tissue oxidative stress and inflammatory response in an experimental model of post-menopausal obesity: the molecular mechanisms[J]. Biochem Anal Biochem, 2016, 5(2): 1-7. |
| [6] |
SANKAR P, ZACHARIAH B, VICKNESHWARAN V, et al. Amelioration of oxidative stress and insulin resistance by soy isoflavones (from Glycine max) in ovariectomized Wistar rats fed with high fat diet: the molecular mechanisms[J]. Exp Gerontol, 2015, 63: 67-75. |
| [7] |
PANNEERSELVAM S, PACKIRISAMY R M, BOBBY Z, et al. Soy isoflavones (Glycine max) ameliorate hypertriglyceridemia and hepatic steatosis in high fat-fed ovariectomized Wistar rats (an experimental model of postmenopausal obesity)[J]. J Nutr Biochem, 2016, 38: 57-69. |
| [8] |
ZHANG S M, KUMARI S, GU Y Q, et al. Soy food intake is inversely associated with newly diagnosed nonalcoholic fatty liver disease in the TCLSIH cohort study[J]. J Nutr, 2020, 150(12): 3280-3287. |
| [9] |
WANG X M, WANG Y, XU W L, et al. Dietary isoflavones intake is inversely associated with non-alcoholic fatty liver disease, hyperlipidaemia and hypertension[J]. Int J Food Sci Nutr, 2022, 73(1): 60-70. |
| [10] |
MAYO B, VÁZQUEZ L, FLÓREZ A B. Equol: a bacterial metabolite from the daidzein isoflavone and its presumed beneficial health effects[J]. Nutrients, 2019, 11(9): 2231. |
| [11] |
SANYAL A J, BRUNT E M, KLEINER D E, et al. Endpoints and clinical trial design for nonalcoholic steatohepatitis[J]. Hepatology, 2011, 54(1): 344-353. |
| [12] |
BUZZETTI E, PINZANI M, TSOCHATZIS E A. The multiple-hit pathogenesis of non-alcoholic fatty liver disease (NAFLD)[J]. Metabolism, 2016, 65(8): 1038-1048. |
| [13] |
HOTAMISLIGIL G S. Inflammation and metabolic disorders[J]. Nature, 2006, 444(7121): 860-867. |
| [14] |
CUI J, SHEN Y, LI R N. Estrogen synthesis and signaling pathways during aging: from periphery to brain[J]. Trends Mol Med, 2013, 19(3): 197-209. |
| [15] |
VENETSANAKI V, POLYZOS S A. Menopause and non-alcoholic fatty liver disease: a review focusing on therapeutic perspectives[J]. Curr Vasc Pharmacol, 2019, 17(6): 546-555. |
| [16] |
MANSON J E, CHLEBOWSKI R T, STEFANICK M L, et al. Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women's Health Initiative randomized trials[J]. JAMA, 2013, 310(13): 1353-1368. |
| [17] |
PRADÈRE J P, HERNANDEZ C, KOPPE C, et al. Negative regulation of NF-κB p65 activity by serine 536 phosphorylation[J]. Sci Signal, 2016, 9(442): ra85. |
| [18] |
LIN Z H, CAI F F, LIN N, et al. Effects of glutamine on oxidative stress and nuclear factor-κB expression in the livers of rats with nonalcoholic fatty liver disease[J]. Exp Ther Med, 2014, 7(2): 365-370. |
| [19] |
刘妍, 常丽萍, 高怀林. 胰岛素抵抗的发病机制研究进展[J]. 世界中医药, 2021, 16(11): 1671-1674. LIU Y, CHANG L P, GAO H L. Advances in the pathogenesis of insulin resistance[J]. World Chin Med, 2021, 16(11): 1671-1674. |
| [20] |
SANTOLERI D, TITCHENELL P M. Resolving the paradox of hepatic insulin resistance[J]. Cell Mol Gastroenterol Hepatol, 2019, 7(2): 447-456. |
| [21] |
JI G Y, YANG Q H, HAO J, et al. Anti-inflammatory effect of genistein on non-alcoholic steatohepatitis rats induced by high fat diet and its potential mechanisms[J]. Int Immunopharmacol, 2011, 11(6): 762-768. |
| [22] |
王涛, 梁慧丽. 慢性乙型病毒性肝炎患者中血清HBsAg水平与HBV DNA及肝功能的关系[J]. 河南医学研究, 2019, 28(7): 1303-1304. WANG T, LIANG H L. Relationship between serum HBsAg level and HBV DNA and liver function in patients with chronic viral hepatitis B[J]. Henan Med Res, 2019, 28(7): 1303-1304. |
| [23] |
SUBEDI L, JI E, SHIN D, et al. Equol, a dietary daidzein gut metabolite attenuates microglial activation and potentiates neuroprotection in vitro[J]. Nutrients, 2017, 9(3): E207. |
| [24] |
LU C, GAO R J, ZHANG Y Y, et al. S-equol, a metabolite of dietary soy isoflavones, alleviates lipopolysaccharide-induced depressive-like behavior in mice by inhibiting neuroinflammation and enhancing synaptic plasticity[J]. Food Funct, 2021, 12(13): 5770-5778. |
| [25] |
BANDARA M, ARUN S J, ALLANSON M, et al. Topical isoflavonoids reduce experimental cutaneous inflammation in mice[J]. Immunol Cell Biol, 2010, 88(7): 727-733. |
| [26] |
RAFⅡ F. The role of colonic bacteria in the metabolism of the natural isoflavone daidzin to equol[J]. Metabolites, 2015, 5(1): 56-73. |




