2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系防原医学教研室,全军复合伤研究所,创伤、烧伤与复合伤国家重点实验室,重庆市纳米医学工程研究中心
2. State Key Laboratory of Trauma, Burns and Combined Injury, Department of Anti-Radiation Medicine, Chongqing Engineering Research Center for Nanomedicine, Institute of Combined Injury, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
乳腺癌是女性比较常见的恶性肿瘤之一。近年来,其发病率呈现出较快的上升趋势,虽有较多的治疗选择,乳腺癌仍有10%~20% 的死亡率,其主要的死亡原因是癌症的浸润转移[1-2]。目前,放射治疗是各种恶性肿瘤的基础治疗措施之一。据统计,超过50%的癌症患者在患病期间接受放射治疗,其对于提高病患整体存活、改善生活质量有重要贡献[3-5]。然而,诸多基于体外细胞和在体动物实验的研究证据表明电离辐射(ionizing radiation,IR)可以通过多种机制促进肿瘤转移。研究发现,IR可通过对肿瘤细胞的直接作用和对肿瘤微环境的间接影响促进肿瘤上皮-间质转化(epithelial-to-mesenchymal transition, EMT)、侵袭、迁移、血管新生乃至转移[6]。临床研究表明,特定肿瘤在放射治疗后会产生促转移和促侵袭的信号[7]。因此,开展针对IR促进肿瘤转移的机制与防治药物研究具有积极的意义。
柳氮磺吡啶(sulfasalazine, SSZ)为磺胺类抗菌药,临床上广泛用于类风湿性骨关节炎和炎症性肠病的治疗,其作用机制包括抑制NF-κB活性发挥抗炎作用和拮抗胱氨酸转运蛋白体亚基SLC7A11/xCT功能诱导癌细胞铁死亡[8-9]。新近研究表明SSZ通过多种途径抑制肿瘤细胞的转移[10-11],提示其在肿瘤治疗中具有潜在的良好应用前景,但关于SSZ对辐照促进肿瘤转移作用的影响尚不清楚。本研究采用小鼠乳腺癌细胞株4T1和人乳腺癌细胞株MCF-7为研究对象,评价SSZ对IR诱导乳腺癌细胞EMT、迁移、侵袭等表型的影响;并进一步采用4T1细胞乳腺癌肺转移模型评价SSZ对IR促进肿瘤转移的拮抗,以期为IR促进肿瘤转移的药物防治提供基础。
1 材料与方法 1.1 材料 1.1.1 细胞人乳腺癌细胞株MCF-7、小鼠乳腺癌细胞株4T1购自中国科学院典型培养物保藏委员会细胞库,由陆军军医大学全军复合伤研究所实验室保存。
1.1.2 动物5~7周龄BALB/c雌鼠共50只,体质量16~20 g,在陆军军医大学动物实验中心无菌条件下饲养。
1.1.3 主要试剂DMEM培养基、RPMI 1640培养基、胎牛血清购自美国Cytiva公司;电泳凝胶试剂盒、电泳液购自上海雅酶生物医药公司;BCA蛋白浓度测定试剂盒、Vimentin抗体(AF0318)、Snail抗体(AF8013)、β-Tubulin抗体(AF1216)购自上海碧云天生物技术公司;E-cadherin抗体(#3195)购自美国CST公司;MMP2抗体(ab86607)、MMP9抗体(ab283575)、xCT抗体(ab175186)、山羊抗小鼠二抗抗体、山羊抗兔二抗抗体购自英国Abcam公司;丝裂霉素购自美国GEN-VIEW公司;SSZ购自美国MCE公司;Transwell实验试剂盒购自美国CORNING公司;伤口愈合2孔插件购自德国Ibidi公司;结晶紫染色液购自北京索莱宝科技公司。
1.2 方法 1.2.1 细胞培养和分组人乳腺癌细胞株MCF-7培养于90% DMEM高糖培养基+10% 胎牛血清中。小鼠乳腺癌细胞株4T1培养于90% RPMI 1640培养基+10% 胎牛血清+100 U/mL青霉素+100 g/mL链霉素中。所有细胞株培养于37 ℃、5% CO2的恒温培养箱中。使用陆军军医大学中心实验室X射线辐照仪RS2000在160 kV、25 mA的条件下,以1.265 Gy/min的剂量率进行辐照。通过设定X射线(筒称X线)不同照射时间(95、190、285、379、474 s)以达到不同照射剂量(2、4、6、8、10 Gy)。
实验分4组:对照组(Con)、SSZ组、IR组和IR+SSZ组;Con组细胞正常培养,IR组对细胞进行4 Gy的X线照射,SSZ组采用0.5 mmol/L的SSZ处理细胞,IR+SSZ组在对细胞进行4 Gy的X线照射后,采用0.5 mmol/L的SSZ处理细胞。
1.2.2 划痕愈合实验将MCF-7和4T1细胞稀释至6×106/mL,以每孔1 mL均匀接种于6孔板中(伤口愈合2孔插件内接种密度稍大于插件外)。待伤口愈合2孔插件内细胞长至90% 融合后,进行4 Gy的X线照射。照射后立即加入细胞增殖抑制剂丝裂霉素(10 μg/mL)以及SSZ(0.5 mmol/L)孵育2 h。取下伤口愈合2孔插件,形成划痕,并拍照记录划痕线与插件交汇线两侧划痕的宽度(记为0 h数值)。将细胞置于37 ℃、5% CO2的恒温培养箱中培养,24 h后再次原位测量划痕宽度并拍照记录,与0 h数值做比较。使用TScratch软件分析测量划痕面积,24 h划痕面积与0 h划痕面积比值代表划痕愈合面积百分比。
1.2.3 细胞侵袭实验将Transwell小室置于6孔板中,消化MCF-7或4T1细胞至细胞悬液,1 000 r/min离心5 min,用无血清DMEM/ RPMI 1640培养基调整细胞数至1×105/mL,转至Transwell小室,每个小室加入200 μL细胞悬液,在小室下层加入含10%胎牛血清的DMEM/RPMI 1640培养基作为趋化剂。6孔板于培养箱中过夜后进行辐照,辐照后SSZ组于小室内加入0.5 mmol/L的SSZ,孵育48 h,用棉签拭去非侵袭性细胞,采用甲紫(结晶紫)固定并染色,在100倍显微镜下计数细胞。
1.2.4 Western blot检测辐照后48 h取材,于细胞孔板中加入300 μL细胞裂解液,随后收集裂解液于EP管中,将EP管在4 ℃、14 000 r/min的条件下离心10 min后提取上清液,按照BCA法检测定量蛋白后加入蛋白上样缓冲液制备样品。蛋白样品在SDS-PAGE凝胶进行电泳分离,随后转印至PVDF膜,用5% 脱脂奶粉于37 ℃摇床封闭1 h,加入配置好的一抗于4 ℃摇床孵育过夜,使用PBS在摇床上洗膜后,加入配置好的二抗于37 ℃摇床孵育1 h,再次使用PBS在摇床上洗膜,使用奥德赛显色仪显色成像并测量灰度值。
1.2.5 动物模型实验选用5~7周龄BALB/c雌鼠进行小鼠乳腺癌4T1荷瘤实验,小鼠按照体质量顺序编号后随机分为4组:Con组、SSZ组、IR组和IR+SSZ组(每组纳入10~13只小鼠)。小鼠按50 μL/20 g腹腔注射2%戊巴比妥进行麻醉,随后于背部皮下接种4T1细胞(1×105/只),24 h后,SSZ组及IR+SSZ组小鼠于腹腔注射8 mg/只的SSZ(SSZ在每次注射前新鲜配制),其余两组于腹腔注射等体积生理盐水,2次/d,直至处死小鼠。10 d后,用铅板挡住IR组和IR+SSZ组小鼠除肿瘤外的其他身体部位,然后用4 Gy的X线照射肿瘤部位。Con组和SSZ组不做照射处理。
小鼠肺转移结节计数:注射4T1细胞后第30天使用脊椎脱臼法处死小鼠,随后从小鼠气管注射Bouin’s固定液至肺部完全充起,取下肺组织,于PBS液中简单漂洗后置于Bouin’s固定液中固定,24 h后观察小鼠肺转移结节(肺组织表面的白色凸起点状物即为肺转移灶)并计数。
肺组织按常规方法制备蜡块后切片,经脱蜡、复水后进行HE染色,于光学显微镜下观察各组小鼠肺转移灶的病理学改变。
1.3 统计学分析采用GraphPad Prism 8.0统计软件进行分析。计量资料以x±s表示,同一分子在不同辐照剂量下的表达量比较采用t检验,各组间分子表达量的比较、划痕实验、侵袭实验结果及小鼠原位瘤体积和肺转移灶数量的比较采用单因素方差分析。P < 0.05表示差异有统计学意义。
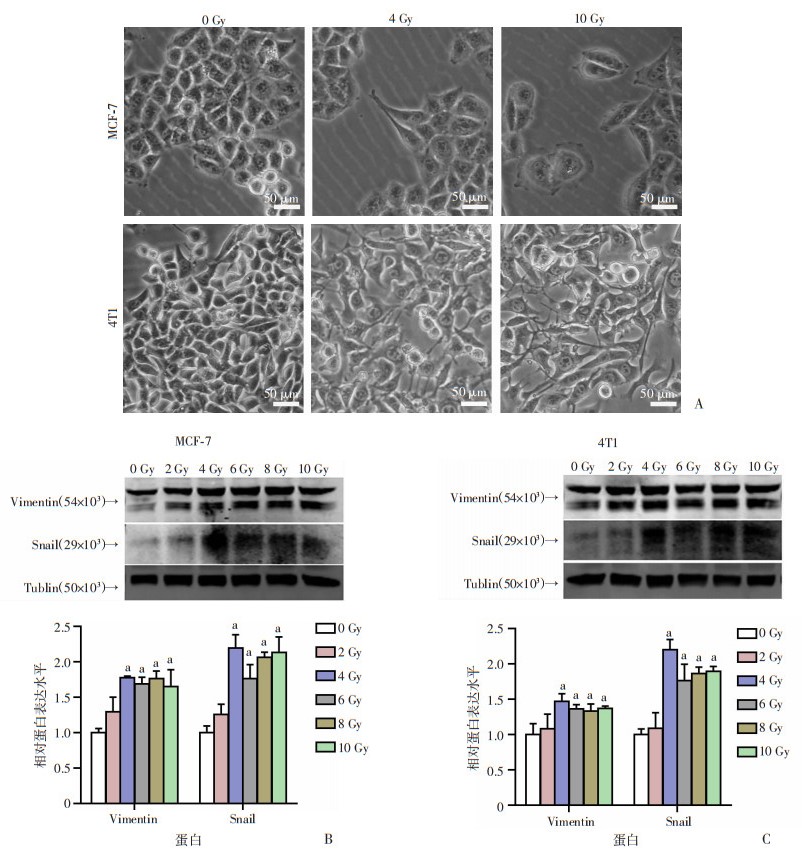
2 结果 2.1 IR诱导乳腺癌细胞MCF-7、4T1发生EMT形态变化以及相关蛋白标志物的表达两种乳腺癌细胞(MCF-7、4T1)在未照射时,细胞形态正常,细胞间连接紧密,呈“铺路石样”(图 1A)。采用2、4、6、8、10 Gy的X线照射后,随着照射剂量的增加,逐渐失去原有的立方形态,出现不同程度的EMT形态学变化;MCF-7细胞变为“摊鸡蛋样”形态,细胞间间隙增大;4T1细胞失去细胞间的紧密接触,细胞向“纺锤样”或多角样演化,形成伪足。Western blot检测EMT相关分子的表达,结果显示,两种乳腺癌细胞均出现间充质蛋白Snail和Vimentin的表达增高,且在4 Gy的照射剂量下较为明显(图 1B、C)。
|
|
a:P < 0.05,与0 Gy组比较 A:X线照射后48 h乳腺癌细胞MCF-7、4T1形态变化;B:Western blot检测不同剂量的X线照射后MCF-7细胞EMT相关分子Vimentin和Snail的表达及半定量分析;C:Western blot检测不同剂量的X线照射后4T1细胞EMT相关分子Vimentin和Snail的表达及半定量分析 图 1 IR对乳腺癌细胞形态的影响及EMT相关分子的Western blot检测结果 |
2.2 SSZ抑制IR诱导的乳腺癌细胞EMT表型
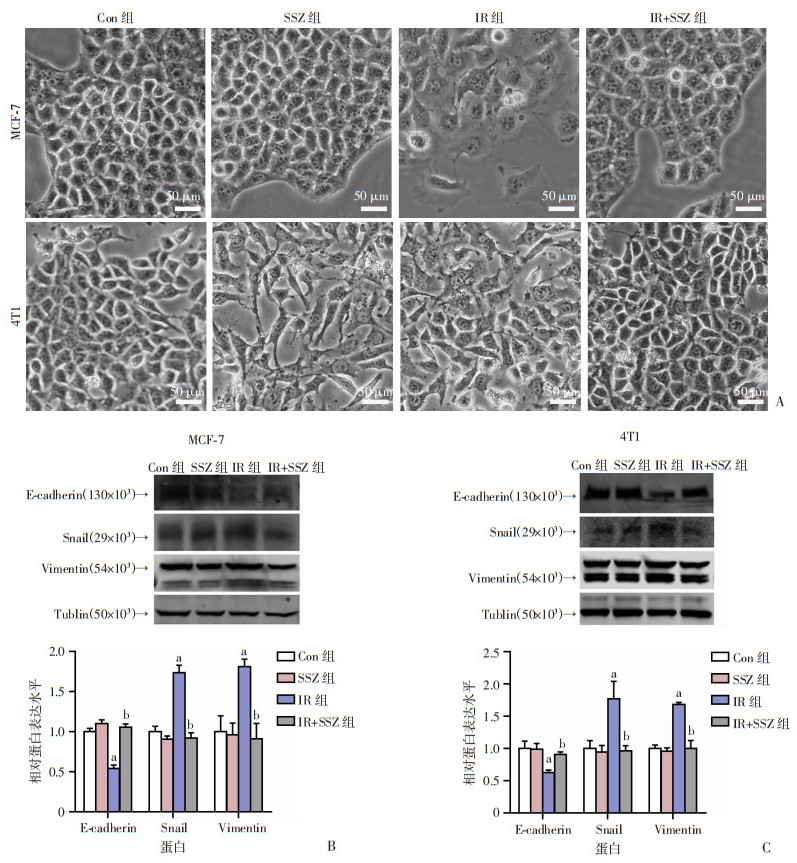
4 Gy的X线分别照射乳腺癌细胞MCF-7和4T1,然后采用SSZ(0.5 mmol/L)处理乳腺癌细胞2 h,观察照射后48 h的形态学改变。结果显示,单纯使用SSZ对细胞形态学变化的影响不明显,而IR促进乳腺癌细胞EMT变化的趋势能够被SSZ显著抑制(图 2A)。Western blot检测乳腺癌细胞EMT相关分子表达的结果显示,与Con组比较,IR组的细胞上皮标志蛋白E-cadherin表达降低(P < 0.05),间充质标志蛋白Vimentin和Snail表达升高(P < 0.05);与IR组比较,IR+SSZ组细胞上皮标志蛋白E-cadherin表达升高(P < 0.05),而间充质标志蛋白Vimentin和Snail表达降低(P < 0.05)。与细胞形态学变化的结果一致,表明SSZ可以抑制IR诱导的乳腺癌细胞EMT(图 2B、C)。
|
|
a:P < 0.05,与Con组比较;b:P < 0.05,与IR组比较 A:4 Gy的X线照射后各组MCF-7、4T1细胞形态变化;B:Western blot检测各组MCF-7细胞EMT相关分子的表达及半定量分析;C:Western blot检测各组4T1细胞EMT相关分子的表达及半定量分析 图 2 IR及SSZ对乳腺癌细胞形态的影响及EMT相关分子的Western blot检测结果 |
2.3 SSZ抑制IR对乳腺癌细胞促迁移和促侵袭的作用
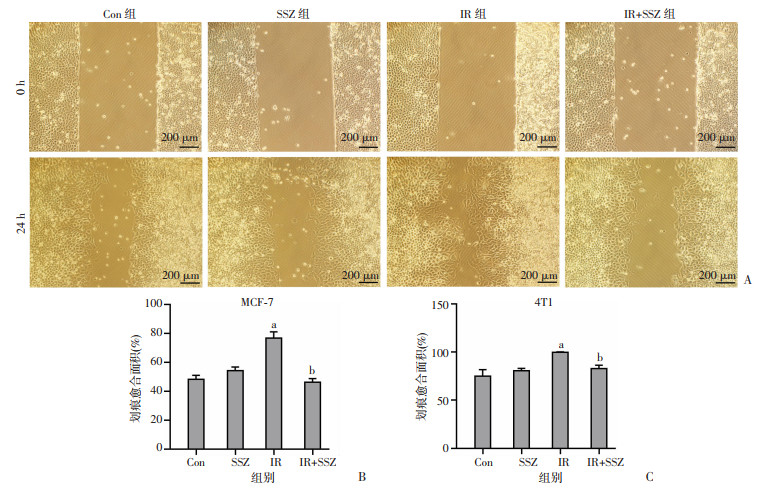
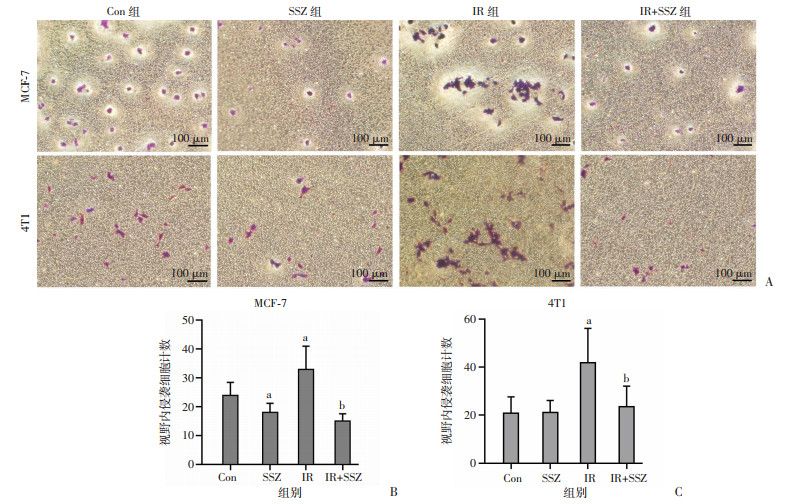
采用划痕实验和Transwell实验分别检测IR后乳腺癌细胞迁移和侵袭能力的变化及SSZ对其的影响。MCF-7细胞划痕实验结果显示(图 3A、B),与Con组比较,IR组细胞的划痕愈合速度增快(P < 0.05);与IR组比较,IR+SSZ组细胞的划痕愈合速度减慢(P < 0.05)。Transwell实验结果与划痕实验结果基本一致(图 4A、B),与Con组比较,SSZ组的细胞侵袭能力降低(P < 0.05),IR组的细胞侵袭能力明显增加(P < 0.05);与IR组比较,IR+SSZ组的细胞侵袭能力显著降低(P < 0.05)。4T1细胞的划痕实验(图 3C)和Transwell实验(图 4A、C)得到类似的结果,IR促进4T1细胞的迁移能力和侵袭能力,而SSZ抑制IR的促迁移、侵袭作用。
|
|
a:P < 0.05,与Con组比较;b:P < 0.05,与IR组比较 A:划痕愈合实验观察各组MCF-7细胞划痕愈合情况;B:各组MCF-7细胞划痕愈合面积;C:各组4T1细胞划痕愈合面积 图 3 IR及SSZ对乳腺癌细胞划痕愈合速度的影响 |
|
|
a:P < 0.05,与Con组比较;b:P < 0.05,与IR组比较 A:细胞侵袭实验观察各组细胞的侵袭能力;B:各组MCF-7细胞的侵袭细胞数;C:各组4T1细胞的侵袭细胞数 图 4 IR及SSZ对乳腺癌细胞侵袭能力的影响 |
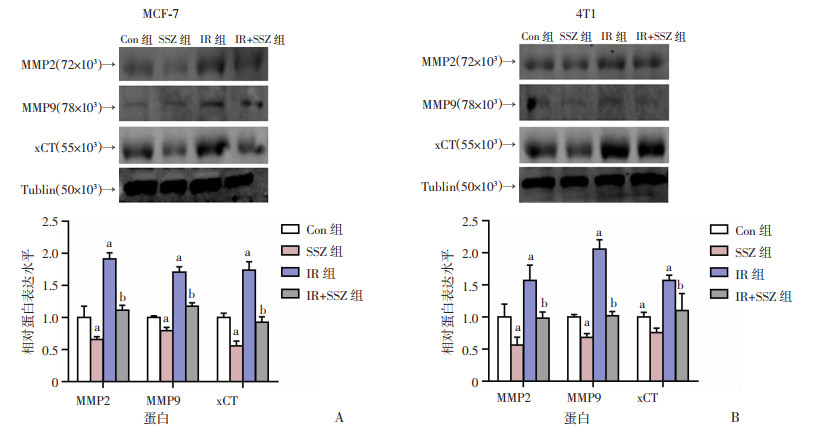
2.4 SSZ抑制转移相关MMP2/9、xCT等分子的蛋白表达
采用Western blot检测各组细胞转移相关分子的表达,结果显示,4 Gy的X线照射明显促进了乳腺癌细胞MMP2/9和xCT的表达,无论是单纯使用SSZ或是IR后使用SSZ,MMP2/9和xCT的表达都被抑制(图 5)。
|
|
a:P < 0.05,与Con组比较;b: P < 0.05,与IR组比较 A:MCF-7细胞MMP2/9和xCT的表达及半定量分析;B: 4T1细胞MMP2/9和xCT的表达及半定量分析 图 5 Western blot检测各组乳腺癌细胞MMP2/9和xCT的表达 |
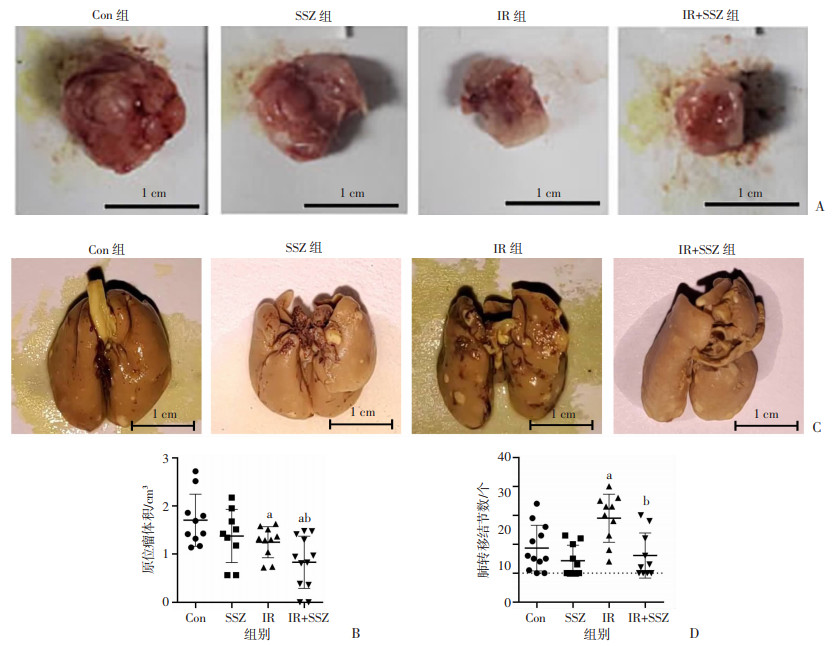
2.5 IR促进小鼠4T1乳腺癌肺转移,SSZ有效抑制IR的促肺转移效应
构建4T1小鼠乳腺癌肺转移的模型以判断IR和SSZ对体内肿瘤模型的影响,如图 6A、B所示,Con组、SSZ组、IR组、IR+SSZ组小鼠原位瘤体积分别为(1.70± 0.54)、(1.37±0.55)、(1.24±0.32)、(0.83±0.54)cm3。与Con组比较,IR组和IR+SSZ组的小鼠原位瘤体积显著降低(P < 0.05),与IR组比较,IR+SSZ组原位瘤体积降低更显著(P < 0.05),而SSZ组原位瘤体积与Con组相比差异无统计学意义。说明IR对原位瘤的生长有明显抑制作用,且SSZ与IR存在协同作用。计数各组小鼠肺转移结节,如图 6C、D所示,Con组、SSZ组、IR组、IR+SSZ组小鼠肺转移结节数分别为(8.67±7.88)、(4.30±5.39)、(19.00±8.31)、(6.10±7.78)个。与Con组比较,SSZ组肺转移结节数变化无统计学差异,而IR组小鼠的肺转移结节数显著增多(P < 0.05),与IR组比较,IR+SSZ组的肺转移结节数显著降低(P < 0.05)。实验结果表明:①4 Gy的X线照射对小鼠原位瘤生长的抑制作用显著,且IR协同SSZ进一步抑制了原位瘤的生长,但4 Gy的X线照射同时促进了小鼠乳腺癌肺转移;②SSZ对小鼠乳腺癌的肺转移无明显抑制作用,但可以显著拮抗IR诱导的促转移效应。
|
|
a:P < 0.05,与Con组比较;b:P < 0.05,与IR组比较 A:各组小鼠原位瘤大体观;B:各组小鼠的原位瘤体积;C:各组小鼠肺转移灶大体观;D:各组小鼠肺部转移结节数 图 6 IR以及SSZ对小鼠原位瘤以及乳腺癌肺转移的影响 |
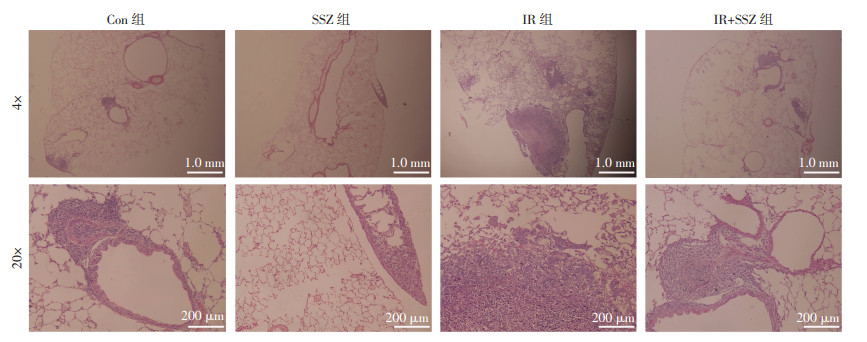
小鼠肺组织各组转移灶的HE染色结果显示,与Con组比较,SSZ组无明显差异,而IR组的肿瘤肺转移灶数量增多,面积增加,边界欠清,有明显弥散的趋势。与IR组比较,IR+SSZ组的肺转移灶数量减少,面积减小,边界清晰(图 7)。
|
| 图 7 HE染色观察各组小鼠肺转移灶形态 |
3 讨论
放射治疗是包括乳腺癌在内的多种恶性肿瘤的基础治疗措施之一,虽然尚缺乏放射治疗是否能促进特定病患肿瘤早期复发、转移的临床试验证据,但基于在体动物的研究表明IR能够通过多种途径促进肿瘤的转移[12-13]。本研究采用乳腺癌细胞的离体细胞模型和在体肺转移模型,评价SSZ对IR诱导肿瘤转移的拮抗作用。结果显示,SSZ能有效抑制IR诱导乳腺癌细胞EMT、迁移、侵袭等转移相关表型,下调MMP2/9、xCT等蛋白表达水平,其作为治疗措施对在体局部照射促进乳腺癌肺转移的作用显示显著拮抗效果。
EMT是指具有极性的上皮样细胞转化为具有活动能力的间质样细胞过程,被认为是肿瘤转移级联反应中早期关键事件,在肿瘤转移侵袭中发挥重要作用。肿瘤细胞通过EMT丢失上皮细胞样表征-极性和细胞间接触等,从而获得迁移能力以侵袭正常的组织和器官,形成癌症的远处转移和复发导致病情恶化[14-15]。
既往研究报道IR能够诱导体外培养肿瘤细胞出现EMT表型[16]。本实验结果与之一致,不同剂量的X线照射可诱导人乳腺癌细胞株MCF-7和小鼠乳腺癌细胞株4T1出现EMT表型。两种乳腺癌细胞4 Gy单次照射即可出现典型EMT表型,因此选取这一剂量开展后续实验研究。与照射引起EMT表型相对应,本研究发现离体细胞4 Gy的X线照射能够促进乳腺癌细胞迁移与侵袭,而在体实验显示荷瘤局部4 Gy的X线照射能显著促进4T1细胞的肺转移,表明IR能够促进肿瘤转移。但需要指出的是:IR促进肿瘤转移与放射治疗促进肿瘤转移是两个概念。临床上放疗的处方剂量虽然单次不大,但连续照射的累积剂量很高,其作用的目的是在尽量减少对正常组织器官损害前提下以IR杀死肿瘤细胞。在放射治疗的作用模式下肿瘤细胞可能出现脱落播散,但这些以EMT或循环肿瘤细胞形式的播散难以产生转移灶。譬如最近有研究发现非小细胞肺癌患者在放疗后不同阶段均存在患者循环肿瘤细胞的显著增多,这些细胞是具有EMT表型、DNA损伤等特征的活细胞,但在体外培养体系增殖能力有限[3]。而本研究显示,4T1乳腺癌荷瘤局部的4 Gy单次照射即可显著使得瘤体积缩小,杀死较多肿瘤细胞,但可促进肿瘤的肺转移。这一结果是单次IR作用的结果,如果以放射治疗的方案将可能在肺部转移之前即将原位瘤全部杀死。
最近研究报道IR可以诱导xCT的表达上调,通过拮抗铁死亡促进细胞存活[17]。先前有报道认为xCT在乳腺癌细胞株的表达水平与EMT密切相关[18],而SSZ能通过抑制xCT逆转EMT表型[19]。由此,我们推测IR诱导肿瘤细胞的转移能力增强表型可能与xCT相关,故而尝试以SSZ为防治药物评价其对IR促进肿瘤转移表型的影响。本研究结果表明,SSZ对乳腺癌细胞株MCF-7和4T1的本身形态及EMT相关分子表达的影响均有限,但能够显著降低IR诱导的Snail、Vimentin等间质蛋白表达,促进E-cadherin等上皮来源蛋白表达,同时可以从形态上部分逆转EMT表型。与之类似,迁移和侵袭实验结果也表明,SSZ对非照射细胞的作用有限,但能显著抑制IR诱导的促转移相关表型。新近研究报道,SSZ在具有典型间质特征的乳腺癌细胞MDA-MB-231能够抑制其EMT表型[18],与本研究仅在照射细胞起作用的结果不尽相同,可能与本研究采用的细胞具有典型上皮特征有关。
本研究初步探讨SSZ抑制电离辐射诱导的乳腺癌细胞EMT、迁移、侵袭等转移相关表型增强的可能机制。发现IR能促进基质金属蛋白酶MMP2/9、xCT等蛋白水平的表达,而SSZ能抑制上述蛋白的基础水平和辐射诱导后的表达。研究表明IR诱导表达的基质金属蛋白酶对于IR促进肿瘤转移发挥了重要作用,而SSZ可以通过抑制NF-κB活性下调其表达[20-21],在本实验体系可能存在类似的机制。xCT的水平与肿瘤细胞的转移能力密切相关,作为xCT抑制剂的SSZ发挥拮抗肿瘤转移的作用或与此有关。然而,到底何种因素在SSZ抑制IR诱导乳腺癌细胞增强的转移相关表型中发挥核心关键作用,尚待更加深入系统的研究。需要指出的是,虽然SSZ能够抑制上述分子在乳腺癌细胞的基础表达水平,但对未照射细胞的迁移、侵袭表型影响有限,提示其发挥作用或有其他机制存在。
与离体细胞的实验结果一致,SSZ治疗在动物实验中也显示较好效果。将4T1乳腺癌细胞在背部皮下进行接种荷瘤会出现肺部转移,而4 Gy单次荷瘤局部照射后能够显著促进肺部转移。SSZ能够显著抑制IR导致的肺部转移促进作用。照射的两组小鼠原位瘤大小均显著降低,但SSZ组比单纯照射的IR组瘤体积降低更显著,提示二者在杀伤肿瘤细胞方面存在协同作用。SSZ能够显著降低原位瘤局部照射导致的肺转移结节数目,但其与未照射小鼠在肺转移结节数目上差异无统计学意义。鉴于本实验仅采用1个给药剂量,而SSZ本身具有较宽泛的安全剂量,后续的量效关系值得进一步摸索。需要指出的是,虽然SSZ治疗对未照射肿瘤显示出减少原位瘤体积和肺转移结节数目的趋势,但差异没有统计学意义。
综上所述,本研究表明SSZ显示出较好的抑制IR诱导乳腺癌细胞株EMT、迁移、侵袭等转移相关表型的作用,其作为治疗措施对在体局部照射乳腺癌的肺转移促进作用具有显著拮抗效果,提示其或可作为肿瘤放射治疗时联合用药以降低潜在的肿瘤转移风险。
作者贡献声明:贺戈参与设计研究方案,实验操作,采集、清理以及分析数据,撰写论文;汪国建参与实验,采集、清理以及分析数据;赵娜和龙爽参与实验;王涛提出研究思路,设计研究方案,采集、清理以及分析数据,论文修改;明佳提出研究思路,设计研究方案,论文修改。
| [1] |
LIU C, LI Z, XU L, et al. GALNT6 promotes breast cancer metastasis by increasing mucin-type O-glycosylation of α2M[J]. Aging (Albany NY), 2020, 12(12): 11794-11811. |
| [2] |
LIU S R, WANG L, ZHANG R. Corylin suppresses metastasis of breast cancer cells by modulating miR-34c/LINC00963 target[J]. Libyan J Med, 2021, 16(1): 1883224. |
| [3] |
马娜, 曲宝林, 解传滨, 等. 肿瘤精确放射治疗技术的发展与挑战[J]. 中国医疗设备, 2021, 36(12): 149-153. MA N, QU B L, XIE C B, et al. Development and challenge of precise radiotherapy for cancer[J]. China Med Devices, 2021, 36(12): 149-153. |
| [4] |
KANTAPAN J, PAKSEE S, DUANGYA A, et al. A radiosensitizer, gallotannin-rich extract from Bouea macrophylla seeds, inhibits radiation-induced epithelial-mesenchymal transition in breast cancer cells[J]. BMC Complement Med Ther, 2021, 21: 189. |
| [5] |
LEE J, KIM W C, YOON W S, et al. Implications of radiotherapy utilization in Korea from 2010 to 2019[J]. J Korean Med Sci, 2021, 36(18): e117. |
| [6] |
SUNDAHL N, DUPREZ F, OST P, et al. Effects of radiation on the metastatic process[J]. Mol Med, 2018, 24(1): 16. |
| [7] |
MARTIN O A, ANDERSON R L, RUSSELL P A, et al. Mobilization of viable tumor cells into the circulation during radiation therapy[J]. Int J Radiat Oncol Biol Phys, 2014, 88(2): 395-403. |
| [8] |
唐瑞, 徐苏颖, 杨男, 等. 中药组方联合美沙拉嗪/柳氮磺吡啶治疗溃疡性结肠炎有效性及安全性的系统评价[J]. 中国医院药学杂志, 2021, 41(20): 2113-2120. TANG R, XU S Y, YANG N, et al. Effect and safety of traditional Chinese medicine formulaplus mesalazine/salazosulfapyridine for ulcerative colitis: a systematic review and Meta-analysis[J]. Chin J Hosp Pharm, 2021, 41(20): 2113-2120. |
| [9] |
MA M Z, CHEN G, WANG P, et al. Xc-inhibitor sulfasalazine sensitizes colorectal cancer to cisplatin by a GSH-dependent mechanism[J]. Cancer Lett, 2015, 368(1): 88-96. |
| [10] |
ZHENG Z J, LUO G H, SHI X C, et al. The Xc-inhibitor sulfasalazine improves the anti-cancer effect of pharmacological vitamin C in prostate cancer cells via a glutathione-dependent mechanism[J]. Cell Oncol (Dordr), 2020, 43(1): 95-106. |
| [11] |
SHAMAA M M. Sulfasalazine synergistically enhances the inhibitory effects of imatinib against hepatocellular carcinoma (HCC) cells by targeting NFκB, BCR/ABL, and PI3K/AKT signaling pathway-related proteins[J]. FEBS Open Bio, 2021, 11(3): 588-597. |
| [12] |
ZHENG Z Y, JIA S F, SHAO C S, et al. Irradiation induces cancer lung metastasis through activation of the cGAS-STING-CCL5 pathway in mesenchymal stromal cells[J]. Cell Death Dis, 2020, 11(5): 326. |
| [13] |
BOUCHARD G, THERRIAULT H, BUJOLD R, et al. Induction of interleukin-1β by mouse mammary tumor irradiation promotes triple negative breast cancer cells invasion and metastasis development[J]. Int J Radiat Biol, 2017, 93(5): 507-516. |
| [14] |
LVÖND F, SUGIYAMA N, BILL R, et al. Distinct contributions of partial and full EMT to breast cancer malignancy[J]. Dev Cell, 2021, 56(23): 3203-3221. |
| [15] |
MA J, LI J J, WANG Y, et al. WSZG inhibits BMSC-induced EMT and bone metastasis in breast cancer by regulating TGF-β1/Smads signaling[J]. Biomed Pharmacother, 2020, 121: 109617. |
| [16] |
SHIN S W, CHOI C, KIM H, et al. MnTnHex-2-PyP 5+, coupled to radiation, suppresses metastasis of 4T1 and MDA-MB-231 breast cancer via AKT/snail/EMT pathways[J]. Antioxidants (Basel), 2021, 10(11): 1769. |
| [17] |
LEI G, ZHANG Y L, KOPPULA P, et al. The role of ferroptosis in ionizing radiation-induced cell death and tumor suppression[J]. Cell Res, 2020, 30(2): 146-162. |
| [18] |
郑雪婷, 赵飞, 赵瑞, 等. xCT调节乳腺癌细胞转移的作用机制研究[J]. 军事医学, 2015, 39(5): 334-338, 363. ZHENG X T, ZHAO F, ZHAO R, et al. Molecular mechanism of metastasis in breast adenocarcinoma regulated by xCT[J]. Mil Med Sci, 2015, 39(5): 334-338, 363. |
| [19] |
YU H C, YANG C C, JIAN L, et al. Sulfasalazine-induced ferroptosis in breast cancer cells is reduced by the inhibitory effect of estrogen receptor on the transferrin receptor[J]. Oncol Rep, 2019, 42(2): 826-838. |
| [20] |
YUE H Y, HU K, LIU W Q, et al. Role of matrix metalloproteinases in radiation-induced lung injury in alveolar epithelial cells of Bama minipigs[J]. Exp Ther Med, 2015, 10(4): 1437-1444. |
| [21] |
WU Q, ZHOU X Q, LI P, et al. ROC1 promotes the malignant progression of bladder cancer by regulating p-IκBα/NF-κB signaling[J]. J Exp Clin Cancer Res, 2021, 40(1): 158. |




