肾移植是治疗终末期肾脏疾病(end stage renal disease,ESRD)患者的优先选择,开放肾移植术(open kidney transplantation,OKT)是目前的金标准[1]。随着外科微创化技术时代的进步,机器人辅助腹腔镜肾移植术(robotic-assisted kidney transplantation, RAKT)逐渐成为更多移植中心的选择[2],但是RAKT手术在国内仍然推广缓慢,与学术界对该手术的安全性和有效性存在争议有关。本研究回顾性分析本科室2018年6月至2022年3月进行肾移植患者的资料,比较4例RAKT患者和10例OKT患者围手术期的安全性和有效性,以期为肾移植患者临床治疗决策提供参考。
1 资料与方法 1.1 临床资料纳入2018年6月至2022年3月陆军特色医学中心泌尿外科进行肾移植的患者14例,其中男性8例,女性6例,年龄22~45岁。纳入标准:终末期肾病患者,肾小球滤过率<20 mL·min-1·1.73 m-2;排除标准:①腹部大手术史;②骼血管严重硬化患者。本研究获得陆军特色医学中心伦理委员会审批[医研伦审(2022)第112号]。根据手术方式分为2组,RAKT组:男性2例,女性2例,中位年龄28 (22~33)岁,采用机器人辅助腹腔下亲属肾移植;OKT组:男性6例,女性4例,中位年龄35 (27~45)岁,采用尸体供肾开放肾移植手术。两组受者在体质量指数(BMI)、术前血肌酐、术前e-GFR等差异无统计学意义(表 1)。RAKT组4例均为左侧供肾,OKT组左侧供肾6例,两组左右侧供肾未见明显差异。
| 组别 | n | BMI/kg·m-2 | 术前血肌酐/μmol·L-1 | 术前e-GFR/mL·min-1·1.73m-2 |
| OKT组 | 10 | 20.9±2.7 | 931.3±226.5 | 7.3±2.6 |
| RAKT组 | 4 | 22.2±7.4 | 976.2±146.1 | 6.7±1.7 |
| P值 | 0.63 | 0.79 | 0.66 |
1.2 手术方式
RAKT组:采用美国Intuitive Surgical公司达芬奇机器人Xi系统,手术方式参照文献[3]。患者取截石位,头低脚高。作6 cm绕脐腹部中切口,用多功能腹腔镜Port封闭切口并作为镜头孔。距脐部右侧12 cm、左侧8 cm及16 cm分别做8 mm切口作为机器人手术系统1、2、3臂的机械臂孔,1臂内上方、内下方8 cm分别作12、5 mm切口作为辅助孔。充分游离髂外动静脉,沿右侧腹壁切开腹膜,上至回盲部上方约3 cm,下至脐正中韧带下方,预备肾窝(图 1A)。将供肾放入自制薄膜肾袋内,乳胶套包裹块状冰围绕肾周(图 1B)。将移植肾经腹部多功能Port置入腹腔,使肾血管朝向髂血管,输尿管朝向膀胱。使用血管阻断夹阻断右髂外静脉,采用CV-6缝合线分别将供肾静脉、动脉与右髂外静脉、动脉行端侧吻合(图 1C、D)。开放肾静、动脉,输尿管采用黏膜隧道法行输尿管膀胱吻合,管内留置F6双J管(图 1E)。将肾脏翻转置入肾窝,倒刺线关闭原腹膜(图 1F),在盆腔及肾周分别置入引流管后,实现肾脏腹膜外化。
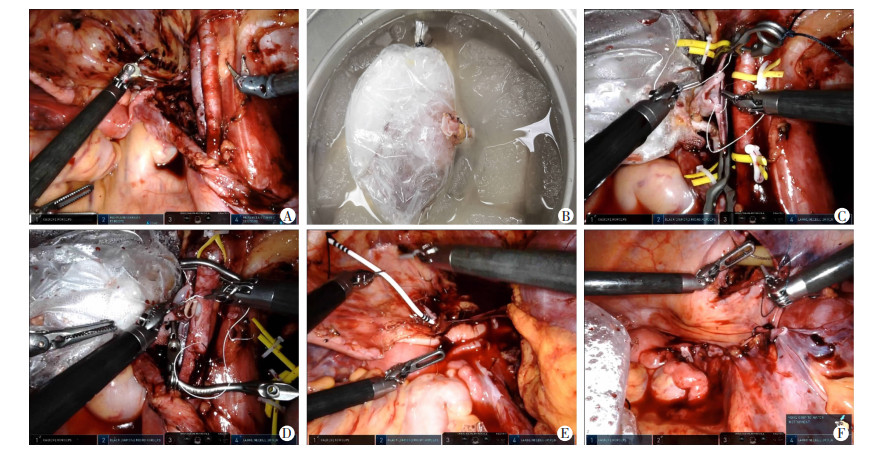
|
| A:游离髂血管及预备肾窝;B:移植肾装入冰袋内;C:缝合静脉;D:缝合动脉;E:输尿管膀胱再植;F:移植肾腹膜外化 图 1 RAKT手术示意图 |
OKT组:按照指南[4]采用右侧腹直肌旁弧形切口,显露腹外斜肌腱膜,平腹直肌鞘外侧缘切开,剪开腹横筋膜见腹膜,充分游离髂外动、静脉。供肾装入肾袋后肾静脉与髂外静脉5-0无损伤血管缝线连续锁边缝合,肾动脉与髂外动脉用6-0无损伤血管缝线行连续外翻缝合。开放肾静、动脉,检查无明显出血后,移植肾的输尿管与膀胱黏膜吻合。移植肾上、下极分别留置1根引流管后,逐层关闭切口。
1.3 观察指标比较RAKT组与OKT组之间的动脉吻合时间、静脉吻合时间、术中出血量、输血比例、肾周引流管留置时间、术后住院时间、术后并发症及术后3、7 d血肌酐值。
1.4 统计学分析采用SPSS 18.0统计软件处理数据。计量资料以x±s表示,组间比较采用t检验;计数资料以例(%)表示,组间比较采用χ2检验。以P < 0.05为差异有统计学意义。
2 结果 2.1 围手术期结果14例患者手术均顺利完成,RAKT组动脉吻合时间为(32.5±6.5)min,OKT组为(24.3±5.3)min,两组动脉吻合时间差异无统计学意义(P=0.07);两组静脉吻合时间差异也无统计学意义(P=0.06);RAKT组术中出血量(162.5±47.8)mL,显著低于OKT组(P=0.02);RAKT组引流管留置时间(P=0.01)、术后住院时间(P < 0.01)均显著短于OKT组;见表 2。RAKT组有1例术中输血,OKT组有9例术中输血(P < 0.01)。
| 组别 | n | 动脉吻合时间/min | 静脉吻合时间/min | 术中出血量/mL | 术后住院时间/d | 引流管留置时间/d | 术后3 d血肌酐(μmol/L) | 术后7 d血肌酐(μmol/L) | 术中输血/例 |
| OKT组 | 10 | 24.3±5.3 | 14.6±1.5 | 245.1±68.5 | 16.3±2.1 | 10.0±1.2 | 259.6±73.2 | 142.8±42.1 | 9 |
| RAKT组 | 4 | 32.5±6.5 | 16.5±3.8 | 162.5±47.8 | 13.0±2.5 | 6.5±0.5 | 155.5±49.2 | 98.1±33.2 | 1 |
| P值 | 0.07 | 0.06 | 0.02 | 0.01 | < 0.01 | 0.02 | 0.08 | < 0.01 |
2.2 术后并发症发生情况
RAKT组患者术后恢复均良好,尤其是1例超重患者(BMI 33.08 kg/m2)未出现伤口脂肪液化,4例患者均在术后第3天下床活动,无并发症发生。OKT组患者术后2例发生并发症,其中1例因术后出现伤口脂肪液化,愈合延迟;另1例因严重的膀胱痉挛出现术后漏尿,再次行输尿管膀胱再植术,术后2个月恢复正常。其余供受者术后均恢复良好。两组患者术后并发症发生率差异有统计学意义(P < 0.01)。
2.3 术后移植肾功能情况RAKT组术后3 d血肌酐水平为(155.5±49.2)μmol/L,显著低于OKT组(P=0.02);术后7 d两组血肌酐水平差异无统计学意义(P=0.08),见表 2。术后3 d肾功能恢复存在统计学差异,与RAKT组肾脏本身都是健康人体获取有直接关系,随着时间的延长和病例数的增加,两组的长期肾功能恢复无明显差异。
3 讨论 3.1 RAKT的适应人群自从2010年美国伊利诺斯大学GIULIANOTTI教授等[4]实施世界上首例完整的RAKT手术后,国外多个移植中心陆续报道了超过100台的RAKT手术[5],与OKT手术比较,结果显示两组移植肾功能、肾功能延迟恢复发生率、移植肾存活率等差异均无统计学意义,机器人辅助肾移植组则在术中出血、术后伤口感染等并发症方面显著优于OKT组。解放军总医院于2018年率先在国内报道RAKT成功案例,随后在华西医院、昆明市第一人民医院等单位顺利开展[6]。既往RAKT手术推荐适用于BMI > 40 kg/m2的患者[7]。这类患者由于脂肪厚度影响了血管吻合,同时脂肪液化导致的术后切口感染率发生较高。这类超胖患者在中国人群中偏低,移植肾术后肌酐与BMI密切相关[8]。本组1例RAKT受者BMI达到33.08 kg/m2,术后切口未发生感染,但移植术后肌酐波动在150~180 μmol/L。因此,我们建议RAKT手术可选取BMI < 30 kg/m2患者,利于移植肾的长期存活。
3.2 RAKT移植肾动静脉和输尿管吻合方式的优劣RAKT最大的优势就是动静脉的吻合,相对于开放手术,达芬奇机器人的可转腕手术器械拥有7个自由度,更适合在骨盆等狭窄区域操作[6]。如在泌尿外科的全膀胱切除、前列腺等手术中,机械腕比人手更为灵活;主刀者通过三维高分辨率腔镜,能够获得立体的高清晰图像,利用达芬奇机器的滤除颤抖功能,使得主刀通过机器腕在吻合肾脏动静脉时更准确和稳定,大大减少了术中的出血量,本组4例受者均未术中输血。同时RAKT对于动静脉的长短要求较OKT大幅降低。由于右肾静脉短,OKT一般选择左侧供肾,从而降低手术难度,既往通过后腹腔镜下的腔静脉钳可提高右侧供肾的获取率[9],但术者需有长期的腹腔镜吻合技术经验。在RAKT手术中移植肾可以放置在髂外动静脉旁,同时右侧髂窝较左侧更接近体表,因此采用RAKT手术对于左右侧的选择可能更加灵活。RAKT的这个优势可能更利于如输尿管损伤后的自体肾移植手术,该技术能降低因为血管吻合困难而导致的肾脏丢失[10]。目前根据报道机器人辅助肾移植主要排除标准中有骼血管严重硬化的患者。这可能跟机器人的机械腕不能很好地游离髂内动脉有关。这部分患者仍然需要OKT行移植肾动脉与髂内动脉的端端吻合。因此,术前髂血管的CT三维重建利于对患者的全面评估。
传统OKT常采用Lich输尿管膀胱再植技术,虽然技术成熟,但是在输尿管与膀胱吻合完全前,肾周的渗出、尿液等可能影响术者仔细分辨输尿管与膀胱的黏膜,导致术后漏尿、输尿管狭窄或双J管的误缝合等并发症[3]。本研究中OKT组1例受者因术后漏尿再次行输尿管膀胱再植术,术后2个月患者恢复正常。RAKT中输尿管膀胱再植由于气腹压力,促使尿液等液体持续向引流袋中灌注,维持输尿管与膀胱黏膜吻合时的清晰视野,减少了上述并发症的出现。
3.3 机器人辅助腹腔镜肾移植的低温保护一般公认肾脏的热缺血时间不超过30 min,同时移植肾处于20 ℃的温缺血状态可提供最大程度的肾保护[11]。因此,RAKT中采取何种低温保护技术,维持移植肾的低温环境,一直是国内外泌尿外科医生关注的热点。初期开展RAKT的单位,医生与护理等保障团队之间需要更多的配合熟练。传统的腹腔镜下肾脏低温保护技术主要通过肾周放置冰屑、肾动脉低温灌注和肾盂逆行低温灌注3种方式,其中肾周冰屑降温技术简单可靠[12]。国内外普遍采用改进的Menon技术:用冰纱布垫包裹移植肾放入腹腔,术中间歇性添加冰屑维持移植肾的低温环境,延长温缺血时间[13-14]。有研究报道冰水透过纱布垫流入腹腔刺激肠道,导致麻痹性肠梗阻需手术治疗[14]。为此,本研究参考文献[3]将移植肾装入封闭塑料袋,肾周用薄膜套装入块状冰,在肾蒂处剪一开口,经通道装入腹腔。该方法操作简单,对手术视野遮挡较小,但助手通过Gelport持续添加冰屑,影响手术进程。目前有研究报道使用自制的通道维持肾周低温[15],但该方法对于肾脏核心区域降温不够确定,值得更多的探索和研究。
3.4 RAKT手术的医师培训RAKT自报道以来,经过十多年的发展,其安全性和可靠性逐步被移植医生接受。一方面由于机器人手术需要医生、护理团队经过专业的培训和获取资质,国内外这类医院需要优先购置昂贵的机器人等配套设备。目前国内的机器人装机量约260台,同时具有移植资质的医院和医师就更少;另一方面机器人培训资质常先进行一定数量的腹腔镜培训,再经过一定数量RAKT的学习历练[16]。这种培训模式拉长了机器人肾移植医师的培训年限,本团队机器人手术医师自2017年至今进行了超过500台的机器人下前列腺、肾部分切除等手术经验为基础。因此,如何快速、有效的培训合格的RAKT手术医师,是进一步推广RAKT手术的举措之一。
综上,本研究初步证实RAKT手术在围手术期具有出血少、短期并发症少、患者恢复快等优点。但纳入例数较少,后续将增加病例数进一步验证RAKT手术能否逐步取代传统开放手术。
志谢 感谢解放军总医院泌尿外科张旭院士对本单位开展RAKT手术的悉心指导| [1] |
AUGUSTINE J. Kidney transplant: new opportunities and challenges[J]. Cleve Clin J Med, 2018, 85(2): 138-144. |
| [2] |
SPIERS H V M, SHARMA V, WOYWODT A, et al. Robot-assisted kidney transplantation: an update[J]. Clin Kidney J, 2021, 15(4): 635-643. |
| [3] |
赵鉴明, 范阳, 陈欣, 等. 机器人辅助腹腔镜同种异体肾移植术的早中期结果[J]. 微创泌尿外科杂志, 2021, 10(2): 80-83. ZHAO J M, FAN Y, CHEN X, et al. Early and mid-term results of robot-assisted laparoscopic kidney transplantation[J]. J Minim Invasive Urol, 2021, 10(2): 80-83. |
| [4] |
GIULIANOTTI P, GORODNER V, SBRANA F, et al. Robotic transabdominal kidney transplantation in a morbidly obese patient[J]. Am J Transplant, 2010, 10(6): 1478-1482. |
| [5] |
AHLAWAT R, SOOD A, JEONG W, et al. Robotic kidney transplantation with regional hypothermia versus open kidney transplantation for patients with end stage renal disease: an ideal stage 2B study[J]. J Urol, 2021, 205(2): 595-602. |
| [6] |
林涛. 机器人辅助手术系统在肾移植中的应用[J]. 器官移植, 2022, 13(1): 1-5. LIN T. Application of robot assisted surgical system in kidney transplantation[J]. Organ Transplant, 2022, 13(1): 1-5. |
| [7] |
SPAGGIARI M, LENDACKI F R, DI BELLA C, et al. Minimally invasive, robot-assisted procedure for kidney transplantation among morbidly obese: positive outcomes at 5 years post-transplant[J]. Clin Transplant, 2018, 32(11): e13404. |
| [8] |
TANGDHANAKANOND K, MANDELBROT D. Evaluation of high-risk living kidney donors[J]. Front Biosci (Elite Ed), 2015, 7(1): 158-167. |
| [9] |
ZHONG X, HUANG C B, LI L K, et al. Endo-satinsky clamp hybrid in situ perfusion in retroperitoneoscopic donor nephrectomy for right-sided kidney[J]. Urology, 2019, 130: 191-195. |
| [10] |
DECAESTECKER K, VAN PARYS B, VAN BESIEN J, et al. Robot-assisted kidney autotransplantation: a minimally invasive way to salvage kidneys[J]. Eur Urol Focus, 2018, 4(2): 198-205. |
| [11] |
NELSON R J, DAGENAIS J, MAURICE M J, et al. Robotic cold ischemia achieves comparable functional outcomes to open cold ischemia during partial nephrectomy for complex kidney tumors[J]. Urol Ann, 2018, 10(4): 386-390. |
| [12] |
NAYA Y, KAWAUCHI A, YONEDA K, et al. A comparison of cooling methods for laparoscopic partial nephrectomy[J]. Urology, 2008, 72(3): 687-689. |
| [13] |
PRUDHOMME T, BEAUVAL J B, LESOURD M, et al. Robotic-assisted kidney transplantation in obese recipients compared to non-obese recipients: the European experience[J]. World J Urol, 2021, 39(4): 1287-1298. |
| [14] |
ABAZA R, GHANI K R, SOOD A, et al. Robotic kidney transplantation with intraoperative regional hypothermia[J]. BJU Int, 2014, 113(4): 679-681. |
| [15] |
谭顺成, 崔建春, 宋永琳, 等. 机器人辅助腹腔镜肾移植术初步经验(附22例报告)[J]. 微创泌尿外科杂志, 2021, 10(3): 157-162. TAN S C, CUI J C, SONG Y L, et al. Preliminary experience of robot-assisted laparoscopic kidney transplantation(report of 22 cases)[J]. J Minim Invasive Urol, 2021, 10(3): 157-162. |
| [16] |
SOOD A, GHANI K R, AHLAWAT R, et al. Application of the statistical process control method for prospective patient safety monitoring during the learning phase: robotic kidney transplantation with regional hypothermia (IDEAL phase 2a-b)[J]. Eur Urol, 2014, 66(2): 371-378. DOI: 10.1016/j.eururo.2014.02.055.https://pubmed.ncbi.nlm.nih.gov/24631408/
|




