成人生长激素缺乏症(adult growth hormone deficiency, AGHD)是一组常见于下丘脑-垂体轴损害的内分泌疾患,其临床表现具有非特异性[1-4]。生长激素(growth hormone, GH)替代治疗可使AGHD患者在多方面获益,由于AGHD的漏诊率较高,故正确诊断AGHD对后续开展替代治疗具有重要意义[1-2, 5-6]。GH存在脉冲式分泌的特点,单次随机血清GH不能用于AGHD的诊断。胰岛素低血糖激发试验(insulin tolerance test,ITT)是诊断AGHD的金标准[2, 7-9]。ITT过程中指南推荐注射剂量(0.1~0.15 U/kg)后血糖 <2.2 mmol/L或者血糖<2.6 mmol/L且低于基线的50%视为ITT激发成功,即充分低血糖[8];本课题组的实际操作中观察到体质指数(body mass index, BMI)且基线血糖较高的受试者,更容易出现ITT激发失败,即出现不充分低血糖,这可能与胰岛素抵抗相关;考虑BMI简单易测,且BMI一定程度上可反映胰岛素抵抗[10-13],故本研究旨在研究ITT出现不充分低血糖的影响因素, 同时提出BMI切点值,以更好地预测不充分低血糖的发生。
1 对象与方法 1.1 研究对象选取2010年1月至2021年12月于重庆医科大学附属第一医院内分泌科门诊及住院部就诊的可疑AGHD患者416例, 其中男121例,女295例,均行ITT。根据单次注射胰岛素后低血糖是否充分将416例患者分为充分低血糖组(n=321)和不充分低血糖组(n=95)。纳入标准:①患有器质性下丘脑-垂体疾病;②曾接受垂体瘤手术或有垂体瘤放疗史;③创伤性脑损伤;④产后大出血病史;⑤不明原因月经紊乱、性腺功能减退及骨质疏松者。排除标准:①其他垂体激素替代过度或不足;②心脑血管疾病及癫痫患者;③严重高血压患者;④颅内高压者;⑤严重肝肾功能障碍者;⑥精神疾病患者以及妊娠期女性;⑦哺乳期患者;⑧糖尿病患者;⑨低血糖症患者。本研究已通过重庆医科大学附属第一医院伦理委员会审查(2022-K324)。
1.2 方法 1.2.1 基础资料收集受试者的性别、年龄、身高、体质量、BMI等基础数据,询问受试者基础疾病、是否使用激素替代治疗情况等。
1.2.2 生化检查所有受试者于空腹状态抽取静脉血,完善肝肾功、血脂、垂体激素、糖化血红蛋白(glycosylated hemoglobin A1c, HbA1c)等实验室检查。
1.2.3 ITT行ITT前一天受试者清淡进食,晚上8点后禁饮禁食。行ITT当天早上,受试者在空腹、平静状态下仰卧于床, 由医护人员建立静脉通道和心电监护仪,静脉推注生物合成人胰岛素0.1~0.15 U/kg后记录胰岛素剂量,分别于注射前30 min、注射前0 min及注射后30、45、60、90、120 min采静脉血, 进行血糖、GH检测。如出现低血糖症状,需记录时间并检测血糖、GH。密切监测心率、血压和有无低血糖症状。将注射胰岛素后血糖 < 2.2 mmol/L或血糖 < 2.6 mmol/L且低于基线血糖的50%视为激发成功。
1.3 统计学分析所有统计学分析在SPSS 22.0及R 4.0.0软件中进行。经Shapiro-Wilk检验,数据均为非正态性分布,计量资料以M(P25, P75)表示,组间比较采用非参数秩和检验;采用Spearman相关性分析检验相关性,并采用散点图及局部加权回归(local weighted regression,Lowess)曲线表示二者关联,方差膨胀因子(variance inflation factor,VIF)>5的指标剔除防止多重共线性;采用多因素Logistic回归分析,纳入单因素分析中P < 0.05的指标,采用逐步回归方法筛选自变量,得到不充分低血糖的影响因素;采用受试者工作特征(receiver operating characteristic, ROC)曲线分析相关指标对不充分低血糖的预测价值,计算约登指数得出各自的切点值。P < 0.05为差异有统计学意义。
| 基本资料 | 充分低血糖组(n=321) | 不充分低血糖组(n=95) | P |
| 女/男(例) | 244/77 | 51/44 | < 0.001 |
| 年龄/岁 | 37.00(28.00, 45.00) | 44.00 (32.00, 52.00) | 0.001 |
| BMI/kg·m-2 | 21.40(19.56, 23.60) | 25.82(24.24, 27.70) | < 0.001 |
| 首次胰岛素剂量/U | 8.10(6.48, 9.52) | 11.00(9.00, 14.20) | < 0.001 |
| 基线血糖/mmol·L-1 | 5.00(4.60, 5.40) | 5.40(5.20, 6.00) | < 0.001 |
| 基线GH/ng·mL-1 | 0.22(0.06, 1.13) | 0.07(0.03, 0.17) | < 0.001 |
| GH峰值/ng·mL-1 | 2.16(0.35, 5.25) | 2.02(0.21, 4.00) | 0.282 |
| 空腹胰岛素/μU·mL-1 | 5.30(3.11, 7.27) | 15.72(11.28, 19.73) | < 0.001 |
| HbA1c(%) | 5.40(5.20, 5.60) | 5.50(5.30, 5.90) | 0.003 |
| TSH/ng·mL-1 | 2.40(1.28, 3.64) | 2.07(1.19, 3.21) | 0.124 |
| COR/nmol·L-1 | 235.93(182.00, 320.26) | 234.04(179.16, 341.62) | 0.537 |
| ACTH/pg·mL-1 | 19.84(15.03, 27.09) | 21.37(15.83, 29.32) | 0.164 |
| LDL-C/mmol·L-1 | 2.46(2.00, 3.10) | 3.20(2.48, 3.52) | < 0.001 |
| HDL-C/mmol·L-1 | 1.27(1.03, 1.60) | 1.14(0.88, 1.32) | < 0.001 |
| TC/mmol·L-1 | 4.56(3.70, 5.35) | 4.61(3.75, 5.65) | 0.255 |
| TG/mmol·L-1 | 1.11(0.89, 1.80) | 1.42(0.98, 2.39) | 0.008 |
| ALT/U·L-1 | 18.00(13.00, 24.00) | 21.00(14.00, 28.00) | 0.090 |
| AST/U·L-1 | 20.00(16.00, 27.00) | 19.00(16.00, 26.00) | 0.455 |
| Cr/nmol·L-1 | 56.00(51.50, 64.00) | 56.00(50.00,67.00) | 0.906 |
2 结果 2.1 两组患者的临床资料比较
充分低血糖组受试者性别分布为男性77例、女性244例,不充分低血糖组受试者性别分布为男性44例、女性51例;充分低血糖组的年龄、BMI、首次胰岛素剂量、基线血糖、基线GH、空腹胰岛素、HbA1c、低密度脂蛋白胆固醇(low density lipoprotein cholesterin, LDL-C)、甘油三酯(triglyceride,TG)均低于不充分低血糖组(P < 0.05);高密度脂蛋白胆固醇(high density lipoprotein cholesterin, HDL-C)高于不充分低血糖组,以上差异均有统计学意义(P < 0.05,表 1)。促甲状腺激素(thyroid stimulating hormone, TSH),皮质醇(cortisol, COR),促肾上腺皮质激素(adrenocorticotropic hormone, ACTH),总胆固醇(total cholesterol, TC),丙氨酸氨基转移酶(alanine aminotransferase, ALT),天门冬氨酸氨基转移酶(aspartate aminotransferase, AST),肌酐(creatinine, Cr)均没有统计学意义(表 1)。
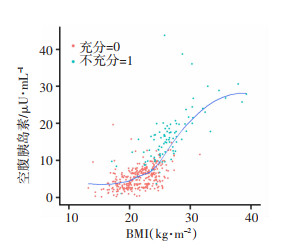
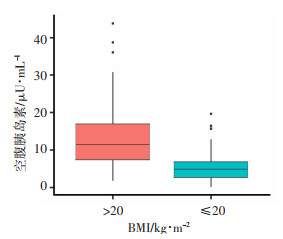
2.2 BMI与空腹胰岛素之间的关系不充分低血糖绝大部分与胰岛素抵抗相关联,而空腹胰岛素是胰岛素抵抗的重要指标。BMI与空腹胰岛素关联分析发现,随BMI的增加,空腹胰岛素呈上升趋势;充分低血糖组BMI≥24所占比例为19.94%,不充分低血糖组中BMI≥24所占比例为83.16%(表 2);在不充分低血糖组中,随BMI增加空腹胰岛素增长较快,表示这部分人群胰岛素抵抗与BMI显著关联(图 1)。箱线图显示在超重人群中空腹胰岛素显著高于正常人群(图 2)。
| 组别 | n | BMI<24 | BMI≥24 | 合计 |
| 充分低血糖组 | 321 | 257(80.06) | 64(19.94) | 321(100) |
| 不充分低血糖组 | 95 | 16(16.84) | 79(83.16) | 95(100) |
| 合计 | 416 | 273 | 143 | 416 |
|
| 图 1 BMI与空腹胰岛素相关性散点图及Lowess曲线 |
|
| 图 2 BMI分层箱线图 |
2.3 不充分低血糖影响因素的多因素Logistic回归分析
以低血糖是否充分为因变量(不充分=1,充分=0),排除多重共线性后纳入性别、年龄、BMI、基线血糖、基线GH、HbA1c、LDL-C、HDL-C、TG为自变量进行多因素Logistic回归分析,采用逐步回归筛选自变量,结果显示BMI、基线血糖、LDL-C、HDL-C均有统计学意义(P < 0.05,表 3);性别、年龄、基线GH、TG均无统计学意义。
| 因素 | β | SE | Wald | P | OR(95% CI) |
| BMI/kg·m-2 | 0.551 | 0.075 | 53.647 | <0.001 | 1.735(1.497~2.010) |
| 基线血糖/mmol·L-1 | 0.922 | 0.241 | 14.589 | <0.001 | 2.515(1.567~4.036) |
| LDL-C/mmol·L-1 | 0.702 | 0.177 | 15.72 | <0.001 | 2.018(1.426~2.856) |
| HDL-C/mmol·L-1 | -0.982 | 0.451 | 4.747 | 0.029 | 0.375(0.155~0.906) |
2.4 相关指标对不充分低血糖的预测价值
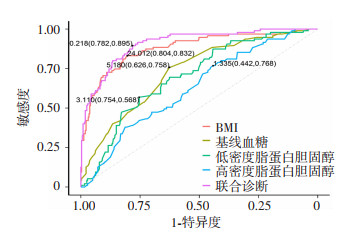
将BMI、基线血糖、LDL-L、HDL-C进行预测价值分析,结果显示BMI预测不充分低血糖的ROC曲线下面积(area under the ROC curve, AUC)为0.880,采用约登指数计算此时BMI切点值为24.012,敏感度为0.832,特异度为0.804;基线血糖预测不充分低血糖的AUC为0.730, 采用约登指数计算此时基线血糖切点值为5.180 mmol/L,敏感度为0.758,特异度为0.626;LDL-C预测不充分低血糖的AUC为0.700, 采用约登指数计算此时LDL-C切点值为3.110 mmol/L,敏感度为0.568,特异度为0.754;HDL-C预测不充分低血糖的AUC为0.627, 采用约登指数计算此时HDL-C切点值为1.335 mmol/L,敏感度为0.768,特异度为0.442;四者联合诊断预测不充分低血糖的AUC为0.909, 敏感度为0.895,特异度为0.782(图 3)。联合诊断的公式为logit(低血糖是否充分)=0.551×BMI+0.922×基线血糖+0.702×LDL-C-0.982×HDL-C-20.016。
|
| 图 3 相关指标预测不充分低血糖的ROC曲线 |
3 讨论
AGHD临床表现具有非特异性,如身体成分异常改变、糖耐量异常、血脂异常[1-4]等,故正确诊断具有挑战性。生长激素由腺垂体分泌,与下丘脑-垂体-肾上腺轴(hypothalamic-pituitary-adrenal axis,HPA axis)共同由下丘脑进行调控,故ITT不仅是诊断AGHD的金标准[2, 7-9],也可以一定程度上反应HPA轴的功能[14-15]。临床上单次注射胰岛素后出现不充分低血糖的比例较高,为提高ITT激发成功率, 本研究组对不充分低血糖的影响因素进行研究,并探讨不充分低血糖的BMI切点值,对后续临床应用具有一定意义。
有关ITT不充分低血糖的影响因素目前研究结论尚不太一致。多个研究发现BMI、胰岛素释放曲线下面积、收缩压、胰岛素抵抗、基线血糖、胰岛素剂量等因素是不充分低血糖的影响因素[9, 14, 16-18];本研究同样证实以上结论,但是目前尚未提出联合检测的指标。本研究纳入416例患者行ITT, 并分析不充分低血糖的影响因素,并得出BMI切点值。结果表明高BMI、高基线血糖、高LDL-C、低HDL-C是不充分低血糖的影响因素,同时发现BMI、基线血糖、LDL-C、HDL-C联合检测对不充分低血糖有较高的预测价值。
不充分低血糖主要与患者的胰岛素抵抗相关[9, 18]。既往研究已证实胰岛素抵抗与BMI、血脂异常相关, 高BMI、高LDL-C可能会加快胰岛素抵抗的发展并可能会相互促进[10-13]。本研究证实BMI与空腹胰岛素明显相关,这从侧面证实BMI与胰岛素抵抗具有较强的关联。同时,本研究发现BMI是不充分低血糖的影响因素,使用ROC曲线探讨BMI切点值对不充分低血糖的预测价值,结果表明BMI预测不充分低血糖的AUC为0.880,约登指数计算此时BMI切点值为24.012。故建议BMI>24.012 kg/m2的受试者可适当增加首次胰岛素注射剂量,有效诱发低血糖,避免追加胰岛素。
本研究结果显示,血脂同样与不充分低血糖相关,考虑受胰岛素抵抗影响[13]。血脂、肥胖与胰岛素敏感性三者互相关联,均为代谢综合征的一部分,影响不充分低血糖的发生。尽管本研究建立的联合模型预测不充分低血糖的能力较单一BMI预测更好,但两者间的AUC相差有限,且联合模型在应用上难以进行精准的判断,而单一BMI预测在临床上使用更简便,由此,认为BMI单一预测对于临床具有更高的价值。有研究发现ITT用于临床较为安全,不良事件少[14, 19];也有研究发现ITT会导致小儿出现低钾血症,严重者甚至死亡[20-21]。以上研究中出现严重低血糖的受试者均为儿童,故在对老年人及儿童行ITT时应更加慎重,严格排除ITT禁忌证。本课题组在所行的ITT中未发现受试者有严重不良反应。故在排除禁忌证、做好试验前宣教及准备、规范ITT操作流程的前提下,ITT较为安全。
本研究尚有不足之处:①本研究为回顾性研究,需要更大样本的队列或前瞻性研究进行验证;②本研究为单中心研究,受试者大部分是中国西南地区人群,存在一定选择性偏倚。
综上所述,高BMI、高基线血糖、高LDL-C水平、低HDL-C水平均为不充分低血糖的影响因素,四者联合检测和BMI单一指标均对不充分低血糖有较高的预测价值,值得临床借鉴。可重新考虑ITT胰岛素注射剂量,建议BMI切点值以上的受试者适当增大胰岛素剂量以诱发有效低血糖。
| [1] |
MOLITCH M E, CLEMMONS D R, MALOZOWSKI S, et al. Evaluation and treatment of adult growth hormone deficiency: an endocrine society clinical practice guideline[J]. J Clin Endocrinol Metab, 2011, 96(6): 1587-1609. |
| [2] |
GUPTA V. Adult growth hormone deficiency[J]. Indian J Endocrinol Metab, 2011, 15(Suppl 3): S197-S202. |
| [3] |
BURMAN P, MATTSSON A F, JOHANNSSON G, et al. Deaths among adult patients with hypopituitarism: hypocortisolism during acute stress, and de novo malignant brain tumors contribute to an increased mortality[J]. J Clin Endocrinol Metab, 2013, 98(4): 1466-1475. |
| [4] |
GASCO V, FERRERO A, BISCEGLIA A, et al. The cut-off limits of growth hormone response to the insulin tolerance test related to body mass index for the diagnosis of adult growth hormone deficiency[J]. Neuroendocrinology, 2021, 111(5): 442-450. |
| [5] |
SIMPSON H, SAVINE R, SÖNKSEN P, et al. Growth hormone replacement therapy for adults: into the new millennium[J]. GrowthHorm IGF Res, 2002, 12(1): 1-33. |
| [6] |
SVENSSON J, BENGTSSON B A, ROSÉN T, et al. Malignant disease and cardiovascular morbidity inhypopituitary adults with or without growth hormone replacement therapy[J]. J Clin Endocrinol Metab, 2004, 89(7): 3306-3312. |
| [7] |
GABREANU G R. An update on the diagnosis of growth hormone deficiency[J]. Discoveries (Craiova), 2018, 6(1): e82. |
| [8] |
中华医学会内分泌学分会. 成人生长激素缺乏症诊治专家共识(2020版)[J]. 中华内分泌代谢杂志, 2020, 36(12): 995-1002. Branch of Endocrinology of Chinese Medical Association. Expert consensus on diagnosis and treatment of adult growth hormone deficiency(2020)[J]. Chin J Endocrinol Metab, 2020, 36(12): 995-1002. |
| [9] |
张豫文, 孙首悦, 陈宇红, 等. 关于优化胰岛素低血糖-生长激素刺激试验中胰岛素用量计算方法的初步探索[J]. 中华内分泌代谢杂志, 2017(1): 29-33. ZHANG Y W, SUN S Y, CHEN Y H, et al. Optimizing the method in calculating the insulin dosages in the insulin hypoglycemia-growth hormone stimulation test: preliminary exploration[J]. Chin J Endocrinol Metab, 2017(1): 29-33. |
| [10] |
王敏. BMI和胰岛素抵抗在非糖尿病人群中的关系研究[D]. 长春: 吉林大学, 2021. WANG M. Study on the associations between BMI and insulin resistance in non-diabetic population[D]. Changchun: Jilin University, 2021. |
| [11] |
MVLLER-WIELAND D, KOTZKA J. Correction of insulin resistance and the metabolic syndrome[J]. Handb Exp Pharmacol, 2005(170): 591-617. |
| [12] |
KAHN B B, FLIER J S. Obesity and insulin resistance[J]. J Clin Invest, 2000, 106(4): 473-481. |
| [13] |
MALIK S U F, MAHMUD Z, ALAM J, et al. Relationship among obesity, blood lipids and insulin resistance in Bangladeshi adults[J]. Diabetes Metab Syndr, 2019, 13(1): 444-449. |
| [14] |
AJALA O, LOCKETT H, TWINE G, et al. Depth and duration of hypoglycaemia achieved during the insulin tolerance test[J]. Eur J Endocrinol, 2012, 167(1): 59-65. |
| [15] |
SARLOS S, INDER W J. Selective use of the insulin tole rance test to diagnose hypopituitarism[J]. Intern Med J, 2013, 43(1): 89-93. |
| [16] |
LEE P, GREENFIELD J R, HO KK Y. Factors determining inadequate hypoglycaemia during insulin tolerance testing (ITT) after pituitary surgery[J]. Clin Endocrinol (Oxf), 2009, 71(1): 82-85. |
| [17] |
LANGE M, SVENDSEN O L, SKAKKEBAEK N E, et al. An audit of the insulin-tolerance test in 255 patients with pituitary disease[J]. Eur J Endocrinol, 2002, 147(1): 41-47. |
| [18] |
TAKAHASHI K, NAKAMURA A, MIYOSHI H, et al. Factors associated with an inadequate hypoglycemia in the insulin tolerance test in Japanese patients with suspected or proven hypopituitarism[J]. Endocr J, 2017, 64(4): 387-392. |
| [19] |
李林蔓, 任伟, 李金超, 等. ITT试验的诊断价值及安全性观察[J]. 解放军医学杂志, 2012, 37(4): 346-349. LI L M, REN W, LI J C, et al. Clinical observation of diagnostic value and safety of insulin tolerance test[J]. Med J Chin PLA, 2012, 37(4): 346-349. |
| [20] |
BINDER G, BOSK A, GASS M, et al. Insulin tolerance test causes hypokalaemia and can provoke cardiac arrhythmias[J]. Horm Res, 2004, 62(2): 84-87. |
| [21] |
SHAH A, STANHOPE R, MATTHEW D. Hazards of pharmac- ological tests of growth hormone secretion in childhood[J]. BMJ, 1992, 304(6820): 173-174. |




