急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)是急性肺损伤最严重的阶段,其平均病死率为30%~40%[1-2]。在ARDS的晚期,持续性肺泡损伤、修复、重建和过度的细胞外基质沉积导致肺纤维化[3]。有研究表明肺纤维化的程度与ARDS的预后和死亡率密切相关[4-6]。此外,内皮功能障碍导致内皮细胞(endothelial cells,EC)损伤和血管生成受损,也被认为是ARDS发病机制中的重要致病机制。然而,导致纤维增生性ARDS的因素以及这种病理反应的潜在机制仍不清楚。内皮-间质转化(endothelial-to-mesenchymal transition,EndMT) 是成纤维细胞的来源之一[7-8]。内皮细胞在此过程中其细胞骨架开始变化,细胞间黏附力下降,最终转化为梭型的成纤维细胞[9]。抑制EndMT、恢复EC功能,可有效缓解ARDS的发病进程。
隐丹参酮(cryptotanshinone,CTS)是从丹参根中提取的一种脂溶性化合物,不仅具有抗氧化、抗炎症和抗纤维化等多种药理活性[10],还能逆转上皮间质转化(epithelial-mesenchymal transition,EMT)过程[11]。EndMT早于EMT发生[12],我们推测CTS可以改善ARDS患者的早期肺纤维化。因此,本研究通过气管滴注脂多糖(lipopolysaccharide,LPS)制作ARDS小鼠模型,以验证CTS是否可通过EndMT减轻ARDS小鼠的早期肺纤维化。
1 材料与方法 1.1 实验动物分组及ARDS模型构建8周龄SPF级雄性C57BL/6小鼠,体质量18~25 g,购自重庆医科大学实验动物中心。将C57BL/6J小鼠适应性喂养7 d后随机分为①正常组(Control):腹腔注射等量无菌磷酸盐缓冲液(phosphate-buffered saline,PBS);②模型组(LPS):气管滴注LPS(5 mg/kg)造模,7 d后处死小鼠;③处理组(CTS+LPS):LPS建模前腹腔注射CTS(60 mg/kg)预处理3 d,建模完成后连续予以7 d;④CTS组(CTS):腹腔注射等量CTS。每天记录1次每只小鼠的体质量及生存情况。末次给药24 h后处死小鼠,结束实验,并收集支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)和肺组织以备后续实验使用。
1.2 主要试剂隐丹参酮购于美国Med Chem Express公司;脂多糖、BCA试剂盒、羟脯氨酸试剂盒购于北京索莱宝科技有限公司;SDS-PAGE凝胶配制试剂盒、极超敏ECL化学发光试剂盒购于上海碧云天生物技术有限公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG抗体购于武汉三鹰生物技术有限公司;甘油醛-3-磷酸脱氢(GAPDH)抗体购于南京巴傲得生物科技有限公司;兔抗CD31、波形蛋白(Vimentin)、α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)购于美国Cell Signaling Technology公司;兔抗VE-cadherin购于美国Invitrogen公司。
1.3 肺组织病理学检查末次给药24 h后,腹腔注射1%戊巴比妥钠(50 mg/kg)麻醉小鼠,充分暴露胸腔,取各组右肺组织,利用4%多聚甲醛固定24 h后包埋在石蜡中,肺组织切片后用HE和Masson染色,显微镜下观察肺组织的病理变化。参照肺损伤评分和肺纤维化评分标准进行评分[13-14]。
1.4 肺组织湿/干质量(wet-to-dry,W/D) 比值取小鼠右肺称取湿质量,然后将肺组织置于干燥箱中,60 ℃干燥48 h,称取干质量。根据前后称量结果计算肺组织的W/D。
1.5 BALF中总细胞和蛋白浓度以及炎症相关细胞因子检测经气管注射1 mL冰磷酸盐缓冲液(PBS)灌洗左肺,30 s后缓慢回抽,重复3次,将收集到的BALF,在4 ℃下以1 500 r/min离心15 min,留取BALF离心后的沉淀用于总细胞计数,上清分别应用BCA试剂盒检测蛋白浓度和ELISA试剂盒测定BALF上清中TNF-α、IL-6、IL-1β、IL-10、TGF-β1的含量。
1.6 羟脯氨酸(hydroxyproline,HYP)含量测定将肺组织称重并尽量剪碎以便消化。严格按照试剂盒说明书操作,读取各孔560 nm波长处光密度值D(560),并通过公式计算出待测样品的含量。
1.7 免疫组化(immunocytochemistry,IHC)检测EndMT表达取肺组织石蜡切片,脱蜡、水化、抗原修复、阻断内源性过氧化酶,一抗4 ℃孵育过夜,二抗室温孵育50 min,显色、复染、脱水、透明、封片,显微镜下观察,用Image J软件分析蛋白的相对表达量。
1.8 Western blot检测EndMT标志蛋白表达称取适量肺组织制备成组织匀浆,置于冰冷组织裂解液,在4℃下以12 000 r/min离心10 min,取上清液。采用BCA进行蛋白定量,调整蛋白浓度。配置浓缩胶和分离胶,电泳后转膜至PVDF膜,封闭1 h。一抗4 ℃孵育过夜,二抗常温孵育1 h。超敏发光液显影曝光,Image J软件系统对蛋白条带灰度值进行分析。
1.9 统计学方法应用GraphPad Prism 9.0软件进行统计分析,数据以x±s表示,各组间的比较采用单因素方差分析,样本均数间的比较采用LSD-t检验。P < 0.05表示差异具有统计学意义。
2 结果 2.1 CTS对ARDS小鼠生存曲线及体质量变化的影响与正常组比较,模型组小鼠的生存率和体质量均在气管滴注LPS后均明显下降(P < 0.05);与模型组比较,处理组小鼠的生存率和体质量均明显上升(P < 0.05)。见图 1。
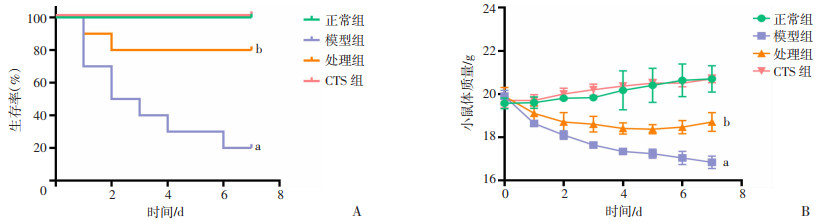
|
|
a:P < 0.05,与正常组比较;b:P < 0.05,与模型组比较 A:CTS对ARDS小鼠生存率影响;B:CTS对ARDS小鼠体质量影响 图 1 小鼠7 d生存率和体质量分析 (n=3,x±s) |
2.2 CTS对ARDS小鼠肺损伤的影响
正常组小鼠肺组织保持正常组织结构,未见明确炎症细胞浸润。与正常组比较,模型组小鼠肺组织大量炎性细胞浸润,肺泡结构广泛破坏,肺泡毛细血管充血扩张,小鼠肺损伤评分、肺组织W/D、BALF中细胞总数及蛋白浓度明显升高(P < 0.05);与模型组比较,处理组小鼠的肺组织病变较模型组明显减轻,肺泡结构有所恢复,炎症细胞浸润减少,小鼠肺损伤评分、肺组织W/D、BALF中细胞总数及蛋白浓度明显下降(P < 0.05)。见图 2。
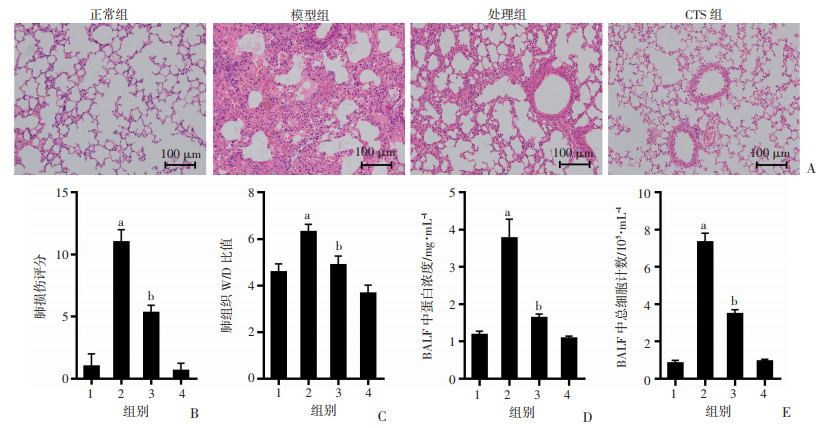
|
|
a:P < 0.05,与正常组比较;b:P < 0.05,与模型组比较; 1:正常组;2:模型组;3:处理组;4:CTS组 A:HE染色观察肺组织病理学改变;B:肺损伤评分;C:肺组织W/D比值;D:BALF中蛋白浓度;E:BALF中总细胞计数 图 2 CTS对ARDS小鼠肺损伤的影响 (n=3,x±s) |
2.3 CTS对ARDS小鼠BALF中炎性细胞因子和促纤维化细胞因子的影响
与正常组比较,模型组小鼠BALF中促炎因子(TNF-α、IL-6、IL-1β)和促纤维化因子TGF-β1分泌量显著升高,抗炎因子(IL-10)分泌量显著减少(P < 0.05);与模型组比较,处理组可明显降低促炎因子(TNF-α、IL-6、IL-1β)和促纤维化因子(TGF-β1),增加抗炎因子(IL-10)的分泌量(P < 0.05)。见图 3。
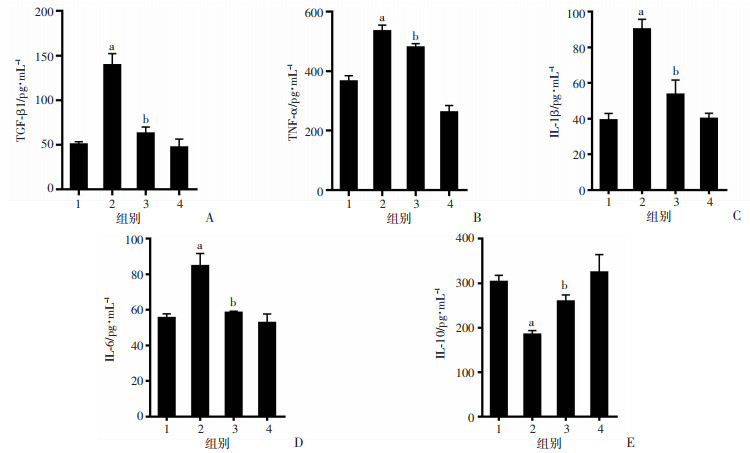
|
|
a:P < 0.05,与正常组比较;b:P < 0.05,与模型组比较; 1:正常组;2:模型组;3:处理组;4:CTS组 A:TGF-β1水平;B:TNF-α水平;C:IL-1β水平;D:IL-6水平;E:IL-10水平 图 3 CTS对ARDS小鼠BALF中炎症因子和促纤维化因子的影响 (n=3,x±s) |
2.4 CTS对ARDS小鼠早期肺纤维化的影响
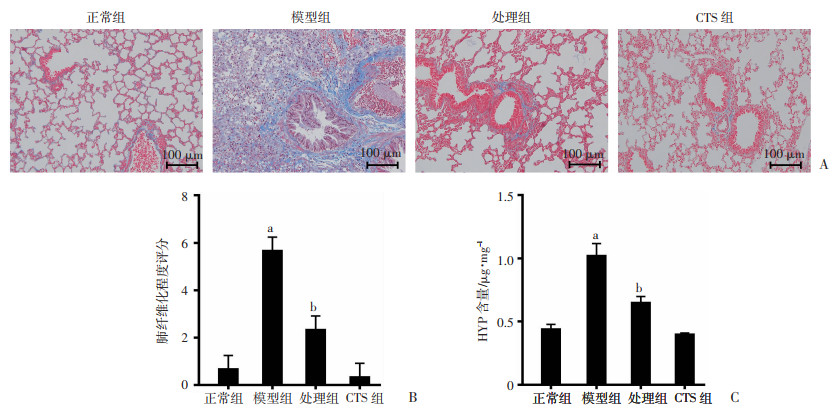
正常组小鼠肺组织保持正常组织结构,未见纤维组织增生性改变。模型组可见纤维组织增生;处理组小鼠的肺组织未见纤维组织增生。见图 4A。
|
|
a:P < 0.05,与正常组比较;b:P < 0.05,与模型组比较 A:Masson染色观察小鼠肺组织病理学改变;B:肺纤维化程度评分;C:HYP含量 图 4 CTS对ARDS小鼠早期肺病理性纤维增生的影响 (n=3,x±s) |
与正常组比较,模型组小鼠纤维化严重程度评分显著升高(P < 0.05);与模型组比较,处理组纤维化严重程度评分显著降低(P < 0.05)。见图 4B。
2.5 CTS对ARDS小鼠肺组织HYP含量的影响与正常组比较,模型组肺组织HYP水平均显著升高(P < 0.05);与模型组比较,处理组HYP水平均明显下降(P < 0.05)。见图 4C。
2.6 CTS对ARDS小鼠肺组织中CD31、α-SMA蛋白表达的影响与正常组比较,模型组小鼠肺组织中CD31阳性表达显著减弱,α-SMA阳性表达显著增强(P < 0.05);与模型组比较,处理组CD31阳性表达出现上调,α-SMA阳性表达出现下调(P < 0.05),见图 5。

|
| 图 5 IHC观察CTS对小鼠肺组织CD31和α-SMA表达的影响 |
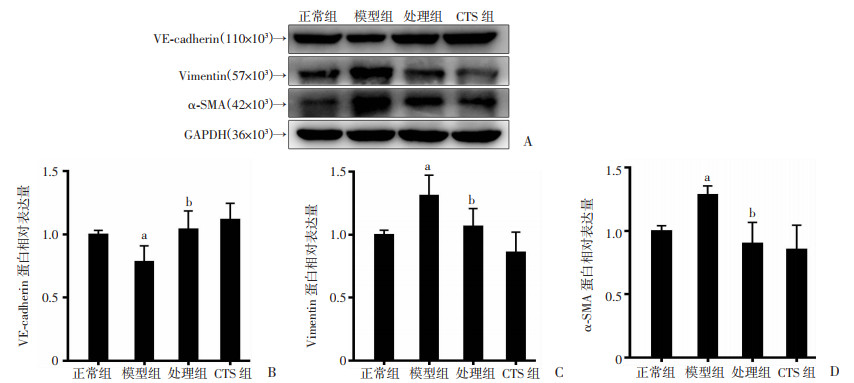
2.7 CTS对ARDS小鼠肺组织中VE-cadherin、Vimentin、α-SMA蛋白表达的影响
与正常组比较,模型组小鼠肺组织中Vimentin、α-SMA蛋白水平均显著升高,VE-cadherin蛋白水平显著降低(P < 0.05);与模型组比较,处理组均可明显抑制Vimentin、α-SMA蛋白水平的表达和减缓VE-cadherin蛋白水平的表达(P < 0.05),见图 6。
|
|
a:P < 0.05,与正常组比较;b:P < 0.05,与LPS模型组比较 A:各组小鼠肺组织Western blot检测结果;B:VE-cadherin蛋白相对表达量;C:Vimentin蛋白相对表达量;D:α-SMA蛋白相对表达量 图 6 隐丹参酮对内皮间质转化标志物相关蛋白的影响 (n=3,x±s) |
3 讨论
2019冠状病毒疾病(Corona Virus Disease 2019,COVID-19)在全球范围内相继爆发,其感染人数不断上升,其中重症患者最终发展为ARDS[15]。尽管许多患者在ARDS的急性病程中幸存下来,但仍有部分患者死于进行性肺纤维化[16]。此外,ARDS患者早期出现肺纤维增生性改变已成为与患者预后不良、高死亡率和患者长期生命质量相关的关键因素[17]。然而,目前的研究中仍缺乏特异性治疗来减少ARDS肺部炎症反应和降低肺部病理性纤维化。
丹参及其有效成分在治疗间质性肺病方面已被广泛研究。例如,丹参酮ⅡA可减少小鼠因脂多糖诱导引起的炎症反应和胶原沉积[18]。除此之外,丹酚酸B可阻断TGF-β1诱导的成纤维细胞增殖和肌成纤维细胞分化[2]。但丹参及其有效成分是否在ARDS中发挥治疗作用,尚未见报道。CTS是从丹参根中提取的一种脂溶性化合物,在心血管疾病尤其是动脉粥样硬化[19]和心脏纤维化[20-21]中具有广泛的治疗作用。在本研究中,我们成功地在小鼠体内构建了LPS诱导的ARDS模型[22],在LPS诱导后,肺组织充满大量炎症细胞,纤维组织增生,W/D重量比、BALF中蛋白质浓度和总细胞计数以及促炎因子分泌增加,抗炎因子分泌减少。本研究结果中促纤维化因子的增加和各实验组羟脯氨酸(HYP)浓度的显著差异也表明LPS诱导小鼠ARDS后出现早期肺纤维化。我们的研究结果进一步表明,CTS可以通过调节肺损伤、炎症反应、早期肺纤维化、羟脯氨酸(HYP)含量来改善LPS诱导的ARDS。因此,CTS对ARDS小鼠的炎症反应和早期肺纤维化具有一定的保护性作用。
ARDS的致病特点是内皮异常激活和损伤[23]。在ARDS的早期,肺微血管内皮细胞首先受到影响。ARDS的重要发病机制是内皮受损导致内皮修复和血管生成功能障碍[1]。新近研究认为ARDS急性病程中肺内皮细胞的抵抗力低于肺上皮细胞[24],并且肺内皮细胞是成纤维细胞的主要来源之一[25-26]。因此,我们认为在ARDS早期进行修复肺血管内皮功能障碍的治疗对患者而言更有价值。本研究结果表明,经LPS诱导后,小鼠内皮细胞标志物(CD31、VE-cadherin)水平显著降低,间质细胞标志物(Vimentin、α-SMA)水平升高;而CTS的治疗有效改善了这一过程,提示CTS可以通过抑制EndMT过程以减轻ARDS后的肺纤维化。
综上所述,我们发现ARDS小鼠的体质量曲线和生存率在CTS治疗后有了显著的上升,其次CTS可以通过抑制EndMT过程减缓肺纤维化的进展,并显著降低ARDS小鼠早期的死亡率。这些发现可能为治疗ARDS和预防ARDS后早期肺纤维化提供新的治疗方法。
| [1] |
MATTHAYM A, ZEMANS R L, ZIMMERMAN G A, et al. Acute respiratory distress syndrome[J]. Nat Rev Dis Primers, 2019, 5(1): 18. |
| [2] |
LIUQ M, CHU H Y, MA Y Y, et al. Salvianolic acid B attenuates experimental pulmonary fibrosis through inhibition of the TGF-β signaling pathway[J]. Sci Rep, 2016, 6: 27610. |
| [3] |
HAMACHER J, LUCAS R, LIJNENH R, et al. Tumor necrosis factor-alpha and angiostatin are mediators of endothelial cytotoxicity in bronchoalveolar lavages of patients with acute respiratory distress syndrome[J]. Am J Respir Crit Care Med, 2002, 166(5): 651-656. |
| [4] |
RAGHU G, COLLARDH R, EGAN J J, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management[J]. Am J Respir Crit Care Med, 2011, 183(6): 788-824. |
| [5] |
MARSHALL R, BELLINGAN G, LAURENT G. The acute respiratory distress syndrome: fibrosis in the fast lane[J]. Thorax, 1998, 53(10): 815-817. |
| [6] |
DHAINAUTJ F, CHARPENTIER J, CHICHE J D. Transforming growth factor-beta: a mediator of cell regulation in acute respiratory distress syndrome[J]. Crit Care Med, 2003, 31(4 Suppl): S258-S264. |
| [7] |
MAN S, SANCHEZ DUFFHUES G, TEN DIJKE P, et al. The therapeutic potential of targeting the endothelial-to-mesenchymal transition[J]. Angiogenesis, 2019, 22(1): 3-13. |
| [8] |
MAK X, LI C L, XU J B, et al. LncRNA Gm16410 regulates PM 2.5-induced lung endothelial-mesenchymal transition via the TGF-β1/Smad3/p-Smad3 pathway[J]. Ecotoxicol Environ Saf, 2020, 205: 111327. |
| [9] |
SUZUKI T, TADA Y J, NISHIMURA R, et al. Endothelial-to-mesenchymal transition in lipopolysaccharide-induced acute lung injury drives a progenitor cell-like phenotype[J]. Am J Physiol Lung Cell Mol Physiol, 2016, 310(11): L1185-L1198. |
| [10] |
TANG Y, CHENY L, CHU Z, et al. Protective effect of cryptotanshinone on lipopolysaccharide-induced acute lung injury in mice[J]. Eur J Pharmacol, 2014, 723: 494-500. |
| [11] |
ZHANG Q Y, GAN C L, LIU H Y, et al. Cryptotanshinone reverses the epithelial-mesenchymal transformation process and attenuates bleomycin-induced pulmonary fibrosis[J]. Phytother Res, 2020, 34(10): 2685-2696. |
| [12] |
ZHAO J L, PATEL J, KAUR S, et al. Sox9 and Rbpj differentially regulate endothelial to mesenchymal transition and wound scarring in murine endovascular progenitors[J]. Nat Commun, 2021, 12(1): 2564. |
| [13] |
LIU D, ZENGB X, ZHANG S H, et al. Rosiglitazone, a peroxisome proliferator-activated receptor-gamma agonist, reduces acute lung injury in endotoxemic rats[J]. Crit Care Med, 2005, 33(10): 2309-2316. |
| [14] |
ASHCROFT T, SIMPSONJ M, TIMBRELL V. Simple method of estimating severity of pulmonary fibrosis on a numerical scale[J]. J Clin Pathol, 1988, 41(4): 467-470. |
| [15] |
BONAVENTURA A, VECCHIÉ A, DAGNA L, et al. Endothelial dysfunction and immunothrombosis as key pathogenic mechanisms in COVID-19[J]. Nat Rev Immunol, 2021, 21(5): 319-329. |
| [16] |
GEORGEP M, WELLS A U, JENKINS R G. Pulmonary fibrosis and COVID-19: the potential role for antifibrotic therapy[J]. Lancet Respir Med, 2020, 8(8): 807-815. |
| [17] |
BURNHAME L, JANSSEN W J, RICHES D W H, et al. The fibroproliferative response in acute respiratory distress syndrome: mechanisms and clinical significance[J]. Eur Respir J, 2014, 43(1): 276-285. |
| [18] |
LI J, ZHENG Y, LI M X, et al. Tanshinone ⅡA alleviates lipopolysaccharide-induced acute lung injury by downregulating TRPM7 and pro-inflammatory factors[J]. J Cell Mol Med, 2018, 22(1): 646-654. |
| [19] |
LIU Z P, XU S W, HUANG X Y, et al. Cryptotanshinone, an orally bioactive herbal compound from Danshen, attenuates atherosclerosis in apolipoprotein E-deficient mice: role of lectin-like oxidized LDL receptor-1 (LOX-1)[J]. Br J Pharmacol, 2015, 172(23): 5661-5675. |
| [20] |
LO S H, HSU C T, NIU H S, et al. Cryptotanshinone inhibits STAT3 signaling to alleviate cardiac fibrosis in type 1-like diabetic rats[J]. Phytother Res, 2017, 31(4): 638-646. |
| [21] |
MA Y Z, LI H, YUE Z B, et al. Cryptotanshinone attenuates cardiac fibrosis via downregulation of COX-2, NOX-2, and NOX-4[J]. J Cardiovasc Pharmacol, 2014, 64(1): 28-37. |
| [22] |
GOODMANR B, PUGIN J, LEE J S, et al. Cytokine-mediated inflammation in acute lung injury[J]. Cytokine Growth Factor Rev, 2003, 14(6): 523-535. |
| [23] |
ORFANOSS E, MAVROMMATI I, KOROVESI I, et al. Pulmonary endothelium in acute lung injury: from basic science to the critically ill[J]. Intens Care Med, 2004, 30(9): 1702-1714. |
| [24] |
WIENER-KRONISHJ P, ALBERTINE K H, MATTHAY M A. Differential responses of the endothelial and epithelial barriers of the lung in sheep to Escherichia coli endotoxin[J]. J Clin Invest, 1991, 88(3): 864-875. |
| [25] |
HASHIMOTO N, PHANS H, IMAIZUMI K, et al. Endothelial-mesenchymal transition in bleomycin-induced pulmonary fibrosis[J]. Am J Respir Cell Mol Biol, 2010, 43(2): 161-172. |
| [26] |
SOHALS S. Endothelial to mesenchymal transition (EndMT): an active process in chronic obstructive pulmonary disease (COPD)?[J]. Respir Res, 2016, 17: 20. |




