椎间盘退变是年龄相关性疾病,并在遗传因素、吸烟、感染、异常力学负荷、椎体终板营养物质的运输减少等诱因刺激下进行性加重。异常炎症被认为是椎间盘退变的重要原因,胞外诱因刺激下,髓核细胞产生促炎症因子如IL-1β和TNF-α,经过NF-κB及MAPK通路激活如P65、ERK、JUNK等内信号分子,促进靶基因的转录,引起联级的扩大炎症反应,促使髓核细胞发生不可逆的改变,并伴随过度的髓核细胞凋亡、衰老、自噬改变。此外,炎性通路的激活促进金属基质蛋白酶表达增加,如MMP3、MMP13、ADAMTS4、ADAMTS5,导致胞外亲水基质的减少以及纤维环结构的破坏,从而导致椎间盘退变甚至髓核突出,造成慢性疼痛,严重影响患者生活质量[1-2]。
锌指蛋白A20是一种内源性保护蛋白,其可通过A20自身的去K-63泛素酶及K-48泛素酶对同一底物实行去泛素化及泛素化实现负反馈地抑制NF-κB炎症信号通路的传导,在炎症疾病领域受到密切关注[3-4]。本课题组的前期研究揭示,A20对髓核细胞具有内源性的保护作用,减弱LPS刺激引起的炎症信号NF-κB过度激活、传导及相关亲水基质的分解[5-6],但在人退变椎间盘髓核细胞中锌指蛋白A20对细胞衰老及凋亡影响不明确。因此本实验拟使用小干扰RNA降低A20表达,LPS作为炎症刺激因素,探究A20对细胞衰老及凋亡的影响及可能机制。
1 材料与方法 1.1 材料 1.1.1 人退变椎间盘髓核组织实验所用标本均来自于重庆医科大学附属第一医院骨科,并获得伦理委员会批准(2016-059),且术前与患者签署知情同意书。收集2020年6月至2021年12月住院患者术中常规切除的退变椎间盘组织。标本来自20例患者,男性9例,女性11例,年龄(42.10±12.07)岁。患者术前症状、体征和影像学检查确诊为腰椎间盘突出症,经保守治疗无效,Pfirrmann分级均为Grade Ⅲ~Ⅴ。
1.1.2 主要试剂DMEM/F12细胞培养液(以色列BI公司),胎牛血清(美国Gibco公司),Ⅱ型胶原酶和LPS(美国Sigma公司),兔抗人P21多克隆、兔抗人P16多克隆(中国万类生物科技公司),兔抗人BCL2单克隆、兔抗人BID单克隆、兔抗人BAX单克隆(美国Abcam公司),兔抗人P-P65单克隆、兔抗人TNFAIP3单克隆抗体(美国Cell Signaling公司),兔抗人P65多克隆抗体、羊抗兔二抗(中国博士德公司),CAPE(中国美仑生物公司),一步法TUNEL细胞凋亡检测试剂盒(绿色荧光,中国碧云天公司)。
1.2 方法 1.2.1 髓核细胞的提取及培养将患者术中切除并废弃的退变髓核组织用50 mL离心管收集,放置冰上。用已高温高压消毒的眼科剪及眼科镊小心分离混入髓核组织中的破碎骨片、肌肉及部分纤维环。无菌PBS溶液仔细冲洗髓核组织,直至冲洗后的废液无明显变色,将髓核组织剪成3~5 mm长宽的碎片,夹入15 mL无菌离心管内,加入大约2倍体积0.25%胰蛋白酶,充分混匀,放置于37 ℃、5%CO2的细胞孵箱内消化30 min,隔10 min摇匀1次。0.25%胰蛋白酶消化完毕后,1 200 r/min离心5 min,吸弃上清液,并加入2倍体积的0.2%二型胶原酶,充分摇匀,消化4 h,每隔40~60 min手动混匀1次。用一次性的200目细胞筛过滤细胞悬液,并用无菌PBS溶液冲洗细胞筛,收集滤液,1 200 r/min离心8 min,弃上清,保留底部沉淀。加入完全培养基,充分重悬,转移至由透气孔的T25细胞培养瓶内,加完全培养基至4 mL,放置细胞孵箱待其贴壁。髓核细胞大致4 d左右可见明显贴壁细胞形态,大约20 d融合度达90%,进行传代,传至P2用于进行后续实验。
1.2.2 人小干扰RNA-A20的构建及转染siRNA-A20由北京擎科生物科技有限公司设计及合成,序列为A20, 正义链5′-CUACUAAUGGGAUCAUUCATT-3′; 反义链5′-UGAAUGAUCCCAUUAGUAGTT-3′。提前将髓核细胞接种至6 cm的培养皿内,密度为50%左右,待其充分贴壁约24 h后,进行小干扰RNA的转染。准备已消毒的1.5 mL EP管,各管内加入100 μL无血清及双抗的基础培养基,一半EP管加入5 μL转染试剂,一半加入适当的siRNA,静止5 min后将其两两混匀,充分混匀后静止20 min。吸弃培养基,用无菌PBS洗涤2~3次,加入无血清及无双抗的基础培养基饥饿大约15 min。转染试剂及siRNA混合液缓慢加入上述的髓核细胞中,siRNA-A20转染终浓度100 nmol/L,放置细胞孵箱。转染4~6 h,将含有转染混合物的细胞培养液吸出,并用PBS清洗1~2次,加入完全培养基继续培养48 h,并观察其形态是否良好,用于后续实验。
1.2.3 实验设计及分组处理为探索锌指蛋白A20在LPS刺激下对细胞凋亡及衰老影响,设置对照组、LPS组、siRNA-A20组、siRNA-A20+LPS组。为明确下调锌指蛋白A20时LPS刺激诱导的细胞凋亡及衰老通过NF-κB通路实现,设置对照组、LPS组、siRNA-A20+LPS组、siRNA-A20+LPS+CAPE组。siRNA-A20转染终浓度100 nmol/L,LPS均为200 μg/mL处理24 h,CAPE为2.5 μmol/L预处理2 h。
1.2.4 Western blot检测相关蛋白表达裂解各组细胞后,冰浴,4 ℃ 12 000 r /min离心15 min,收集上清并定容,BCA法测定上清中蛋白浓度,加入RIPA稀释蛋白以平衡各组间蛋白浓度,以1/4蛋白体积上样缓冲液混合煮沸15 min后上样,恒压80 V进行电泳分离,恒流250 mA进行电转,将蛋白电转至0.22 mm PVDF膜。用快速封闭液对转好的膜封闭30 min,TBST洗涤3次,每次5 min。一抗(1 ∶500) 4 ℃孵育12 h,TBST洗涤3次,每次15 min,二抗(1 ∶3 000) 室温孵育1 h,TBST洗涤2次,每次15 min。显影,发光。用Image J软件处理。系统分析目标条带的光密度值。
1.2.5 β-半乳糖苷酶检测对于6孔板中培养的细胞,吸除细胞培养液,用PBS或HBSS洗涤1次,加入1 mL β-半乳糖苷酶染色固定液,室温固定15 min。吸除细胞固定液,用PBS或HBSS洗涤细胞3次,每次3 min。根据试剂盒说明书将β-半乳糖苷酶染色液A、B、C及X-Gal溶液按照比例配置成染色工作液,每孔加入1 mL染色工作液。用parafilm或保鲜膜封住6孔板防止蒸发,在无CO2孵育箱中37 ℃孵育过夜,普通光学显微镜下观察,拍照并计数阳性细胞占比。
1.2.6 流式细胞仪Annexin V-PI双标法检测细胞凋亡流式细胞仪Annexin V-PI双标法检测髓核细胞凋亡: 髓核细胞培养和处理同前。用PBS洗涤3次,用无EDTA胰蛋白酶消化后,PBS洗涤3次,1 000 r/min离心5 min,采用Annexin V-PI染料染色,流式细胞术检测细胞凋亡率。
1.2.7 TUNEL染色检测细胞凋亡根据试剂盒说明书配制适当量的TUNEL检测液,充分混匀。用PBS或HPBS洗涤2次。在样品上加50 μL TUNEL检测液,37 ℃避光孵育60 min。PBS或HPBS洗涤3次。用抗荧光淬灭封片液封片后荧光显微镜下观察,拍照并计数阳性细胞占比。
1.3 统计学分析采用SPSS 19.0统计学软件进行分析,计量资料以x±s表示。采用单因素方差分析,各组间均值的两-两多重比较采用LSD法。检验水准α=0.05。
2 结果 2.1 人退变髓核组织选择及细胞培养选择退变等级为3级或4级的髓核组织。提取原代细胞第5天,可见明显呈短梭状、聚集细胞贴壁,培养21 d可见细胞逐渐呈长梭形聚集,融合度达85%以上,且细胞形态良好(图 1)。

|
| A:培养5 d的原代髓核细胞(×40);B:培养21 d的原代髓核细胞(×40) 图 1 退变髓核细胞培养 |
2.2 下调A20促进衰老相关蛋白表达
与对照组相比,LPS组P21、P16蛋白表达无明显变化,siRNA-A20组及siRNA-A20+LPS组P21、P16蛋白水平明显增加(P < 0.05),siRAN-A20+LPS组P16及P21略高于siRNA-A20,但差异无统计学意义。见图 2。
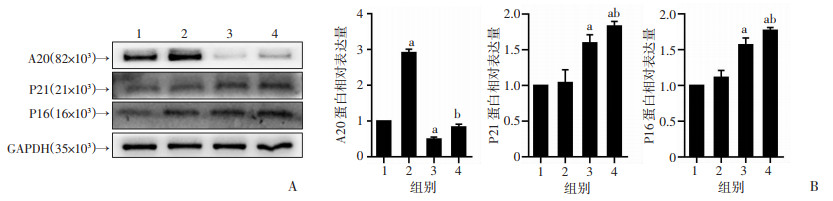
|
| A:Western blot检测结果;B:半定量分析 1:对照组;2:LPS组;3:siRNA-A20组;4:siRNA-A20+LPS组 a:P < 0.05,与对照组比较;b:P < 0.05,与LPS组比较 图 2 Western blot检测衰老相关蛋白表达 |
2.3 siRNA-A20处理后β-半乳糖苷酶染色阳性细胞明显增加
与对照组相比,LPS组阳性细胞占比无明显增加,siRNA-A20组及siRNA-A20+LPS组阳性细胞占比明显增加(P < 0.05)。见图 3。
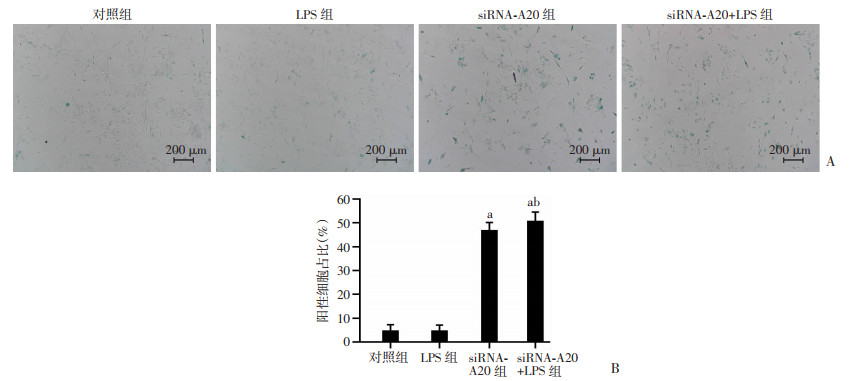
|
| A:β-半乳糖苷酶染色结果;B:各组阳性细胞占比 a:P < 0.05,与对照组比较;b:P < 0.05,与LPS组比较 图 3 各组衰老染色阳性细胞占比 |
2.4 下调A20促进细胞凋亡相关蛋白表达
与对照组相比,LPS组仅BID蛋白量增加(P < 0.05),BCL2、BAX蛋白水平无明显差异;siRNA-A20组蛋白表达与LPS组类似;siRNA-A20+LPS组BID及BAX蛋白明显增加,BCL2明显降低,差异有统计学意义(P < 0.05)。见图 4。
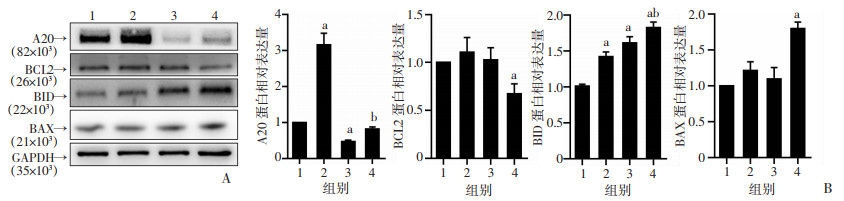
|
| A:Western blot检测结果;B:半定量分析 1:对照组;2:LPS组;3:siRNA-A20组;4:siRNA-A20+LPS组 a:P < 0.05,与对照组比较;b:P < 0.05,与LPS组比较 图 4 各组A20、BCL2、BID、BAX蛋白量表达分析 |
2.5 下调锌指蛋白A20表达量LPS可明显诱导细胞凋亡
单纯LPS刺激及单纯siRNA-A20处理组中细胞凋亡明显高于对照组(P < 0.05),但两组间无统计学差异;siRNA-A20+LPS组细胞凋亡显著增加,高于二者单独作用对细胞凋亡影响(P < 0.05,图 5)。TUNEL染色中,LPS组及siRNA-A20组阳性细胞占比明显高于对照组(P < 0.05),但明显低于siRNA-A20+LPS组(P < 0.05,图 6)。

|
| A:流式细胞仪检测结果;B:细胞凋亡率 1:对照组;2:LPS组;3:siRNA-A20组;4:siRNA-A20+LPS组 a:P < 0.05,与对照组比较;b:P < 0.05,与LPS组比较 图 5 各组细胞凋亡率分析 |
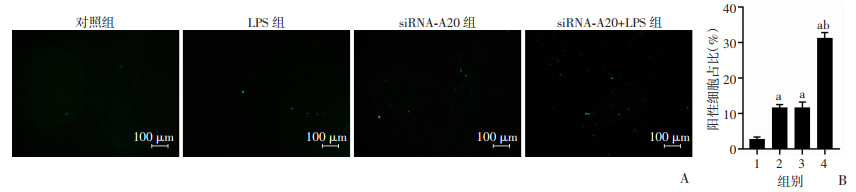
|
| A:TUNEL染色结果;B:阳性细胞占比 1:对照组;2:LPS组;3:siRNA-A20组;4:siRNA-A20+LPS组 a:P < 0.05,与对照组比较;b:P < 0.05,与LPS组比较 图 6 TUNEL染色检测细胞凋亡差异 |
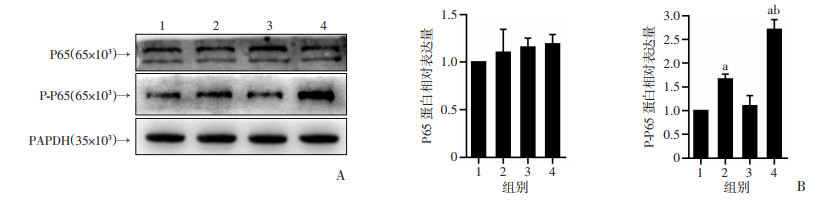
2.6 下调A20表达量LPS刺激可明显增加NF-κB通路活性
与对照组相比,p-P65蛋白水平在LPS组中增加(P < 0.05),在siRNA-A20+LPS组中显著上升(P < 0.05),在siRAN-A20组中无明显差异(图 7)。
|
| A:Western blot检测结果;B:半定量分析 1:对照组;2:LPS组;3:siRNA-A20组;4:siRNA-A20+LPS组 a:P < 0.05,与对照组比较;b:P < 0.05,与LPS组比较 图 7 各组P65及P-P65蛋白表达水平差异 |
2.7 CAPE预处理后衰老及凋亡相关蛋白表达量的变化
与siRNA-A20+LPS组相比,CAPE预处理后,p-P65、P21、P16、BID、BAX蛋白表达降低(P < 0.05),BCL2蛋白表达增加(P < 0.05),A20及P65蛋白水平无明显变化(图 8)。

|
| A:Western blot检测结果;B:半定量分析 1:对照组;2:LPS组;3:siRNA-A20+LPS组;4:siRNA-A20+LPS+CAPE组 a:P < 0.05,与对照组比较;b:P < 0.05,与siRNA-A20+LPS组比较 图 8 CAPE预处理后衰老及凋亡相关蛋白表达量的变化 |
3 讨论
应用siRNA-A20处理髓核细胞后,衰老相关蛋白P21、P16明显增加,且β-半乳糖苷酶染色阳性细胞占比显著提高,提示细胞衰老程度提升。年龄相关性疾病中,细胞衰老占据着重要影响,可由一系列内在和外在的伤害引起,包括致癌激活、氧化和遗传毒性应激、线粒体功能障碍、辐射或化疗药物[7]。在退变的椎间盘中,髓核处于炎性微环境的刺激下,易诱导髓核细胞及其祖细胞的衰老。此外,衰老细胞可产生的衰老相关分泌表型(SAPA)影响周围细胞,加之异常的炎症环境促使正常功能髓核细胞急剧减少,加速髓核组织中干细胞的耗竭,导致椎间盘退变[8-9]。抑制精氨酸酶Ⅱ可减少IL-1β诱导的细胞衰老及凋亡,其机制涉及对NF-κB炎症信号通路的抑制[10]。彭鑫等[11]研究显示,siRNA-A20+TNF-α可明显诱导大鼠髓核细胞的衰老,其机制可能涉及NF-κB通路的过度激活。但在本实验中单纯siRNA-A20处理后,细胞衰老明显增加,联合LPS刺激后,P-P65虽明显上升,但P21、P16及阳性细胞占比与siRNA-A20组无统计学差异。两实验所得结果差异可能与细胞种属及分组不同有关,并且本课题组前期研究提示单纯下调A20可能减弱髓核细胞自噬[5-6],因此A20调节细胞衰老的机制还有待深入探索。
本研究结果表明,LPS或siRNA-A20处理时,可诱导细胞凋亡,且siRNA-A20+LPS组凋亡细胞占比显著升高,并伴随着BID、BAX表达量增加,BCL2下降。细胞凋亡是一种程序性细胞死亡,是正常生长发育的一部分,也在多种疾病中存在,主要分为依赖线粒体的内源性途径及依赖死亡配体受体的外源性途径,但最终都通过Caspase家族蛋白发挥作用[12]。髓核组织处于IL-1β、TNF-α高表达的微环境[1-2],这些炎性刺激可通过细胞外Fas受体、肿瘤坏死因子受体1及肿瘤坏死因子相关配体1诱导外源性的细胞凋亡,并且在炎性因子的作用下,细胞内NF-κB、MAPK等多种信号通路激活,导致了内源性的凋亡发生——线粒体途径凋亡[13-14]。在本实验中,siRNA-A20+LPS组线粒体凋亡途径相关蛋白BID、BAX、BCL2明显改变。BCL2及BID是线粒体凋亡途径的重要蛋白,可激活BAX、BAK,促使线粒体外膜通透性增加,释放细胞色素C,Caspase家族激活,诱导细胞凋亡[12, 15]。因此,猜测siRNA-A20+LPS处理时,凋亡可能通过该途径实现。
髓核细胞中,cortistatin、SS-31均可抑制炎症刺激诱导的NF-κB激活、线粒体损伤及凋亡[13, 16],sirt 6可通过抑制mTOR磷酸化提升髓核细胞自噬流量,阻碍细胞衰老及IL-1β诱导凋亡[17],从而延缓椎间盘退变。本研究中,下调锌指蛋白A20的表达,LPS可明显诱导细胞衰老及凋亡,造成髓核细胞的损伤。给予NF-κB抑制剂CAPE预处理后,可明显减少衰老及凋亡相关蛋白的表达,提示siRNA-A20+LPS诱导的细胞衰老及凋亡可能通过NF-κB通路实现,并且在本课题组前期研究中也已证明过表达锌指蛋白A20可延缓LPS诱导的髓核细胞退变,因此A20在延缓椎间盘的退变中相当重要[6, 18-19]。
综上所述,本研究显示锌指蛋白A20在人退变髓核细胞中同时具有抗细胞凋亡及衰老作用,且在LPS刺激下更凸显出A20蛋白对细胞的保护效果,该作用通过抑制NF-κB实现。此外,下调A20后LPS刺激下线粒体凋亡通路蛋白明显增加,提示锌指蛋白A20的抗凋亡作用可能通过保护线粒体实现,为进一步研究A20对髓核细胞的内源性保护作用提供可靠方向。本研究再次证明锌指蛋白A20对髓核细胞退变的保护作用,并且提示了凋亡可能的作用机制,但在椎间盘退变中A20具体保护机制仍不明确,需进一步探究。
| [1] |
WANG Y J, CHE M X, XIN J G, et al. The role of IL-1β and TNF-α in intervertebral disc degeneration[J]. Biomed Pharmacother, 2020, 131: 110660. |
| [2] |
RISBUD M V, SHAPIRO I M. Role of cytokines in intervertebral disc degeneration: pain and disc content[J]. Nat Rev Rheumatol, 2014, 10(1): 44-56. |
| [3] |
SHEMBADE N, MA A, HARHAJ E W. Inhibition of NF-kappaB signaling by A20 through disruption of ubiquitin enzyme complexes[J]. Science, 2010, 327(5969): 1135-1139. |
| [4] |
BOONE D L, TURER E E, LEE E G, et al. The ubiquitin-modifying enzyme A20 is required for termination of Toll-like receptor responses[J]. Nat Immunol, 2004, 5(10): 1052-1060. |
| [5] |
ZHANG Y, YI W W, XIA H Q, et al. A20 regulates inflammation through autophagy mediated by NF-κB pathway in human nucleus pulposus cells and ameliorates disc degeneration in vivo[J]. Biochem Biophys Res Commun, 2021, 549: 179-186. |
| [6] |
CHEN J, MA Y F, YANG Z J, et al. TNFAIP3 ameliorates the degeneration of inflammatory human nucleus pulposus cells by inhibiting mTOR signaling and promoting autophagy[J]. Aging (Albany NY), 2020, 12(23): 24242-24254. |
| [7] |
HERRANZ N, GIL J. Mechanisms and functions of cellular senescence[J]. J Clin Invest, 2018, 128(4): 1238-1246. |
| [8] |
MANNARINO M, CHERIF H, LI L, et al. Toll-like receptor 2 induced senescence in intervertebral disc cells of patients with back pain can be attenuated by o-vanillin[J]. Arthritis Res Ther, 2021, 23(1): 117. |
| [9] |
MA K, CHEN S, LI Z, et al. Mechanisms of endogenous repair failure during intervertebral disc degeneration[J]. Osteoarthri Cartilage, 2019, 27(1): 41-48. |
| [10] |
LI F D, SUN X F, ZHENG B, et al. Arginase Ⅱ promotes intervertebral disc degeneration through exacerbating senescence and apoptosis caused by oxidative stress and inflammation via the NF-κB pathway[J]. Front Cell Dev Biol, 2021, 9: 737809. |
| [11] |
彭鑫, 张聪, 王锋, 等. A20介导TNF-α炎症微环境下髓核细胞衰老的机制研究[J]. 中国脊柱脊髓杂志, 2019, 29(9): 834-840. PENG X, ZHANG C, WANG F, et al. Mechanism research of senescence of NP cells mediated by A20 in TNF-α inflammation microenvironment[J]. Chin J Spine Spinal Cord, 2019, 29(9): 834-840. |
| [12] |
MCARTHUR K, CHAPPAZ S, KILE B T. Apoptosis in megakaryocytes and platelets: the life and death of a lineage[J]. Blood, 2018, 131(6): 605-610. |
| [13] |
PENG X, WANG K, ZHANG C, et al. The mitochondrial antioxidant SS-31 attenuated lipopolysaccharide-induced apoptosis and pyroptosis of nucleus pulposus cells via scavenging mitochondrial ROS and maintaining the stability of mitochondrial dynamics[J]. Free Radic Res, 2021, 55(11/12): 1080-1093. |
| [14] |
ZHANG X B, HU Y C, CHENG P, et al. Targeted therapy for intervertebral disc degeneration: inhibiting apoptosis is a promising treatment strategy[J]. Int J Med Sci, 2021, 18(13): 2799-2813. |
| [15] |
KAUFMANN T, STRASSER A, JOST P J. Fas death receptor signalling: roles of Bid and XIAP[J]. Cell Death Differ, 2012, 19(1): 42-50. |
| [16] |
ZHAO Y P, QIU C, WANG W H, et al. Cortistatin protects against intervertebral disc degeneration through targeting mitochondrial ROS-dependent NLRP3 inflammasome activation[J]. Theranostics, 2020, 10(15): 7015-7033. |
| [17] |
CHEN J, XIE J J, JIN M Y, et al. Sirt6 overexpression suppresses senescence and apoptosis of nucleus pulposus cells by inducing autophagy in a model of intervertebral disc degeneration[J]. Cell Death Dis, 2018, 9(2): 56. |
| [18] |
张野, 夏辉强, 易威威, 等. 锌指蛋白A20对兔腰椎间盘退变影响的实验研究[J]. 中国修复重建外科杂志, 2021, 35(3): 366-374. ZHANG Y, XIA H Q, YI W W, et al. Experimental study on the effect of zinc finger protein A20 on lumbar intervertebral disc degeneration in rabbits[J]. Chin J Repar Reconstr Surg, 2021, 35(3): 366-374. |
| [19] |
蓝海洋, 杨智杰, 夏辉强, 等. 锌指蛋白A20对内毒素刺激时人椎间盘髓核细胞炎症及退变的影响[J]. 第三军医大学学报, 2019, 41(6): 543-548. LAN H Y, YANG Z J, XIA H Q, et al. Effects of zinc finger protein A20 over-expression on inflammatory response and degeneration of human intervertebral disc nucleus pulposus cells stimulated with lipopolysaccharide[J]. J Third Mil Med Univ, 2019, 41(6): 543-548. |




