2. 510010 广州,中国人民解放军南部战区总医院
2. General Hospital of Southern Theater Command, Guangzhou, Guangdong Province, 510010, China
急性呼吸道疾病(acute respiratory disease,ARD)在全球范围内的发病率和病死率中占很大比例,其中急性病毒性呼吸道感染是最常见的病因(约80%)[1]。近年来SARS、甲型H1N1、MERS和SARS-CoV-2等多种呼吸道病原体威胁全球人类的健康与生命。仅在2021年,全国呼吸道传染病报告发病率为104.18/10万,病死率为0.13/10万[2]。实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)技术以高灵敏、高特异、能够早期诊断为优点广泛用于临床呼吸道病原体检测及科学研究[3-4]。传统RT-qPCR检测前均要对样本进行核酸提取,操作步骤复杂、耗时长,不适用于野外现场检测。近年来,以即时检测(point-of-care testing,POCT)为目标,优化缩短PCR反应耗时的研究层出不穷。许多研究通过简化样品前处理与加速热循环,达到缩短PCR反应耗时的目的。其中免核酸提取[5-7]和全自动核酸提取[8]是主要的样本处理阶段简化方式。极速热循环(ultrafast thermocycling methods)的概念也被提出,旨在提升核酸扩增中的加热冷却模块的控温速率可准确性从而达到快速完成核酸扩增的目的[9]。主要包括电阻加热法、热对流、光束热循环[10]。MENDOZA-GALLEGOS等[11]利用一个铜包裹的功率电阻和一个计算机风扇制成的热循环器作为便携PCR设备的温控装置。铜包裹解决了电阻表面热量分布不均的问题,电阻中央与两端温差小于0.75 ℃。LI等[12]报告了一种金纳米棒促进微流控芯片中液滴的光学加热方法,含有金纳米棒的纳升液滴由低功率808 nm波长激光器加热,由于金纳米棒的高效光热转换率,通过采用具有良好重现性的13.6 mW激光器,可使液滴温度达到95 ℃,加热和冷却时间分别为200、800 ms。LI等[13]开发了一种基于新型双模磁化铁成功集成Fe3O4提供光热转换的纳米簇的超快定量PCR系统。这些簇可以用脉冲激光激发,以进行精确的热循环调制。
本研究的对象为一种基于金属烧结陶瓷加热器和双曲线风冷技术极速热循环检测模块的C7s实时荧光定量PCR仪,不仅保留常规荧光PCR仪的技术性能,同时又能显著缩短检测时间。3D打印技术研制的专用扁平管,以及免核酸提取一步法检测试剂为极速热循环实时荧光定量PCR系统的创新点的极速热循环实时荧光定量PCR系统,研究选用IAV和IBV质粒标准品和临床样本为检测标本,并与传统RT-qPCR结果比较,针对此系统的最低检出限、线性范围、重现性、敏感度和特异度、交叉反应和抗干扰能力等性能指标评价研究。
1 材料与方法 1.1 仪器、材料和试剂本研究所使用的系统为极速热循环实时荧光定量PCR系统,包括C7s实时荧光定量PCR仪型号GNM-C7s(北京金诺美生物技术有限公司)和免核酸提取一步法检测试剂,含核酸扩增试剂和样本处理液(珠海丽珠试剂股份有限公司)。极速热循环系统将流感病毒检测时长控制在30 min以内。其余仪器:加样枪(德国eppendorf公司);生物安全柜;超净工作台(苏州安泰空气技术有限公司);扁平管专用离心机(北京金诺美生物技术有限公司)。
样本分别来自苏州泓迅生物科技股份有限公司以IAV基质蛋白1、基质蛋白2(GenBank:KC739555.1) 和IBV核输出蛋白、非结构蛋白1(GenBank:KP976412.1) 为目的基因片段,克隆插入pUC-Amp载体,构建的IAV和IBV质粒标准品;用于临床评价的临床样本来自南部战区疾控中心生物安全科2016年至2018年收集的鼻/咽拭子样本,参考《军队急性呼吸道传染病病原监测方案(2019修订版)》:流行性感冒确诊阳性175例(IAV阳性样本88例,IBV阳性样本87例);流行性感冒阴性样本103例,其中男性164人(59%),女性114人(41%),平均年龄24岁。
交叉反应样本购自北纳生物的金黄色葡萄球菌(Staphylococcus aureus,S. aureu)、流感嗜血杆菌(Haemophilus influenzae,H. influenzae)、肺炎链球菌(Streptococcus pneumoniae,S. pneumoniae)、呼吸道合胞病毒B(respiratory syncytial virus,RSVB),浓度为6.0× 109、1.50×107、1.50×1011CFU/L和5.60×109 TCID50/L用于交叉反应实验。
临床评价所用的对比试剂为FastKing一步法RT-PCR试剂盒(KR123)[天根生化科技(北京)有限公司];IAV和IBV引物和探针(见表 1);磁珠法核酸提取试剂盒(广州赛百纯生物科技有限公司)。对比仪器为LightCyclerⓇ 96 PCR仪(Roche公司)。
| 病原名称 | 引物与探针 | 序列(5’→3’) |
| IAV | 上游引物 | GACCRATCCTGTCACCTCTGAC |
| 下游引物 | GGGCATTYTGGACAAAKCGTCTACG | |
| 探针 | FAM-TGCAGTCCTCGCTCACTGGGCACG-BHQ1 | |
| IBV | 上游引物 | TCCTCAACTCACTCTTCGAGCG |
| 下游引物 | CGGTGCTCTTGACCAAATTGG | |
| 探针 | FAM-CCAATTCGAGCAGCTGAAACTCGTG-BHQ1 |
1.2 方法 1.2.1 最低检出限评价
选取IAV和IBV质粒标准品,进行系列稀释,稀释浓度为:1×105、1×104、1×103、1×102、1×101、1×100 copies/μL。用极速热循环荧光定量PCR系统检测IAV和IBV质粒标准品(1×100~1×105 copies/μL),每个稀释样本重复测定5次。浓度高于最低检出限的样本,应每次都能被检出。
1.2.2 极速热循环荧光定量PCR系统检测质粒标准品的标准曲线对IAV和IBV质粒标准品(1×100~1×105 copies/μL)用极速热循环荧光定量PCR系统检测,每个浓度检测3次,求平均循环数(cycle threshold,Ct),以IAV和IBV质粒标准品浓度的对数值(lgC)为横坐标,其对应的平均Ct值为纵坐标,绘制标准曲线,通过IBM SPSS Statistic 22作线性回归分析,获得回归方程和线性相关系数R,并按公式(10-1/a-1)×100%求得扩增效率。
1.2.3 重现性评价从278例临床样本中选出IAV和IBV阳性样本各1例,由极速热循环荧光定量PCR系统检测,重复检测8次,获得对应的平均Ct值和标准差(standard deviation,SD),计算变异系数(coefficient of variation,CV),公式为CV=SD/x×100%。
1.2.4 临床评价使用极速热循环荧光定量PCR系统检测278份临床样本,同时根据《军队急性呼吸道传染病病原监测方案(2019修订版)》[14]以传统RT-qPCR为金标准检测临床样本,FastKing一步法RT-PCR试剂盒(KR123)为对比试剂进行对比检测,以评价此系统对临床样本检测的准确性。传统RT-qPCR法检测样品的Ct值>38或无Ct值,判定样品为阴性。
1.2.5 交叉反应评价在IAV、IBV阳性混合样本以及阴性样本中均加入S.aureu、H. influenzae、S. pneumoniae、RSVB后与常规样本一样处理,重复测定3次,查看检出结果。
1.2.6 抗干扰评价随机挑选IAV、IBV阳性样本各1例和阴性样本1例,加入30 g/dL的血红蛋白、3.2 g/dL的甘油三酯和100 μg/mL头孢曲松,重复测定3次,验证抗干扰能力。
1.3 统计学分析对入选的278例临床样本使用极速热循环荧光定量PCR系统和传统RT-qPCR方法进行同步盲法对比实验,对两种检测方法进行Kappa一致性检验及阴阳性符合率计算。通过IBM SPSS Statistic 22计算阴性符合率、阳性符合率、总符合率及其95% CI,并对检测结果进行Kappa检验(K)。Kappa值为一致性系数,评价两种检测方法检测结果是否一致,Kappa值越大,说明检测结果越一致,若K≥0.75,说明两种方法具有高度的一致性,若K < 0.4,说明一致性差,若0.4≤K < 0.75,说明具有良好的一致性[15]。
2 结果 2.1 最低检出限评价极速热循环荧光定量PCR检测系统检测IAV和IBV质粒标准品结果见表 2,扩增曲线见图 1,此系统检测IAV和IBV质粒标准品的最低检出限为1×100 copies/μL。
| 拷贝量(copies/μL) | IAV | IBV |
| 1×100 | 33.21 | 37.61 |
| 1×101 | 32.18 | 35.97 |
| 1×102 | 28.42 | 32.87 |
| 1×103 | 24.54 | 30.27 |
| 1×104 | 22.08 | 24.62 |
| 1×105 | 17.58 | 21.59 |
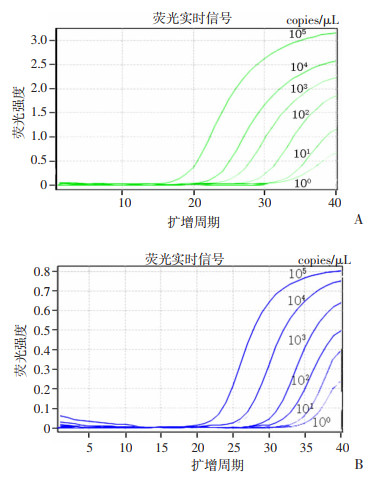
|
| 图 1 IAV(A)和IBV(B)各浓度扩增曲线 |
2.2 IAV和IBV的极速热循环荧光定量PCR标准曲线及线性范围
根据所得IAV和IBV质粒标准品的浓度对数值与其对应的平均Ct值绘制标准曲线见图 2,极速热循环荧光定量PCR检测IAV和IBV质粒的线性范围是100~105 copies/μL。通过IBM SPSS Statistic 22作线性回归分析,IAV标准曲线的R=0.990 5,扩增效率为105%;IBV标准曲线的R=0.986 5,扩增效率为99.42%。建立的极速热循环荧光定量PCR系统有6个数量级的线性检测范围。
|
| 图 2 极速热循环荧光定量PCR系统检测IAV和IBV质粒标准品的标准曲线 |
2.3 重现性评价
如图 3,IAV和IBV样本变异系数分别为4.74%和1.94%,均 < 5%,检测性能稳定,重现性较好。
|
| 图 3 极速热循环荧光定量PCR系统检测IAV(A)和IBV(B)临床样本的重现性 |
2.4 临床评价
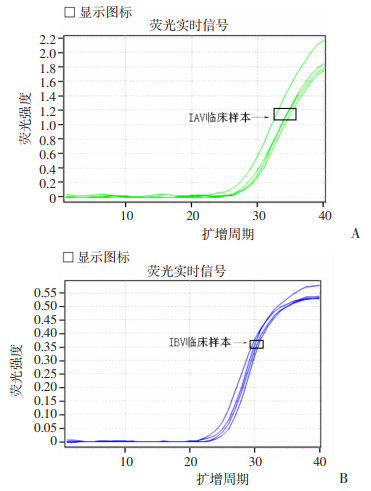
见图 4和表 3可知,以传统RT-qPCR法根据《军队急性呼吸道传染病病原监测方案(2019修订版)》方案作为对比方法,极速热循环荧光定量PCR系统检测流感临床样本敏感度分别为92.57%,特异度均为100%;阳性预测值为100%,阴性预测值为88.79%。
|
| 图 4 传统RT-qPCR法检测临床样本扩增曲线 |
| 极速热循环荧光定量PCR系统检测结果 | 传统RT-qPCR检测结果 | ||
| 阳性 | 阴性 | 合计 | |
| 阳性 | 162 | 0 | 162 |
| 阴性 | 13 | 103 | 116 |
| 合计 | 175 | 103 | 278 |
2.5 交叉反应评价
在IAV、IBV混合样本和阴性样本中均加入S.aureu、H. influenzae、S. pneumoniae、RSVB后进行检测。其中IAV和IBV混合样本中两种病原体互不干扰,均检出为阳性,S.aureu、H. influenzae、S. pneumoniae、RSVB均为阴性,阴性样本检出为阴性,IAV和IBV之间及与其他多种病原体之间无交叉反应(见表 4)。
| 病原体 | IAV | IBV | S. aureu | H. influenzae | S. pneumoniae | RSVB |
| IAV | + | - | - | - | - | - |
| IBV | - | + | - | - | - | - |
| 阴性样本 | - | - | - | - | - | - |
2.6 抗干扰评价
鼻/咽拭子样本中可能存在的干扰物质有血液、分泌物或抗生素等。抗干扰实验结果表明,30 g/dL血红蛋白、3.2 g/dL甘油三酯和100 μg/mL头孢曲松对流感病毒检测无干扰(见表 5)。
| 样本编号 | 临床确诊结果 | 30 g/dL血红蛋白 | 3.2 g/dL甘油三酯 | 100 μg/mL头孢曲松 | ||||||||
| 重复1 | 重复2 | 重复3 | 重复1 | 重复2 | 重复3 | 重复1 | 重复2 | 重复3 | ||||
| 41 | IAV+ | IAV+ | IAV+ | IAV+ | IAV+ | IAV+ | IAV+ | IAV+ | IAV+ | IAV+ | ||
| 88 | IBV+ | IBV+ | IBV+ | IBV+ | IBV+ | IBV+ | IBV+ | IBV+ | IBV+ | IBV+ | ||
| 139 | 阴性样本 | - | - | - | - | - | - | - | - | - | ||
2.7 统计学分析结果
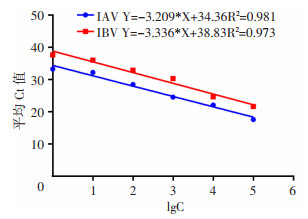
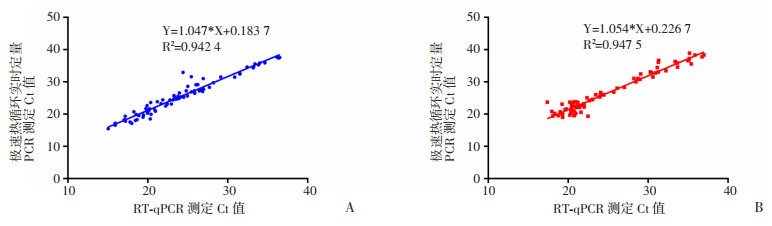
极速热循环荧光定量PCR系统与传统RT-qPCR相比,极速热循环两种方法的阳性符合率为92.57%(95% CI:92.39%~92.75%);阴性符合率为100%;总符合率为95.32%(95% CI:95.29%~95.35%);检测流感临床样本Kappa=0.902(95% CI:0.851~0.953),说明两种方法检测结果具有高度的一致性。由图 5可知,两种方法检测相同样品Ct值变化趋势一致。
|
| 图 5 两种方法检测IAV(A)和IBV(B)临床样本的线性拟合 |
3 讨论
随着分子生物学发展,核酸诊断已在临床中广泛应用。由于呼吸道传染病传播范围广、传播速度快及新发传染病的多发,现场快速检测的需求极速增长。因此,快速高效地检出呼吸道病原体对于临床应用、挽救人类生命健康和阻止疾病扩散具有重要意义。目前,已有基于快速检测呼吸道病原体的POCT开发出来[16]。并有研究证明POCT在诊疗过程中能更快地实现精准治疗,提升了流感等呼吸道疾病的治疗水平[17]。
随着分子技术的飞速发展,为满足生物医学检测的需要,当前实时荧光定量PCR仪向高通量、多通道、超高速POCT方向发展[18]。流行性感冒作为常见的呼吸道感染疾病,且2021年流行性感冒全国发病率相较于2020年呈上升趋势,选用IAV、IBV作为实验研究对象具有重要的临床意义[19]。本研究采用极速热循环荧光定量PCR系统检测IAV和IBV质粒标准品的最低检出限为1×100 copies/μL,线性范围为6个数量级(1×100~1×105 copies/μL),IAV和IBV标准曲线的线性相关系数分别为0.990 5和0.986 5,已达到实时荧光定量PCR水平。鉴于100~105 copies/μL包含了儿童、成人和老人流感患者流感病毒载量范围,故选择6个低浓度梯度的质粒标准品[20-21]。临床样本对比试验表明极速热循环荧光定量PCR系统检测IAV和IBV临床样本敏感度为92.57%,特异度均为100%,阴、阳性预测值分别为88.79%和100%,变异系数均 < 5%,重现性较好,两种流感病毒之间及两种流感病毒与其他多种病原体之间无交叉反应,且30 g/dL血红蛋白、3.2 g/dL甘油三酯和100 μg/mL头孢曲松不干扰检测结果。
极速热循环实时荧光定量PCR系统利用免核酸提取技术和极速热循环加热器,检测时间由传统RT-qPCR法的2.5 h缩短为0.5 h,样品用量由50 μL减少至5 μL。同时与传统RT-qPCR法比较,该系统体积小重量轻并能在现场环境实施快速检测,具有高通量特性,能同时完成IAV和IBV等4种呼吸道病原体同步检测。本研究存在不足之处:①临床样本来源于一个单位,可能不具有广泛代表性。②未制定临床样本的统一入选标准,多为2016-2018年的老样本,缺少近期的新临床样本。③此系统采用核酸扩增检测的方法,存在假阴性,这会造成一定的漏诊现象,为避免漏诊造成流感防控的漏洞,需要结合患者临床症状和实验室其他检测指标对病情进行分析。
综上所述,本研究表明极速热循环荧光定量PCR系统的最低检出限、重现性、特异度与灵敏度等主要性能指标达到了常规实时荧光定量PCR水平,同时能实现现场快速检测。有望成为一种性能优良的呼吸道病原体快速检测POCT装置。
| [1] |
MAHONY J B, PETRICH A, SMIEJA M. Molecular diagnosis of respiratory virus infections[J]. Crit Rev Clin Lab Sci, 2011, 48(5/6): 217-249. |
| [2] |
疾病预防控制局, 2021年全国法定传染病疫情概况[EB/OL]. [2022-04-22]. http://www.nhc.gov.cn/jkj/s3578/202204/4fd88a291d914abf8f7a91f6333567e1.shtml National Administration of Disease Prevention and Control, National epidemiological profile of statutory infectious diseases in 2021[EB/OL][2022-04-22]. http://www.nhc.gov.cn/jkj/s3578/202204/4fd88a291d914abf8f7a91f6333567e1.shtml |
| [3] |
FANG S S, LI J X, CHENG X W, et al. Simultaneous detection of influenza virus type B and influenza A virus subtypes H1N1, H3N2, and H5N1 using multiplex real-time RT-PCR[J]. Appl Microbiol Biotechnol, 2011, 90(4): 1463-1470. |
| [4] |
DIMAIO M A, SAHOO M K, WAGGONER J, et al. Comparison of Xpert Flu rapid nucleic acid testing with rapid antigen testing for the diagnosis of influenza A and B[J]. J Virol Methods, 2012, 186(1/2): 137-140. |
| [5] |
GANGULI A, MOSTAFA A, BERGER J, et al. Rapid isothermal amplification and portable detection system for SARS-CoV-2[J]. Proc Natl Acad Sci USA, 2020, 117(37): 22727-22735. |
| [6] |
ALAFEEF M, MOITRA P, DIGHE K, et al. RNA-extraction-free nano-amplified colorimetric test for point-of-care clinical diagnosis of COVID-19[J]. Nat Protoc, 2021, 16(6): 3141-3162. |
| [7] |
AZMI I, FAIZAN M I, KUMAR R, et al. A saliva-based RNA extraction-free workflow integrated with Cas13a for SARS-CoV-2 detection[J]. Front Cell Infect Microbiol, 2021, 11: 632-646. |
| [8] |
CHAN K, WEAVER S C, WONG P Y, et al. Rapid, affordable and portable medium-throughput molecular device for zika virus[J]. Sci Rep, 2016, 6: 38223. |
| [9] |
LEE J H, CHEGLAKOV Z, YI J, et al. Plasmonic photothermal gold bipyramid nanoreactors for ultrafast real-time bioassays[J]. J Am Chem Soc, 2017, 139(24): 8054-8057. |
| [10] |
LEE S H, PARK S M, KIM B N, et al. Emerging ultrafast nucleic acid amplification technologies for next-generation molecular diagnostics[J]. Biosens Bioelectron, 2019, 141: 111448. |
| [11] |
MENDOZA-GALLEGOS R A, RIOS A, GARCIA-CORDERO J L. An affordable and portable thermocycler for real-time PCR made of 3D-printed parts and off-the-shelf electronics[J]. Anal Chem, 2018, 90(9): 5563-5568. |
| [12] |
LI Z Y, WANG P, TONG L M, et al. Gold nanorod-facilitated localized heating of droplets in microfluidic chips[J]. Opt Express, 2013, 21(1): 1281-1286. |
| [13] |
LI T J, CHANG C M, CHANG P Y, et al. Handheld energy-efficient magneto-optical real-time quantitative PCR device for target DNA enrichment and quantification[J]. NPG Asia Mater, 2016, 8(6): e277. |
| [14] |
军队急性呼吸道传染病病原监测方案(2019修订版)[S], 2019. Army acute respiratory infectious disease pathogen surveillance program (2019)[S], 2019. |
| [15] |
王伟. 介绍一种评价临床检查结果一致性的新指标——Kappa值[J]. 天津医药, 1991, 19(10): 639-640. WANG W. Introduction of a new index to evaluate the consistency of clinical examination results—Kappa value[J]. Tianjin Med J, 1991, 19(10): 639-640. |
| [16] |
AZAR M M, LANDRY M L. Detection of influenza A and B viruses and respiratory syncytial virus by use of clinical laboratory improvement amendments of 1988 (CLIA)-waived point-of-care assays: a paradigm shift to molecular tests[J]. J Clin Microbiol, 2018, 56(7): e00367-e00318. |
| [17] |
SLOMSKI A. Molecular point-of-care test improved influenza care[J]. JAMA, 2021, 325(12): 1135. |
| [18] |
WESTGARD S A, GOLDSCHMIDT H M J, EHRMEYER S S. POCT analysts' perspective: practices and wants for improvement[J]. J Appl Lab Med, 2020, 5(3): 480-493. |
| [19] |
MAUTNER L, BAILLIE C K, HEROLD H M, et al. Rapid point-of-care detection of SARS-CoV-2 using reverse transcription loop-mediated isothermal amplification (RT-LAMP)[J]. Virol J, 2020, 17(1): 160. |
| [20] |
覃岭, 代艳超, 孙坚萍, 等. 流感患者TNF-α和IL-10水平以及与病毒载量相关性研究[J]. 传染病信息, 2019, 32(5): 415-417, 421. QIN L, DAI Y C, SUN J P, et al. Levels of TNF-α and IL-10 and their correlation with influenza virus load in influenza patients[J]. Infect Dis Inf, 2019, 32(5): 415-417, 421. |
| [21] |
陈韵颖, 叶先飞, 周俊, 等. 2357例流感样患儿甲乙型流感病毒检测结果及病毒载量分析[J]. 中华医院感染学杂志, 2020, 30(2): 278-282. CHEN Y Y, YE X F, ZHOU J, et al. Detection of influenza A and B viruses and viral loads in 2 357 children with influenza-like illness[J]. Chin J Nosocomiology, 2020, 30(2): 278-282. |




