2. 030001 太原,山西医科大学基础医学院:基础医学研究中心
2. Basic Medical Research Center, School of Basic Medicine, Shanxi Medical University, Taiyuan, Shanxi Province, 030001, China
阿尔茨海默病(Alzheimer’s disease,AD)是一种以认知和记忆功能损害为主的慢性神经系统退行性疾病,随着老龄化社会的到来,AD的发病率逐年上升并随着年龄的增长呈指数增加[1]。AD的病理特点表现为神经元胞外老年斑、神经元纤维缠结以及海马等脑区神经元大量丢失[2],最终导致与海马区相关的学习记忆功能减弱和认知功能障碍。β淀粉样蛋白(amyloid β-protein,Aβ)毒性学说是AD发病的主流学说[3]。Aβ由β淀粉样前体蛋白(β-amyloid precursor protein,APP)经β-分泌酶和γ-分泌酶水解作用而产生的含有39~43个氨基酸的多肽[4],由细胞分泌,在细胞基质沉淀聚积后具有很强的神经毒性作用[5],可诱导海马神经细胞死亡[6]。
研究发现,在APP/PS1双转基因AD小鼠脑内存在大量的自噬体和溶酶体,自噬体和溶酶体的增加很大程度上是由自噬水平降低引起的[7]。自噬是指吞噬自身受损蛋白或衰老细胞器使其包被进入囊泡,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程。随着AD病情的进展,自噬体逐渐增多,自噬体和溶酶体融合受限,最终引起脑内大量神经细胞丢失和死亡[8]。因此,改善自噬体和溶酶体融合障碍对逆转AD尤为重要。突触融合蛋白17(syntaxin17,STX17)是自噬体和溶酶体融合过程中的关键蛋白。在自噬过程中,STX17蛋白招募SNAP29蛋白和VAMP8蛋白形成STX17-SNAP29-VAMP8复合体,介导自噬体与溶酶体的融合[9]。然而,STX17是否可以改善Aβ诱导的海马神经细胞死亡目前尚不清楚。因此,本研究探讨Aβ31-35对小鼠海马神经细胞中STX17表达和自噬的影响,并观察过表达STX17是否能逆转Aβ31-35所致小鼠海马神经细胞死亡和自噬异常。
1 材料与方法 1.1 动物及细胞6~8周龄的雄性C57BL/6小鼠,质量18~25 g,饲养环境适宜且自由饮食。本研究涉及动物的所有程序均得到山西医科大学伦理委员会批准,使用过程符合国家实验动物使用规定。HT22小鼠海马神经细胞系购自广州吉尼欧生物科技有限公司。
1.2 主要试剂与仪器Aβ31-35试剂(货号:ab120974)、LC3抗体(货号:ab48394)和P62抗体(货号:ab56416)购自英国Abcam公司;Cell Counting Kit-8试剂盒(货号:CK04)购自日本Dojindo公司;STX17抗体(货号:17815-1-P)购自美国Proteintech公司;LV-OE STX17购自中国吉凯公司。
CO2恒温细胞培养箱(货号:HERAcell 150i)购自美国Thermo公司;酶联免疫检测仪(货号:SMP500-071 47-HLXU)购自美国SoftMax公司;PCR扩增仪(货号:MX3005P)购自美国Stratagene公司;凝胶成像系统(货号:BioSpectrum 810)购自美国UVP公司,倒置荧光显微镜(货号:IX51)购自日本Olympus公司。
1.3 WGCNA分析和关键基因筛选使用R语言WGCNA包对GSE 111737数据进行分析,该数据含7例AD患者和6例健康人群,参考GPL21810平台的注释信息将探针转换为相应的基因符号。通过WGCNA包中的“pickSoftThreshold”函数获得相邻函数加权参数的最优值,将其作为软阈值。构建邻接矩阵探索基因的内在联系,利用拓扑重叠矩阵(TOM)相似性函数将邻接矩阵转换为TOM矩阵。基于动态剪切树将基因分为不同模块,并计算模块临床特征的相关性,从中选择与阿尔茨海默病相关程度最高的模块并对该模块中的基因进行后续分析。通过WGCNA分析筛选出来的模块基因分别与自噬基因库和KEGG筛选出的SNARE家族基因取交集。
1.4 小鼠海马神经元HT22细胞培养将-80 ℃取出装有HT22神经细胞的冻存管立即放入37 ℃水浴锅,快速晃动冻存管使其融解,1 000 r/min离心5 min,弃上清后添加新的完全培养基并吹打混匀,将重悬的细胞转移至培养瓶并补加适量的完全培养基,“8”字晃动培养瓶使细胞分布均匀;使用含EDTA的胰酶对生长状态良好的神经细胞进行消化,从而制备成细胞悬液,以2 ×105/孔接种至6孔板,次日观察细胞生长情况,待汇合度达70%进行干预;当培养瓶中细胞生长融合度达到80%时进行传代处理;部分细胞进行冻存处理,以便后续实验需要。后续细胞实验分为对照组(正常培养)和Aβ31-35组(5 μmol/L Aβ31-35处理)。
1.5 小鼠海马内注射给药使用5%水合氯醛对小鼠腹腔进行注射麻醉,将头部固定在三维脑力体定位仪,使用消毒后的剪刀在小鼠头部剪开约1.5 cm的切口;定位海马组织的位置:前囟后2 mm,中线两侧旁开1.8 mm,深度1.8 mm;进行海马内注射。实验分为对照组和Aβ31-35处理组,Aβ31-35组给予Aβ31-35(1 g/L,750 nmol/kg,双侧海马注射共约8.2 μL),对照组注射等量的高压三蒸水。
1.6 CCK-8法检测细胞活性将对数生长期的细胞制备成细胞悬液后接种到96孔板上,次日更换新的完全培养基并进行药物干预,药物处理24 h后,每孔各加入10 μL CCK-8溶液并孵育1.5 h,使用酶标仪测定450 nm处的光密度值[D(450)]并进行数据处理分析,计算公式如下。
1.7 Western blot检测使用配制好的裂解液(RiPa ∶PMSF=100 ∶1)提取组织和细胞的总蛋白,BCA法测蛋白的浓度,对各组溶液进行定量处理,之后放在100 ℃金属浴加热10 min;配制5%的浓缩胶和12%的分离胶,按顺序依次将Marker和蛋白样品加入SDS-PAGE胶样孔内,先设置80 V的电压待跑出一定量Marker后转为120 V;使用甲醇激活PVDF膜后开始进行转膜,再使用5%脱脂奶粉进行封闭(常温,2 h),封闭结束后使用TBST洗膜三次加入相应一抗进行孵育,孵育条件为4 ℃冰箱过夜,次日继续洗膜3次,加入相应二抗,在4 ℃孵育2 h后洗膜3次;吸取适量的Super ECL Plus超敏发光液滴加到PVDF膜蛋白条带上,使用BioSpectrum 810 Imaging System系统采集图像,利用凝胶成像系统曝光并使用ImageJ软件进行分析。
1.8 慢病毒感染及感染细胞的筛选HT22细胞制备成悬液后以1×104/孔接种于96孔板上,设置梯度最佳感染复数MOI为5、10、20、30,加入病毒体积=细胞计数×2×MOI/病毒滴度,根据荧光表达情况选择感染效率最佳MOI。使用1/2小体积感染法:在倒置荧光显微镜下观察培养瓶中细胞生长状态和密度,密度达60%时,弃旧培养基,加PBS缓冲液冲洗一次并更换新的完全培养基,同时加入最佳MOI值所对应的慢病毒量和1/2体积完全培养基和助转剂,待感染4 h后再加入另一半新鲜培养基和助转剂,感染16 h后,将含病毒的培养基换为普通完全培养基。实验分为4组:空病毒组(LV-NC)、空病毒+Aβ31-35组(LV-NC+Aβ31-35)、慢病毒过表达STX17组(LV-OE STX17)、慢病毒过表达STX17+Aβ31-35组(LV-OE STX17+Aβ31-35)。
1.9 实时荧光定量PCR(Real-Time PCR,RT-PCR)检测在各组细胞加入500 μL RNAisoPlus,冰上充分裂解后收集于EP管中,进行总RNA提取、溶解及浓度检测;进行RNA的反转录,以cDNA为模板进行扩增。PCR上游引物:5′-GGAAACCTTAGAAGCGGACTT-3′,下游引物:5′-TCAACATTCACAGCGGCAC-3′。所有结果与对照组GAPDH的表达量进行标化,采用2-ΔΔCt法对目的基因mRNA水平进行相对定量。实验分为3组:普通对照组(Control)、普通对照组+空载组(LV-NC)、普通对照组+载体组(LV-OESTX17)。
1.10 统计学分析采用SPSS 16.0统计软件进行分析,计量资料以x±s表示,组间比较采用完全随机两独立样本t检验,多组间比较采用单因素方差分析,组间差异采用最小显著法(LSD)进行比较,检验水准α=0.05。
2 结果 2.1 生物信息学分析AD患者中STX17表达水平通过WGCNA包的算法,根据无尺度网络分布拟合,选取β=8作为软阈值(图 1A),并计算基因间的相关性矩阵和TOM,使用TOM构建基因间分层聚类树,合并相似模块后得到40个模块(图 1B),其中黑色模块和浅橙色模块与AD的相关性最高(图 1C)。因此黑色模块和浅橙色模块可以作为与AD密切相关的枢纽模块。而后将两个模块的基因分别与自噬基因库和SNARE家族基因取交集,仅有黑色模块提取出STX17(图 1D、E)。
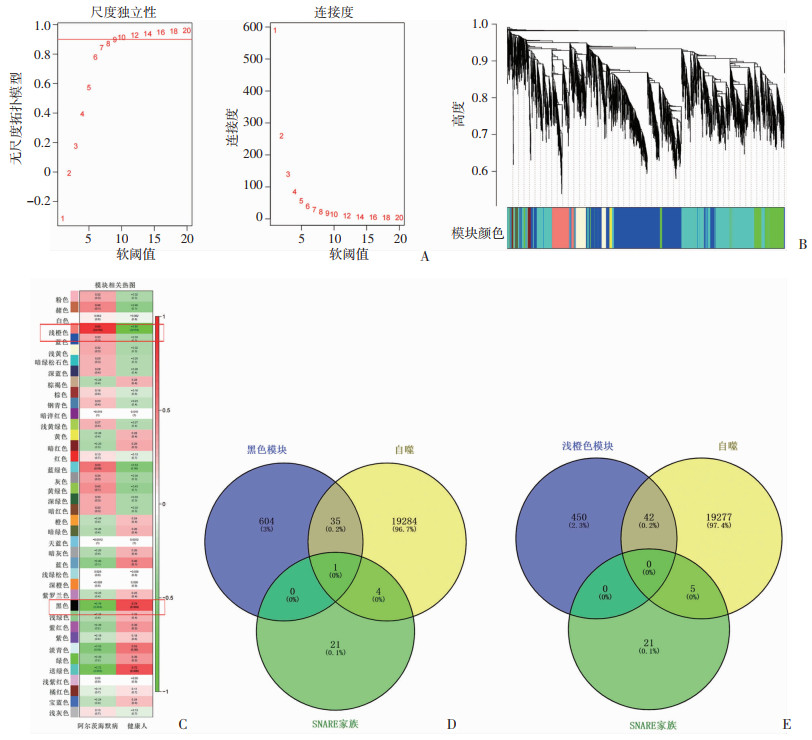
|
| A:基于GSE111737表达数据的软阈值确定;B:基因表达的聚类分析 确定不同的共表达数据模块;C:基因模块与AD之间的相关性热图;D:黑色模块与自噬基因库和SNARE家族基因库取交集;E:浅橙色模块与自噬基因库和SNARE家族基因库取交集 图 1 STX17基因在阿尔茨海默病中表达异常 |
2.2 Aβ31-35可诱导C57BL/6小鼠海马组织和HT22海马神经细胞的STX17蛋白表达下调
与对照组比较,海马内注射Aβ31-35诱导了C57BL/6小鼠海马组织STX17蛋白表达(0.72±0.28)显著降低(P < 0.05,图 2A)。进一步离体研究发现,Aβ31-35作用后,HT22海马神经细胞STX17蛋白表达(0.78±0.16)也较对照组显著降低(P < 0.05,图 2B)。
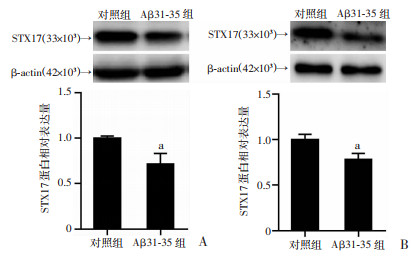
|
|
a:P < 0.05,与对照组比较 A:Western blot检测小鼠海马组织中STX17蛋白的表达及半定量分析;B:Western blot检测HT22海马细胞中STX17蛋白的表达及半定量分析 图 2 Aβ31-35诱导小鼠海马组织和HT22细胞中STX17蛋白表达降低(n=6,x±s) |
2.3 Aβ31-35导致HT22海马神经细胞死亡
5 μmol/L Aβ31-35作用24 h后,HT22海马神经细胞存活率为(81.81±11.65)%,较对照组显著降低(P < 0.05,图 3),表明Aβ31-35对海马神经细胞产生明显的毒性作用。
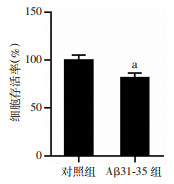
|
| a:P < 0.05,与对照组比较 图 3 Aβ31-35对HT22细胞存活率的影响(n=6,x±s) |
2.4 Aβ31-35诱导小鼠海马神经细胞自噬相关蛋白LC3Ⅱ、P62蛋白表达升高
经海马内注射Aβ31-35后,小鼠海马组织LC3Ⅱ的表达(1.23±0.22)较对照组显著升高(P < 0.05),P62的表达(1.22±0.16)较对照组显著升高(P < 0.05),见图 4A。同样的,Aβ31-35作用HT22海马神经细胞后,细胞中LC3Ⅱ的表达较对照组显著升高(P < 0.05),P62的表达较对照组显著升高(P < 0.05),见图 4B。
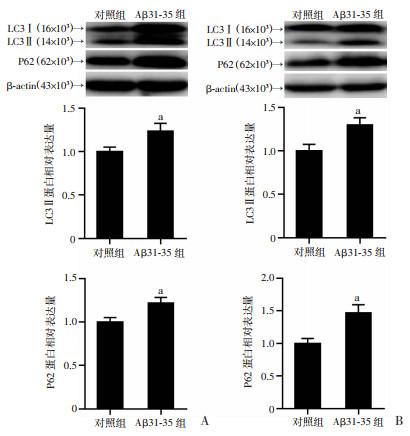
|
|
a:P < 0.05,与对照组比较 A:Western blot检测小鼠海马组织中LC3Ⅱ、P62蛋白表达及半定量分析;B:Western blot检测HT22海马细胞中LC3Ⅱ、P62蛋白表达及半定量分析 图 4 Aβ31-35诱导小鼠海马组织和HT22细胞中LC3、P62蛋白表达升高(n=6,x±s) |
2.5 过表达STX17逆转Aβ31-35诱导的HT22海马神经细胞存活率降低
上海吉凯公司协助构建慢过表达STX17病毒载体(OE STX17,图 5A),设置MOI值,在倒置荧光显微镜下观察细胞感染情况,结果显示MOI=20时荧光强度较高(图 5B),故选用MOI=20用于后续实验;与对照组比较,慢病毒OE STX17感染使HT22海马神经细胞STX17 mRNA表达水平显著升高(P < 0.05,图 5C)。STX17过表达的HT22海马神经细胞存活率为(101.91±13.81)%,较Aβ31-35处理组(79.21±8.75)%显著上升(P < 0.05,图 6),说明过表达STX17可以逆转Aβ诱导的HT22海马神经细胞存活率降低。
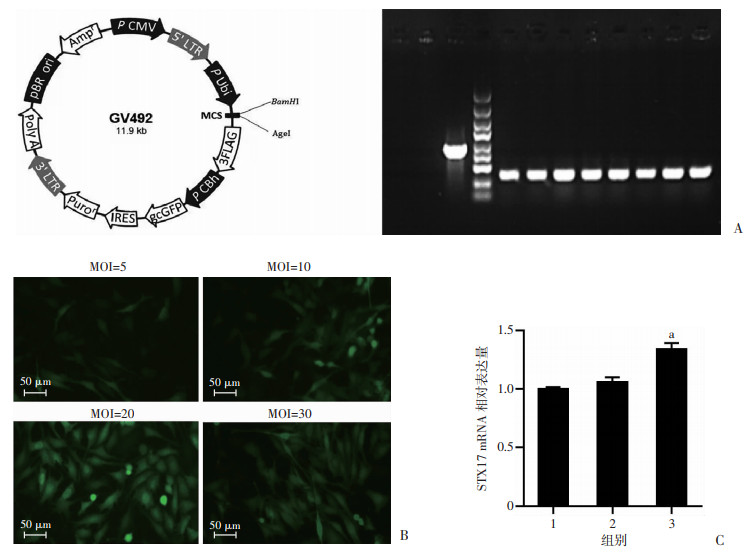
|
| A:上海吉凯公司提供的构建过表达慢病毒载体;B:MOI为5、10、20、30的GFP荧光图;C:RT-PCR检测LV-OE STX17 mRNA表达情况 1:Control;2:LV-NC组; 3:LV-OESTX17;a:P < 0.05,与Control和LV-NC组比较 图 5 OE STX17感染使HT22海马神经细胞STX17 mRNA表达水平显著升高(n=6,x±s) |
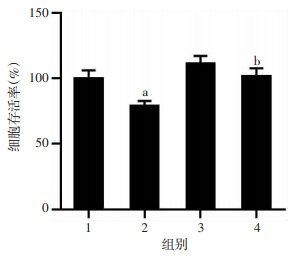
|
| 1:LV-NC组;2:LV-NC+Aβ31-35组;3:LV-OE STX17组;4:LV-OE STX17+Aβ31-35组;a:P < 0.05,与LV-NC组比较,b:P < 0.05,与LV-NC+Aβ31-35组比较 图 6 过表达STX17逆转了Aβ31-35诱导的HT22海马神经细胞存活率降低(n=6,x±s) |
2.6 过表达STX17逆转Aβ31-35诱导的HT22海马神经细胞LC3Ⅱ和P62蛋白升高
慢病毒感染HT22海马神经细胞过表达STX17后,LC3 Ⅱ蛋白表达(0.89±0.23)较Aβ31-35处理组(1.30±0.25)显著降低(P < 0.05,图 7A),P62蛋白表达(0.97±0.29)较Aβ31-35处理组(1.34±0.26)显著降低(P < 0.05,图 7B),表明过表达STX17后拮抗了Aβ31-35诱导的小鼠海马神经细胞LC3 Ⅱ和P62蛋白表达升高。
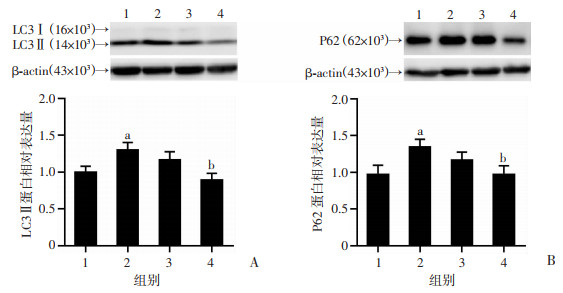
|
|
1:LV-NC组;2:LV-NC+Aβ31-35组;3:LV-OE STX17组;4:LV-OE STX17+Aβ31-35组;a:P < 0.05,与LV-NC组比较,b:P < 0.05,与LV-NC+Aβ31-35组比较 A : Western blot检测LC3Ⅱ蛋白表达及半定量分析;B:Western blot检测P62蛋白表达及半定量分析 图 7 STX17过表达拮抗Aβ31-35诱导的海马神经细胞LC3Ⅱ和P62蛋白表达升高(n=6,x±s) |
3 讨论
本研究通过生物信息学发现AD患者海马组织中STX17表达水平异常,Aβ31-35导致小鼠海马神经细胞存活率下降,诱导了STX17蛋白表达下降和自噬相关蛋白LC3Ⅱ、P62表达升高,使用慢病毒感染HT22海马神经细胞来过表达STX17后,改善了Aβ31-35诱导的海马神经细胞存活率降低和逆转了LC3Ⅱ、P62蛋白表达升高。
AD发病机制不清,目前有多种学说[10],例如Aβ毒性学说、Tau蛋白过度磷酸化学说、氧化应激学说、炎症学说和胆碱能损伤学说等[11],进一步揭示AD发病机制和寻找潜在干预靶点尤为重要。研究发现,AD发生过程中伴有自噬功能障碍[12],AD患者以及AD小鼠模型大脑皮质和海马神经元内存在大量的自噬泡的异常聚集,提示AD过程中存在自噬体和溶酶体融合障碍[13]。在自噬过程中,STX17可与囊泡相关蛋白8(VAMP8)、可溶性NSF黏附蛋白29(SNAP29)形成SNARE复合体共同介导自噬小体与溶酶体的融合,且有研究表明AD患者死后脑样本中SNARE复合体水平降低[14],提示SNARE蛋白复合体与AD的发生或发展相关。本研究采用WGCNA分析GSE 111737数据集获得40个与AD临床特征相关的模块,其中以salmon和black模块的相关性最为显著,而后将自噬基因库和SNARE家族基因与salmon模块和black模块中的基因取交集,最终得到1个AD发病关键基因——STX17基因。
STX17蛋白是自噬体和溶酶体融合的关键蛋白,主要位于内质网和细胞质。STX17蛋白具有特殊的发夹结构,有助于其向自噬体转移[15],转位到自噬体的STX17,募集细胞质中SNAP29与VAMP8并结合形成STX17-VAMP8-SNAP29复合物,介导自噬体与溶酶体的融合。当自噬体和溶酶体融合发生障碍时就会导致自噬流受阻,进而导致细胞内损伤的细胞器和异常蛋白质聚集。通常,评价自噬功能状态主要有2个指标,分别是LC3和P62。LC3是自噬小体膜上特征性标记,自噬形成时,胞浆型LC3(即LC3-1)会酶解掉一小段多肽,转变为膜型(即LC3-Ⅱ),LC3-Ⅱ/Ⅰ比值的大小可在一定程度上评估自噬水平的高低。因此,LC3蛋白的表达高低在某种程度上可以反映自噬小体形成的活跃程度[16]。P62作为自噬选择性底物,在自噬功能正常即自噬流通畅的情况可以被降解,当LC3蛋白升高,P62蛋白水平也升高的情况下提示自噬流受阻,反之,当P62蛋白水平降低时提示自噬流通畅,自噬功能正常[17]。STX17的耗竭阻断了STX17-VAMP8-SNAP29复合物的形成,并损害了溶酶体和自噬体的融合,导致自噬体的积累[18],自噬流受阻,进而导致自噬标记物LC3蛋白和底物P62蛋白表达水平升高[19]。研究证实,在AD模型小鼠脑内STX17蛋白表达明显下调[20]。本研究结果显示,经Aβ31-35的处理后,在体和离体水平小鼠海马神经组织和细胞STX17蛋白表达均显著下调,自噬标志性蛋白LC3Ⅱ、P62表达升高。提示STX17蛋白在阿尔茨海默病的发展进程中起重要作用。
本研究进一步证实STX17蛋白表达异常是否是神经细胞死亡的重要原因。如前文所述,STX17蛋白在调控自噬过程中发挥着重要作用。当自噬过程异常时能导致自噬性细胞死亡,一种程序性细胞死亡[21]。研究发现,STX17可以通过增强自噬通量和减少内质网应激依赖性神经元凋亡来改善缺血/再灌注诱导的神经元损伤[22]。STX17过表达恢复了自噬通量,并且缓解了柯萨奇病毒B3诱导的溶酶体功能障碍,并减少了HeLa细胞中柯萨奇病毒B3感染诱导的细胞凋亡[23]。本研究采用慢病毒感染HT22海马神经细胞来过表达STX17基因进行实验,结果显示LV-OE STX17后改善了Aβ31-35导致的细胞存活率降低。可见,STX17可以有效逆转AD神经细胞死亡,并与细胞自噬功能密切相关,早期合理调控STX17蛋白水平对于减少AD神经细胞死亡意义重大。
| [1] |
LONG J M, HOLTZMAN D M. Alzheimer disease: an update on pathobiology and treatment strategies[J]. Cell, 2019, 179(2): 312-339. |
| [2] |
TIWARI S, ATLURI V, KAUSHIK A, et al. Alzheimer's disease: pathogenesis, diagnostics, and therapeutics[J]. Int J Nanomed, 2019, 14: 5541-5554. |
| [3] |
DI MECO A, CURTIS M E, LAURETTI E, et al. Autophagy dysfunction in Alzheimer's disease: mechanistic insights and new therapeutic opportunities[J]. Biol Psychiatry, 2020, 87(9): 797-807. |
| [4] |
CHEN G F, XU T H, YAN Y, et al. Amyloid beta: structure, biology and structure-based therapeutic development[J]. Acta Pharmacol Sin, 2017, 38(9): 1205-1235. |
| [5] |
KASTANENKA K V, BUSSIERE T, SHAKERDGE N, et al. Immunotherapy with aducanumab restores calcium homeostasis in Tg2576 mice[J]. J Neurosci, 2016, 36(50): 12549-12558. |
| [6] |
LUO Y N, ZHOU S Q, HAEIWA H, et al. Role of amber extract in protecting SHSY5Y cells against amyloid β1-42-induced neurotoxicity[J]. Biomed Pharmacother, 2021, 141: 111804. |
| [7] |
BREWER G J, HERRERA R A, PHILIPP S, et al. Age-related intraneuronal aggregation of amyloid-β in endosomes, mitochondria, autophagosomes, and lysosomes[J]. J Alzheimers Dis, 2020, 73(1): 229-246. |
| [8] |
YIN Y, LI E, SUN G, et al. Effects of DHA on hippocampal autophagy and lysosome function after traumatic brain injury[J]. Mol Neurobiol, 2018, 55(3): 2454-2470. |
| [9] |
KATO S, ARASAKI K, TOKUTOMI N, et al. Syntaxin 17, an ancient SNARE paralog, plays different and conserved roles in different organisms[J]. J Cell Sci, 2021, 134(22): jcs258699. |
| [10] |
FAN L Y, MAO C Y, HU X C, et al. New insights into the pathogenesis of Alzheimer's disease[J]. Front Neurol, 2020, 10: 1312. |
| [11] |
GARCÍA-MESA Y, COLIE S, CORPAS R, et al. Oxidative stress is a central target for physical exercise neuroprotection against pathological brain aging[J]. J Gerontol A Biol Sci Med Sci, 2016, 71(1): 40-49. |
| [12] |
ZHANG Z G, YANG X F, SONG Y Q, et al. Autophagy in Alzheimer's disease pathogenesis: therapeutic potential and future perspectives[J]. Ageing Res Rev, 2021, 72: 101464. |
| [13] |
ZHAO Y, ZHANG Y D, ZHANG J, et al. Molecular mechanism of autophagy: its role in the therapy of Alzheimer's disease[J]. Curr Neuropharmacol, 2020, 18(8): 720-739. |
| [14] |
SHARMA M, BURRÉ J, SVDHOF T C. Proteasome inhibition alleviates SNARE-dependent neurodegeneration[J]. Sci Transl Med, 2012, 4(147): 147r. |
| [15] |
ITAKURA E, MIZUSHIMA N. Syntaxin 17: the autophagosomal SNARE[J]. Autophagy, 2013, 9(6): 917-919. |
| [16] |
SONG T T, SU H F, YIN W, et al. Acetylation modulates LC3 stability and cargo recognition[J]. FEBS Lett, 2019, 593(4): 414-422. |
| [17] |
WU Y Y, ZHENG B R, CHEN W Z, et al. Expression and role of autophagy related protein p62 and LC3 in the Retina in a rat model of acute ocular hypertension[J]. Int J Ophthalmol, 2020, 13(1): 21-28. |
| [18] |
JIA R, GUARDIA C M, PU J, et al. BORC coordinates encounter and fusion of lysosomes with autophagosomes[J]. Autophagy, 2017, 13(10): 1648-1663. |
| [19] |
ZHANG L, FANG Y, ZHAO X Y, et al. BRUCE silencing leads to axonal dystrophy by repressing autophagosome-lysosome fusion in Alzheimer's disease[J]. Transl Psychiatry, 2021, 11(1): 421. |
| [20] |
HERRING A, MVNSTER Y, AKKAYA T, et al. Kallikrein-8 inhibition attenuates Alzheimer's disease pathology in mice[J]. Alzheimers Dement, 2016, 12(12): 1273-1287. |
| [21] |
SIQUEIRA M, RIBEIRO R M, TRAVASSOS L H. Autophagy and its interaction with intracellular bacterial pathogens[J]. Front Immunol, 2018, 9: 935. |
| [22] |
CHEN L, XIA Y F, SHEN S F, et al. Syntaxin 17 inhibits ischemic neuronal injury by resuming autophagy flux and ameliorating endoplasmic Reticulum stress[J]. Free Radic Biol Med, 2020, 160: 319-333. |
| [23] |
TIAN L, YANG Y Y, LI C Y, et al. The cytotoxicity of coxsackievirus B3 is associated with a blockage of autophagic flux mediated by reduced syntaxin 17 expression[J]. Cell Death Dis, 2018, 9(2): 242. |





