在伤口愈合问题的最高层面上涉及两个领域:愈合不足和愈合过度。人类拥有独特的病理性愈合过度负担,可形成病理性瘢痕,临床上主要分为瘢痕疙瘩和增生性瘢痕两类[1]。病理性瘢痕是一种真皮纤维增生性疾病[2]。在自然发展过程中,增生性瘢痕大多经历了基质增殖、稳定和成熟的过程;相反,瘢痕疙瘩却很少成熟,并且不遵循与正常和增生性瘢痕相同的进化、稳定和消退的模式[3]。在临床表现上,这两种异常类型的瘢痕都涉及胶原的过度沉积,但瘢痕疙瘩的临床特点是在原始伤口边界之外广泛生长,具有侵袭性,不会消退[4-6],而增生性瘢痕的临床特点则是在原始伤口边缘内或周围的非侵袭性生长[7]。当前病理性瘢痕的治疗方法主要有皮质类固醇注射治疗、手术切除、激光疗法等多种方法[8],增生性瘢痕通常不耐药,在手术后也不会频繁复发[9],而瘢痕疙瘩往往存在较高的耐药性和复发率。
研究发现,上皮间质转化(epithelium-to-mesenchymal transition,EMT)在病理性瘢痕的形成及发展中起到重要的作用。EMT是指不同类型的上皮细胞在不同因素的影响下,通过一系列生物学变化转化为间充质细胞的生物学过程[10]。EMT过程主要表现为上皮细胞标志物如E-cadherin表达降低,间充质标志物如Vimentin表达升高,此外EMT转化的细胞表达更多的基质金属蛋白酶-9(matrix metalloprotein-9, MMP-9)以降解细胞外基质,进而促进细胞迁移[11]。
肿瘤坏死因子-α(tumor necrosis factor alpha, TNF-α) 是巨噬细胞所释放的细胞因子,在宿主对感染的初始反应和各种全身性免疫介导疾病的发病机制中起核心作用[12], 文献[13-14]也证实了炎症因子TNF-α诱导的EMT在人体皮肤伤口愈合中的作用和机制。二肽基肽酶-4 (dipeptidyl-peptidase 4,DPP4,又称CD26)是一种具有丝氨酸蛋白酶活性的蛋白水解酶,后进一步发现其具有T细胞活化的作用[15]。在一项关于胰腺癌生长及转移的研究中发现, CD26可能诱导EMT过程促进胰腺癌的侵袭表型,抑制CD26可以抑制EMT调控基因的表达[16]。此前, 本课题组已通过对比瘢痕疙瘩表皮层边缘及中心EMT异质性, 探讨了其侵袭性的原因[17],由于增生性瘢痕与瘢痕疙瘩呈现出明显的临床表现差异,我们推测与EMT表达差异有关,TNF-α及CD26可能是其中的关键影响因素。因此,本研究通过对比分析增生性瘢痕、浅表扩张型瘢痕疙瘩的边缘和中心及正常皮肤组织学上的差异及E-cadherin、Vimentin、MMP-9、TNF-α、CD26的表达异质性,探究增生性瘢痕与瘢痕疙瘩临床表现差异的原因及其影响因素,探索病理性瘢痕潜在的治疗靶点以制定更优化的治疗方案。
1 资料与方法 1.1 临床资料纳入2020年10月至2021年8月于本院整形烧伤外科行瘢痕疙瘩及增生性瘢痕切除手术的患者各10例,共10个浅表扩张型瘢痕疙瘩组织和10个增生性瘢痕组织。纳入标准:①符合瘢痕疙瘩疾病和增生性瘢痕疾病的临床诊断标准;②符合浅表扩张型瘢痕疙瘩的定义,即中央区域较萎缩,质软色浅,边缘区域充血隆起,呈持续性浸润生长,病程大于1年;③处于增生期的增生性瘢痕(瘢痕发生3~12个月, 特征为瘢痕明显突起皮肤, 肿胀充血, 表面鲜红, 质地较硬, 明显痒痛不适);④均未接受过治疗的病例。另收集需要进行部分正常皮肤切除手术的患者8例,共8个正常皮肤组织, 患者均知情同意。本研究通过西南医科大学附属医院伦理委员会的批准(KY2019090)。
将瘢痕疙瘩和增生性瘢痕每个标本分为中心及边缘两部分,中心定义为处于瘢痕中央的部位,边缘定义为瘢痕生长外缘与周围健康皮肤相接的部位。分别进行HE、免疫组化染色及Western blot观测。
共纳入瘢痕疙瘩标本10例,男性患者4例,女性患者6例,年龄26~54岁,病史1~12年;其中5例来源于前胸部,3例来源于肩背部,2例来源于上臂。共纳入增生性瘢痕标本10例,男性患者3例,女性患者7例,年龄22~38岁,病史3~12个月;其中5例来源于腹部,3例来源于前臂部,2例来源于大腿部。正常皮肤标本8例,6例为术中需要切除的正常皮肤(3例来源于胸腹部,3例来源于大腿部), 2例为皮片移植术中从全厚皮上修剪掉的多余正常皮肤组织(均来源于腹部);其中男性患者4例,女性患者4例,年龄20~50岁。
1.2 组织学分析所有组织标本采集后15 min内固定于10%中性甲醛溶液中24~48 h,石蜡包埋。
1.2.1 HE染色包埋后对组织蜡块进行切片,切片厚度约4 μm,进行HE染色(武汉赛维尔生物技术有限公司,中国)、封片等。HE染色后在显微镜下(Olympus, BX53, 东京,日本)观察组织学特征。
1.2.2 免疫组织化学染色将石蜡组织4 μm厚连续切片,常规脱蜡至水,修复仪80 ℃抗原修复。以抗E-cadherin(1 ∶200;SantaCruz,美国)、Vimentin(1 ∶50;SantaCruz,美国)、MMP-9(1 ∶50;SantaCruz,美国)、TNF-α(1 ∶200;Novus,德国)、CD26(1 ∶200;CST,美国)的单克隆抗体为一抗,辣根过氧化物酶标记的兔抗鼠IgG为二抗(中杉金桥,中国),使用DAB染色试剂盒(中杉金桥,中国)进行显色,苏木精复染(百灵威, 中国),脱水透明封片后在显微镜(Olympus, BX 53, 东京,日本)下检测棕色抗体,以反映与抗原结合的抗体的存在。阳性区域呈棕色染色,目标蛋白的表达水平由棕色阴影显示。每个标本在高倍镜(×400)下任意选择表皮层的5个不重叠视野,利用Image J软件分析系统测量并记录图像IOD值,再对每例标本所对应所有的平均光密度值(IOD值/分布面积)进行分析。
1.3 Western blot检测将收集的瘢痕样本组织去除真皮及皮下组织,保留表皮组织,在液氮低温状态下研磨成粉末,加入含有蛋白酶抑制剂的裂解液冰浴15 min,同时用细胞超声进一步促进细胞裂解提取蛋白质,4 ℃,12 000 r/min离心40 min,收集上清液。使用BCA蛋白质浓度测定试剂盒测定样品蛋白浓度,100 ℃水浴锅蛋白变性,电泳、转膜、封闭,根据抗体说明书加入稀释后的一抗,4 ℃孵育过夜;TBST洗膜3次,每次10 min;室温孵育特异性二抗(1 ∶5 000)1 h,TBST漂洗4次,每次5 min,加入化学发光底物使用凝胶成像系统显影,使用Image J软件对目的条带的灰度进行分析和计算,记录5组组织目的蛋白条带的灰度值与内参蛋白GAPDH灰度值的比值,进行半定量分析后,采用SPSS 22.0比较各组间表达水平的差异,绘制成图。
1.4 统计学分析采用SPSS 22.0软件进行统计学分析,计量资料以x±s表示,多样本均数间的比较采用单因素方差分析,两两比较采用LSD-t法,检验水准α=0.05。
2 结果 2.1 瘢痕疙瘩内部存在明显异质性,而增生性瘢痕内部则表现出均一性增生性瘢痕与瘢痕疙瘩表皮层均较正常皮肤增厚,且瘢痕疙瘩更加明显;瘢痕疙瘩表皮层内部表现出明显的差异,边缘表皮层类似树根样向真皮层内部延伸,邻近真皮处的角质形成细胞形态改变,而在表皮层的中心部分则仅呈现为扁平的增厚,从中心到边缘表皮层分支逐渐变细变长;增生性瘢痕表皮层内部表现较均一,仅有部分表皮层有轻微的深入真皮趋势,但其分支量及深入程度不及瘢痕疙瘩明显(图 1)。
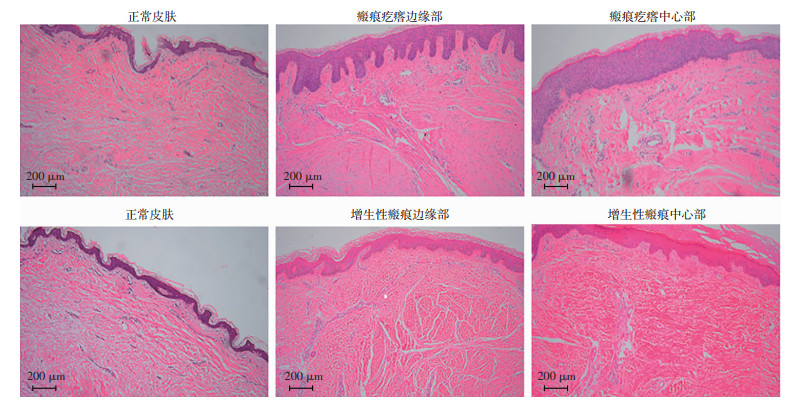
|
| 瘢痕疙瘩边缘表皮明显增厚,呈树根样向真皮层延伸,分支细长;增生性瘢痕边缘表皮稍增厚,轻微深入真皮;瘢痕疙瘩中心部仅表现为表皮层扁平增厚;增生性瘢痕中心部表现与边缘部类似 图 1 HE染色观察瘢痕疙瘩和增生性瘢痕边缘及中心部、正常皮肤的组织形态 |
2.2 EMT相关指标在病理性瘢痕中的表达
采用免疫组织化学方法对增生性瘢痕、浅表扩张型瘢痕疙瘩的边缘和中心及正常皮肤E-cadherin、Vimentin、MMP-9、TNF-α、CD26的表达进行分析。结果表明,瘢痕疙瘩和增生性瘢痕边缘及中心表皮层E-cadherin表达较正常皮肤均明显减弱(P < 0.05),且瘢痕疙瘩边缘较中心明显减弱(P < 0.05),增生性瘢痕边缘及中心表现较均一,差异无统计学意义,见图 2。瘢痕疙瘩和增生性瘢痕边缘及中心表皮层Vimentin、MMP-9、TNF-α、CD26表达较正常皮肤均明显增强(P < 0.05),瘢痕疙瘩边缘显著高于增生性瘢痕(P<0.05),且瘢痕疙瘩边缘显著高于中心(P < 0.05),增生性瘢痕边缘及中心表现较均一,差异无统计学意义,见图 3~6。
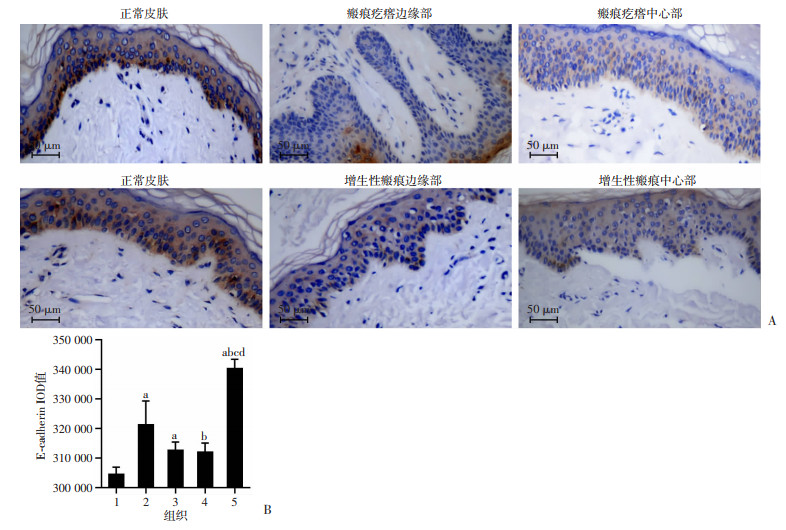
|
| A:免疫组化观察正常皮肤、瘢痕疙瘩和增生性瘢痕边缘及中心部E-cadherin的表达;B:正常皮肤、瘢痕疙瘩和增生性瘢痕边缘及中心部E-cadherin表达的IOD值 1:瘢痕疙瘩边缘部;2:瘢痕疙瘩中心部;3:增生性瘢痕边缘部;4:增生性瘢痕中心部;5:正常皮肤;a:P<0.05,与瘢痕疙瘩边缘部比较;b:P<0.05,与瘢痕疙瘩中心比较;c:P<0.05,与增生性瘢痕中心比较;d:P<0.05,与增生性瘢痕边缘比较 图 2 免疫组织化学检测瘢痕疙瘩和增生性瘢痕边缘及中心部、正常皮肤的E-cadherin表达 |
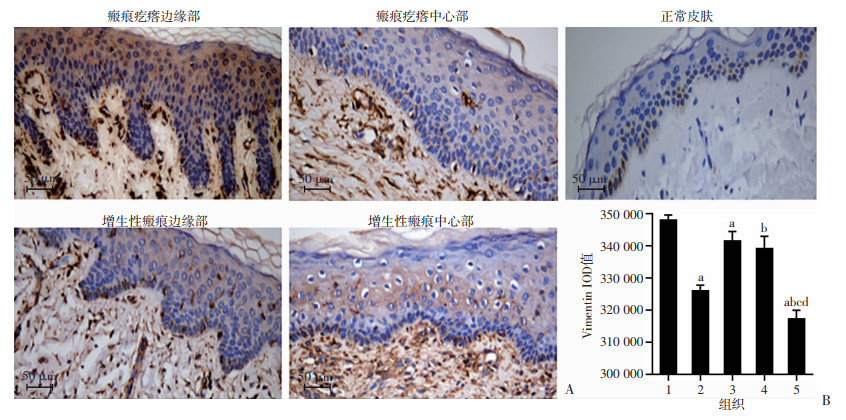
|
| A:免疫组化观察正常皮肤、瘢痕疙瘩和增生性瘢痕边缘及中心部Vimentin的表达;B:正常皮肤、瘢痕疙瘩和增生性瘢痕边缘及中心部Vimentin表达的IOD值 1:瘢痕疙瘩边缘部;2:瘢痕疙瘩中心部;3:增生性瘢痕边缘部;4:增生性瘢痕中心部;5:正常皮肤;a:P<0.05,与瘢痕疙瘩边缘部比较;b:P<0.05,与瘢痕疙瘩中心比较;c:P<0.05,与增生性瘢痕中心比较;d:P<0.05,与增生性瘢痕边缘比较 图 3 免疫组织化学检测瘢痕疙瘩和增生性瘢痕边缘及中心部、正常皮肤的Vimentin表达 |
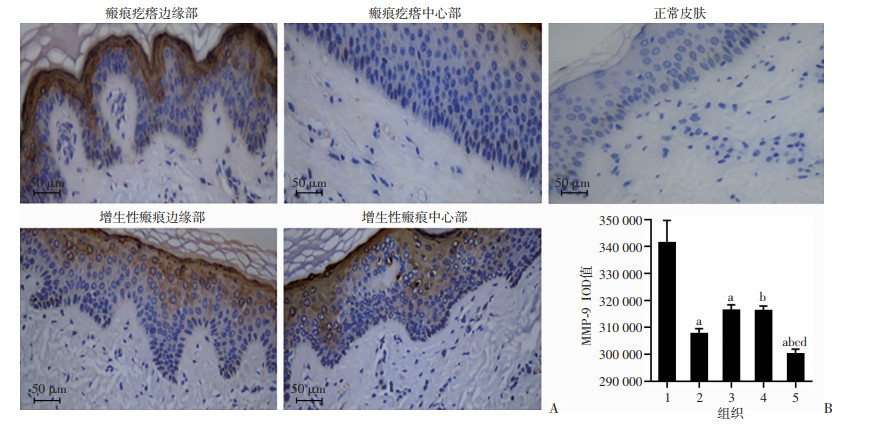
|
| A:免疫组化观察正常皮肤、瘢痕疙瘩和增生性瘢痕边缘及中心部MMP-9的表达;B:正常皮肤、瘢痕疙瘩和增生性瘢痕边缘及中心部MMP-9表达的IOD值 1:瘢痕疙瘩边缘部;2:瘢痕疙瘩中心部;3:增生性瘢痕边缘部;4:增生性瘢痕中心部;5:正常皮肤;a:P<0.05,与瘢痕疙瘩边缘部比较;b:P<0.05,与瘢痕疙瘩中心比较;c:P<0.05,与增生性瘢痕中心比较d:P<0.05,与增生性瘢痕边缘比较 图 4 免疫组织化学检测瘢痕疙瘩和增生性瘢痕边缘及中心部、正常皮肤的MMP-9表达 |
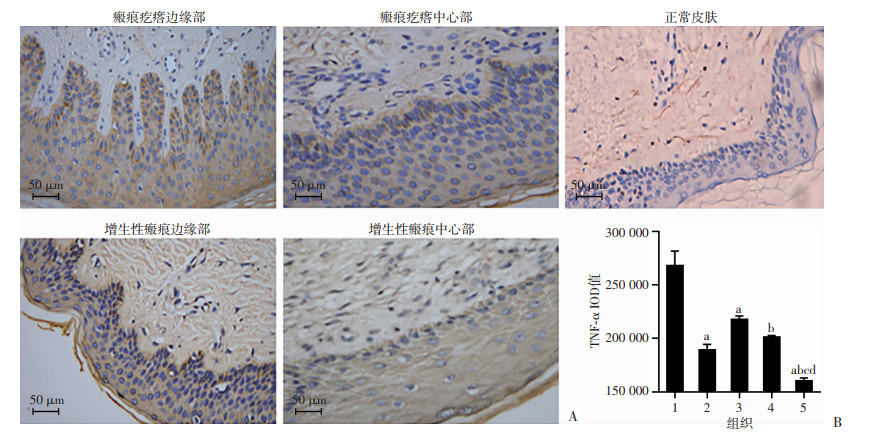
|
| A:免疫组化观察正常皮肤、瘢痕疙瘩和增生性瘢痕边缘及中心部TNF-α的表达;B:正常皮肤、瘢痕疙瘩和增生性瘢痕边缘及中心部TNF-α表达的IOD值 1:瘢痕疙瘩边缘部;2:瘢痕疙瘩中心部;3:增生性瘢痕边缘部;4:增生性瘢痕中心部;5:正常皮肤;a:P<0.05,与瘢痕疙瘩边缘部比较;b:P<0.05,与瘢痕疙瘩中心比较;c:P<0.05,与增生性瘢痕中心比较;d:P<0.05,与增生性瘢痕边缘比较 图 5 免疫组织化学检测瘢痕疙瘩和增生性瘢痕边缘及中心部、正常皮肤的TNF-α表达 |
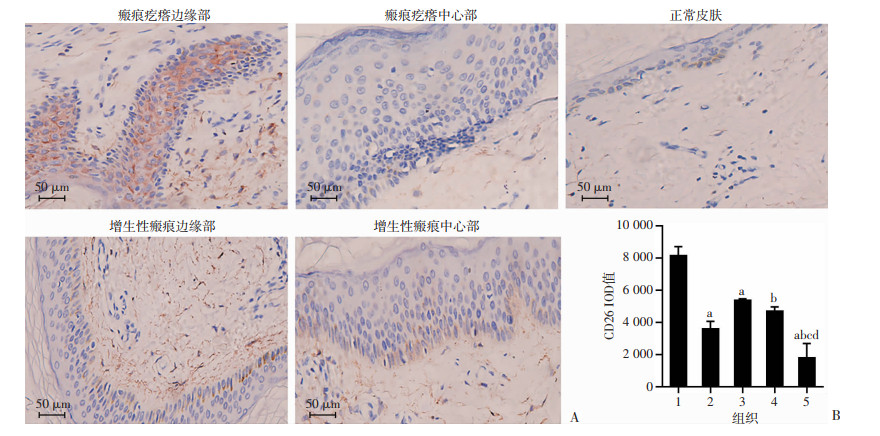
|
| A:免疫组化观察正常皮肤、瘢痕疙瘩和增生性瘢痕边缘及中心部CD26的表达;B:正常皮肤、瘢痕疙瘩和增生性瘢痕边缘及中心部CD26表达的IOD值 1:瘢痕疙瘩边缘部;2:瘢痕疙瘩中心部;3:增生性瘢痕边缘部;4:增生性瘢痕中心部;5:正常皮肤;a:P<0.05,与瘢痕疙瘩边缘部比较;b:P<0.05,与瘢痕疙瘩中心比较;c:P<0.05,与增生性瘢痕中心比较;d:P<0.05,与增生性瘢痕边缘比较 图 6 免疫组织化学检测瘢痕疙瘩和增生性瘢痕边缘及中心部、正常皮肤的CD26表达 |
2.3 Western blot检测EMT相关指标在病理性瘢痕中的表达
瘢痕疙瘩和增生性瘢痕E-cadherin蛋白表达相比于正常皮肤明显减弱(P<0.05), 瘢痕疙瘩边缘较中心显著减弱(P<0.05),增生性瘢痕边缘与中心差异无统计学意义;瘢痕疙瘩和增生性瘢痕Vimentin、MMP-9、TNF-α、CD26蛋白表达较正常皮肤明显增强(P<0.05),瘢痕疙瘩边缘较其中心表达显著增强(P<0.05),增生性瘢痕边缘与中心差异无统计学意义,见图 7。
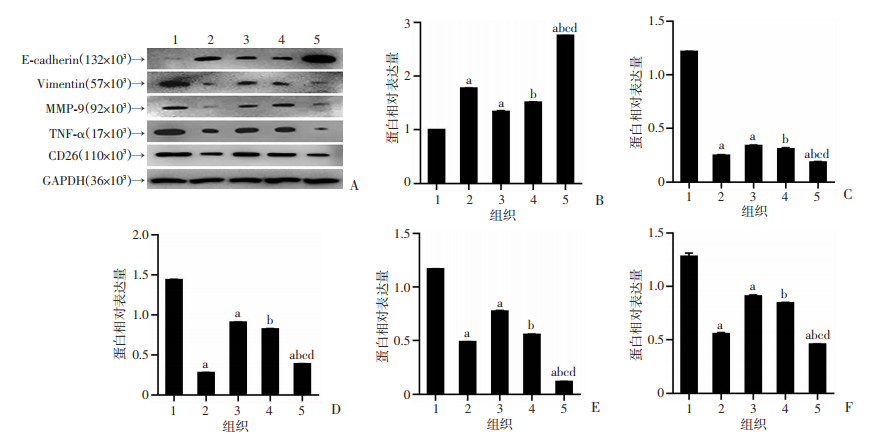
|
| A:Western blot检测结果;B~F:分别为不同部位的皮肤组织E-cadherin、Vimentin、MMP-9、TNF-α、CD26蛋白的表达 1:瘢痕疙瘩边缘部;2:瘢痕疙瘩中心部;3:增生性瘢痕边缘部;4:增生性瘢痕中心部;5:正常皮肤;a:P<0.05,与瘢痕疙瘩边缘部比较;b:P<0.05,与瘢痕疙瘩中心比较;c:P<0.05,与增生性瘢痕中心比较;d:P<0.05,与增生性瘢痕边缘比较 图 7 Western blot检测不同部位的皮肤组织E-cadherin、Vimentin、MMP-9、TNF-α、CD26蛋白的表达 |
3 讨论
病理性瘢痕是指皮肤经历严重损伤后在愈合过程中发生过度纤维化的一种病变组织[12]。由于增生性瘢痕和瘢痕疙瘩在自然发展和临床表现上存在着明显的差异性[18],使得针对它们的治疗效果和研究方向各异。上皮间质转化(EMT)是创面愈合中重要的过程,而该过程中不同因素引起的细胞外基质破坏和沉积失衡会导致病理性瘢痕组织形成[19]。目前,已有许多研究阐述并支持EMT在病理性瘢痕形成中的作用[20]。本课题组前期研究在一定程度上解释了EMT可能是瘢痕疙瘩边缘侵袭性生长的原因之一[17],但既往研究大多集中于对同一类型病理性瘢痕的单独研究,缺乏增生性瘢痕和瘢痕疙瘩的对比研究,通过本研究或可有助于解释其二者临床表现上的明显差异,同时为指导增生性瘢痕和瘢痕疙瘩的治疗提供新的思路。
本研究表明,瘢痕疙瘩及增生性瘢痕较正常皮肤在组织学和EMT程度上均存在差异,且瘢痕疙瘩内部存在明显差异性,而增生性瘢痕却呈现出整体较均一的表现。病理性瘢痕的特征是胶原生成过多,胶原是细胞外基质的一部分,已有证据表明EMT在其中起着关键作用[21]。同时,瘢痕疙瘩及增生性瘢痕E-cadherin表达明显弱于正常皮肤,且仅在瘢痕疙瘩内部存在异质性;瘢痕疙瘩及增生性瘢痕间充质标志物Vimentin、MMP-9表达明显强于正常皮肤,仅在瘢痕疙瘩内部存在异质性。以上结果表明,EMT在两种类型瘢痕中的高表达可能是病理性瘢痕胶原异常沉积的原因,而瘢痕疙瘩的EMT明显强于增生性瘢痕,且仅在其内部存在异质性解释了瘢痕疙瘩相较于增生性瘢痕独有的侵袭性生长、不稳定、不易消退的特点,而导致其差异的原因在下文将进行进一步分析。目前已有证据表明增生性瘢痕与瘢痕疙瘩可能是同一种疾病的不同形式[22],本研究为此增添了新的证据,未来在临床治疗上应更加强调瘢痕疙瘩的特殊性,可在常用治疗手段上辅以关键分子的靶点治疗。
TNF-α与正常的原代角质形成细胞共培养时可诱导其向成纤维细胞转化[2],TNF-α在病理性瘢痕中高表达并诱导EMT可能是影响其异常发展的重要机制。本研究表明,瘢痕疙瘩及增生性瘢痕TNF-α表达显著高于正常皮肤,且瘢痕疙瘩边缘显著高于中心,而增生性瘢痕边缘与中心则无明显差异,与其EMT表达程度一致。此外,本研究还发现在增生性瘢痕某些炎症浸润区域的网状上皮卷曲程度较边缘及中心明显。结合以上结果表明,TNF-α是EMT活跃程度的重要影响因素。
CD26具有广泛的生物活性底物和免疫调节特性,参与不同的生理和病理过程并起到重要作用[23]。最近,几种蛋白酶逐渐步入人们视线,成为治疗纤维化疾病的药物开发焦点[24]。在一项关于胰腺癌生长及转移的研究中发现,CD26可能诱导EMT过程促进胰腺癌的侵袭表型,抑制CD26可以抑制EMT调控基因的表达[16]。因为CD26在肿瘤生长及转移中起到重要的作用,且参与诱导EMT过程,所以考虑CD26可能也是病理性瘢痕EMT活跃程度的重要影响因素。本研究表明,CD26几乎只存在于正常皮肤的真皮中,而在增生性瘢痕与瘢痕疙瘩的表皮和真皮中均存在且呈显著增加,瘢痕疙瘩边缘部最甚,在CD26高表达的瘢痕区域胶原沉积也更多,预示着CD26对病理性瘢痕形成起到一定的促进作用。CD26可通过影响细胞外主要成纤维细胞簇(如mFB1和mFB2)的产生来调节细胞外基质的生成,从而导致瘢痕的胶原过度沉积[25],应用CD26抑制剂后也发现其可通过干扰细胞外基质的产生和组织来改善瘢痕的形成[26]。本研究显示,相较于正常皮肤,CD26在病理性瘢痕的表皮中也存在,其表达程度似乎与EMT表达程度存在正比关系。既往研究表明CD26具有T细胞活化的作用,可能通过调节炎症反应从而诱导EMT发生,还可以调节Periostin,是EMT的标志物和诱导物[27],说明CD26可能影响EMT的活跃程度。此外,CD26可降低TGF-β1介导的α-SMA的表达,调节肌成纤维细胞的分化,与特异性基因敲除的程度相当[28],但其并不是通过干扰TGF-β1的经典通路如SMAD和ERK信号通路来发挥作用[29], 对已知的非典型的TGF-β1信号通路也无干扰作用[30]。进一步研究发现,CD26至少部分通过Gsk3β调节TGF-β1信号[31-32],参与病理性瘢痕的形成,这在我们未来的研究中可行更深层次的探索。由此得知,CD26可能不仅影响病理性瘢痕的EMT程度,还在瘢痕发生、发展中的多个层面起重要的作用,其可能成为病理性瘢痕的潜在治疗靶点。
本研究发现,瘢痕疙瘩和增生性瘢痕均表现出较正常皮肤的EMT高表达,提示EMT参与了病理性瘢痕的发生及发展,然而EMT在瘢痕疙瘩内部表现出活跃程度的异质性,而在增生性瘢痕中整体活跃度较低且均一,似乎可以解释瘢痕疙瘩与增生性瘢痕的临床表现明显差异的原因,TNF-α可能是影响其中的关键因素。此外,本研究发现CD26在一定程度上促进病理性瘢痕的形成,同时其可能也是EMT的重要影响因素,是病理性瘢痕的关键因子,有望成为治疗病理性瘢痕的潜在靶点。未来在治疗病理性瘢痕时可针对TNF-α、CD26进行重点治疗,除此之外,瘢痕疙瘩的治疗中予以重点部位关键分子治疗可能起到很好的效果。
| [1] |
KARPPINEN S M, HELJASVAARA R, GULLBERG D, et al. Toward understanding scarless skin wound healing and pathological scarring[J]. F1000Research, 2019, 8: F1000FacultyRev-F1000Faculty787. DOI: 10.12688/f1000research.18293.1.
|
| [2] |
OGAWA R. Keloid and hypertrophic scars are the result of chronic inflammation in the reticular dermis[J]. Int J Mol Sci, 2017, 18(3): 606. |
| [3] |
LIMANDJAJA G C, NIESSEN F B, SCHEPER R J, et al. Hypertrophic scars and keloids: overview of the evidence and practical guide for differentiating between these abnormal scars[J]. Exp Dermatol, 2021, 30(1): 146-161. |
| [4] |
EKSTEIN S F, WYLES S P, MORAN S L, et al. Keloids: a review of therapeutic management[J]. Int J Dermatol, 2021, 60(6): 661-671. |
| [5] |
BERMAN B, MADERAL A, RAPHAEL B. Keloids and hypertrophic scars: pathophysiology, classification, and treatment[J]. Dermatol Surg, 2017, 43(Suppl 1): S3-S18. |
| [6] |
SORG H, TILKORN D J, HAGER S, et al. Skin wound healing: an update on the current knowledge and concepts[J]. Eur Surg Res, 2017, 58(1/2): 81-94. |
| [7] |
GHAZAWI F M, ZARGHAM R, GILARDINO M S, et al. Insights into the pathophysiology of hypertrophic scars and keloids: how do they differ?[J]. Adv Skin Wound Care, 2018, 31(1): 582-595. |
| [8] |
ELSAIE M L. Update on management of keloid and hypertrophic scars: a systemic review[J]. J Cosmet Dermatol, 2021, 20(9): 2729-2738. |
| [9] |
OGAWA R, DOHI T, TOSA M, et al. The latest strategy for keloid and hypertrophic scar prevention and treatment: the Nippon Medical School (NMS) protocol[J]. J Nippon Med Sch, 2021, 88(1): 2-9. |
| [10] |
YUAN F L, SUN Z L, FENG Y, et al. Epithelial-mesenchymal transition in the formation of hypertrophic scars and keloids[J]. J Cell Physiol, 2019, 234(12): 21662-21669. |
| [11] |
GANDALOVIC ˇ OVÁ A, VOMASTEK T, ROSEL D, et al. Cell polarity signaling in the plasticity of cancer cell invasiveness[J]. Oncotarget, 2016, 7(18): 25022-25049. |
| [12] |
MURDACA G, SPANÒ F, CONTATORE M, et al. Potential use of TNF-α inhibitors in systemic sclerosis[J]. Immunotherapy, 2014, 6(3): 283-289. |
| [13] |
KUMA Y I, HOSOMICHI J, MAEDA H, et al. Intermittent hypoxia induces turbinate mucosal hypertrophy via upregulating the gene expression related to inflammation and EMT in rats[J]. Sleep Breath, 2021, 25(2): 677-684. |
| [14] |
VALATAS V, FILIDOU E, DRYGIANNAKIS I, et al. Stromal and immune cells in gut fibrosis: the myofibroblast and the scarface[J]. Ann Gastroenterol, 2017, 30(4): 393-404. |
| [15] |
辛宇, Melia Bogari, Zin Mar Aung, 等. CD26分子在正常皮肤组织和瘢痕疙瘩组织中成纤维细胞表达的差异分析[J]. 中国美容整形外科杂志, 2017, 28(1): 39-42. XIN Y, BOGARI M, AUNG Z M, et al. Analysis of expression of the CD26 marker on keloid fibroblasts[J]. Chin J Aesthetic Plast Surg, 2017, 28(1): 39-42. |
| [16] |
YE C, TIAN X, YUE G, et al. Suppression of CD26 inhibits growth and metastasis of pancreatic cancer[J]. Tumour Biol, 2016. |
| [17] |
杨雨婷, 刘兰, 丁晓斌, 等. 瘢痕疙瘩中心与边缘表皮层形态学和上皮间质转化相关指标表达的异质性研究[J]. 第三军医大学学报, 2021, 43(11): 1025-1031. YANG Y T, LIU L, DING X B, et al. Heterogeneity: epidermal morphology and expression of epithelial-mesenchymal transition-related factors between the center and margin of keloids[J]. J Third Mil Med Univ, 2021, 43(11): 1025-1031. |
| [18] |
HU M S, LONGAKER M T. Dipeptidyl peptidase-4, wound healing, scarring, and fibrosis[J]. Plast Reconstr Surg, 2016, 138(5): 1026-1031. |
| [19] |
LV K Y, XIA Z F, Chinese Consensus Panel on the Prevention and Treatment of Scars. Chinese expert consensus on clinical prevention and treatment of scar[J]. Burns Trauma, 2018, 6: 27. |
| [20] |
STONE R C, PASTAR I, OJEH N, et al. Epithelial-mesenchymal transition in tissue repair and fibrosis[J]. Cell Tissue Res, 2016, 365(3): 495-506. |
| [21] |
YUAN F L, SUN Z L, FENG Y, et al. Epithelial-mesenchymal transition in the formation of hypertrophic scars and keloids[J]. J Cell Physiol, 2019, 234(12): 21662-21669. |
| [22] |
HUANG C Y, AKAISHI S, HYAKUSOKU H, et al. Are keloid and hypertrophic scar different forms of the same disorder? A fibroproliferative skin disorder hypothesis based on keloid findings[J]. Int Wound J, 2014, 11(5): 517-522. |
| [23] |
IWANAGA T, NIO-KOBAYASHI J. Cellular expression of CD26/dipeptidyl peptidase Ⅳ[J]. Biomed Res, 2021, 42(6): 229-237. |
| [24] |
KANNO Y. The role of fibrinolytic regulators in vascular dysfunction of systemic sclerosis[J]. Int J Mol Sci, 2019, 20(3): 619. |
| [25] |
JIANG Y, YAO Y, LI J, et al. Functional dissection of CD26 and its pharmacological inhibition by sitagliptin during skin wound healing[J]. Med Sci Monit, 2021, 27: e928933. |
| [26] |
VORSTANDLECHNER V, LAGGNER M, COPIC D, et al. The serine proteases dipeptidyl-peptidase 4 and urokinase are key molecules in human and mouse scar formation[J]. Nat Commun, 2021, 12(1): 6242. |
| [27] |
KOMIYA E, OHNUMA K, YAMAZAKI H, et al. CD26-mediated regulation of periostin expression contributes to migration and invasion of malignant pleural mesothelioma cells[J]. Biochem Biophys Res Commun, 2014, 447(4): 609-615. |
| [28] |
MENOU A W, DUITMAN J, CRESTANI B. The impaired proteases and anti-proteases balance in Idiopathic Pulmonary Fibrosis[J]. Matrix Biol, 2018, 68/69: 382-403. |
| [29] |
HATA A, CHEN Y G. TGF-β signaling from receptors to smads[J]. Cold Spring Harb Perspect Biol, 2016, 8(9): a022061. |
| [30] |
VORSTANDLECHNER V, LAGGNER M, COPIC D, et al. The serine proteases dipeptidyl-peptidase 4 and urokinase are key molecules in human and mouse scar formation[J]. Nat Commun, 2021, 12(1): 6242. |
| [31] |
YANG F, XIONG H R, DUAN L, et al. MiR-1246 promotes metastasis and invasion of A549 cells by targeting GSK-3β-mediated Wnt/β-catenin pathway[J]. Cancer Res Treat, 2019, 51(4): 1420-1429. |
| [32] |
MA Z G, YUAN Y P, ZHANG X, et al. Piperine attenuates pathological cardiac fibrosis via PPAR-γ/AKT pathways[J]. EBioMedicine, 2017, 18: 179-187. |




