2. 400016 重庆,重庆市急救医疗中心:肝胆外科
2. Department of Hepatobiliary Surgery, Chongqing Emergency Medical Center, Chongqing, 400016, China
据最新全球癌症统计数据报告,肝细胞癌(hepatocellular carcinoma,HCC)的发病率居所有恶性肿瘤第6位,但致死率高居第3位[1]。侵袭与转移是导致肝癌高死亡率的主要原因,然而当前关于肝癌侵袭转移的分子机制仍没有完全阐明。透明质酸介导的细胞游走受体(hyaluronan-mediated motility receptor,HMMR)作为细胞外基质重要组成成分透明质酸的相关膜受体之一,在胶质瘤、乳腺癌、胃癌、结直肠癌、膀胱癌等多种人类恶性肿瘤中高表达[2-6],提示HMMR可能作为一个重要的肿瘤相关抗原参与并调控肿瘤的发生发展。相关研究还发现HMMR在HCC中的表达水平也显著增高,并且与HCC患者预后不良密切相关[7],进一步还发现HMMR高表达与HCC患者的临床分期和病理分级呈明显的正相关关系[8],这些结果揭示了HMMR可能在HCC的侵袭转移中发挥着作用。但截至目前,HMMR在HCC侵袭转移过程中发挥的具体作用及其分子机制仍不明了。因此本文旨在探究HMMR对HCC侵袭转移的作用及其可能的生物学机制。
1 材料与方法 1.1 材料 1.1.1 肝癌及癌旁组织样本12例肝癌及对应癌旁组织的冻存样本用于检测HMMR的表达水平。样本来源于2013年8月至2015年8月于重庆市急救医疗中心肝胆外科接受肝癌肝切除术的患者。肝癌组织样本经病理诊断证实为肝细胞癌。癌旁肝组织的获取参照《原发性肝癌规范化病理诊断指南》(2015年版),取自距离肿瘤组织1 cm以上的肝脏组织。术后3年内连续每年对患者进行追踪随访,经B超、CT、MRI等影像学检查发现肝内外转移者即诊断为肝癌伴转移。
1.1.2 细胞和动物肝癌细胞株MHCC97H购自复旦IBS细胞资源中心。细胞株L02、SK-Hep-1、Huh7和PLC/PRF/5由本实验室传代及保存。12只6周龄健康雄性裸鼠,体质量(20.6±1.2)g,购买并代养于重庆医科大学实验动物中心。
1.1.3 试剂高糖DMEM培养液、胎牛血清购自Gibco公司。Lipofectamine 2000转染试剂购自Thermo Fisher公司。Transwell小室购自美国Corning。HMMR抗体、E-cadherin、N-cadherin、Vimentin和GAPDH抗体购自Proteintech公司。MEK、p-MEK、ERK、p-ERK抗体购自Bioworld公司。靶向HMMR的慢病毒购自吉凯基因公司。MEK抑制剂U1026购自MCE公司。靶向HMMR的siRNA由吉玛基因公司设计并合成;相关引物均由上海生工合成。
1.2 方法 1.2.1 细胞转染和感染常规用高糖DMEM、10%胎牛血清和1%青链霉素双抗于37 ℃,5%CO2孵箱中培养细胞。参照吉玛公司提供的说明书溶解siRNA, 采用lipofectamine 2000转染试剂将靶向HMMR的siRNA转染至肝癌细胞构建沉默HMMR的细胞模型(siHMMR-1组、siHMMR-2组),同时转染与HMMR的序列无同源性的siRNA作为阴性对照(siNC组)。利用lipofectamine 2000转染试剂将携带HMMR的pcDNA3.1质粒转染至肝癌细胞构建HMMR过表达细胞模型(HMMR组),同时转染空白质粒作为阴性对照(pcDNA3.1组)。另一方面,稳定敲减HMMR细胞株(shHMMR组)的构建则根据吉凯基因提供的慢病毒感染手册进行操作,病毒感染后72 h在细胞中加入终浓度1.5 μg/mL的嘌呤霉素进行筛选,筛选7 d后将嘌呤霉素浓度减至1/4继续维持。同时构建空白敲减的细胞株作为阴性对照(shNC组)。
1.2.2 实时荧光定量PCR(qRT-PCR)检测适量TRIzol裂解细胞或组织样本,利用天根公司RNA提取试剂盒提取总RNA。取1 μg所提RNA,通过逆转录试剂盒获得相应cDNA。利用TaKaRa公司的SYBR Green试剂盒检测HMMR的mRNA水平。HMMR上游引物为:5′-AGCAACAGGAGGAAGACT-3′,下游引物为:5′-ATAGAGGAGACGCCACTT-3′。GAPDH上游引物为:5′-TATGACAACAGCCTCAAGAT-3′,下游引物为:5′-AGTCCTTCCACGATACCA-3′。PCR程度为:95 ℃,2 min;95 ℃,15 s,60 ℃,20 s,72 ℃,20 s,40个循环;72 ℃, 5 min。相对定量PCR结果采用2-ΔΔCt法分析。关于组织样本,以癌旁组织为对照,癌组织中HMMR的mRNA水平升高大于1.5倍的定义为HMMR高表达,而降低大于1.5倍的则定义为HMMR低表达。
1.2.3 Western blot检测取30 μg细胞或组织总蛋白经10% SDS-PAGE凝胶电泳,后转膜至PVDF膜,5%牛奶封闭2 h,TBST洗膜3次后加入一抗(抗HMMR 1 ∶2 000,抗E-cadherin 1 ∶1 000, 抗N-cadherin;1 ∶1 000, 抗Vimentin 1:2 000,抗p-MEK 1 ∶1 000, 抗MEK 1 ∶2 000,抗p-ERK 1 ∶1 000,抗ERK 1 ∶2 000,GAPDH 1 ∶5 000), 4℃摇床孵育过夜。次日洗膜后室温孵育抗兔或抗鼠二抗,ECL显影。
1.2.4 免疫组化实验石蜡包埋肝癌及癌旁组织切片,55 ℃烤箱过夜。次日,取出切片,再置于95 ℃烤箱,10 min。然后依次经历脱蜡、抗原修复、透膜,内源性过氧化物酶阻断剂室温封闭10 min。接着山羊工作血清室温封闭1 h。滴加一抗(1 ∶100,TBS稀释)后于4 ℃暗盒孵育过夜。次日,TBS清洗3次后滴加生物素标记二抗孵育1 h。DAB显色后,苏木精复染,梯度酒精、二甲苯脱水后中性树脂封片。显微镜下观察并拍照。
1.2.5 细胞划痕实验采用1 mg/mL丝裂霉素预处理细胞2 h,去除细胞增殖对迁移侵袭的影响。然后以30×104/孔接种至6孔板,次日细胞铺满整孔。10μL枪头垂直并均匀的横过细胞,造成“创口”。PBS清洗3次去除划下的细胞,加入无血清培养基培养,置于37 ℃,5%CO2培养箱中培养。按0、24 h取样,随机取5个视野拍照。根据公式计算:细胞迁移率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%。
1.2.6 Transwell实验沉默HMMR的MHCC97H细胞取8×104/小室,过表达HMMR以及10 μmol/L U1026处理48 h后的Huh7细胞分别取20×104/小室进行实验。接种至小室前细胞经丝裂霉素预处理,方法同前。①迁移:细胞用300 μL无血清培养基重悬后加入普通Transwell小室内,小室外加入800 μL常规培养基,置于孵箱中孵育;②侵袭:提前从-20 ℃冰箱取出含基质胶的Transwell小室置于24孔板中,小室内外加入适量无血清培养基后于孵箱中预热小室30 min。吸弃孔内外培养基,按照细胞迁移实验的操作步骤加入细胞。24 h后从孵箱中取出小室,PBS清洗2次,轻柔地用棉签擦净小室内膜的细胞,然后小室置于4%多聚甲醛中固定15 min。双蒸水清洗2次后,用0.1%结晶紫溶液染色30 min。双蒸水冲洗、晾干后,显微镜下拍照并随机选取5个视野计数穿过小室的细胞数。
1.2.7 裸鼠尾静脉肝癌肺转移模型12只裸鼠随机分为2组,每组6只。稳定敲减HMMR的MHCC97H细胞和空白敲减细胞,分别以灭菌生理盐水重悬后以2×106/300 μL经尾静脉注射入裸鼠体内。每3~5天观察小鼠存活情况。8周后处死裸鼠,取出肺组织,4%多聚甲醛固定,石蜡包埋、切片和HE染色。
1.3 统计学分析采用GraphPad Prism 8进行统计学分析,数据以x±s表示。两组间比较采用Student-t检验,两组以上比较采用单因素方差分析。采用卡方检验分析患者临床病理特征与HMMR表达的相关性。P < 0.05为差异具有统计学意义。
2 结果 2.1 肝癌患者不同临床病理特征中HMMR的表达采用卡方检验分析12例肝癌患者临床病理特征与HMMR表达水平的关系,发现HMMR的表达水平与肝癌TNM分期存在显著的相关性(表 1)。虽然5例伴有肺转移患者癌组织中HMMR的表达均增高,但数据分析并未检测到HMMR表达水平与肝癌肺转移之间的相关性,考虑可能与样本数偏少有关。
| 基本信息 | 数量 | HMMR的表达 | P值 | |
| 高(n=9) | 低(n=3) | |||
| 性别 | ||||
| 男 | 8 | 7 | 1 | 0.157 |
| 女 | 4 | 2 | 2 | |
| 年龄/岁 | ||||
| ≤50 | 2 | 1 | 1 | 0.371 |
| >50 | 10 | 8 | 2 | |
| AFP/μg·mL-1 | ||||
| ≤400 | 6 | 4 | 2 | 0.505 |
| >400 | 6 | 5 | 1 | |
| 肿瘤大小/cm | ||||
| ≤5 | 5 | 3 | 2 | 0.311 |
| >5 | 7 | 6 | 1 | |
| 肺转移 | ||||
| 有 | 5 | 5 | 0 | 0.091 |
| 无 | 7 | 4 | 3 | |
| TNM分期 | ||||
| Ⅰ+Ⅱ | 6 | 3 | 3 | 0.046 |
| Ⅲ+Ⅳ | 6 | 6 | 0 | |
2.2 HMMR在肝癌细胞系和肝癌组织中高表达
采用qRT-PCR和Western blot法检测正常人肝细胞L02和4种肝癌细胞系,以及12对肝癌和癌旁组织中HMMR的mRNA和蛋白表达水平。结果显示肝癌细胞中HMMR的表达水平均明显高于L02细胞(图 1A、B),并且HMMR的mRNA水平在高侵袭性肝癌细胞系MHCC97H的表达量最高,在低侵袭性肝癌细胞Huh7中的表达最低。此外,临床样本检测结果也发现肝癌组织中HMMR的相对表达水平高于癌旁组织(P < 0.05,图 1C、D),并且转移组肝癌组织中HMMR的相对表达水平明显高于非转移组(P < 0.05,图 1E、F)。以上结果提示HMMR可能在肝癌中发挥了促癌转移的作用。

|
| A:qRT-PCR检测正常肝细胞和肝癌细胞中HMMR mRNA的表达;B:Western blot检测正常肝细胞和肝癌细胞中HMMR蛋白表达及半定量分析;C:肝癌和癌旁组织中HMMR mRNA的表达;D:免疫组化观测肝癌和癌旁组织中HMMR的蛋白表达和定位;E:肝癌和癌旁组织中HMMR蛋白的表达 N:癌旁组织;T:癌组织;F:转移组和非转移组肝癌组织中HMMR mRNA的表达(n=6) 图 1 HMMR在肝癌细胞系和肝癌组织中的mRNA和蛋白表达水平 |
2.3 HMMR的表达对肝癌细胞迁移侵袭能力的影响
利用siRNA沉默MHCC97H细胞中HMMR的表达(图 2A), 划痕实验结果表明,siHMMR-1组、siHMMR-2组沉默HMMR表达后,细胞的“愈合”能力明显低于siNC组(P < 0.01,图 2B), Transwell实验也显示siHMMR-1组和siHMMR-2组细胞在有或无基质胶小室底滤膜上的数量较siNC组减少(P < 0.01,图 2C)。提示HMMR表达降低后细胞迁移和侵袭能力减弱。另一方面,过表达HMMR后(图 2D),HMMR组Huh7细胞的“愈合”率明显高于pcDNA3.1组(P < 0.01,图 2E),Transwell实验也显示HMMR组细胞穿透小室底膜的数量明显多于pcDNA3.1组(P < 0.01,图 2F),提示HMMR过表达后细胞迁移及侵袭能力增强。
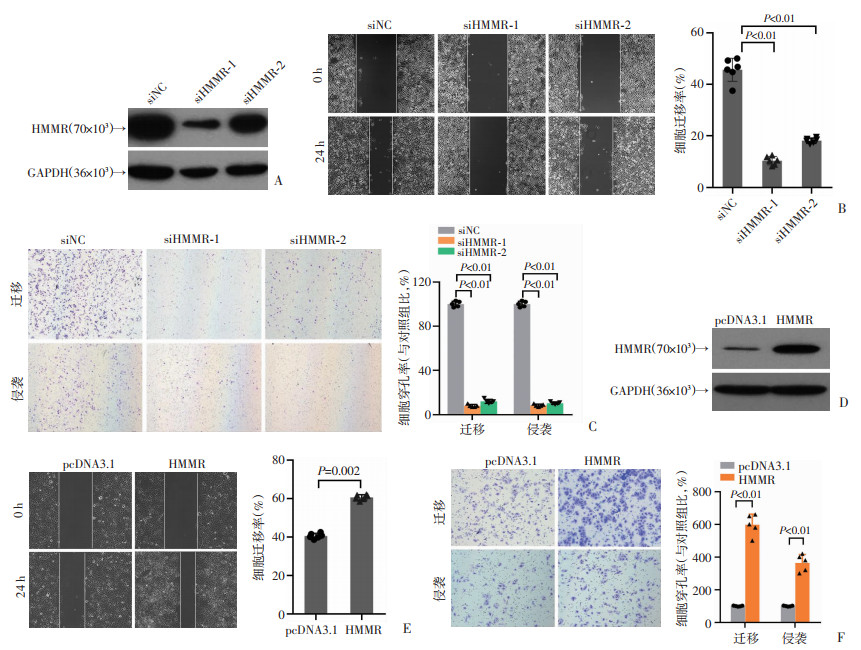
|
| A、D: Western blot检测沉默或过表达HMMR后细胞中HMMR的表达;B:沉默HMMR后划痕实验结果(100×);C:沉默HMMR后Transwell实验结果(200×);E:HMMR过表达后划痕实验结果(100×);F:HMMR过表达后Transwell实验结果(200×) 图 2 HMMR对肝癌细胞迁移侵袭能力的影响 |
2.4 HMMR的表达对肝癌细胞EMT的影响
采用Western blot检测沉默/过表达HMMR之后细胞中上皮间质转化(epithelialm-esencFhymal transition,EMT)相关蛋白E-cadherin、Vimentin和N-cadherin的表达变化。结果显示,与对照组比较,沉默HMMR后N-cadherin和Vimentin的表达下调,E-cadherin表达上调;而过表达HMMR后N-cadherin和Vimentin的表达上调,E-cadherin表达下调,差异均有统计学意义(P < 0.05,图 3)。
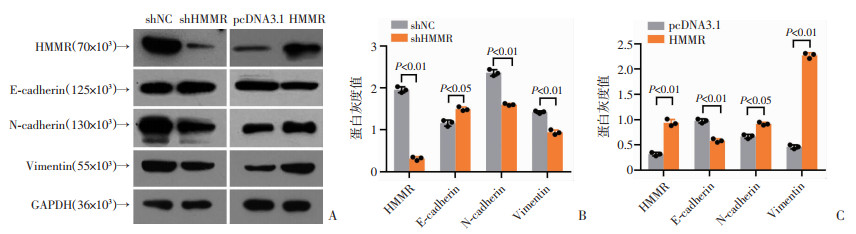
|
| A: Western blot检测沉默/过表达HMMR后细胞中EMT相关蛋白的表达;B:沉默HMMR后细胞中EMT相关蛋白表达的灰度值;C:过表达HMMR后细胞中EMT相关蛋白表达的灰度值 图 3 沉默/过表达HMMR后EMT相关蛋白表达水平的变化 |
2.5 HMMR表达变化对肝癌肺转移的影响
通过尾静脉注射HMMR稳定沉默的MHCC97H细胞和对照组细胞(图 4A),结果显示,稳定沉默HMMR的肝癌细胞引起的小鼠肺转移病灶的数量明显低于shNC对照组(P < 0.05,图 4B、C)。
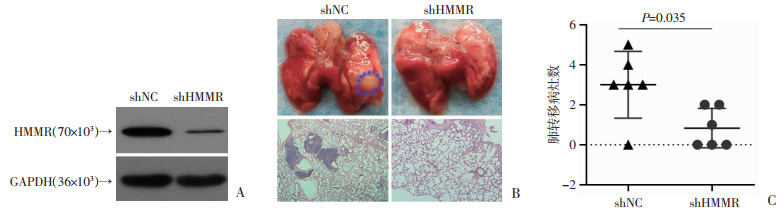
|
| A: Western blot检测稳定沉默HMMR的细胞株中HMMR的表达;B:HE染色观察裸鼠肝癌细胞肺转移(200×);C:肺转移计数 图 4 HMMR对肝癌细胞肺转移的影响 |
2.6 HMMR表达变化对MEK/ERK信号通路的影响
通过Western blot检测HMMR对细胞中MEK、ERK、p-MEK以及p-ERK的蛋白水平的影响,结果见图 5A,过表达HMMR后,细胞中p-MEK和p-ERK的表达水平显著上调(P < 0.01),但MEK和ERK的蛋白表达水平无明显变化(P>0.05)。采用MEK抑制剂U1026处理细胞48 h,结果发现处理后的细胞中上调的p-MEK和p-ERK的蛋白表达水平明显下调(P < 0.01),但MEK和ERK的蛋白表达水平无明显变化(P>0.05)。并且抑制剂处理后的细胞其迁移侵袭能力也显著降低(P < 0.01,图 5B),证实MEK/ERK信号通路介导了HMMR对肝癌细胞迁移侵袭的促进作用。
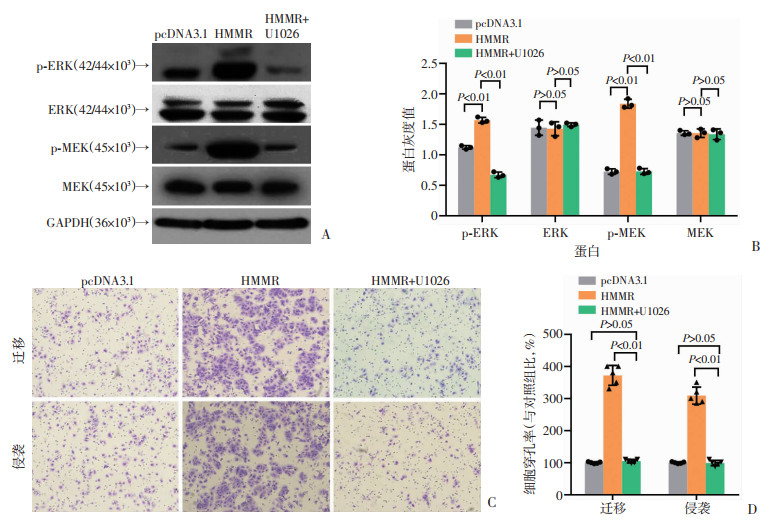
|
| A: Western blot检测MEK、p-MEK、ERK、p-ERK蛋白的表达及半定量分析;B:Transwell实验检测细胞迁移侵袭能力的变化(×200) 图 5 过表达HMMR经MEK抑制剂U1026处理后对各组细胞MEK/ERK信号通路的影响 |
3 讨论
肝细胞癌是我国人民因癌症死亡的主要病因之一,而导致HCC高致死率的最主要原因就是转移和术后复发。现有的分子靶向药物索拉菲尼等虽可一定程度延长晚期肝癌患者的生命,但仍无法防治肝癌复发和转移。因此,深入研究HCC侵袭转移的发生机制,探索能够预测、监测HCC转移的潜在标记物,甚至找到能够有效延缓或终止肝癌转移的方法,是解决目前肝癌治疗难题的关键措施,对实现个体化治疗,延长患者生存时间具有重要意义。
研究报道HMMR通过参与细胞运动从而在多种恶性肿瘤的发生、发展中发挥关键作用[10]。在HCC中,王敏等[11]和黄晨阳等[12]均报道HMMR在肝癌组织的表达水平显著高于癌旁正常组织,并且高表达HMMR的肝癌患者预后较差。同时,细胞水平的研究还发现HMMR可以促进肝癌细胞的增殖[12]。然而,HMMR在HCC转移中的作用尚不清楚。本研究首先在细胞层面证实HMMR在肝癌细胞系中高表达,并且发现高侵袭性肝癌细胞中HMMR的表达量显著高于低侵袭性肝癌细胞。接着,在临床样本中检测发现HMMR与转移性HCC之间的潜在关系,提示HMMR可能在HCC的侵袭转移中具有重要作用。鉴于肝癌的侵袭深度和远处转移是导致患者预后差的关键因素,为了明确HMMR在HCC侵袭转移中的作用,本研究分别以MHCC97H和Hun7细胞为研究对象进行一系列体内外实验,结果发现沉默HMMR可以抑制肝癌细胞的迁移侵袭和肺转移,而过表达HMMR可以增强肝癌细胞的迁移侵袭能力。另有研究发现HMMR在伤口愈合过程中增加并促进细胞迁移,这一过程可能与EMT密切相关[13]。ZHANG等[14]研究发现HMMR通过激活TGF-β/Smad2信号通路诱导EMT并增强胃癌细胞的干细胞特性。LU等[15]报道在头颈癌中高表达HMMR后下游富集最显著的通路依次是KRAS信号路径、EMT相关通路等。然而,在肝细胞癌中HMMR与EMT的关系尚不明确。本研究结果发现沉默HMMR可以上调E-cadherin的表达,同时下调N-cadherin和Vimentin的表达;而过表达HMMR后E-cadherin的表达却下降,N-cadherin和Vimentin表达增高,提示HMMR表达变化可以调控EMT,HMMR可能通过EMT进程参与调控HCC的侵袭转移。
透明质酸与其受体相互作用引发的细胞内一系列复杂的信号通路是透明质酸参与细胞运动调节的主要机制。CD44和HMMR是细胞表面两种主要的透明质酸受体。既往研究围绕CD44开展的比较多,已有报道透明质酸结合CD44可以通过激活SRC/MEK/ERK,PI3K/AKT/mTOR,以及PI3K-4EBP1-SOX2等信号通路调控肿瘤细胞的干性、增殖、迁移和侵袭[16-17]。而作为透明质酸的主要受体之一的HMMR,现有研究对于其发挥生物学功能的分子机制却报道极少。ASSMANN等[18]发现HMMR可以与细胞内的激酶、钙调蛋白和细胞骨架微管蛋白结合,提示HMMR可能参与细胞骨架重组。MISSINATO等研究[19]发现透明质酸与HMMR结合后可通过激活SRC/FAK信号通路最终引起心外膜细胞EMT和迁移。以上这些研究提示HMMR被激活后可能也是通过细胞内信号的级联放大反应来发挥生物学功能的。在前人研究的基础上[9],本研究还发现在肝癌细胞内HMMR的表达变化可以引起MEK/ERK信号通路活性的改变;且MEK抑制剂可以明显减弱高表达HMMR所引起的细胞迁移侵袭能力的增加,以及MEK和ERK磷酸化水平的升高,证实HMMR可通过调控MEK/ERK信号通路参与调控肝癌细胞的迁移侵袭。MEK/ERK信号通路是丝裂原活化蛋白激酶级联反应的经典通路,也是研究最多的激酶通路,其在肿瘤细胞的迁移和转移过程中有着不可或缺的作用。本研究结果证实HMMR在肝癌侵袭转移中的关键作用,同时也揭示HMMR促进肝癌细胞转移的潜在分子机制,为探索肝癌新型分子标记物以及预防肝癌侵袭转移新方法提供一定的理论依据。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. |
| [2] |
LI J Y, JI X J, WANG H D. Targeting long noncoding RNA HMMR-AS1 suppresses and radiosensitizes glioblastoma[J]. Neoplasia, 2018, 20(5): 456-466. |
| [3] |
LU X Q, ZHANG J Q, ZHANG S X, et al. Identification of novel hub genes associated with gastric cancer using integrated bioinformatics analysis[J]. BMC Cancer, 2021, 21(1): 697. |
| [4] |
KANG H G, KIM W J, KANG H G, et al. Galectin-3 interacts with C/EBPβ and upregulates hyaluronan-mediated motility receptor expression in gastric cancer[J]. Mol Cancer Res, 2020, 18(3): 403-413. |
| [5] |
CHEN W G, GAO C, LIU Y, et al. Bioinformatics analysis of prognostic miRNA signature and potential critical genes in colon cancer[J]. Front Genet, 2020, 11: 478. |
| [6] |
YANG D, MA Y, ZHAO P C, et al. Systematic screening of protein-coding gene expression identified HMMR as a potential independent indicator of unfavorable survival in patients with papillary muscle-invasive bladder cancer[J]. Biomed Pharmacother, 2019, 120: 109433. |
| [7] |
SHEN S, KONG J J, QIU Y W, et al. Identification of core genes and outcomes in hepatocellular carcinoma by bioinformatics analysis[J]. J Cell Biochem, 2019, 120(6): 10069-10081. |
| [8] |
DAI Q H, LIU T, GAO Y C, et al. Six genes involved in prognosis of hepatocellular carcinoma identified by Cox hazard regression[J]. BMC Bioinformatics, 2021, 22(1): 167. |
| [9] |
ZHANG S, CHANG M C, ZYLKA D, et al. The hyaluronan receptor RHAMM regulates extracellular-regulated kinase[J]. J Biol Chem, 1998, 273(18): 11342-11348. |
| [10] |
HE Z C, MEI L, CONNELL M, et al. Hyaluronan mediated motility receptor (HMMR) encodes an evolutionarily conserved homeostasis, mitosis, and meiosis regulator rather than a hyaluronan receptor[J]. Cells, 2020, 9(4): E819. |
| [11] |
王敏, 陈泽峰, 韩志伟, 等. 基于TCGA数据库分析肝细胞肝癌组织中HMMR表达与患者临床特征及预后的相关性[J]. 现代肿瘤医学, 2021, 29(7): 1173-1178. WANG M, CHEN Z F, HAN Z W, et al. The correlation between the expression of HMMR and clinical characteristics and prognosis of hepatocellular carcinoma based on TCGA database[J]. J Mod Oncol, 2021, 29(7): 1173-1178. |
| [12] |
黄晨阳, 李强, 程斌. HMMR促进原发性肝癌细胞增殖且与不良预后的相关性[J]. 国际检验医学杂志, 2020, 41(7): 861-866. HUANG C Y, LI Q, CHENG B. Clinical significance of HMMR expression in liver cancer patients and its influence on proliferation of liver cancer cell[J]. Int J Lab Med, 2020, 41(7): 861-866. |
| [13] |
YE S, LIU Y, FULLER A M, et al. TGFβ and hippo pathways cooperate to enhance sarcomagenesis and metastasis through the hyaluronan-mediated motility receptor (HMMR)[J]. Mol Cancer Res, 2020, 18(4): 560-573. |
| [14] |
ZHANG H Z, REN L L, DING Y, et al. Hyaluronan-mediated motility receptor confers resistance to chemotherapy via TGFβ/Smad2-induced epithelial-mesenchymal transition in gastric cancer[J]. FASEB J, 2019, 33(5): 6365-6377. |
| [15] |
LU T Z, ZHENG Y H, GONG X C, et al. High expression of hyaluronan-mediated motility receptor predicts adverse outcomes: a potential therapeutic target for head and neck squamous cell carcinoma[J]. Front Oncol, 2021, 11: 608842. |
| [16] |
YANG C X, SHENG Y M, SHI X X, et al. CD44/HA signaling mediates acquired resistance to a PI3Kα inhibitor[J]. Cell Death Dis, 2020, 11(10): 831. |
| [17] |
GOMEZ K E, WU F L, KEYSAR S B, et al. Cancer cell CD44 mediates macrophage/monocyte-driven regulation of head and neck cancer stem cells[J]. Cancer Res, 2020, 80(19): 4185-4198. |
| [18] |
ASSMANN V, JENKINSON D, MARSHALL J F, et al. The intracellular hyaluronan receptor RHAMM/IHABP interacts with microtubules and actin filaments[J]. J Cell Sci, 1999, 112(Pt 22): 3943-3954. |
| [19] |
MISSINATO M A, TOBITA K, ROMANO N, et al. Extracellular component hyaluronic acid and its receptor Hmmr are required for epicardial EMT during heart regeneration[J]. Cardiovasc Res, 2015, 107(4): 487-498. |




