蛛网膜下腔出血(subarachnoid hemorrhage,SAH)是出血性中风的一种类型,幸存者通常会留下永久性残疾、认知缺陷(尤其是执行功能和短期记忆)和心理健康症状(例如抑郁,焦虑),导致与健康相关的生活质量显著下降[1-2]。SAH后早期脑损伤(early brain injury, EBI)是指各种原因引起的SAH发生后的72 h内全脑的急性损伤,可能是发生脑血管痉挛以及神经后遗症的重要原因。已经有研究表明:血小板源性生长因子受体(platelet-derived growth factor receptor,PDGFR)信号传导在原肠胚形成以及颅神经、心脏神经、性腺、肺脏、肠道、皮肤、骨骼等发育中具有重要作用[3],在血管形成和早期造血中也已经明确了PDGFR信号转导的作用[1]。PDGF信号传导与多种疾病有关。在脑出血的实验小鼠模型中,纤溶酶激活PDGF-DD有助于炎症和巨噬细胞浸润[4]。在前期实验中,我们发现PDGFR通路和氧化应激通路均能介导早期脑损伤,并提出两者可能在一定程度上相互影响[5-6]。本研究通过建立大鼠SAH模型,设立24、48 h两个时间节点,研究SAH后抑制PDGFR活化及活性氧(reactive oxygen species,ROS)对早期脑损伤的作用,探讨它们影响SAH后早期脑损伤的可能机制,以期为临床治疗提供新的思路和靶点。
1 材料与方法 1.1 实验动物及分组48只成年雄性健康Sprague-Dawley大鼠购自重庆医科大学实验动物中心,体质量(290±20)g,分为假手术组(sham)、SAH组、PDGF受体抑制组(Imatinib)和ROS抑制组(N-乙酸半胱氨酸,N-acetyl-L-cysteine, NAC),每组12只。参考文献[6]报道的血管内穿刺方法建立SAH模型:采用5%水合氯醛(0.6 mL/100 g)+ 2%戊巴比妥钠(0.2 mL/100 g)麻醉大鼠,行颈部正中纵行切口,结扎左侧颈外动脉后,经残端插入尼龙线,至颈内动脉到大脑中动脉和大脑前动脉分叉处刺破血管壁。手术完成后,置大鼠于加温垫上,直至自主
呼吸恢复。假手术组(sham组)同样进行手术步骤,但尼龙线不插破血管。sham组、SAH组术后1 h按体质量给予1.2 mL/kg生理盐水,Imatinib组与NAC组分别于术后1 h给予Imatinib(120 mg/kg)[5-6]和NAC(200 mg/kg)[7]腹腔注射。分别于术后24、48 h收集标本。
根据文献[8]报道的方法,将脑底面及脑桥腹侧面分为6个部分,每部分按出血量多少进行评分(0~3分),共18分,分值越大,出血越严重。≤8分及≥16分均不纳入[9]。若动物死亡,则随机补充以保证样本量。本实验中共死亡8只大鼠,总死亡率为14.29%。本研究的动物实验方案经重庆医科大学实验动物伦理委员会核准。
1.2 试剂Phospho-PDGF Receptor β小鼠抗大鼠单克隆抗体、PDGF Receptor β小鼠抗大鼠单克隆抗体、β-tubulin兔抗大鼠单克隆抗体、Phospho-SAPK/JNK小鼠抗大鼠单克隆抗体、SAPK/JNK小鼠抗大鼠单克隆抗体、c-Jun兔抗大鼠单克隆抗体、Phospho-c-Jun兔抗大鼠单克隆抗体均为美国CST公司产品;NAC HRP标记山羊抗兔IgG、HRP标记山羊抗鼠IgG为Beyotime (中国)公司产品。
1.3 大鼠神经行为学评分SAH后24、48 h,按改良的Garcia法进行评定。从四肢活动度、自主性活动、前肢伸展、体侧本体感觉、爬坡和触须反应6个方面对大鼠行为进行评价,每项3分,总分18分,得分越低说明大鼠神经功能缺失越明显。
1.4 脑含水量测定大鼠麻醉后,快速断头取脑。脑组织切为4个部分,称湿质量后放入55 ℃烘箱中烘烤72 h,再称干质量,脑含水量=(湿质量-干质量)/湿质量×100%。
1.5 Western blot检测动物以5%水合氯醛(0.6 mL/100 g)+2%戊巴比妥钠(0.2 mL/100 g)麻醉,剖开胸腔,暴露心脏,以4 ℃预冷的PBS溶液作左心室灌注(1 mL/kg),剪开右心耳,灌注至右心耳流出液变清亮后断头取脑,分作2份(即双侧大脑半球)。样本先以液氮冷冻后于-80 ℃保存。经过蛋白质提取、蛋白浓度测定后配制成2 μg/μL的待测液,行SDS-PAGE电泳,转膜,孵育,发光显色后使用Image lab对目标条带进行定量分析。
1.6 MDA含量和ROS水平的测定取大鼠新鲜脑组织研磨匀浆,用MDA检测试剂盒(Beyotime,中国)和ROS检测试剂盒(Beyotime,中国)测定。
1.7 统计学分析采用SPSS 20.0统计软件,计量资料用x±s表示。两组间差异比较采用独立样本t检验,多组间比较采用单因素分析,事后检验采用Dunnett’s检验比较对照组和实验组间的差异。检验水准:α=0.05。
2 结果 2.1 抑制PDGFR活化和ROS可以改善SAH后早期脑损伤 2.1.1 SAH评分比较与SAH组相比,Imatinib组及NAC组的SAH评分无明显差异(图 1),表明手术对大鼠整体产生的应激相似。
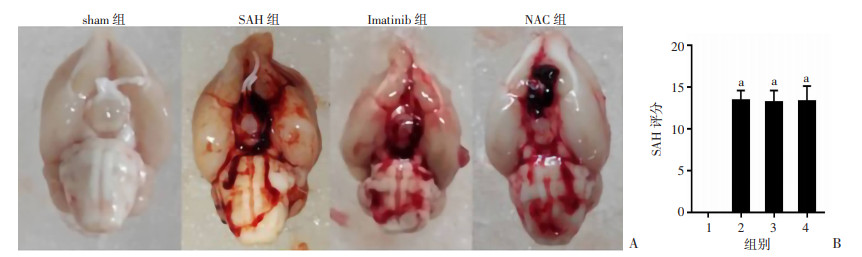
|
| A:大鼠术后24 h大脑出血情况;B:各组SAH评分(n=12) 1:sham组;2:SAH组;3:Imatinib组;4:NAC组;a: P < 0.05,与sham组比较 图 1 各组大鼠术后24 h大脑出血情况与SAH评分 |
2.1.2 脑含水量变化
术后24、48 h,SAH组的脑含水量均明显高于其他组(P < 0.05,图 2),表明使用Imatinib和ROS抑制剂明显缓解了大鼠SAH后脑水肿。
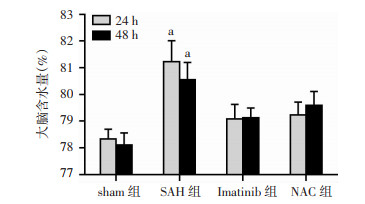
|
| a: P < 0.05,与其他组比较 图 2 各组大鼠术后24、48 h脑含水量 (n=12) |
2.1.3 MMP-9表达变化
术后24 h,SAH组MMP-9表达较sham组明显升高,Imatinib组和NAC组的MMP-9表达较SAH组降低(P < 0.05,图 3),表明Imatinib和ROS抑制剂的使用使SAH引起的大鼠早期脑损伤导致的血脑屏障破坏得到了缓解。

|
|
1:sham组;2:SAH组;3:Imatinib组;4:NAC组; a:P < 0.05,与sham组比较;b:P < 0.05,与SAH组比较 A:Western blot检测;B:半定量分析 图 3 Western blot检测各组大鼠术后24 h脑组织中MMP-9表达 (n=6) |
2.1.4 神经功能评分比较
术后24、48 h,SAH组神经功能评分较sham组明显降低(P < 0.05),Imatinib组与NAC组较SAH组明显升高(P < 0.05,图 4),表明使用ROS抑制剂或Imatinib抑制PDGFR均能改善SAH后的早期脑损伤。
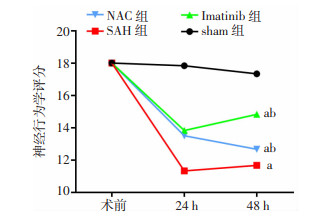
|
| a:P < 0.05,与sham组比较;b:P < 0.05,与SAH组比较 图 4 各组大鼠神经行为学评分 (n=6) |
2.2 氧化损伤参与PDGFR激活 2.2.1 MDA含量与ROS水平的变化
术后24、48 h,Imatinib组与NAC组脑组织中MDA含量和ROS水平较SAH组均下降;与Sham组比较,SAH组ROS水平明显上升(P < 0.05,图 5),提示抑制ROS后,SAH后的早期脑损伤得到缓解,ROS参与了早期脑损伤。
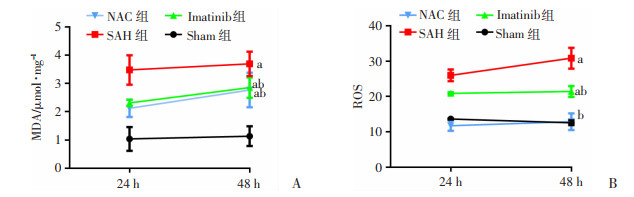
|
| a:P < 0.05,与sham组比较;b:P < 0.05,与SAH组比较 图 5 各组大鼠术后24、48 h脑组织中MDA含量(A)与ROS(B)水平的变化 (n=6) |
2.2.2 PDGFRβ与p-PDGFRβ的表达
术后24、48 h,与SAH组相比,Imatinib组和NAC组大鼠脑组织中PDGFRβ与p-PDGFRβ的表达明显降低(P < 0.05,图 6),表明NAC和imatinib不仅抑制了PDGFRβ的表达,还抑制了p-PDGFRβ的表达,即抑制PDGFRβ的活性。

|
|
1:sham组;2:SAH组;3:Imatinib组;4:NAC组;a:P < 0.05,与sham组比较;b:P < 0.05,与SAH组比较 A:Western blot检测;B、C:分别为PDGFR-β、p-PDGFRβ表达半定分析 图 6 Western blot检测各组大鼠术后24、48 h脑组织中PDGFRβ、p-PDGFRβ的表达 (n=6) |
2.3 PDGFR活化可能通过JNK与c-Jun通路参与早期脑损伤
术后24 h,与SAH组相比,NAC组和Imatinib组脑组织中p-JNK、p-c-Jun表达均下降(P < 0.05,图 7)。表明SAH后,JNK通路活性上升,而PDGFR抑制剂抑制了JNK和c-Jun的磷酸化,JNK途径可能是PDGFR发挥作用的途径。
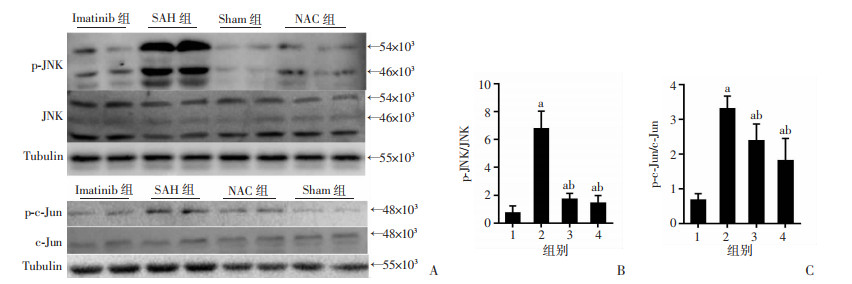
|
|
1:sham组;2:SAH组;3:Imatinib组;4:NAC组;a:P < 0.05,与Sham组比较;b:P < 0.05,与SAH组比较 A:Western blot检测;B、C:分别为p-JNK、p-c-Jun表达半定量分析 图 7 Western blot检测各组大鼠术后24 h脑组织中JNK与c-jun的表达 (n=6) |
3 讨论
以往对SAH的研究主要集中在脑血管痉挛和迟发性脑缺血[10]。临床试验表明:脑血管痉挛并不是SAH患者预后不良的唯一原因。越来越多的证据表明:SAH发病后72 h内的早期脑损伤是导致患者死亡率高、致残率高的主要原因。早期脑损伤的主要病理机制包括颅内压升高、脑血流量减少、氧化应激、神经炎症、血脑屏障破坏、脑水肿和神经元细胞凋亡等[11-12]。神经炎症和脑水肿在SAH后早期胞损伤中起着重要作用[13-14]。神经炎症反应对中枢神经系统稳态至关重要[15]。然而,过度的神经炎症反应还可能破坏血脑屏障的连接复合体,导致血脑屏障功能障碍,引起多种炎症性中枢神经系统疾病[16]。有研究表明:SAH后MMP-9和血管内皮生长因子(VEGF)的过表达促进BBB通透性的增加,与神经炎症和脑水肿有关[17]。
本课题组在之前的研究中发现:大鼠发生SAH后数小时内的抗氧化应激干预可有效减轻早期脑损伤,大鼠发生SAH后24 h内出现脑组织氧化应激状态的增强[5], 也发生PDGFR的活化[6]。在缺血后的大脑中,氧化应激会触发小胶质细胞和星形胶质细胞的激活,导致炎症介质(如细胞因子、趋化因子和基质金属蛋白酶)水平显著升高[18],并导致大脑内皮细胞完整性丧失。PDGFR-β直接参与SAH后的血管事件,有研究表明:PDGFR-β在SAH后升高,到72 h时,其表达回到基线水平[19]。而对于SAH后发生早期脑损伤时PDGFR及ROS的关系则鲜有研究。
本研究建立大鼠SAH模型,模拟临床实施治疗,在出血后1 h分别应用PDGFR抑制剂Imatinib及ROS抑制剂NAC腹腔注射处理,检测PDGFR和脂质氧化产物水平,并统计动物死亡率、体质量变化,评估神经行为学障碍、血脑屏障通透性,测定脑含水量。证实了PDGFR以及氧化应激损伤在大鼠SAH后的早期脑损伤中起着重要作用。抑制PDGFR表达后,动物的脑水肿、血脑屏障、行为学评分都得到改善,而且氧化应激产物水平也有一定下降;同时,在使用了ROS清除剂后,PDGFR的激活也受到抑制。因此,我们推测:在早期脑损伤中,ROS参与了PDGFR的激活,同时,PDGFR激活能进一步加重自由基损伤。本研究观察到大鼠SAH后应用PDGFR抑制剂,MMP-9表达下降,脑水肿程度降低,JNK通路的激活也被抑制,这与上述结果相符,表明MAPK通路中的JNK通路是SAH后早期脑损伤中PDGFR活化发挥效应的重要途径。有研究也证实:除了直接被PDGF激活之外,PDGFR还能够以配体非依赖性途径活化,如氧化应激可以在不依赖配体存在的条件下直接激活PDGFR[8, 20-22]。这些研究中还提到:在没有PDGF的情况下,ROS可能通过Src家族激酶的活化而间接地使PDGFR磷酸化。此外,PDGFR介导的mTOR激活的下游信号传导抑制了自噬,并伴随着线粒体ROS的积累。
本研究结果显示:抑制PDGFR表达后,SAH大鼠的脑水肿、血脑屏障、行为学评分都得到改善,且氧化应激产物水平也有一定下降;同时,在使用了ROS的抑制剂之后,PDGFR的激活也受到抑制。表明ROS参与了PDGFR的激活,PDGFR激活能进一步加重自由基损伤。JNK-MMP-9途径是早期脑损伤中引起血脑屏障破坏的重要途径。本研究为临床上减少早期脑损伤、防止血脑屏障破坏以及改善早期脑损伤时的脑水肿提供了参考数据。本研究还发现抑制PDGFR表达或抑制氧化应激产生都不能完全改善早期脑损伤后被破坏的血脑屏障,这是因为早期脑损伤不仅只引起SAH后的脑水肿,还引起神经炎症[23-24]。如何在早期给予干预,减少这一过程对疾病后续发展的影响,需要进一步研究。
| [1] |
PAPADOPOULOS N, LENNARTSSON J. The PDGF/PDGFR pathway as a drugtarget[J]. Mol Aspects Med, 2018, 62: 75-88. |
| [2] |
LOVELOCK C E, RINKEL G J E, ROTHWELL P M. Time trends in outcome of subarachnoid hemorrhage: population-based study and systematic review[J]. Neurology, 2010, 74(19): 1494-1501. |
| [3] |
CONTRERAS O, CÓRDOVA-CASANOVA A, BRANDAN E. PDGF-PDGFR network differentially regulates the fate, migration, proliferation, and cell cycle progression of myogenic cells[J]. Cell Signal, 2021, 84: 110036. |
| [4] |
YANG P, MANAENKO A, XU F, et al. Role of PDGF-D and PDGFR-β in neuroinflammation in experimental ICH mice model[J]. Exp Neurol, 2016, 283(Pt A): 157-164. |
| [5] |
ZHAN Y, CHEN C H, SUZUKI H, et al. Hydrogen gas ameliorates oxidative stress in early brain injury after subarachnoid hemorrhage in rats[J]. Crit Care Med, 2012, 40(4): 1291-1296. |
| [6] |
ZHAN Y, KRAFFT P R, LEKIC T, et al. Imatinib preserves blood-brain barrier integrity following experimental subarachnoid hemorrhage in rats[J]. J Neurosci Res, 2015, 93(1): 94-103. |
| [7] |
秦媛媛. NADPH和NOX抑制剂Apocynin(夹竹桃麻素)联用在小鼠脑卒中模型中抗炎和神经保护的作用[D]. 苏州: 苏州大学, 2017. QIN Y Y. Anti-inflammatory and neuroprotective effects of combined NADPH and the NOX inhibitor apocynin in a mouse model of stroke[D]. Suzhou: Soochow University, 2017. |
| [8] |
KOBAYASHI K, ARAYA J, MINAGAWA S, et al. Involvement of PARK2-mediated mitophagy in idiopathic pulmonary fibrosis pathogenesis[J]. J Immunol, 2016, 197(2): 504-516. |
| [9] |
CHEN C H, MANAENKO A, ZHAN Y, et al. Hydrogen gas reduced acute hyperglycemia-enhanced hemorrhagic transformation in a focal ischemia rat model[J]. Neuroscience, 2010, 169(1): 402-414. |
| [10] |
NEIFERT S N, CHAPMAN E K, MARTINI M L, et al. Aneurysmal subarachnoid hemorrhage: the last decade[J]. Transl Stroke Res, 2021, 12(3): 428-446. |
| [11] |
GERAGHTY J R, DAVIS J L, TESTAI F D. Neuroinflammation and microvascular dysfunction after experimental subarachnoid hemorrhage: emerging components of early brain injury related to outcome[J]. Neurocrit Care, 2019, 31(2): 373-389. |
| [12] |
RASS V, HELBOK R. Early brain injury after poor-grade subarachnoidhemorrhage[J]. Curr Neurol Neurosci Rep, 2019, 19(10): 78. |
| [13] |
HAYMAN E G, WESSELL A, GERZANICH V, et al. Mechanisms of global cerebral edema formation in aneurysmal subarachnoid hemorrhage[J]. Neurocrit Care, 2017, 26(2): 301-310. |
| [14] |
ZHANG Z Y, FANG Y J, LENAHAN C, et al. The role of immune inflammation in aneurysmal subarachnoid hemorrhage[J]. Exp Neurol, 2021, 336: 113535. |
| [15] |
MUNDT S, GRETER M, FLVGEL A, et al. The CNS immune landscape from the viewpoint of a T cell[J]. Trends Neurosci, 2019, 42(10): 667-679. |
| [16] |
BENNETT M, CHIN A, LEE H J, et al. Proteoglycan 4 reduces neuroinflammation and protects the blood-brain barrier after traumatic brain injury[J]. J Neurotrauma, 2021, 38(4): 385-398. |
| [17] |
WU C, HU Q, CHEN J Y, et al. Inhibiting HIF-1α by 2ME2 ameliorates early brain injury after experimental subarachnoid hemorrhage in rats[J]. Biochem Biophys Res Commun, 2013, 437(3): 469-474. |
| [18] |
BALL S G, SHUTTLEWORTH C A, KIELTY C M. Vascular endothelial growth factor can signal through platelet-derived growth factorreceptors[J]. J Cell Biol, 2007, 177(3): 489-500. |
| [19] |
WAN W F, DING Y, XIE Z Y, et al. PDGFR-β modulates vascular smooth muscle cell phenotype via IRF-9/SIRT-1/NF-κB pathway in subarachnoid hemorrhage rats[J]. J Cereb Blood Flow Metab, 2019, 39(7): 1369-1380. |
| [20] |
KURITA Y, ARAYA J, MINAGAWA S, et al. Pirfenidone inhibits myofibroblast differentiation and lung fibrosis development during insufficient mitophagy[J]. Respir Res, 2017, 18(1): 114. |
| [21] |
AOMATSU E, CHOSA N, NISHIHIRA S, et al. Cell-cell adhesion through N-cadherin enhances VCAM-1 expression via PDGFRβ in a ligand-independent manner in mesenchymal stem cells[J]. Int J Mol Med, 2014, 33(3): 565-572. |
| [22] |
FRIJHOFF J, DAGNELL M, AUGSTEN M, et al. The mitochondrial reactive oxygen species regulator p66Shc controls PDGF-induced signaling and migration through protein tyrosine phosphatase oxidation[J]. Free Radic Biol Med, 2014, 68: 268-277. |
| [23] |
TAO T, LIU G J, SHI X, et al. DHEA attenuates microglial activation via induction of JMJD3 in experimental subarachnoid haemorrhage[J]. J Neuroinflammation, 2019, 16(1): 243. |
| [24] |
PENG Y C, ZHUANG J F, YING G Y, et al. Stimulator of IFN genes mediates neuroinflammatory injury by suppressing AMPK signal in experimental subarachnoid hemorrhage[J]. J Neuroinflammation, 2020, 17(1): 165. |




