前列腺癌(prostate cancer,PCa)作为危害男性健康的常见恶性肿瘤之一,近年来其发病率及病死率逐年上升,跃居为第二大全球男性癌症相关性死亡原因[1-4]。晚期PCa易进展为非雄激素依赖性PCa,这将使传统的手术治疗和去势治疗无效[5-6]。因此,寻找低毒高效的抗肿瘤药物以应对非雄激素依赖性PCa极为迫切。
双氢青蒿素(dihydroartemisinin,DHA)是一种从青蒿素中提取的有效抗疟疾药物,近年来,针对其潜在的抗肿瘤作用研究取得进展[7-9],相关机制与细胞程序性死亡有关[10-11]。细胞程序性死亡包括细胞凋亡、焦亡等[12-14]。国外及本课题组前期研究结果显示:DHA虽然可以通过上调促凋亡基因以及下调抗凋亡基因的表达诱导细胞凋亡以达到抗肿瘤的目的[15-16],但低剂量的DHA抗肿瘤作用更偏向于抑制细胞增殖,而诱导细胞凋亡的作用有限,提示在诱导细胞凋亡外可能还有其他的抗肿瘤途径[17]。在前期的体内实验中,我们发现DHA也能诱导细胞发生焦亡现象,但其相关机制不清,这为PCa中DHA的抗肿瘤作用研究提供了一个新的方向。
细胞焦亡是一种由Gasdermin蛋白家族介导的高度促炎性、程序性坏死的细胞死亡形式。目前的研究发现,依赖于Caspase-1/Gasdermin D(GSDMD)的焦亡经典途径与肿瘤的发生、发展关系密切[18],经典途径在非雄激素依赖性PCa中起主导作用[19]。在经典途径中,抑癌基因凋亡相关斑点样蛋白(apoptosis-associated speck-like protein containing a CARD,ASC)与上游黑色素瘤缺乏因子2(absent in melanoma 2,AIM2)特异性结合为炎性复合体,是激活下游Caspase-1和GSDMD诱导细胞焦亡的关键[20-22]。结合前期研究发现,抑癌基因ASC的表达受表观遗传学机制的调控,PCa中高甲基化状态导致ASC的表达沉默[23-24],ASC的沉默失活是导致肿瘤发生和癌细胞增殖的重要因素[25]。因此,本研究旨在探讨DHA调控ASC的甲基化状态以及上下游目的基因的表达,从而诱导PCa细胞发生细胞焦亡,以期为DHA抗肿瘤机制研究提供新的思路。
1 材料与方法 1.1 主要仪器与试剂胎牛血清、DMEM/F12、glutaMAX添加剂购自美国Gibco公司;DHA、DAC和二甲基亚砜(DMSO)均购于美国Sigma-Aldrich公司;兔抗ASC、兔抗AIM2和兔抗Caspase-1和兔抗GSDMD单克隆抗体购自美国Cell Signaling Technology公司,兔抗β-肌动蛋白多克隆抗体来自中国北京博奥森公司,辣根过氧化物酶偶联二抗[抗兔免疫球蛋白G (IgG)抗体]购自北京ZSGB-BIO OriGene公司;CCK-8细胞增殖及毒性检测试剂盒、PRIPA裂解液,SDS-PAGE蛋白上样缓冲液,SDS-PAGE凝胶配制试剂盒,BCA蛋白浓度测定试剂盒、Caspase-1比色检测试剂盒、乳酸脱氢酶释放检测试剂盒、IL-18 ELISA检测试剂盒和IL-1β ELISA检测试剂盒购自中国碧云天生物技术公司;DNeasy提取试剂盒购于美国Qiagen公司;SYBR酶、反转录试剂盒购自日本TaKaRa公司;抗体稀释液购自中国新赛美公司;甲基化检测试剂盒购自英国Abcam公司。
荧光光谱仪(F-7000)购于日本日立高科技公司;实时荧光定量PCR仪、4 ℃离心机、ChemiDox XRs凝胶成像仪购自美国Bio-Rad公司;透射电子显微镜购自日本JEOL JEM-1400 PLUS公司,扫描电子显微镜购自日本HITACHI SU8010公司。
1.2 细胞培养与药物干预人PCa细胞PC-3、DU145均购自中国科学院上海细胞库。DMEM/F12混以10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素、2 mmol/L glutaMAX配置培养基于37 ℃、5% CO2、95%湿度孵育,每3天传代1次。
将DHA溶于DMSO溶剂制备为0.1 mmol/L的母液,4 ℃保存,0.22 μm过滤器过滤后使用。将DAC溶于DMSO溶剂制备为0.1 mmol/L的母液,-20 ℃保存以备使用。将PC-3和DU145细胞分为对照组与药物组。将细胞按5×103/孔接种于96孔板,每组6个重复孔,培养48 h待细胞生长至80%,加入DHA和DAC处理48 h。测定3 h前,每组更换混合10 μL CCK-8试剂的100 μL培养基。用荧光光谱仪(F-7000)测定450 nm波长下的光密度值[D(450)]。按公式计算抑制率和存活率:抑制率= [D(450)药物组-D(450)对照组]/[D(450)对照组-D(450)空白组],存活率=[D(450)药物组-D(450)空白组]/ [D(450)对照组-D(450)空白组]。
1.3 裸鼠成瘤实验选择4~6周龄雄性裸鼠(购自重庆医科大学实验动物中心,编号为110011210104105881)作为成瘤对象,裸鼠品系为BALB/c Nude,均为SPF级,许可证号:SCXK(京)2016-0006。按照对照组及药物组划分为各组6只。将PC-3细胞(约5×106 /mL)重悬于PBS中,经皮穿刺将0.1 mL细胞悬液接种于裸鼠右大腿附近的下背部,饲养14 d,待肿瘤直径达到0.5 cm×0.6 cm。选择相同体质量和肿瘤质量的裸鼠进行药物干预,随机分为对照组和药物组,每组4只。对照组注射DMSO,药物组以DHA(50 μmol/L)每隔1天注射1次,第13天收集肿瘤。通过肿瘤体积测定,观察DHA对肿瘤的抑制效率。并将肿瘤组织用于后续蛋白免疫印迹检测以及电镜观察。
1.4 电镜观察 1.4.1 透射电镜对照组待细胞生长至80%时继续培育48 h,药物组待细胞生长至80%时予以50 μmol/L DHA培养48 h。从细胞中收集的样品,1 000 r/min离心10 min形成团块。去除上清液,沿管壁加入戊二醛固定剂。4 ℃保存,后期置于电镜下观察。体内实验中,用眼科剪分离1.3中对照组与药物组的肿瘤组织,4%戊二醛固定4 h,1% OsO4固定2 h。然后将肿瘤脱水、包埋、超薄切片,置于电镜下观察。
1.4.2 扫描电镜对照组待细胞生长至80%时继续培育48 h,药物组待细胞生长至80%时予以50 μmol/L DHA培养48 h。细胞标本1 000 r/min离心10 min,PBS洗涤2次,去除上清液。将1.5 μL细胞悬液加在喷有铂金的载玻片上,静置1 h。然后将载玻片放入戊二醛固定1 h,PBS洗涤3次,每次7 min。然后依次用梯度浓度乙醇(30%、50%、70%、90%和无水乙醇)和叔丁醇(30%、50%、70%、90%和无水叔丁醇)进行脱水。最后将载玻片冷藏30 min,抽真空后用扫描电子显微镜进行观察。
1.5 Caspase-1比色检测、乳酸脱氢酶释放检测实验细胞焦亡过程中细胞膜破裂会导致细胞外Caspase-1含量增加,LDH释放到细胞膜外。采用Caspase-1比色法和LDH释放实验检测PC-3和DU145细胞膜的完整性。
1.5.1 Caspase-1比色检测对照组待细胞生长至80%时继续培育48 h,药物组待细胞生长至80%时予以50 μmol/L DHA培养48 h。将细胞以250×g离心10 min,用Caspase-1比色检测试剂盒中25 μL裂解液冷孵育10 min,再10 000×g离心1 min。将上清液移至96孔板,每组3孔重复。加入50 μL细胞裂解液处理后,每个反应孔加入5 μL的Caspase-1标准品,37 ℃条件下静置1.5 h。用荧光光谱仪测定450 nm处的光密度值[D(450)]。活性比=[D(450)药物组-D(450)空白组]/[D(450)对照组-D(450)空白组]。
1.5.2 LDH释放实验对照组待细胞生长至80%时继续培育48 h,药物组待细胞生长至80%时予以50 μmol/L DHA培养48 h。采用LDH细胞毒性测定试剂盒检测细胞膜破裂后的含量释放程度。将样品种于96孔板上(每孔加入100 μL细胞悬液)。待细胞生长2 d后,每孔加入10 μL细胞裂解液和100 μL LDH反应液,室温孵育30 min。用荧光光谱仪测定600 nm处的光密度值[D(600)]。释放比=[D(600)药物组-D(600)空白组]/ [D(600)对照组-D(600)空白组]。
1.6 ELISA法检测IL-18、IL-1β释放量采用酶联免疫吸附测定(enzyme-linked immuno sorbent assay,ELISA)法检测IL-18、IL-1β释放量以验证PC-3和DU145细胞膜的完整性。对照组待细胞生长至80%时继续培育48 h,药物组待细胞生长至80%时予以50 μmol/L DHA培养48 h。800 r/min离心5 min后将细胞悬液接种于96孔板内, 100 μL/孔,室温静置2 h。弃上清洗板2次后加入100 μL生物素化抗体,室温静置1 h。弃上清洗板2次后加入100 μL Streptavidin,避光孵育30 min。弃上清洗板2次后加入100 μL显色剂,避光孵育30 min。加入终止液50 μL后用荧光光谱仪测定450 nm处的光密度值[D(450)]。计算IL-18、IL-1β的相对表达量。
1.7 Annexin V-PI流式细胞术将PC-3和DU145细胞分别分为对照组、药物组,共4组。对照组待细胞生长至80%时继续培育48 h,药物组待细胞生长至80%时予以50 μmol/L DHA培养48 h。用胰酶消化离心(800 r/min,5 min)后移至1.5 μL的微型离心管内并添加PBS重悬,送至重庆医科大学生命科学研究院进行细胞定量检测。
1.8 亚硫酸氢盐基因组测序PCR将PC-3和DU145细胞分别分为对照组、阳性对照组(DAC 2 μmol/L)和药物组(DHA 50 μmol/L),共6组。对照组待细胞生长至80%时继续培育48 h,药物组待细胞生长至80%时分别予以2 μmol/L DAC和50 μmol/L DHA培养48 h。使用DNeasy提取试剂盒从PC-3和DU145细胞中提取基因组DNA。对亚硫酸氢盐修饰的DNA样本进行亚硫酸氢盐基因组测序,使用针对ASC启动子中CpG富集区的引物集来观察其甲基化状态。引物序列:ASC上游5′-GGGATTAAGGGTGTAGTAAGGAAG-3′,下游5′-CCAACTTATCRATAAAATCCAAAAC-3′。亚硫酸氢盐基因组测序在含有GoTaq混合物的反应溶液中进行40个循环(94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s)。在2%的琼脂糖凝胶中进行PCR分析。将PCR产物连接至pTG19-T载体进行测序。
1.9 实时荧光定量PCR对照组细胞生长至80%时继续培育48 h,药物组细胞生长至80%时予以50 μmol/L DHA培养48 h。提取细胞RNA用由PrimeScriptTM RT试剂试剂盒与gDNA Eraser进行反转录。引物序列如下: β-actin上游5′-CGGCACCACCATGTACCCT-3′,下游5′-ACACGGAGTACTTGCGCTCAG-3′;ASC上游5′-TGACGGATG-AGCAGTACCA-3′,下游5′-GGCCTGGAGGAGCAAGT-3′;AIM2上游5′-CGTTTGAGACCCAAGAAGGC-3′,下游5′-ACGTGAGGCGCTATTTACCT-3′);Caspase-1上游5′-ACAGGCATGACAATGCTGCT-3′,下游5′-GCTGTC-AGAGGTCTTGTGCT-3′;GSDMD上游5′-GTGCTTGCA-GGGTGAGG-3′,下游5′-GCTCGTGGAACGCTTGT-3′。扩增的反应条件为: 95℃反应30 s,90℃反应5 s,57 ℃反应30 s,循环39次,最后65℃反应30 s。数据采用2-△△Ct法计算mRNA相对表达量。重复3次。
1.10 蛋白免疫印迹法 1.10.1 体外实验检测焦亡相关蛋白AIM2、Caspase-1、GSDMD、GSDMD-N时,对照组待细胞生长至80%时继续培育48 h,药物组待细胞生长至80%时予以50 μmol/L DHA培养48 h。检测抑癌基因ASC的蛋白表达情况时,对照组待细胞生长至80%时继续培育48 h,药物组待细胞生长至80%时分别予以2 μmol/L DAC和50 μmol/L DHA培养48 h。从细胞中收集总蛋白,采用BCA蛋白增强检测试剂盒检测蛋白浓度,加入含1% PMSF的RIPA裂解液冰上裂解30 min,用SDS装载缓冲液煮沸10 min。通过SDS-聚丙烯酰胺凝胶电泳(12%凝胶)。随后,将分离的蛋白质电转移至PVDF膜。用含有5%脱脂牛奶的TBST封闭,分别用以下抗体在4 ℃中孵育过夜:兔抗AIM2、ASC、Caspase-1、GSDMD (1∶1 000)和兔抗β-actin(1∶1 000)。过夜后用TBST洗涤3次,用二抗(1∶20 000)在室温下孵育1 h,再用TBST洗涤3次。特异性蛋白通过ChemiDoc XRS成像系统进行显影。重复3次。
1.10.2 体内实验分别提取1.3中对照组与药物组的肿瘤组织总蛋白。加入含1% PMSF的RIPA裂解液,冰下超声破碎和涡旋振荡5 min共6次,4 ℃下12 000 r/min离心20 min。后续步骤与体外实验相同。重复3次。
1.11 数据分析生物信息学分析使用R语言ggplots2软件对TCGA数据进行编辑。采用GraphPad Prism 9(美国GraphPad Software Inc.)绘制数据并进行统计分析。数据以x±s表示,多组比较采用单因素方差分析,组间比较采用t检验。P < 0.05为差异有统计学意义。
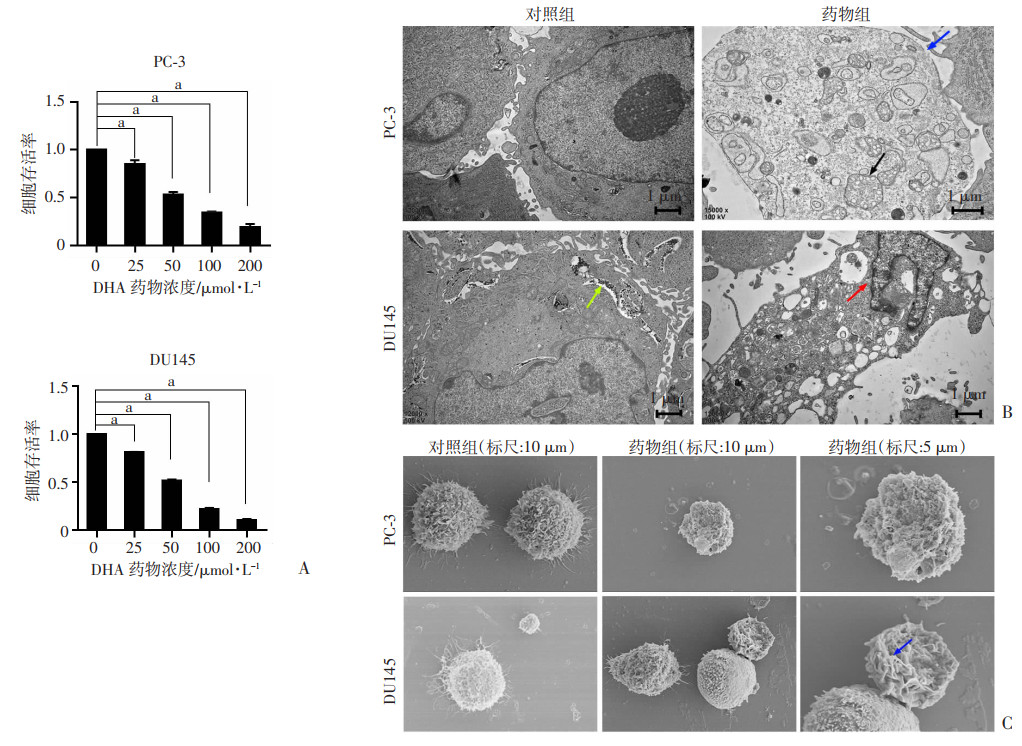
2 结果 2.1 DHA作用下非雄激素依赖性PCa细胞PC-3和DU145的体外实验 2.1.1 DHA对PC-3和DU145细胞的增殖及形态学影响采用CCK-8检测非雄激素依赖性PCa细胞株PC-3和DU145的细胞增殖情况,结果显示PC-3和DU145细胞均表现出浓度依赖性的增殖抑制(图 1A)。根据计算获得二者的IC50 [PC-3:(46.70±0.83)μmol/L;DU145:(48.13±0.94)μmol/L],确定最适药物浓度(均选取50 μmol/L)分别对PC-3和DU145进行加药处理,电镜下形态学观察可见:不同于其他细胞死亡形式,细胞焦亡的特征为细胞膜完整性的缺失以及细胞内容物的释放。透射电镜图像显示细胞内吹泡样改变、线粒体肿胀、细胞膜破裂(图 1B)。扫描电镜观察显示细胞膜形成孔道,丧失完整性(图 1C)。表明DHA可诱导PC-3和DU145发生焦亡样形态学改变。
|
| A:DHA处理PCa细胞株PC-3和DU145 48 h的细胞存活率(n=3,x±s) a:P < 0.01;B:透射电镜观察两组PCa细胞形态DHA处理PC-3细胞后,细胞膜完整性缺失(蓝色箭头),细胞内大量空泡(黑色箭头);DU145细胞含有大量的糖原(绿色箭头),破裂的细胞释放出大量内容物(红色箭头);C:扫描电镜观察正常细胞和破裂细胞形态DU145细胞的纤毛较圆钝(蓝色箭头) 图 1 DHA对PC-3和DU145细胞的增殖及形态学影响 |
2.1.2 细胞焦亡的辅助验证
通过Caspase-1比色检测、LDH释放实验发现,DHA作用下的PC-3和DU145胞外Caspase-1、LDH水平均有明显上升(P < 0.01,图 2A、B),进一步证明细胞膜完整性缺失导致内容物的释放。ELISA检测结果显示药物组IL-18表达量、IL-1β表达量较对照组明显增多(P < 0.01,图 2C、D)。Annexin V-PI双染流式细胞术结果显示,DHA作用下的药物组PI阳性细胞比率明显高于对照组(P < 0.01,图 2E)。

|
|
a:P < 0.01 A:Caspase-1比色检测;B:LDH释放实验检测;C:ELSIA检测IL-18表达;D:ELSIA检测IL-1β表达;E:Annexin V-PI双染流式细胞术检测 图 2 细胞焦亡的辅助验证(n=3,x±s) |
2.1.3 DHA对PC-3、DU145的抑癌基因ASC的表达调控
生物信息学分析显示,相比于正常前列腺细胞,抑癌基因ASC在PCa细胞中表达明显下调(P<0.05,图 3A)。以不同浓度DAC作用于PC-3、DU145观察细胞增殖情况(图 3B),分别以DHA和DAC[根据IC50结果,PC-3:(2.64±1.02)μmol/L;DU145:(2.47±1.02)μmol/L;均选取2 μmol/L]的最适药物浓度作用于PC-3和DU145细胞检测ASC的mRNA和蛋白表达水平,结果发现DHA对ASC表达的上调作用在两种细胞中均优于DAC(P < 0.01,图 3C、D)。通过亚硫酸氢盐测序实验,结果显示DHA的去甲基化效果明显优于DAC(P < 0.01,图 3E)。

|
|
a:P < 0.05,b:P < 0.01 A:生物信息学分析火山图 红点和绿点分别表示与正常前列腺细胞相比,在PCa中显著上调和下调的差异基因,灰点表示差异不显著的基因;B:DAC处理PCa细胞株PC-3和DU145 48 h的细胞存活率;C:实时荧光定量PCR检测ASC mRNA水平的相对表达量;D:蛋白免疫印迹法测定ASC蛋白表达水平 1:对照组;2:DAC;3:DHA;E:对PC-3和DU145细胞中对ASC的每个CpG位点(圆点)进行亚硫酸氢盐基因组测序黑色圆点:甲基化CpG位点;中空圆点:未甲基化的CpG位点;柱状图为根据亚硫酸氢盐基因组测序分析ASC的甲基化率 图 3 差异表达基因ASC及其甲基化状态(n=3,x±s) |
2.1.4 DHA对PC-3、DU145的AIM2、Caspase-1、GSDMD的mRNA及蛋白表达影响
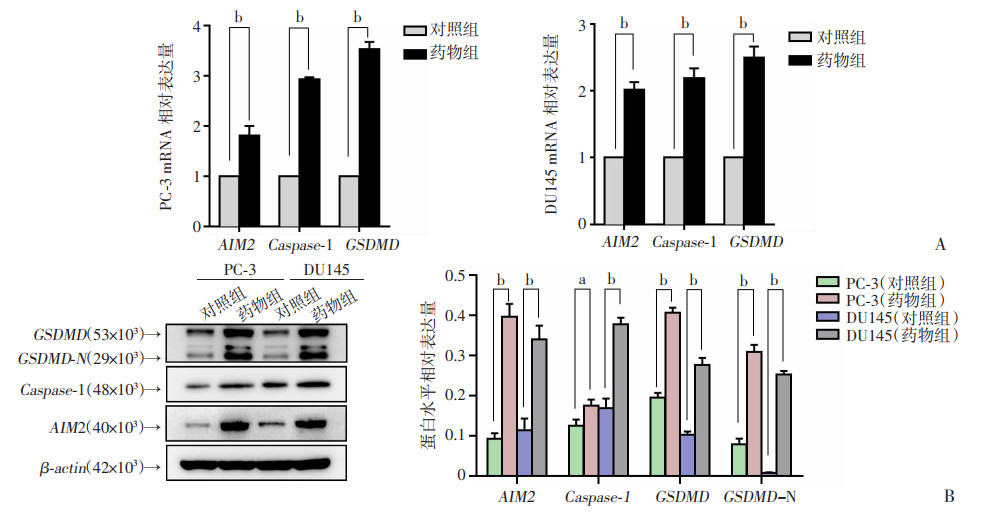
通过实时荧光定量PCR、蛋白免疫印迹法检测ASC上下游基因AIM2、Caspase-1、GSDMD的表达水平,结果显示在PC-3和DU145细胞中,DHA均明显上调AIM2、Caspase-1、GSDMD和GSDMD-N端的基因表达(P < 0.01,图 4)。细胞焦亡相关蛋白的表达上调辅助验证DHA作用下PCa细胞发生细胞焦亡。
|
| a:P < 0.05,b:P < 0.01 A:RT-qPCR检测AIM2、Caspase-1和GSDMD的mRNA水平的相对表达量;B:蛋白免疫印迹法测定AIM2、Caspase-1、GSDMD和GSDMD-N端的蛋白水平表达 图 4 焦亡相关基因在mRNA和蛋白水平的表达情况(n=3,x±s) |
2.2 DHA作用下非雄激素依赖性PCa细胞PC-3和DU145的体内实验
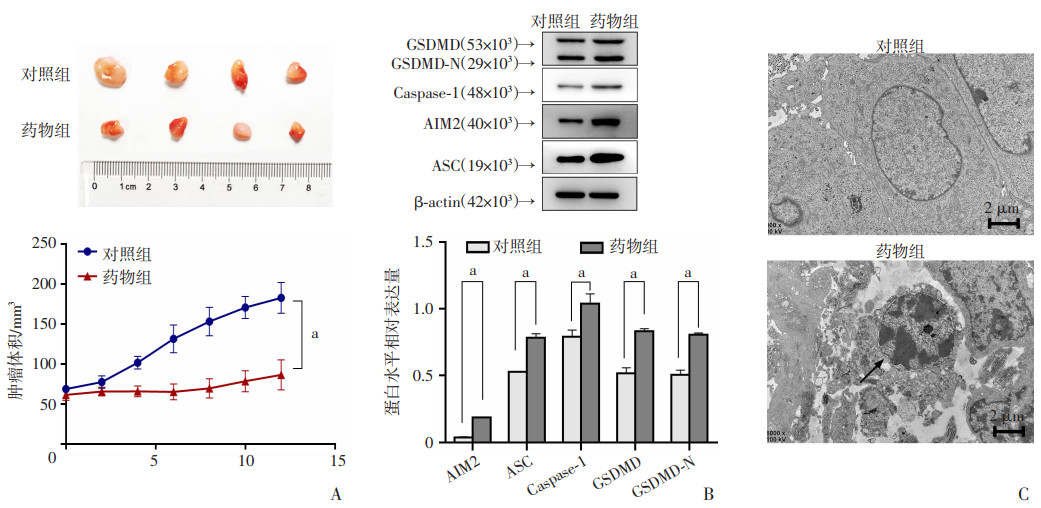
选择PCa骨转移细胞系、恶性程度高、浸润侵袭性较强的PC-3细胞构建裸鼠种植瘤模型。结果显示,药物组的肿瘤体积小于对照组(图 5A),提示DHA显著抑制肿瘤的生长。通过蛋白免疫印迹法检测目的基因的表达水平,结果显示ASC、AIM2、Caspase-1、GSDMD和GSDMD-N端表达恢复(图 5B),与体外实验结果一致。电镜观察瘤体组织形态学变化,与正常PCa细胞相比,DHA处理后的小鼠组织细胞丧失膜的完整性,并释放内容物至细胞外(图 5C),该图像结果与体外实验保持一致。
|
| a:P < 0.01 A:肿瘤体积与肿瘤生长曲线;B:蛋白免疫印迹法测定肿瘤组织的AIM2、ASC、Caspase-1、GSDMD和GSDMD-N端的蛋白表达水平;C:透射电镜观察瘤体组织的形态学表现 ↑:示细胞膜破裂的焦亡样形态学改变 图 5 DHA治疗处理的裸鼠成瘤实验(n=3,x±s) |
3 讨论
与早期PCa相比,晚期PCa的药物治疗选择较为棘手。近年来,DHA药物的抗肿瘤潜力得到关注,抗肿瘤机制的研究在临床用药领域取得较大突破[26-27]。与传统的抗肿瘤药物不同,DHA具有毒副作用小、对正常细胞伤害小等明显优势[28]。本课题组前期研究发现,低剂量DHA诱导PCa细胞凋亡的作用有限,但能明显抑制肿瘤生长,其抑癌机制与调控关键因子的甲基化水平有关。结合在PCa细胞中发现细胞焦亡样改变,而焦亡经典途径中的关键因子因高甲基化状态致使表达沉默,这为探索DHA通过细胞焦亡途径抗肿瘤的机制研究提供了一条有前景的思路。近年国外研究也证实DHA可促进多种肿瘤发生细胞焦亡[29],在本课题组前期DHA调控细胞甲基化状态的研究成果基础上,本研究旨在结合表观遗传学机制与细胞焦亡来探讨DHA对PCa的抗肿瘤作用。
本研究结果表明DHA在体内实验和体外实验均对肿瘤的抑制作用显著,电镜观察到细胞膜完整性缺失、内容物释放等焦亡样形态学改变。Caspase-1比色检测、LDH释放实验、ELSIA检测结果显示在DHA诱导细胞焦亡过程中,细胞膜破裂导致细胞内容物Caspase-1、LDH释放至胞外,炎性因子IL-18、IL-1β表达升高,提示焦亡作用产生炎性反应。确认细胞焦亡的表型改变后,由此将展开对细胞焦亡的机制探索。细胞焦亡众多通路中,仅经典途径与非雄激素依赖性PCa关系紧密[19]。在经典途径中,抑癌基因ASC与上游AIM2特异性结合,形成炎性小体激活下游Caspase-1裂解GSDMD,从而诱导细胞焦亡[20, 30-31]。结合前期实验了解到,表观遗传学机制与肿瘤的发生发展密切相关,转录水平的改变是引起肿瘤发生的重要因素[32]。表观遗传学机制中,在DNA甲基转移酶的催化下,甲基团与CpG二核苷酸胞嘧啶的第5个碳原子共价结合,导致抑癌基因沉默[25]。ASC作为经典通路中诱导焦亡发生不可或缺的重要基因,同时也受表观遗传性学机制的调控[28, 33]。由于PCa的高甲基化状态抑制了ASC的正常表达,导致肿瘤的发生[24],本研究通过生物信息学分析验证了这一观点。但是ASC的甲基化是一个可逆的过程,本课题组前期研究发现DHA具有逆转甲基化的作用[17]。因此本研究通过亚硫酸氢盐测序检测DHA作用下ASC的甲基化表达变化。为了比较DHA的去甲基化效果和临床适用性,将DAC作为阳性对照,结果显示与临床的抗肿瘤药物和甲基化抑制剂相比,DHA在抑制肿瘤增殖和ASC的去甲基化效果方面均优于DAC,这为DHA抗癌机理的探索提供了一个新的视角。通过实时荧光定量PCR、蛋白免疫印迹法检测ASC表达恢复后的上下游基因AIM2、Caspase-1、GSDMD和GSDMD-N端的表达水平改变情况发现,DHA明显恢复以上焦亡相关蛋白的表达,进一步为DHA诱导PCa细胞焦亡提供实验依据,但其深入机制仍需继续探索。
为了进一步验证DHA诱导焦亡以达到抗肿瘤的实际效用,本研究选取4~6周龄雄性裸鼠构建模型并对药物组行DHA治疗。结果显示DHA治疗明显抑制肿瘤生长;电镜观察瘤体组织也显示了焦亡现象的发生,以上实验均证实了体外实验中DHA抑制肿瘤增殖并诱导细胞焦亡的结果。蛋白免疫印迹法检测瘤体组织中目的基因的表达情况,结果显示焦亡相关蛋白的表达上调进一步证实体外实验的结果。
综上所述,本研究将传统药物与新型抗肿瘤手段相结合,同时进行体外实验和体内实验探究DHA诱导非雄激素依赖性PCa产生焦亡以达到抗肿瘤的作用,通过恢复ASC的表达改变,以期探索DHA诱导焦亡产生的具体机制,为DHA作为临床抗肿瘤药物的研究提供理论基础,为临床抗癌新药的选择提供更多可能性。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. |
| [3] |
PERNAR C H, EBOT E M, WILSON K M, et al. The epidemiology of prostate cancer[J]. Cold Spring Harb Perspect Med, 2018, 8(12): a030361. |
| [4] |
顾秀瑛, 郑荣寿, 张思维, 等. 2000—2014年中国肿瘤登记地区前列腺癌发病趋势及年龄变化分析[J]. 中华预防医学杂志, 2018, 52(6): 586-592. GU X Y, ZHENG R S, ZHANG S W, et al. Analysis on the trend of prostate cancer incidence and age change in cancer registration areas of China, 2000 to 2014[J]. Chin J Prev Med, 2018, 52(6): 586-592. |
| [5] |
KOJIMA S, GOTO Y, NAYA Y. The roles of microRNAs in the progression of castration-resistant prostate cancer[J]. J Hum Genet, 2017, 62(1): 25-31. |
| [6] |
SKVORTSOV S, SKVORTSOVA I I, TANG D, et al. Concise review: prostate cancer stem cells: current understanding[J]. Stem Cells, 2018, 36(10): 1457-1474. |
| [7] |
KAJUBI R, OCHIENG T, KAKURU A, et al. Monthly sulfadoxine-pyrimethamine versus dihydroartemisinin-piperaquine for intermittent preventive treatment of malaria in pregnancy: a double-blind, randomised, controlled, superiority trial[J]. Lancet, 2019, 393(10179): 1428-1439. |
| [8] |
YANG J, HE Y K, LI Y B, et al. Advances in the research on the targets of anti-malaria actions of artemisinin[J]. Pharmacol Ther, 2020, 216: 107697. |
| [9] |
SUÁREZ-POZOS E, MARTÍNEZ-LOZADA Z, MÉNDEZ-FLORES O G, et al. Characterization of the cystine/glutamate antiporter in cultured Bergmann Glia cells[J]. Neurochem Int, 2017, 108: 52-59. |
| [10] |
THITA T, JADSRI P, THAMKHANTHO J, et al. Phenotypic and genotypic characterization of Thai isolates of Plasmodium falciparum after an artemisinin resistance containment project[J]. Malar J, 2018, 17(1): 197. |
| [11] |
DU S J, XU G, ZOU W Q, et al. Effect of dihydroartemisinin on UHRF1 gene expression in human prostate cancer PC-3 cells[J]. Anticancer Drugs, 2017, 28(4): 384-391. |
| [12] |
ROGERS C, FERNANDES-ALNEMRI T, MAYES L, et al. Cleavage of DFNA5 by caspase-3 during apoptosis mediates progression to secondary necrotic/pyroptotic cell death[J]. Nat Commun, 2017, 8: 14128. |
| [13] |
DHURIYA Y K, SHARMA D. Necroptosis: a regulated inflammatory mode of cell death[J]. J Neuroinflamm, 2018, 15(1): 199. |
| [14] |
JIANG L Z, POON I K H. Methods for monitoring the progression of cell death, cell disassembly and cell clearance[J]. Apoptosis, 2019, 24(3/4): 208-220. |
| [15] |
KIANI B H, KAYANI W K, KHAYAM A U, et al. Artemisinin and its derivatives: a promising cancer therapy[J]. Mol Biol Rep, 2020, 47(8): 6321-6336. |
| [16] |
LIU Y M, GAO S J, ZHU J, et al. Dihydroartemisinin induces apoptosis and inhibits proliferation, migration, and invasion in epithelial ovarian cancer via inhibition of the hedgehog signaling pathway[J]. Cancer Med, 2018, 7(11): 5704-5715. |
| [17] |
XIA T, LIU S H, XU G, et al. Dihydroartemisinin induces cell apoptosis through repression of UHRF1 in prostate cancer cells[J]. Anti Cancer Drugs, 2021, 33(1): e113-e124. |
| [18] |
FANG Y, TIAN S W, PAN Y T, et al. Pyroptosis: a new frontier in cancer[J]. Biomed Pharmacother, 2020, 121: 109595. |
| [19] |
PANCHANATHAN R, RAMALINGAM V, LIU H Z, et al. Human prostate epithelial cells activate the AIM2 inflammasome upon cellular senescence: role of POP3 protein in aging-related prostatic inflammation[J]. Life (Basel), 2021, 11(4): 366. |
| [20] |
WANG B, TIAN Y, YIN Q. AIM2 inflammasome assembly and signaling[J]. Adv Exp Med Biol, 2019, 1172: 143-155. |
| [21] |
WANG B, YIN Q. AIM2 inflammasome activation and regulation: a structural perspective[J]. J Struct Biol, 2017, 200(3): 279-282. |
| [22] |
KESAVARDHANA S, KANNEGANTI T D. Mechanisms governing inflammasome activation, assembly and pyroptosis induction[J]. Int Immunol, 2017, 29(5): 201-210. |
| [23] |
WANG S P, TAILOR K, KWABI-ADDO B. Androgen-induced epigenetic profiles of polycomb and trithorax genes in prostate cancer cells[J]. Anticancer Res, 2020, 40(5): 2559-2565. |
| [24] |
YANG Y Q, FUENTES F, SHU L M, et al. Epigenetic CpG methylation of the promoter and reactivation of the expression of GSTP1 by astaxanthin in human prostate LNCaP cells[J]. AAPS J, 2017, 19(2): 421-430. |
| [25] |
LI Y, MENG L Y, SHI T, et al. Diagnosis and prognosis potential of four gene promoter hypermethylation in prostate cancer[J]. Cell Biol Int, 2021, 45(1): 117-126. |
| [26] |
MOHAMED S H, ELGIUSHY H R, TAHA H B, et al. An investigative study of antitumor properties of a novel thiazolo[4, 5-d]pyrimidine small molecule revealing superior antitumor activity with CDK1 selectivity and potent pro-apoptotic properties[J]. Bioorg Med Chem, 2020, 28(17): 115633. |
| [27] |
DAI X S, ZHANG X Y, CHEN W, et al. Dihydroartemisinin: a potential natural anticancer drug[J]. Int J Biol Sci, 2021, 17(2): 603-622. |
| [28] |
WANG L, LI J C, SHI X L, et al. Antimalarial Dihydroartemisinin triggers autophagy within HeLa cells of human cervical cancer through Bcl-2 phosphorylation at Ser70[J]. Phytomedicine, 2019, 52: 147-156. |
| [29] |
LI Y Q, WANG W, LI A X, et al. Dihydroartemisinin induces pyroptosis by promoting the AIM2/caspase-3/DFNA5 axis in breast cancer cells[J]. Chem Biol Interact, 2021, 340: 109434. |
| [30] |
GENÇ H, HAZUR J, KARAKAYA E, et al. Differential responses to bioink-induced oxidative stress in endothelial cells and fibroblasts[J]. Int J Mol Sci, 2021, 22(5): 2358. |
| [31] |
ARIOTTI N, WU Y P, OKANO S, et al. An inverted CAV1 (caveolin 1) topology defines novel autophagy-dependent exosome secretion from prostate cancer cells[J]. Autophagy, 2021, 17(9): 2200-2216. |
| [32] |
WANG Y P, GAO W Q, SHI X Y, et al. Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a gasdermin[J]. Nature, 2017, 547(7661): 99-103. |
| [33] |
SHEN C, LU A, XIE W J, et al. Molecular mechanism for NLRP6 inflammasome assembly and activation[J]. Proc Natl Acad Sci USA, 2019, 116(6): 2052-2057. |






