2. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院神经内科;
3. 614000 四川 乐山,武警四川省总队医院神经外科
2. Department of Neurology, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Neurosurgery, Hospital of Sichuan Armed Police Corps, Leshan, Sichuan Province, 614000, China
脊髓损伤(spinal cord injury, SCI)发病率高,致残率高,导致严重的神经功能障碍。除胶质瘢痕外,纤维瘢痕是阻碍神经再生的重要因素。纤维瘢痕主要是成纤维细胞增殖组成,其释放的炎症因子以及细胞外基质成分阻碍了轴突新生。因此,抑制纤维瘢痕能改善脊髓损伤后运动功能。炎症反应在纤维瘢痕形成中发挥重要作用,调控炎症反应能减少纤维瘢痕形成。
大麻素受体2(cannabinoid receptor 2,CBR2)是一个G蛋白偶联受体家族,主要表达于外周免疫细胞和胶质细胞。有学者认为其在神经系统,也可能存在于神经元中[1],能抑制皮肤创伤纤维化[2]、心肌纤维化[3]、肾纤维化[4]和肺纤维化[5],但在脊髓损伤后纤维瘢痕形成中的作用并不清楚。CBR2激动剂通过抗炎活性降低脑损伤后的神经变性[6],同时可降低脊髓中Iba1的表达及IL-1β、TNF-α和IL-6的生成[7]。既然大麻素受体能在脊髓损伤后发挥抗炎作用,结合纤维瘢痕形成机制,我们推测CBR2激动剂能抑制脊髓损伤后纤维瘢痕形成。为了验证上述假说,本研究建立大鼠脊髓损伤模型后给予CBR2激动剂干预,探讨其对纤维瘢痕的抑制作用及神经保护作用。
1 材料与方法 1.1 主要试剂和药品一抗兔抗PDGFRβ、兔抗层粘连蛋白、兔抗纤连蛋白、兔抗-tubulin βⅢ、鸡抗胶质纤维酸性蛋白(glial fibrillary acidic protein, GFAP)均购自Abcam公司,二抗山羊抗鸡IgG及、山羊抗兔IgG购自Abcam公司。CBR2激动剂AM1241购自Abcam公司、CBR2拮抗剂AM630购自Cayman公司。TGF-β1(MK1722A)、iNOS(MK1515A)、TNF-α(MK1721B)、IL-1β(MK1588B)、CD206(MK7025B)、Arg-1(MK6667B) ELISA试剂盒均购自江苏MEIKE公司。
1.2 实验分组及给药方案大鼠由陆军军医大学实验动物中心提供。选取出生6~8周,体质量(240±20)g的雌性Sprague-Dawley大鼠144只。动物实验经陆军军医大学实验动物护理与使用伦理委员会批准[SYXK(渝)20170002]。实验分组:①假手术组(sham组,n=24);②载体组(vehicle组,n=40);③AM1241组(n=40);④AM1241+ AM630组(n=40)。假手术组和载体组术后立即给予生理盐水3 mL/kg,AM1241组术后立即给予AM1241(ab120934 3 mg/kg)首剂。AM1241+AM630组在给予AM1241治疗前30 min给予AM630 (Cayman 10006974 3 mg/kg)。药物均腹腔注射,每隔24 h给药1次,连续14 d。术后腹腔注射左氧氟沙星,连续3 d,1次/d,预防感染。膀胱压迫每日2次,直至自主膀胱功能恢复。
1.3 建立动物模型大鼠腹腔注射戊巴比妥钠(40 mg/kg)麻醉。按照既往手术方式建模[8-9]。不同之处在于T9段背侧垂直于脊髓长轴硬脑膜和蛛网膜切开暴露脊髓后,再使用预先标记刀尖的虹膜剪切开1.5 mm。将肌肉和皮肤缝合,放置在孵箱中,直到动物复苏。假手术组只移除椎板以暴露硬脊膜,但不切开硬脊膜。术后对其余各组进行MRI (Bruker 7.0T)检查,确认背侧半切模型符合实验要求。
1.4 行为学评估在术后1、3、7、14、21、28 d,根据大鼠质量,每组进行分层抽样,按随机数字表法选取8只大鼠进行后肢功能行为学评估。将大鼠置于直径2 m的圆形平台上,持续4 min,观察后肢的运动情况,进行Basso Beattie Bresnahan (BBB)评分,0分为无活动能力,完全瘫痪;21分为运动功能正常[9-11]。2 h后,进行斜板实验(olique board test)。将大鼠放置在铺有橡胶垫的矩形板上,逐步增加与水平地面的夹角,当大鼠能在斜板停留保持5 s以上,记录此时角度,测3次,取均值[9, 11]。
1.5 免疫荧光染色术后28 d,大鼠用戊巴比妥钠腹腔注射麻醉(40 mg/kg),4%多聚甲醛灌注后取脊髓组织(n=10)。而后用4%多聚甲醛溶液固定24 h,30%蔗糖溶液脱水过夜,取损伤中心头侧及尾侧各5 mm,OCT包埋后切片,切片厚度为16 μm。进行PDGFRβ、层黏连蛋白、纤连蛋白、tubulin βⅢ的免疫荧光染色。滴加兔抗PDGFRβ(1 ∶200)、兔抗层黏连蛋白(1 ∶200)、兔抗纤连蛋白(1 ∶100)、兔抗tubulin βⅢ (1 ∶500)、鸡抗GFAP (1 ∶1 000)一抗4 ℃孵育过夜,二抗山羊抗鸡IgG(1 ∶1 000)、山羊抗兔IgG(1 ∶500) 37 ℃孵育2 h。DAPI复染细胞核,用抗荧光猝灭封片剂封片,用激光共聚焦显微镜观察结果。
1.6 Western blot检测术后28 d,各组大鼠腹腔注射戊巴比妥钠(40 mg/kg) 麻醉后处死,取包含损伤中心头侧和尾侧各5 mm的脊髓(n=8)。提取总蛋白,用BCA蛋白浓度测定试剂盒检测总蛋白浓度。调整浓度至相同体积后,SDS-PAGE电泳取蛋白,转移至PVDF膜上,密封1 h,一抗(GFAP 1 ∶5 000, PDGFRβ 1 ∶500, 纤连蛋白1 ∶1 000, GAP-43 1 ∶500),4 ℃孵育过夜。二抗孵育2 h,用化学发光溶液显示图像。利用Image Lab软件对各条带的相对值进行分析。
1.7 电生理检查术后28 d,采用Keypoint 9033A07肌电图仪测量感觉诱发电位(sensory evoked potential, SEP)和运动诱发电位(motor evoked potential, MEP)。大鼠腹腔注射戊巴比妥钠(40 mg/kg)麻醉(n=10)。共使用5根针电极,按文献[12]放置每根电极的位置。SEP用适合后肢轻微抽搐的直流方波电脉冲刺激。灵敏度5 μV/D,扫描速度10 ms/D,带通滤波范围20~3 000 Hz,采用叠加技术,叠加次数200次,0.4~1.5 mA电脉冲可使后肢脚趾轻微抽搐,频率3 Hz。记录SEP潜伏期和振幅。然后更换电极来检测MEP,方法参见文献[9]。
1.8 ELISA检测术后14 d,取包含损伤中心头尾侧各5 mm的脊髓组织匀浆进行ELISA检测(n=6),4 ℃、12 000×g离心15 min。具体方法参见文献[13]。使用MEIKE TGF-β1(MK1722A)、iNOS(MK1515A)、TNF-α(MK1721B)、IL-1β(MK1588B)、CD206(MK7025B)、Arg-1(MK6667B)ELISA试剂盒,按生产厂家使用说明进行操作。
1.9 统计学分析采用SPSS 22.0统计软件对数据进行分析,Image J_1.8.0软件测量PDGFRβ、层黏连蛋白和纤连蛋白免疫阳性染色区域。数据以x±s表示,多组间比较采用单因素方差分析,LSD比较组间差异。检验水准:α=0.05。
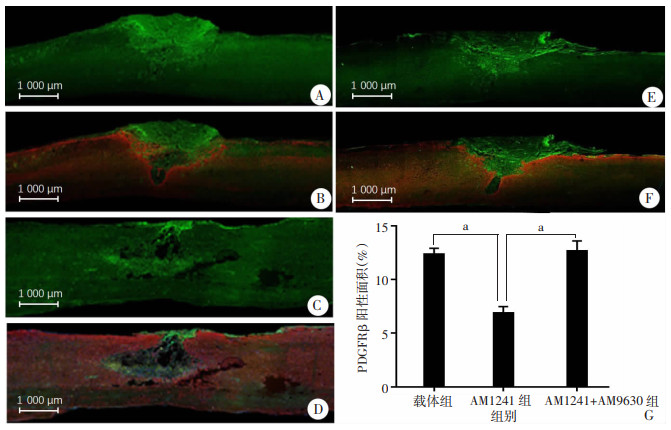
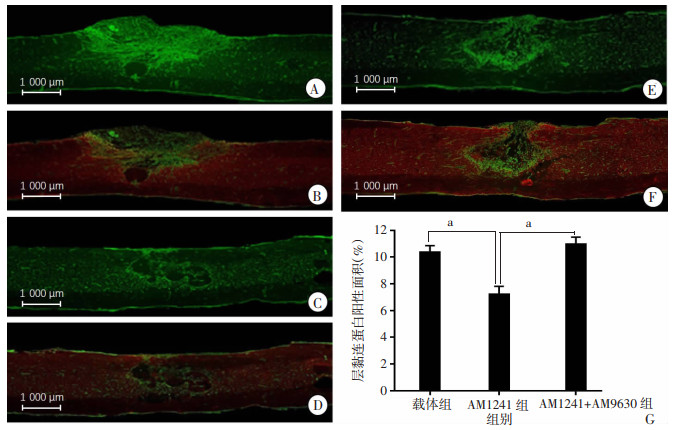
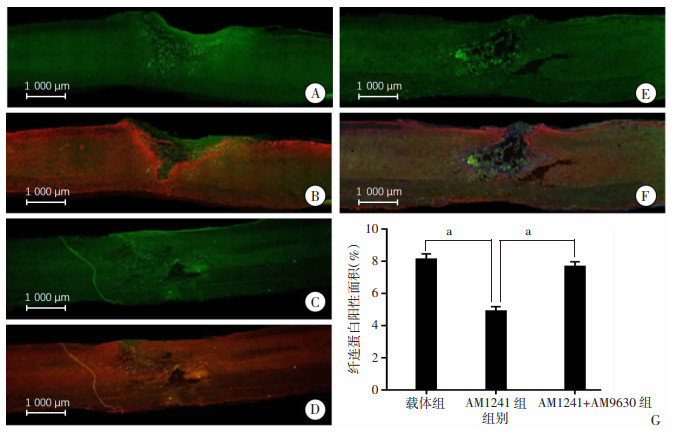
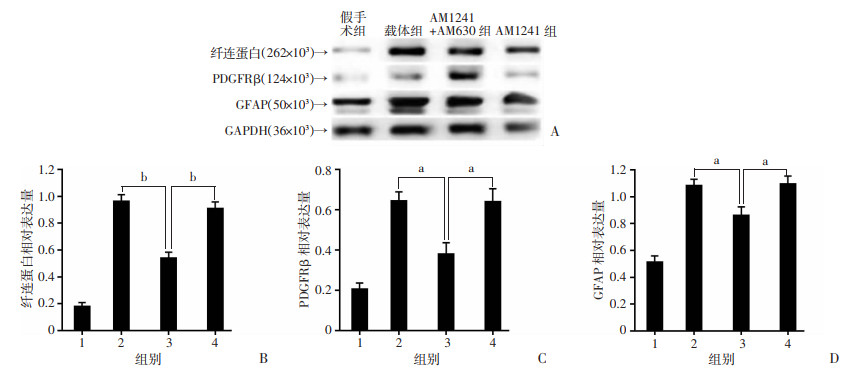
2 结果 2.1 AM1241抑制脊髓损伤后的纤维瘢痕形成使用PDGFRβ、层黏连蛋白和纤连蛋白染色检测脊髓损伤后的纤维瘢痕形成情况,使用Image J_1.8.0软件测量PDGFRβ、层黏连蛋白和纤连蛋白染色阳性区域。结果显示,脊髓损伤后,纤维瘢痕标记物PDGFRβ(图 1)、层黏连蛋白(图 2)和纤连蛋白(图 3)表达显著升高,与载体组比较,激活CBR2后显著降低PDGFRβ、层黏连蛋白和纤连蛋白阳性面积(P < 0.05)。而给予CBR2拮抗剂AM630阻断CBR2作用后逆转了上述现象(P < 0.05)。表明激活CBR2能抑制纤维瘢痕形成。Western blot结果也显示同样的趋势,AM1241降低了纤连蛋白、PDGFRβ和GFAP的表达,而CBR2阻断剂AM630逆转了这一现象(图 4)。
|
| A、B:载体组单标及双标染色;C、D:AM1241组单标及双标染色;E、F:AM1241+AM630组单标及双标染色 GFAP为红色;PDGFRβ为绿色;G:各组PDGFRβ阳性面积百分比 a: P < 0.05 图 1 激光共聚焦显微镜下观察脊髓损伤区域PDGFRβ、GFAP双标免疫荧光染色表达 |
|
| A、B:载体组单标及双标染色; C、D:AM1241组单标及双标染色;E、F:AM1241+AM630组单标及双标染色 GFAP为红色;层黏连蛋白为绿色;G:各组层黏连蛋白阳性面积百分比 a: P < 0.05 图 2 激光共聚焦显微镜下观察脊髓损伤区域层黏连蛋白、GFAP双标免疫荧光染色表达 |
|
| A、B:载体组单标及双标染色;C、D:AM1241组单标及双标染色;E、F:AM1241+AM630组单标及双标染色 GFAP为红色;纤连蛋白为绿色;G:各组纤连蛋白阳性面积百分比 a: P < 0.05 图 3 激光共聚焦显微镜下观察脊髓损伤区域纤连蛋白、GFAP双标免疫荧光染色表达 |
|
|
a: P < 0.05,b: P < 0.01; 1: 假手术组;2:载体组;3:AM1241组;4:AM1241+AM630组 A: Western blot检测结果;B: 纤连蛋白相对表达量;C:PDGFRβ相对表达量;D:GFAP相对表达量 图 4 Western blot检测纤连蛋白、PDGFRβ及GFAP的表达 |
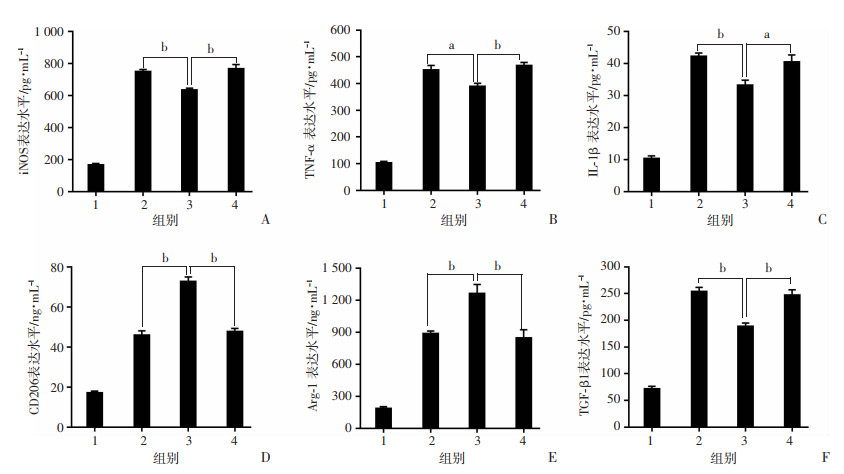
2.2 AM1241影响巨噬细胞的极化,降低促纤维化细胞因子的表达
ELISA法检测M1型巨噬细胞的标记物iNOS、TNF-α和IL-1β,M2型巨噬细胞标记物CD206、Arg-1以及促纤维化细胞因子TGF-β1。结果显示AM1241降低了M1型巨噬细胞标记物的表达,增加M2型巨噬细胞标记物的表达,降低了促纤维化因子的表达,但这一作用被AM630所逆转(图 5)。
|
|
1: 假手术组;2:载体组;3:AM1241组;4:AM1241+AM630组;a: P < 0.05,b: P < 0.01 A:iNOS;B:TNF-α;C:IL-1β;D:CD206;E:Arg-1;F:TGF-β1 图 5 ELISA检测相关细胞因子水平变化 |
2.3 AM1241减少脊髓损伤大鼠神经细胞凋亡,促进神经系统功能恢复
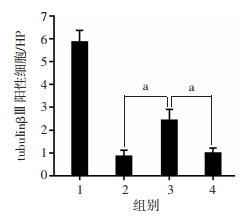
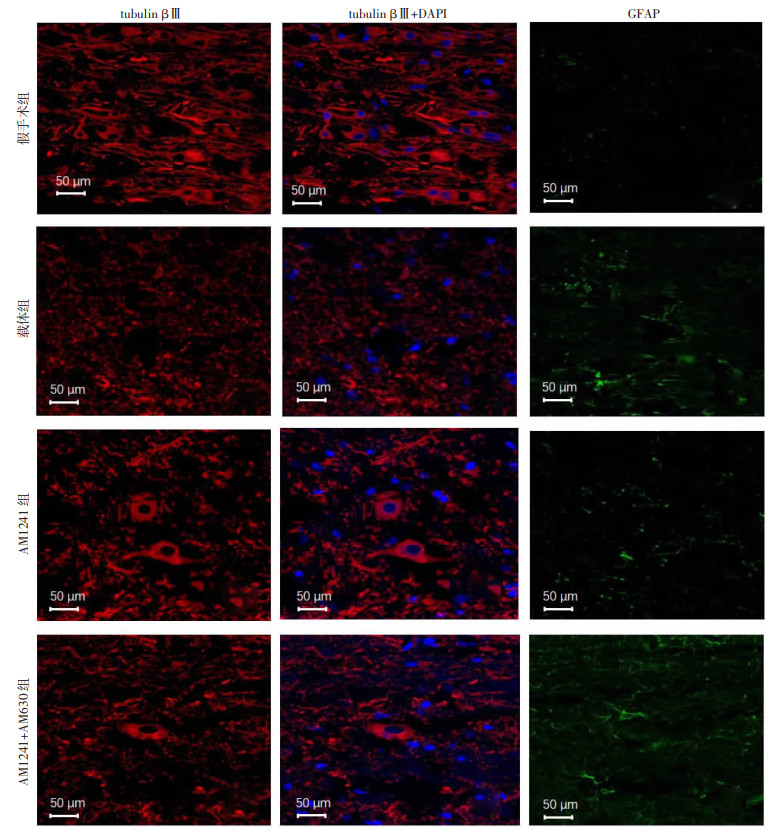
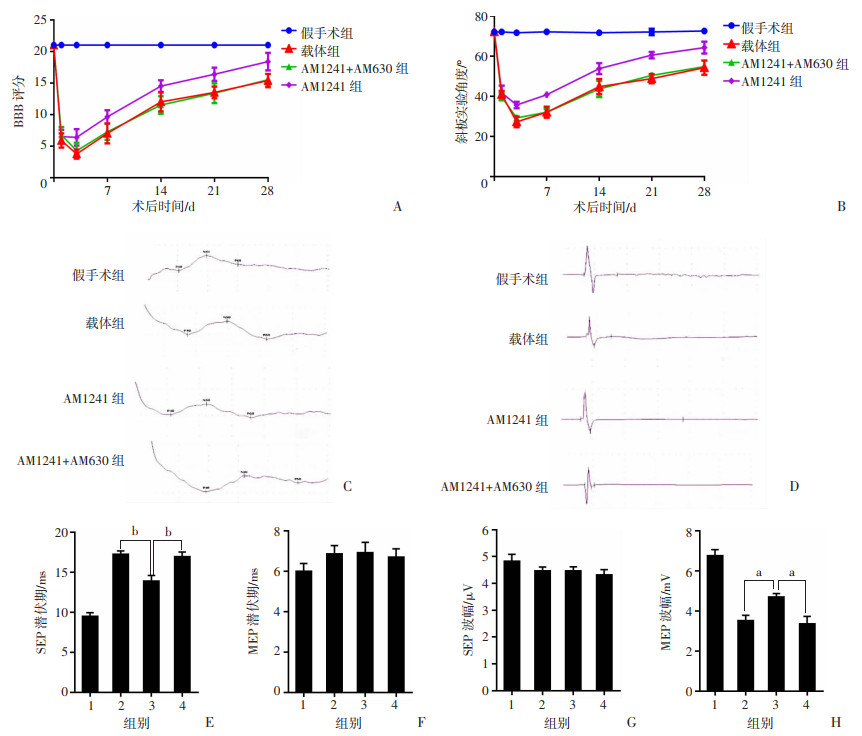
脊髓损伤后28 d进行tubulin βⅢ免疫荧光染色,结果显示AM1241组tubulin βⅢ阳性细胞增加,GFAP表达减少。AM1241促进了脊髓损伤后神经元细胞的存活,而AM630逆转了这一现象(图 6、7)。除术后第1天外,AM1241组各时间点BBB评分及斜板实验角度均高于载体组和AM1241+AM630组。术后28 d,与载体组及AM1241+AM630组比较,AM1241组BBB评分显著升高[载体组(15.38±0.38),AM1241组(18.38± 0.50),AM1241+AM630组(15.50±0.33), P < 0.05];斜板实验角度也显著增加[载体组(54.25±1.25)°,AM1241组(64.25±1.05)°,AM1241+AM630组(54.75± 0.49)°,P < 0.05]。术后第28天对实验动物进行SEP和MEP电生理检查,结果显示AM1241组SEP潜伏期短于载体组和AM1241+AM630组,MEP波幅高于载体组和AM1241+AM630组(图 8)。表明AM1241促进脊髓损伤后神经元细胞的存活及神经系统功能的恢复。
|
| 1: 假手术组;2:载体组;3:AM1241组;4:AM1241+AM630组;a: P < 0.05 图 6 各组tublin β Ⅲ阳性细胞的比较 |
|
| 红色为tubulin βⅢ;绿色为GFAP;蓝色为DAPI 图 7 免疫荧光染色观察大鼠脊髓损伤后神经细胞存活情况 |
|
| A:各时间点的BBB评分;B:各时间点的斜板实验结果;C:各组典型SEP;D:各组典型MEP;E:各组SEP潜伏期的比较;F:各组MEP潜伏期的比较;G:各组SEP波幅的比较;H:各组MEP波幅的比较 1:假手术组;2:载体组;3:AM1241组;4:AM1241+AM630组;a: P < 0.05,b: P < 0.01 图 8 SCI后各时间点的行为学评估及术后第28天的电生理检查结果 |
3 讨论
胶质瘢痕因其GFAP和硫酸软骨素蛋白多糖(chondroitin sulfate proteoglycon, CSPG),历来被认为是轴突再生的主要障碍。但近年来, 一些学者认为, 神经胶质瘢痕并不是轴突再生的一个障碍,纤维瘢痕抑制轴突再生的能力更强[14]。生物素葡聚糖胺(biotin dextran amine, BDA)跟踪的轴突尖端可以穿透胶质瘢痕和胶质纤维化界面,并与YFP+ A型周细胞来源的细胞接触,但很难穿透纤维瘢痕,纤维瘢痕的减少有助于脊髓损伤后神经功能的恢复[14]。还有一个观点在脊髓损伤后的亚急性阶段,胶质瘢痕是一个基本支持轴突再生的因素,在局部免疫调节中起着神经保护和组织修复等有益作用[15]。此外,大量重要的CSPG被证明是由非星形胶质细胞产生的,主要为成纤维细胞和巨噬细胞,而它们是形成纤维瘢痕的基本要素[15-16]。因此,近年来纤维瘢痕在脊髓损伤后的作用受到较多关注。
既往研究主要关注CBR2激动剂减轻疼痛方面的作用,也有多个系统中抗纤维化作用的报道。在脊髓损伤中,大麻素一直被患者用作治疗疼痛和痉挛的非传统疗法[17]。近年研究证实,CBR2激动剂在SCI后发挥抗炎作用[7],但在SCI后对纤维瘢痕的作用及机制却并不清楚。ZHANG等[18]发现,假手术组大鼠脊髓CBR2表达低或缺失,但脊髓损伤后其表达明显升高。而CBR2主要由单核细胞、巨噬细胞等造血细胞表达[19-20]。在纤维瘢痕的形成过程中,巨噬细胞通过调节成纤维细胞的迁移参与纤维瘢痕的形成。巨噬细胞分M1型和M2型。促炎M1巨噬细胞在脊髓损伤迅速激活,释放高水平的促炎细胞因子,包括IL-1β、TNF-α和iNOS,加重炎症过程,促进神经元凋亡[21-22]。M2巨噬细胞具有抗炎作用,主要通过分泌IL-10和Arg-1,并表达CD206和CD163[23-24]。TGF-β1的表达已被证明是纤维化和ECM蛋白活性合成的重要媒介[25]。APRIL(TNF-α的超家族成员)KO小鼠相较于野生型SCI后表现出更少的纤维瘢痕,提示M1巨噬细胞促进了纤维瘢痕的形成[26]。
根据纤维瘢痕的主要成分是成纤维细胞及其细胞外基质,本研究通过PDGFRβ、层黏连蛋白、纤连蛋白的免疫荧光染色和Western blot检测,发现AM1241减少了脊髓损伤后的纤维瘢痕,但这种作用被CBR2拮抗剂AM630逆转。PDGFRβ是成纤维细胞的可靠标记物[27],而层黏连蛋白和纤连蛋白为纤维瘢痕的主要成分,为成纤维细胞分泌细胞外基质蛋白[16]。通过神经元染色、行为学及电生理实验,发现AM1241增加大鼠神经细胞存活,促进神经系统功能恢复。最后,根据纤维瘢痕的形成机制,对M1和M2型巨噬细胞相关细胞因子进行检测,发现AM1241降低促炎M1型巨噬细胞(iNOS、IL-1β、TNF-α)的表达,增加抗炎M2型巨噬细胞(CD206、Arg-1)的表达,而AM630逆转了这一趋势。
综上所述,本研究证实CBR2激动剂AM1241能通过抑制脊髓损伤后M1巨噬细胞数量,增加M2巨噬细胞数量,从而抑制TGF-β表达,减少成纤维细胞的激活,抑制纤维瘢痕形成,保护残存神经元,促进大鼠脊髓损伤后运动功能恢复,为脊髓损伤的治疗提供了新的实验室数据。
本研究存在一定的局限性,首先CBR2激动剂抑制SCI后纤维瘢痕是否通过其他信号通路发挥作用仍需进一步研究;其次,为了排除用药不足对纤维瘢痕形成的干扰,仅选择第14天纤维瘢痕成熟的时机作为完成药物干预时间点,未来的研究需要更多的时间点和更长的观察时间。
利益冲突声明 所有作者声明不存在利益冲突。
| [1] |
ANAND U, OTTO W R, SANCHEZ-HERRERA D, et al. Cannabinoid receptor CB2 localisation and agonist-mediated inhibition of capsaicin responses in human sensory neurons[J]. Pain, 2008, 138(3): 667-680. |
| [2] |
CORREIA-SÁ I, PAIVA A, CARVALHO C M, et al. Cutaneous endocannabinoid system: does it have a role on skin wound healing bearing fibrosis?[J]. Pharmacol Res, 2020, 159: 104862. |
| [3] |
LI X, HAN D, TIAN Z H, et al. Activation of cannabinoid receptor type Ⅱ by AM1241 ameliorates myocardial fibrosis via Nrf2-mediated inhibition of TGF-β1/Smad3 pathway in myocardial infarction mice[J]. Cell Physiol Biochem, 2016, 39(4): 1521-1536. |
| [4] |
ZHOU L L, ZHOU S, YANG P, et al. Targeted inhibition of the type 2 cannabinoid receptor is a novel approach to reduce renal fibrosis[J]. Kidney Int, 2018, 94(4): 756-772. |
| [5] |
PARLAR A, ARSLAN S O, YUMRUTAS O, et al. Effects of cannabinoid receptor 2 synthetic agonist, AM1241, on bleomycin induced pulmonary fibrosis[J]. Biotech Histochem, 2021, 96(1): 48-59. |
| [6] |
YU S J, REINER D, SHEN H, et al. Time-dependent protection of CB2 receptor agonist in stroke[J]. PLoS One, 2015, 10(7): e0132487. |
| [7] |
ZHANG M Y, DONG L L, ZOU H C, et al. Effects of cannabinoid type 2 receptor agonist AM1241 on morphine-induced antinociception, acute and chronic tolerance, and dependence in mice[J]. J Pain, 2018, 19(10): 1113-1129. |
| [8] |
YUAN J C, LIU W, ZHU H T, et al. Curcumin inhibits glial scar formation by suppressing astrocyte-induced inflammation and fibrosis in vitro and in vivo[J]. Brain Res, 2017, 1655: 90-103. |
| [9] |
WANJIANG W, XIN C, YAXING C, et al. Curcumin improves human umbilical cord-derived mesenchymal stem cell survival via ERK1/2 signaling and promotes motor outcomes after spinal cord injury[J]. Cell Mol Neurobiol, 2020, 2020Nov27. |
| [10] |
YUAN J C, ZOU M M, XIANG X, et al. Curcumin improves neural function after spinal cord injury by the joint inhibition of the intracellular and extracellular components of glial scar[J]. J Surg Res, 2015, 195(1): 235-245. |
| [11] |
向鑫, 袁继超, 陈飞, 等. 姜黄素诱导内源性神经干细胞促进大鼠脊髓损伤后功能修复[J]. 第三军医大学学报, 2014, 36(9): 883-887. XIANG X, YUAN J C, CHEN F, et al. Curcumin induces endogenous neural stem cells to promote functional recovery in rats after spinal cord injury[J]. J Third Mil Med Univ, 2014, 36(9): 883-887. |
| [12] |
XIE C Z, LI X Z, FANG L, et al. Effects of athermal shortwave diathermy treatment on somatosensory evoked potentials and motor evoked potentials in rats with spinal cord injury[J]. Spine (Phila Pa 1976), 2019, 44(13): E749-E758. |
| [13] |
廖小俊, 袁继超, 朱海涛, 等. 莱菔硫烷对小鼠脊髓损伤后后肢功能的作用[J]. 第三军医大学学报, 2016, 38(10): 1066-1072. LIAO X J, YUAN J C, ZHU H T, et al. Effect of sulforaphane on hindlimb function after spinal cord injury in mice[J]. J Third Mil Med Univ, 2016, 38(10): 1066-1072. |
| [14] |
DIAS D O, KIM H, HOLL D, et al. Reducing pericyte-derived scarring promotes recovery after spinal cord injury[J]. Cell, 2018, 173(1): 153-165.e22. |
| [15] |
ANDERSON M A, BURDA J E, REN Y L, et al. Astrocyte scar formation aids central nervous system axon regeneration[J]. Nature, 2016, 532(7598): 195-200. |
| [16] |
HELLAL F, HURTADO A, RUSCHEL J, et al. Micro-tubule stabilization reduces scarring and causes axon regeneration after spinal cord injury[J]. Science, 2011, 331(6019): 928-931. |
| [17] |
POOYANIA S, ETHANS K, SZTURM T, et al. A randomized, double-blinded, crossover pilot study assessing the effect of nabilone on spasticity in persons with spinal cord injury[J]. Arch Phys Med Rehabil, 2010, 91(5): 703-707. |
| [18] |
ZHANG J, HOFFERT C, VU H K, et al. Induction of CB2 receptor expression in the rat spinal cord of neuropathic but not inflammatory chronic pain models[J]. Eur J Neurosci, 2003, 17(12): 2750-2754. |
| [19] |
BAHR B A, KARANIAN D A, MAKANJI S S, et al. Targeting the endocannabinoid system in treating brain disorders[J]. Expert Opin Investig Drugs, 2006, 15(4): 351-365. |
| [20] |
LAPRAIRIE R B, KELLY M E M, DENOVAN-WRIGHT E M. The dynamic nature of type 1 cannabinoid receptor[CB(1)] gene transcription[J]. Br J Pharmacol, 2012, 167(8): 1583-1595. |
| [21] |
TALAMONTI E, PAUTER A M, ASADI A, et al. Impairment of systemic DHA synthesis affects macrophage plasticity and polarization: implications for DHA supplementation during inflammation[J]. Cell Mol Life Sci, 2017, 74(15): 2815-2826. |
| [22] |
CITRON B A, ARNOLD P M, SEBASTIAN C, et al. Rapid upregulation of caspase-3 in rat spinal cord after injury: mRNA, protein, and cellular localization correlates with apoptotic cell death[J]. Exp Neurol, 2000, 166(2): 213-226. |
| [23] |
ETZERODT A, MOESTRUP S K. CD163 and inflammation: biological, diagnostic, and therapeutic aspects[J]. Antioxid Redox Signal, 2013, 18(17): 2352-2363. |
| [24] |
YANG R L, HE J Y, WANG Y L. Activation of the niacin receptor HCA2 reduces demyelination and neurofilament loss, and promotes functional recovery after spinal cord injury in mice[J]. Eur J Pharmacol, 2016, 791: 124-136. |
| [25] |
LIU G, FRIGGERI A, YANG Y P, et al. miR-21 mediates fibrogenic activation of pulmonary fibroblasts and lung fibrosis[J]. J Exp Med, 2010, 207(8): 1589-1597. |
| [26] |
FUNK L H, HACKETT A R, BUNGE M B, et al. Tumor necrosis factor superfamily member APRIL contributes to fibrotic scar formation after spinal cord injury[J]. J Neuroinflamm, 2016, 13(1): 87. |
| [27] |
SODERBLOM C, LUO X T, BLUMENTHAL E, et al. Perivascular fibroblasts form the fibrotic scar after contusive spinal cord injury[J]. J Neurosci, 2013, 33(34): 13882-13887. |




