终末期肾病(end stage renal disease, ESRD),也称尿毒症,因其并发症多、病死率高,已成为危害人类健康的重大疾患之一。腹膜透析(peritoneal dialysis,PD)是ESRD患者广泛采用的肾脏替代治疗方式之一,全球超过11%的ESRD患者选择PD治疗[1]。由于长期生物不相容性透析液(含有高糖、糖基化终末产物等)的暴露、腹膜炎的反复刺激以及腹腔尿毒症环境的影响等原因,腹膜可发生渐进性损伤,最终发生腹膜纤维化而导致PD治疗失败,直接影响患者的生存质量和预后[2]。针对PD相关性腹膜纤维化尚缺乏有效的防治方法。研究发现,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)治疗能促进损伤的腹膜间皮细胞修复,缓解腹膜炎症及纤维化,并能从一定程度上改善腹膜功能[3]。BMSCs的成瘤性、增殖分化不可控性是限制其应用的主要瓶颈。研究发现,外泌体(exosomes)是由细胞内多囊泡体与细胞膜融合后释放到胞外基质的膜性囊泡,携带有细胞来源相关的多种蛋白质、脂类、DNA、mRNA、miRNA等,参与细胞间通讯、细胞迁移、血管新生和免疫调节等多种生物学过程[4]。
间充质干细胞(marrow mesenchymal stem cells,MSCs)来源的外泌体的生物学功能与BMSCs相似,且相较于BMSCs而言,存在稳定性高,易于储存、易于提取、免疫原性低等优势[5-6]。最新研究表明,BMSCs外泌体已在促进心脏、肾脏等器官损伤修复方面展现出潜力,可通过抑制组织炎症、纤维化及促进损伤后细胞增殖修复发挥治疗作用[7]。因此,BMSCs外泌体治疗可能是比BMSCs治疗更具有优势的一种新型疗法。本研究利用BMSCs外泌体来探索其对高糖腹透液诱导的腹膜纤维化小鼠模型的治疗作用,从而为BMSCs外泌体治疗PD腹膜纤维化提供理论依据。
1 材料与方法 1.1 实验动物本研究采用35只SPF级健康雄性C57bl/6小鼠,体质量18~20 g, 6~8周龄,购自陆军特色医学中心实验动物中心,生产许可证号:SCXY(京)2016-0006。
1.2 小鼠BMSCs原代分离将3只小鼠以脱颈断髓法处死后用乙醇浸泡,无菌条件下取出双侧胫骨和股骨,去除残存软组织,剪除胫骨和股骨骨骺两端。用培养基冲洗骨髓腔后吹打细胞悬液,使细胞流出,再通过细胞筛收集细胞,反复清洗,直到骨髓腔变白。骨髓细胞的悬液在1 000 r/min条件下离心5 min; 去除上清液,重悬细胞沉淀。取出细胞,混匀后将全骨髓细胞铺在T75细胞培养瓶。将培养瓶置于充满低氧混合气(5% O2, 10% CO2, 85% N)的缺氧小室后,将细胞置于37℃细胞培养箱培养。如果BMSCs贴壁成簇生长达到80%即可进行传代工作; PBS清洗,胰酶消化。细胞悬液加入完全培养基终止消化, 在1 000 r/min条件下离心5 min;去除上清液,加入完全培养基重悬细胞沉淀, 1 ∶2进行传代。2~3 d后,细胞汇合度达80%以上,可再次传代分离的原代BMSCs传代培养[8]。
1.3 小鼠BMSCs的鉴定将提取的小鼠原代细胞进行细胞染色及流式细胞检测,所提取的原代细胞98%以上表面分子标记为CD29(+)、CD90(+),CD34(-)、CD11b(-);对提取的小鼠原代BMSCs进行成骨及成脂分化诱导,成骨诱导21 d后,茜素红染色显示体外诱导细胞可形成大量钙结节;同时,成脂诱导21 d后,油红O染色可见体外诱导细胞形成明显脂滴。本部分实验证实,所提取的小鼠BMSCs纯度较高,且具有多向分化能力,可用于进一步实验。
1.4 小鼠BMSCs来源外泌体的分离与鉴定收集BMSCs上清,经2 000×g 4 ℃离心30 min,取上清后经0.22 μm滤膜过滤,滤液经120 000×g 4 ℃超速离心2 h, 重悬沉淀后,经120 000×g 4 ℃超速离心2 h, 冷PBS重悬,-80 ℃长期保存;通过透射电镜观察可见典型的杯托状外泌体结构,Western blot检测可见外泌体标志蛋白CD63、CD9均表达,从而符合外泌体鉴定标准[9]。
1.5 构建高糖腹膜透析液诱导的腹膜纤维化小鼠模型将32只小鼠随机分为4组(n=8):①正常对照组: 不予任何处理;②生理盐水组:小鼠腹腔内注射0.9%生理盐水(0.1 mL/g),每日2次;③4.25%腹膜透析液组:小鼠腹腔内注射4.25%腹膜透析液(0.1 mL/g),每日2次(4.25%为葡萄糖浓度,广州百特公司);④4.25%腹膜透析液+外泌体组:小鼠腹腔内注射4.25%腹膜透析液(0.1 mL/g),每日2次,并分别于第28天和第35天每只小鼠腹腔内注射一次外泌体进行治疗(200 μg· kg-1· dose-1)[10-11];各组小鼠均连续注射42 d。42 d后取壁腹膜,用生理盐水冲洗干净后,迅速剪裁2/3的组织放置冻存管内备用,剩余部分用锋利的刀片整齐的切成2条长1 cm,宽4 mm的组织,放入4%的多聚甲醛里面固定至少24 h后脱水包埋。
1.6 腹膜组织病理染色及免疫组化腹膜组织石蜡切片进行PAS、Masson染色及免疫组化染色。烤片后,按照二甲苯、无水乙醇、95%乙醇、75%乙醇的顺序依次进行脱蜡复水后, 清水冲洗。Masson染色:天青石蓝,清水冲洗,苏木素,清水冲洗,马松染料,清水冲洗,磷钼酸,苯胺蓝,清水冲洗。PAS染色:高碘酸浸染,清水冲洗,PAS滴染,清水冲洗,苏木素,清水冲洗。免疫组化:高压抗原修复,PBS浸洗,山羊血清封闭,PBS浸洗,免疫组化笔以组织为中心画圈标记,3%过氧化氢,滴加一抗α-SMA(武汉三鹰公司),Collagen-Ⅰ(美国Abcam公司), Collagen-Ⅲ(美国Abcam公司)抗体,稀释浓度均为1 ∶200,4 ℃湿盒过夜,PBS浸洗,滴加二抗,湿盒内37 ℃孵育,PBS浸洗,DAB工作液显微镜下显色。苏木素染液浸泡,蒸馏水冲洗,盐酸乙醇分化,蒸馏水漂洗,95%~100%乙醇梯度脱水,二甲苯透明,中性树脂封片。光镜下观察小鼠腹膜组织的病理改变,并利用腹膜组织PAS和Masson染色评估腹膜厚度。腹膜厚度计算方法为每个标本随机选择8个视野,每个视野计数8次,取平均值。免疫组化染色分别使用阳性细胞百分比(腹膜间皮下区域组化染色阳性细胞数/总细胞数,每个样本随机选择6个视野,取平均值)和阳性面积百分比(阳性区域面积/腹膜间皮下区域总面积,每个样本随机选择6个视野,取平均值)通过Image-Pro Plus 6.0软件来进行半定量评估。
1.7 改良腹膜平衡实验小鼠建模42 d后,进行改良腹膜平衡实验(peritoneal balance test, PET)评估腹膜功能[12]。选用3 mL、7 %腹膜透析液(4.25%腹膜透析液9 mL与50%葡萄糖注射液0.58 mL配制而成)注射小鼠腹腔, 经120 min的腹膜交换获得通透性参数。在第120分钟PET结束时,绝大部分腹腔透析液经由腹腔回收, 残余部分通过开腹置入预先称重调零的干纱布,在精密天平上称重获得(误差幅度: 1 μL)。在假定液体密度为1的情况下,将所有液体重量转化为体积参与计算超滤量(ultrafiltration, UF)。最终计算的超滤量为收集的透析液标本体积的总和减去透析前注射的体积。
1.8 实时定量PCR实时定量PCR (quantitative real-time PCR,qRT-PCR)用Primer Premier 5软件设计反应的引物,用Oligo软件验证和评估引物。引物序列:GAPDH (F: AATGGATTTGGACGCATTGGT; R: TTTGCACTGGTAC-GTGTTGAT); Collagen-Ⅰ(F: CCTCAGGGTATTGCTGGACAAC;R: CAGAAGGACCTTGTTTGCCAGG);Collagen-Ⅲ(F: GACCAAAAGGTGATGCTGGACAG;R: CA-AGACCTCGTGCTCCAGTTAG);α-SMA(F:TGCTGACAGAGGCACCACTGAA;R: CAGTTGTACGTCCAGA-GGCATAG)。采用TRIzol法提取RNA,RNA逆转为cDNA。采用Promega试剂盒, 按照TAKARA PrimeScriptTM RT reagen Kit with gDNA Eraser(日本TAKARA公司)说明书配制反应体系,将反应体系放入PCR仪,逆转录反应。逆转录后,按照SYBRⓇ Green Realtinme PCR Master Mix(日本TOYOBO公司)试剂盒说明书加样,将CFX 96荧光定量PCR检测系统(美国Bio-rad公司)设置好Tm值后自动分析。
1.9 酶联免疫吸附剂测定(enzyme linked immunosorbent assay,ELISA)利用ELISA试剂盒标准流程(上海恒远生物科技有限公司)严格按照说明书检测小鼠尿液和细胞培养上清TGF-β水平。
1.10 统计学分析采用SPSS 19.0软件进行数据统计分析,对于正态分布的计量资料,组间比较采用单因素方差分析。对于非正态分布的计量资料,组间比较采用Kruskal Wallis检验。P < 0.05为差异有统计学意义。
2 结果 2.1 原代流式细胞仪鉴定BMSCs表面标志物及BMSCs分化结果利用流式细胞检测对小鼠原代BMSCs进行表型鉴定,结果提示BMSCs表达整合素家族类抗原标志分子CD29、黏附分子家族类抗原标志分子CD90,而不表达细胞抗原CD11b和细胞抗原CD34(图 1A)。利用成骨诱导和成脂诱导检测BMSCs多向分化潜能,成骨诱导分化可见细胞形态由梭形变为多角形, 细胞呈多层性、重叠性排列,形成间质内含大量矿盐沉积的钙化结节。茜素红S染色可见矿化结节呈现红色,见图 1B。成脂肪诱导分化诱导而成的脂肪细胞累积脂质,脂滴变大并合并呈串珠状。经油红O染色呈鲜红色,见图 1C。
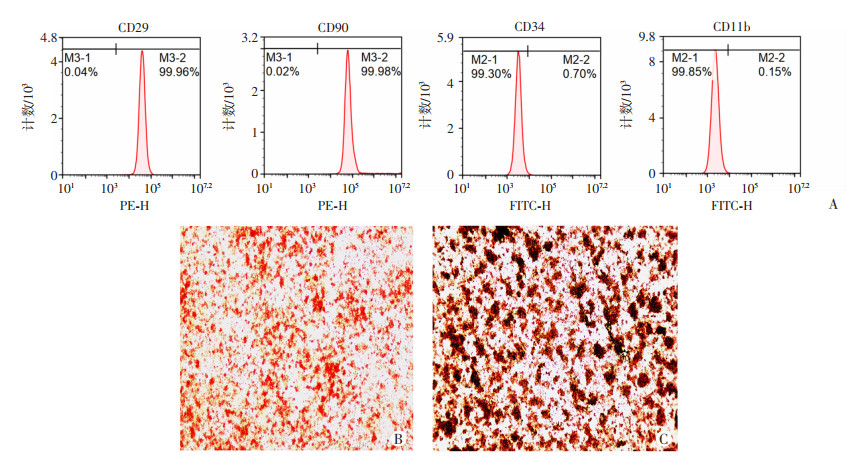
|
| A:BMSCs表面分子标记的流式检测;B: BMSCs成骨诱导茜素红染色(×40);C:BMSCs成脂诱导油红O染色(×40) 图 1 小鼠BMSCs的鉴定 |
2.2 小鼠BMSCs来源外泌体的电镜观察及标志物鉴定结果
电镜下观察到外泌体典型的杯口状结构,见图 2A。同时Western blot结果显示外泌体标志蛋白CD9、CD63均呈阳性,见图 2B。

|
| A: 透射电镜下外泌体的形态;B: 外泌体表面分子蛋白CD9和CD63的表达 图 2 小鼠骨髓间充质干细胞外泌体鉴定 |
2.3 外泌体治疗抑制高糖腹膜透析液诱导的腹膜增厚
与正常对照组比较,4.25%腹膜透析液组小鼠的腹膜厚度明显增加(图 3)。4.25%腹膜透析液+外泌体组的小鼠腹膜厚度程度表达水平明显低于4.25% 腹膜透析液组,提示外泌体治疗能减轻高糖导致的腹膜增厚, 差异均具有统计学意义(P < 0.05)。
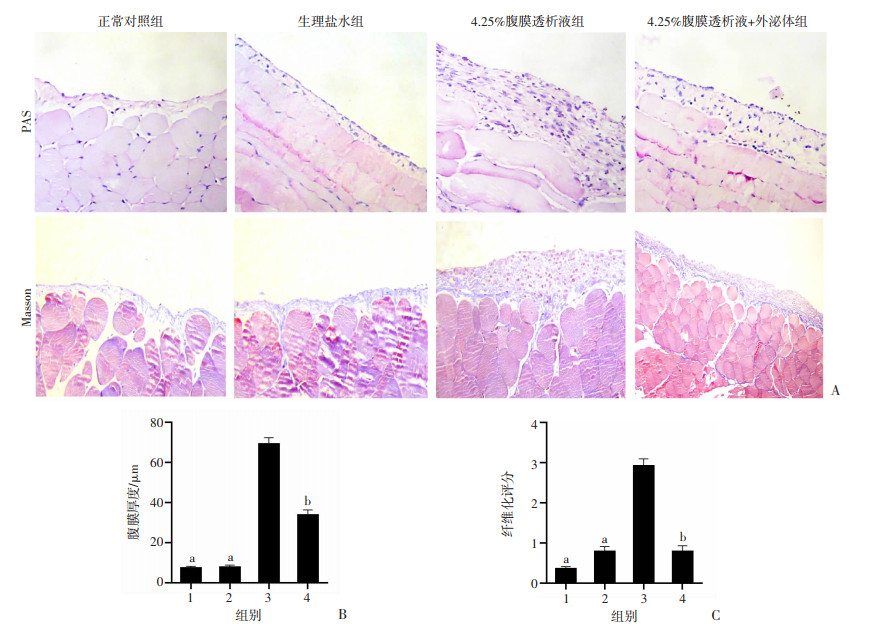
|
| A:小鼠腹膜组织PAS和Masson染色(×200);B: 小鼠腹膜厚度;C:小鼠腹膜纤维化评分 1: 正常组;2:生理盐水组;3:4.25%腹膜透析液组;4:4.25%腹膜透析液+外泌体组 a: P < 0.01,b: P < 0.05, 与4.25%腹膜透析液组比较 图 3 外泌体治疗抑制高糖腹透液导致的小鼠腹膜增厚 (x±s,n=3) |
2.4 外泌体治疗抑制高糖腹膜透析液诱导的小鼠腹膜组织纤维化标志物的表达
免疫组化结果发现,与正常对照组比较,4.25%腹膜透析液组腹膜纤维化的标志物表达(α-SMA,Collagen-Ⅰ, Collagen-Ⅲ)显著增强(图 4),提示4.25%腹透液持续42 d灌注会诱导腹膜出现显著的腹膜纤维化。外泌体治疗组比4.25%组纤维化标志物(α-SMA,Collagen-Ⅰ, Collagen-Ⅲ)表达显著降低,提示外泌体治疗能够缓解高糖腹膜透析液刺激下小鼠腹膜纤维化的程度。
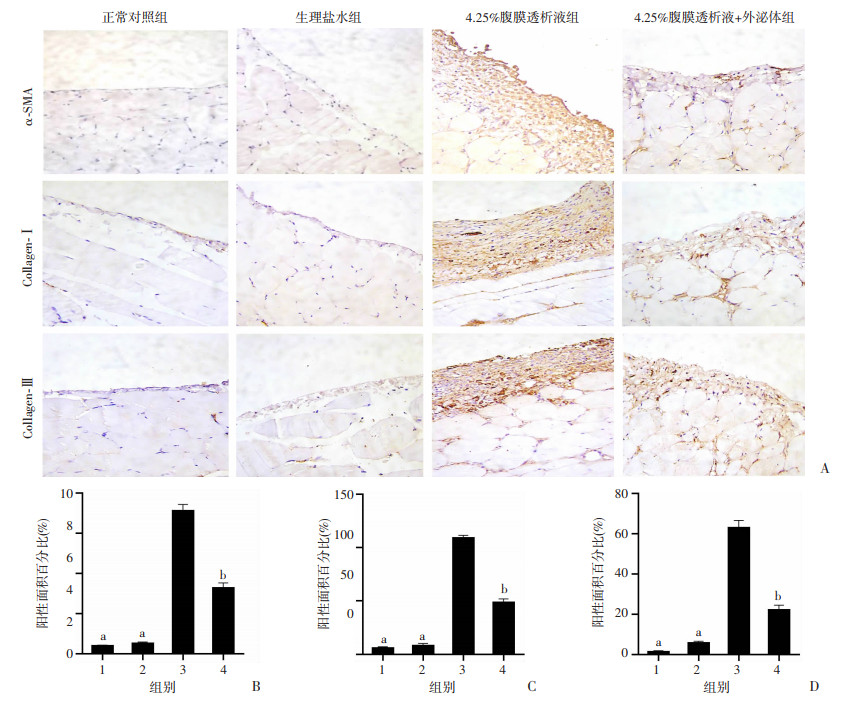
|
| A:免疫组化检测小鼠腹膜组织纤维化指标(α-SMA、Collagen-Ⅰ、Collagen-Ⅲ)组化水平(×200);B:α-SMA表达阳性面积百分比;C:Collagen-Ⅰ表达阳性面积百分比;D:Collagen-Ⅲ表达阳性面积百分比 1: 正常对照组;2:生理盐水组;3:4.25%腹膜透析液组;4:4.25%腹膜透析液+外泌体组 a: P < 0.01, b: P < 0.05, 与4.25%腹膜透析液组比较 图 4 外泌体治疗缓解高糖腹透液诱发的小鼠腹膜纤维化标志物的表达 (x±s,n=3) |
通过检测小鼠腹膜组织纤维化标志mRNA水平发现,与正常对照组比较,4.25%腹膜透析液组小鼠腹膜纤维化标志(α-SMA,Collagen-Ⅰ, Collagen-Ⅲ)mRNA水平明显增高(图 5)。4.25%腹膜透析液+外泌体组小鼠腹膜厚纤维化指标mRNA水平明显低于4.25%腹膜透析液组,提示外泌体治疗能抑制高糖腹膜透析液导致的腹膜纤维化, 差异具有统计学意义(P < 0.05)。
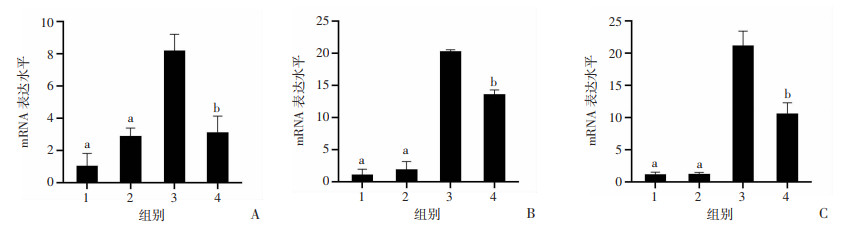
|
| 1: 正常组;2:生理盐水组;3:4.25%腹膜透析液组;4:4.25%腹膜透析液+外泌体组 a: P < 0.01, b: P < 0.05, 与4.25%腹膜透析液组比较 图 5 RT-qPCR检测小鼠腹膜组织α-SMA(A)、Collagen-Ⅰ(B)及Collagen-Ⅲ(C)的mRNA水平 (x±s,n=3) |
2.5 外泌体治疗抑制高糖腹透液诱导的腹膜促纤维化因子的表达
与正常对照组比较,4.25%腹膜透析液组小鼠腹膜组织TGF-β1促纤维化因子的mRNA表达水平与蛋白浓度显著升高,提示高糖刺激引起腹膜促纤维化因子升高。4.25%腹膜透析液+外泌体组与4.25%腹膜透析液组比较,腹膜组织促纤维化因子水平与蛋白浓度明显降低,提示外泌体能有效抑制高糖刺激引起的腹膜促纤维化因子的升高(图 6), 差异具有统计学意义(P < 0.05)。
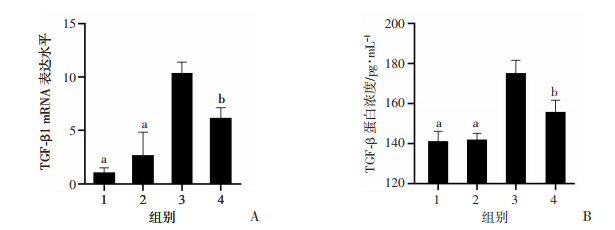
|
| A: RT-qPCR检测各组小鼠腹膜TGF-β1 mRNA表达水平; B:ELISA检测各种小鼠腹膜TGF-β1蛋白浓度 1: 正常组;2:生理盐水组;3:4.25%腹膜透析液组;4:4.25%腹膜透析液+外泌体组 a: P < 0.01, b: P < 0.05, 与4.25%腹膜透析液组比较 图 6 RT-qPCR与ELISA检测在各组小鼠腹膜组织中促纤维化因子的表达 (n=3,x±s) |
2.6 外泌体治疗改善高糖腹透液诱导的腹膜功能损伤
腹膜功能受损一般表现为PET实验显示高转运状态(葡萄糖浓度比下降,尿素氮浓度比升高),但超滤量下降。这由于腹膜对葡萄糖的平衡速度快,溶质浓度梯度迅速下降,腹膜对水分的超滤不充分。PET实验结果显示,与正常对照组比较,4.25%腹膜透析液组小鼠腹膜功能表现为高转运状态,但超滤功能显著下降,提示高糖诱导小鼠腹膜高转运状态及超滤功能损伤。4.25%腹膜透析液+外泌体组小鼠腹膜功能与正常对照组的溶质平衡作用、超滤功能比较无显著差异。而4.25%腹膜透析液+外泌体组与4.25%腹膜透析液组比较,小鼠腹膜超滤功能增强、高转运状态改善,提示外泌体改善高糖腹膜透析液诱导的腹膜高转运状态及腹膜超滤功能受损(图 7), 差异具有统计学意义(P < 0.05)。
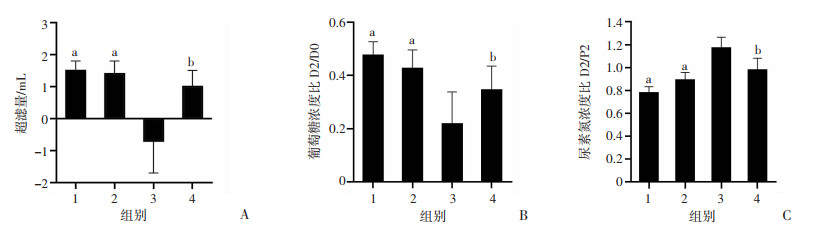
|
| A: 小鼠腹膜功能超滤量的对比;B: 2 h腹膜摄取葡萄糖比值;C: 各组尿素氮清除速度 1: 正常组;2:生理盐水组;3:4.25%腹膜透析液组;4:4.25%腹膜透析液+外泌体组 a: P < 0.01, b: P < 0.05, 与4.25%腹膜透析液组比较 图 7 改良腹膜平衡实验检测各组小鼠腹膜的超滤与转运功能 (x±s,n=3) |
3 讨论
本研究利用骨髓间充质干细胞外泌体治疗高糖诱导的腹膜透析相关性腹膜纤维化,首次发现BMSCs外泌体能够有效抑制高糖诱导的腹膜增厚和腹膜纤维化。其分子机制可能是通过外泌体内成分抑制促纤维化因子TGF-β1的表达。因此,外泌体治疗可能是一种新型有效的延缓腹膜纤维化的临床治疗手段,有助于延长尿毒症患者的腹膜透析时间,提高其生活便捷度和生存质量。
已有研究证实,外泌体治疗在肾脏、肺、肝脏等器官中具有抑制纤维化的作用[13]。目前,研究认为间充质干细胞外泌体主要是通过miRNAs发挥其生物学作用。一些miRNA已被证实发挥抗纤维化的作用,如miR-125b-5p,miR-146a-5p, miR-34c-5p等[14-16]。骨髓间充质干细胞外泌体能够抑制上皮间充质转化(epithelial-mesenchymal transition, EMT)改善心肌纤维化[17]。也有研究发现外泌体通过抑制多种蛋白质的核心岩藻糖基化来改善肾间质纤维化[18]。外泌体还能调控多种miRNA缓解不同动物模型中的腹膜纤维化[20]、特发性肺纤维化[18]及肝脏纤维化[19]。因此,为深入机制研究,还需要进一步明确外泌体发挥抗纤维化作用的关键miRNA及其机制。
PD相关性腹膜纤维化是由多种因素共同作用导致的,可能与长期暴露于高浓度葡萄糖、高级糖基化降解产物、尿毒症毒素等有关[20-23]。高糖腹透液诱导的腹膜纤维化是目前公认的导致PD技术受限的主要原因[24]。高糖腹透液可引起持续的腹膜慢性炎症反应,导致腹膜纤维化[25-27]。因此,本研究采用高糖腹透液刺激造模,发现能够明显诱导小鼠腹膜出现纤维化。本研究还发现BMSCs外泌体可明显减轻TGF-β1表达的升高。由此,本研究认为间充质干细胞外泌体可能通过其内miRNAs靶向抑制TGF-β1表达及其下游信号通路,从而改善腹膜纤维化。
综上所述,BMSCs外泌体治疗可能通过抑制高糖腹透液诱导的促纤维化因子TGF-β1表达及其下游通路的激活,从而发挥抑制腹膜纤维化的作用,可为防治PD相关性腹膜纤维化提供新思路及新方法。
| [1] |
THURLOW J S, JOSHI M, YAN G F, et al. Global epidemiology of end-stage kidney disease and disparities in kidney replacement therapy[J]. Am J Nephrol, 2021, 52(2): 98-107. |
| [2] |
MORINELLI T A, LUTTRELL L M, STRUNGS E G, et al. Angiotensin Ⅱ receptors and peritoneal dialysis-induced peritoneal fibrosis[J]. Int J Biochem Cell Biol, 2016, 77(Pt B): 240-250. |
| [3] |
ALATAB S, NAJAFI I, ATLASI R, et al. A systematic review of preclinical studies on therapeutic potential of stem cells or stem cells products in peritoneal fibrosis[J]. Italian J Urol Nephrol, 2018, 70(2): 162-178. |
| [4] |
李清茹, 张琳琪, 陈旭, 等. 间充质干细胞来源细胞外囊泡治疗和修复急慢性肾损伤[J]. 中国组织工程研究, 2022, 26(31): 5069-5075. LI Q R, ZHANG L Q, CHEN X, et al. Mesenchymal stem cells-derived extracellular vesicles in the treatment and repair of acute and chronic renal injuries[J]. Chin J Tissue Eng Res, 2022, 26(31): 5069-5075. |
| [5] |
程娇娇, 崔钧贺, 高永胜, 等. 外泌体在远隔缺血预适应中对神经细胞的保护作用[J]. 生理科学进展, 2020, 51(3): 216-218. CHENG J J, CUI J H, GAO Y S, et al. Effect of exosomes on neurocytes protection in remote ischemic preconditioning[J]. Prog Physiol Sci, 2020, 51(3): 216-218. |
| [6] |
项协隆, 林沁. 腹膜纤维化大鼠模型研究进展[J]. 医学综述, 2010, 16(10): 1445-1447. XIANG X L, LIN Q. Advances in peritoneal fibrosis rat model[J]. Med Recapitul, 2010, 16(10): 1445-1447. |
| [7] |
JIE S, YUCHEN Z, ZHIFANG N, et al. Mesenchymal stem cell-derived small extracellular vesicles in the treatment of human diseases: progress and prospect[J]. World J Stem Cells, 2021, Jan 26;13(1): 49-63. |
| [8] |
程欢, 苏盖, 陶思跃, 等. 小鼠骨髓间充质干细胞的稳定高效培养及外泌体的提取[J]. 安徽医科大学学报, 2020, 55(4): 518-522. CHENG H, SU G, TAO S Y, et al. Stable and efficient culture of mouse bone marrow mesenchymal stem cells and extraction of its exosomes[J]. Acta Univ Med Anhui, 2020, 55(4): 518-522. |
| [9] |
KHATUN Z, BHAT A, SHARMA S, SHARMA A, et al. Elucidating diversity of exosomes: biophysical and molecular characterization methods[J]. Nanomedicine (Lond), 2016, Sep; 11(17): 2359-2377. |
| [10] |
EBRAHIM N, AHMED I A, HUSSIEN N I, et al. Mesenchymal stem cell-derived exosomes ameliorated diabetic nephropathy by autophagy induction through the mTOR signaling pathway[J]. Cells, 2018, 7(12): E226. |
| [11] |
蔡青利, 汪晓月, 蔡明玉, 等. 干细胞外泌体减轻高糖腹膜透析液诱导的腹膜炎症[J]. 中华肾病研究电子杂志, 2021, 10(5): 252-258. CAI Q L, WANG X Y, CAI M Y, et al. Stem cell-derived exosomes alleviated peritonitis induced by high glucose-based peritoneal dialysis dialysate[J]. Chin J Kidney Dis Investig Electron Ed, 2021, 10(5): 252-258. |
| [12] |
YOKOI H, KASAHARA M, MORI K, et al. Pleiotrophin triggers inflammation and increased peritoneal permeability leading to peritoneal fibrosis[J]. Kidney Int, 2012, 81(2): 160-169. |
| [13] |
NIKFARJAM S, REZAIE J, ZOLBANIN N M, et al. Mesenchymal stem cell derived-exosomes: a modern approach in translational medicine[J]. J Transl Med, 2020, 18(1): 449. |
| [14] |
ZHANG Y, PAN Y J, LIU Y H, et al. Exosomes derived from human umbilical cord blood mesenchymal stem cells stimulate regenerative wound healing via transforming growth factor-β receptor inhibition[J]. Stem Cell Res Ther, 2021, 12(1): 434. |
| [15] |
WU L, RONG C, ZHOU Q, et al. Bone marrow mesenchymal stem cells ameliorate cisplatin-induced renal fibrosis via miR-146a-5p/Tfdp2 axis in renal tubular epithelial cells[J]. Front Immunol, 2021, 11: 623693. |
| [16] |
HU X M, SHEN N, LIU A Q, et al. Bone marrow mesenchymal stem cell-derived exosomal miR-34c-5p ameliorates RIF by inhibiting the core fucosylation of multiple proteins[J]. Mol Ther, 2022, 30(2): 763-781. |
| [17] |
LI Q M, JIN Y P, YE X Q, et al. Bone marrow mesenchymal stem cell-derived exosomal microRNA-133a restrains myocardial fibrosis and epithelial-mesenchymal transition in viral myocarditis rats through suppressing MAML1[J]. Nanoscale Res Lett, 2021, 16(1): 111. |
| [18] |
KADOTA T, FUJITA Y, ARAYA J, et al. Human bronchial epithelial cell-derived extracellular vesicle therapy for pulmonary fibrosis via inhibition of TGF-β-WNT crosstalk[J]. J Extracell Vesicles, 2021, 10(10): e12124. |
| [19] |
HUANG Y J, CAO J, LEE C Y, et al. Umbilical cord blood plasma-derived exosomes as a novel therapy to reverse liver fibrosis[J]. Stem Cell Res Ther, 2021, 12(1): 568. |
| [20] |
LAI K N, LEUNG J C. Inflammation in peritoneal dialysis[J]. Nephron Clin Pract, 2010, 116(1): c11-c18. |
| [21] |
MITTELMAIER S, NIWA T, PISCHETSRIEDER M. Chemical and physiological relevance of glucose degradation products in peritoneal dialysis[J]. J Ren Nutr, 2012, 22(1): 181-185. |
| [22] |
SALZER W L. Peritoneal dialysis-related peritonitis: challenges and solutions[J]. Int J Nephrol Renovasc Dis, 2018, 11: 173-186. |
| [23] |
HONDA K, HAMADA C, NAKAYAMA M, et al. Impact of uremia, diabetes, and peritoneal dialysis itself on the pathogenesis of peritoneal sclerosis: a quantitative study of peritoneal membrane morphology[J]. Clin J Am Soc Nephrol, 2008, 3(3): 720-728. |
| [24] |
DEVUYST O, MARGETTS P J, TOPLEY N. The pathophysiology of the peritoneal membrane[J]. J Am Soc Nephrol, 2010, 21(7): 1077-1085. |
| [25] |
ZHOU Q, BAJO M A, DEL PESO G, et al. Preventing peritoneal membrane fibrosis in peritoneal dialysis patients[J]. Kidney Int, 2016, 90(3): 515-524. |
| [26] |
MUTSAERS S E, PRÊLE C M, PENGELLY S, et al. Mesothelial cells and peritoneal homeostasis[J]. Fertil Steril, 2016, 106(5): 1018-1024. |
| [27] |
KASTELEIN A W, VOS L M C, DE JONG K H, et al. Embryology, anatomy, physiology and pathophysiology of the peritoneum and the peritoneal vasculature[J]. Semin Cell Dev Biol, 2019, 92: 27-36. |




