癌症占全球死亡人数的25%,放化疗仍然是目前癌症治疗的主要方式之一。然而,实体瘤中心区域缺血缺氧是导致化疗失败的重要因素[1-2]。相关研究表明肿瘤缺血缺氧造成细胞内pH值降低,阻碍化疗药物有效渗入,可引起多重耐药产生化疗抵抗,肿瘤缺血缺氧是临床肿瘤学界有待攻克的难题[3-4]。
近几年来,大量研究发现超声激励微泡空化(ultrasound stimulated microbubble,USMB)产生声孔效应可短暂增加微血管壁通透性,增强化疗药的有效释放[5-6]。然而,超声激励微泡空化作用过强,也有可能使肿瘤微血管内皮细胞破裂产生不可逆的机械性损伤,影响化疗药物有效释放[7-8]。这些副作用的发生主要与机械指数、脉冲宽度(pulse length,PL)、脉冲重复频率(pulse repetition frequency,PRF)和占空比等有关[9]。因此,选择合适的超声治疗参数,对于增强肿瘤化疗药物的递送至关重要。
本课题组前期就不同超声机械指数对肿瘤灌注的影响进行了研究,发现机械指数(mechanical index,MI)为0.2~0.3,超声联合微泡治疗后肿瘤超声造影的峰值强度和曲线下面积显著增加,增强了肿瘤灌注[10],改善肿瘤缺血缺氧血状态。然而,不同脉冲宽度、脉冲重复频率和占空比等其他超声参数对肿瘤灌注的影响尚有待研究。因此,本实验在MI和占空比等参数固定的情况下,着重研究不同脉冲重复频率和脉冲宽度组合对超声激励微泡空化增强肿瘤血供及释药的影响。
1 材料与方法 1.1 实验动物选用雌性、健康、6~8周龄C57BL/6小鼠24只,体质量(17.74±0.43)g,购买于北京华阜康生物科技有限公司[许可证号:SCXK(渝)20170002],实验过程中动物操作和处理方案通过陆军军医大学实验动物福利伦理委员会审核(AMUWEC20213009)。MC-38肿瘤细胞由陆军军医大学第二附属医院超声科实验室提供[11]。
1.2 实验仪器与试剂 1.2.1 仪器飞依诺70(VINNO 70)为彩色多普勒超声诊疗一体机,选用频率为4~12 MHz的X4-12L高频线阵探头。该仪器具有微泡空化调控(Vflash)功能及可变区域(region of interest,ROI)超声弱聚焦式发射功能。Vflash功能可通过调节脉冲重复频率和脉冲宽度、机械指数等声学参数辐照肿瘤区域进行超声治疗。VINNO 70特有的超声造影定量分析软件(contrast burst imaging,CBI)可根据造影图像中微泡亮度射频信号绘制时间-强度曲线(time intensity curve,TIC),从该曲线上可获得超声造影峰值强度和曲线下面积。
1.2.2 主要试剂“脂氟显”是由陆军军医大学第二附属医院超声科研制的一种脂质微泡[17-19],外观为乳白色悬浮液,核心气体为全氟丙烷,使用前经振荡器均匀震荡90 s,微泡原液浓度约为(2~9)×109/mL;超声治疗微泡由微泡原液用生理盐水稀释至浓度约为(2~9)×106·mL-1·min-1,治疗10 min;超声造影微泡浓度为(2~9)×109/mL。注射用三溴乙醇购买于美国西格玛化学科技有限公司,注射用阿霉素(doxorubicin, DOX)购买于大连美仑生物科技有限公司。
1.3 实验方法 1.3.1 建立动物模型MC38细胞于37℃、5%CO2孵箱中培养,显微镜下观察待细胞贴壁生长融合至85%,选取对数生长期细胞用0.25%含EDTA胰酶消化,以100×g离心5 min,弃上清液,磷酸盐缓冲液(phosphate buffer saline,PBS)重悬,调整细胞浓度约(3~5)×107/mL,随机选取小鼠背部一侧,备皮、消毒,取细胞悬液约130 μL接种于皮下,轻度按压30 s防止细胞悬液漏出,肿瘤最大径约0.8 cm时可进行治疗。
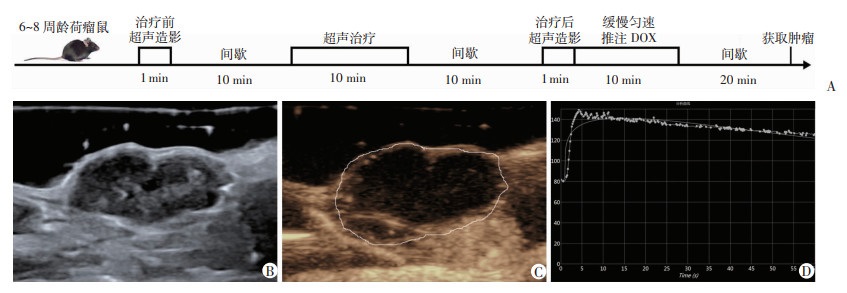
1.3.2 肿瘤治疗方法24只荷瘤鼠随机分为3组,每组8只:对照组(A组,超声假照);PL3.0+PRF2000+DOX组(B组,用较高PRF较低PL超声辐照治疗);PL34.5+PRF200+DOX组(C组,用较高PL较低PRF超声辐照治疗)。各组超声治疗声学参数设置详见表 1。三溴乙醇工作液以体质量0.02 mL/g腹腔注射麻醉荷瘤鼠,俯卧位固定小鼠,建立尾静脉通道。在探头与肿瘤之间以2 cm耦合垫充分耦合,适度用力避免探头压迫肿瘤组织影响肿瘤血供。选取肿瘤最大切面并固定超声探头,经尾静脉按体质量0.001 mL/g推注超声造影微泡,随之注射0.2 mL无菌生理盐水冲管,并储存60 s动态造影图像,10 min后造影微泡在体内基本廓清。B、C组按照预先选择设定好的治疗参数(表 1)使空化治疗探头轻轻垂直于肿瘤表面,调节弱聚焦框将肿瘤包含其中,治疗10 min,治疗过程中缓慢匀速推注治疗微泡0.3 mL,A组将探头轻置于肿瘤表面假照10 min,期间缓慢推注治疗微泡0.3 mL。10 min后待小鼠体循环中治疗微泡大致清除干净,同时肿瘤造影界面无残余微泡亮度信号时,再次对小鼠进行超声造影检查,方法如前并储存60 s动态造影图像。治疗结束后,每只小鼠按照0.01 mg/g体质量10 min内经尾静脉缓慢匀速推注1 mg/mL DOX,20 min后获取小鼠肿瘤组织(图 1A)。
| 组别 | 频率/MHz | MI | 占空比(%) | PL | 单个脉冲持续时间/μs | PRF/Hz |
| A组 | 0 | 0 | 0 | 0 | 0 | 0 |
| B组 | 3 | 0.28 | 0.20 | 3.0 | 1.00 | 2 000 |
| C组 | 3.7 | 0.28 | 0.19 | 34.5 | 9.32 | 200 |
| PL:单个脉冲周期数;PRF:每秒超声发射的脉冲总量 | ||||||
|
| A:超声治疗C57BL/6小鼠MC-38肿瘤详细时间轴,B:MC-38肿瘤超声二维图像,C:MC-38肿瘤(白线区域)超声造影定量分析描迹图,D: MC-38肿瘤超声造影定量分析所得的时间-强度曲线(从中可获取肿瘤造影PI和AUC值) 图 1 C57BL/6小鼠MC-38肿瘤超声治疗及结果分析示意图 |
1.4 测量指标 1.4.1 超声造影定量分析
各组治疗前后超声动态造影均采用VINNO70诊疗一体机自带的时间-强度分析软件沿着肿瘤边界勾画出包含整个肿瘤的最大感兴趣区(图 1),从该曲线上可获得肿瘤峰值强度(peak intensity,PI)和曲线下面积(area under curve,AUC),并统计各组结果。
1.4.2 肿瘤血流灌注面积截取治疗前后超声造影图像中肿瘤最大切面图,使用AutoCAD软件手动勾画肿瘤灌注区和肿瘤非灌注区。计算肿瘤灌注百分比的公式为:肿瘤灌注区面积/(肿瘤灌注区面积+肿瘤非灌注区面积)×100%。
1.4.3 高效液相观察治疗结束后经小鼠左心室灌注生理盐水,剥离浅表皮肤获取小鼠肿瘤组织,清除肿瘤表面微血管及脂肪,准确称量,加入1 000 μL提取液,研磨30 min,15 000×g离心10 min,取上清液1000 μL,氮气40 ℃下吹干后,用乙腈复溶,涡旋混匀、过滤,取10 μL样本分析,并记录色谱图,计算DOX的相对浓度获得肿瘤组织内部药物浓度。
1.4.4 病理观察治疗结束后,每组随机选取两只小鼠,获取部分肿瘤组织,脱水、浸蜡、包埋、切片,HE染色并封片。由两名经验丰富的病理科专家在未知样本分组的情况下,显微镜下观察肿瘤组织微结构并拍照。
1.5 统计学分析采用SPSS 25.0统计软件分析各组数据。各组计量资料符合正态分布,以 x±s表示。采用配对样本t检验比较各组超声造影PI、AUC及肿瘤灌注百分比,单因素方差分析用于比较各组间DOX药物浓度。以P<0.05为差异有统计学意义。
2 结果 2.1 动物建模结果本次实验共计纳入24只荷瘤小鼠,各组间荷瘤小鼠体质量、肿瘤大小比较均无统计学意义。实验过程中无动物死亡。
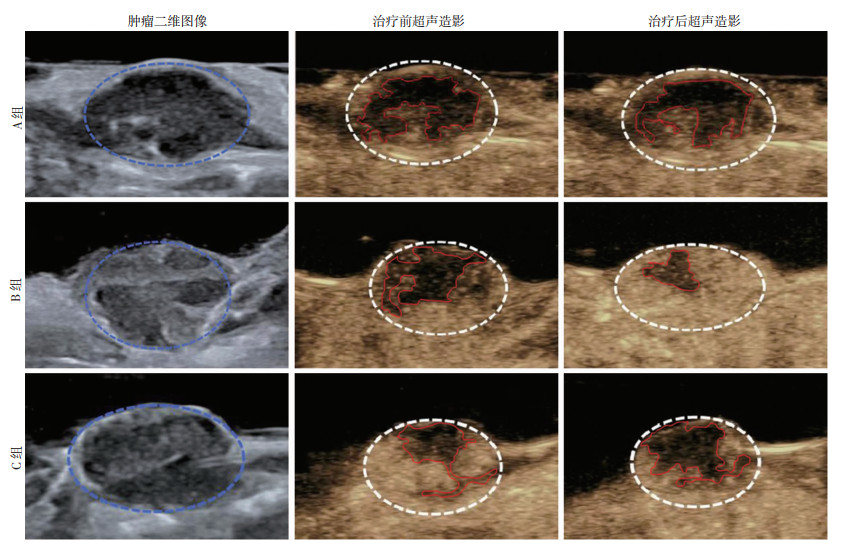
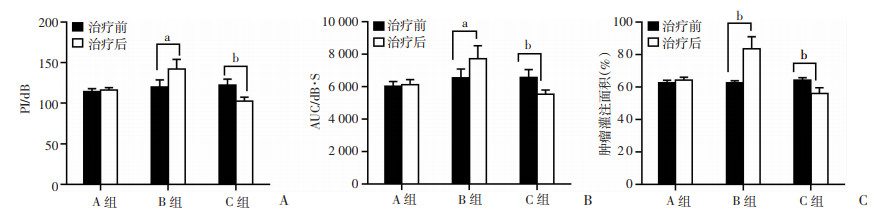
2.2 超声造影定量分析结果超声造影显示(表 2、图 2):治疗前各组肿瘤PI值及AUC值均无统计学差异(P>0.05)。A组超声治疗后,肿瘤血流灌注区域与治疗前相比无明显改变,PI值、AUC值与治疗前相比差异无统计学意义(P>0.05)。B组治疗后,造影图像显示肿瘤灌注区域与治疗前相比明显增加,PI值、AUC值与治疗前相比分别增加了19.3% 和18.0%,差异有统计学意义(P<0.01,P<0.01)。C组治疗后,肿瘤灌注区域与治疗前相比明显缩小,PI值、AUC值与治疗前相比分别降低了16.0%、15.8%,差异有统计学意义(P<0.000 1,P<0.001)。
| 组别 | 治疗前 | 治疗后 | |||
| PI/dB | AUC/dB·s | PI/dB | AUC/dB·s | ||
| A组 | 114.55±3.22 | 6 027.24±305.16 | 115.93±3.38 | 6 107.22±301.92 | |
| B组 | 119.90±8.81 | 6 539.75±538.31 | 142.20±1.79a | 7 720.83±796.71a | |
| C组 | 122.05±7.60 | 6 561.62±489.01 | 102.49±4.89b | 5 523.51±263.94a | |
| a:P<0.01;b:P < 0.000 1,与同组治疗前比较。AUC (dB·s):为曲线下方每秒PI(dB)的叠加 | |||||
|
| 蓝色虚线示超声二维模式下肿瘤区域;白色虚线示超声造影模式下肿瘤区域;红色实线示肿瘤非灌注区 图 2 荷瘤小鼠MC-38肿瘤超声二维图及超声治疗前后肿瘤造影图像 |
2.3 肿瘤灌注面积百分比结果
肿瘤灌注面积百分比定量分析显示(图 3):治疗后,B组的灌注面积百分比与治疗前相比增加了21.0%,差异有统计学意义(P<0.000 1)。治疗后,C组灌注面积由治疗前64.1%降至55.9%,差异有统计学意义(P<0.000 1)。A组的治疗前后灌注面积没有明显统计学差异(P>0.05)。
|
| a:P<0.01;b:P<0.000 1 图 3 MC-38肿瘤治疗前后小鼠超声造影PI值、AUC值、肿瘤血流灌注面积百分比比较(n=8,x±s) |
2.4 肿瘤组织内DOX药物浓度
治疗结束后,A、B、C组肿瘤内DOX浓度均值分别为(135.60±99.49)、(660.24±45.68)、(151.10± 92.40) ng/g,B组肿瘤内DOX浓度是A组的5.0倍,差异有统计学意义(P<0.000 1),B组肿瘤内DOX浓度是C组的4.8倍,差异有统计学意义(P<0.000 1),而A组和C组肿瘤内DOX浓度没有显著差异(P>0.05)。
2.5 肿瘤组织病理结果在光学显微镜低倍镜下,各组小鼠肿瘤细胞核呈索状、细胞核大、呈暗染,有明显病理改变的核仁。高倍镜下A组肿瘤微血管轻度扩张;B组肿瘤微血管扩张充血;C组肿瘤微血管部分扩张,部分微血管破裂出血,红细胞渗出肿瘤间质(图 4)。

|
| 图 4 各组小鼠MC-38肿瘤组织HE染色后光镜下观察肿瘤微结构 |
3 讨论
超声激励微泡空化产生声孔效应与微血管壁通透性高度相关,其渗透性的改变由轻度增强到不可逆性破裂出血[12]。超声参数的选择是确保化疗药物释放,达到预期化疗效果的重要组成部分,可通过调节超声治疗相关声学参数增加化疗药物释放实现肿瘤预期治疗效果[13-14]。因此,选择合适的声学参数对有效调控化疗药物释放非常重要。
3.1 超声激励微泡空化的具体机制细胞膜是由磷脂双分子层和蛋白质非共价结合形成的双层质膜结构,细胞膜具有选择通透性及屏障功能,超声联合微泡产生的空化作用可以短暂增强微血管膜通透性,增加靶向区域药物剂量,减少化疗药物引起的副作用[15]。USMB的空化作用主要是稳定空化和惯性空化,稳定空化时气泡轻微震荡,产生交替循环的收缩和舒张,在气泡周围形成微流,在血管腔内产生对流和流体流动可以促进化疗药物渗透;惯性空化时微泡内径非线性增加,增大到一定程度后迅速破裂,形成微流、喷射流及超声冲击波,对周围血管内皮产生牵拉和扩张等机械应力和剪切应力,致细胞崩裂溶解[16]。相关研究表明[10],USMB产生的副作用可能与相对较高的微泡浓度、较高的声压和较高的超声脉冲宽度有关。微泡的浓度关系着超声激励微泡空化作用效果,较低的微泡浓度不能实现理想的空化效应,而微泡浓度过高,会形成声阻隔带,造成远场微泡受超声激励作用减弱,导致感兴趣区微泡空化作用不佳,微泡浓度为1×107~1×108/mL时,超声激励微泡可产生较好的空化效应[12]。因此,本次研究采用的治疗微泡在微泡原液基础上稀释至(2~9)×107/mL,以实现辐照区微泡充分空化,最大化增加靶向治疗区微血管通透性,促进化疗药物通过脉管系统渗入肿瘤间质。
3.2 超声激励微泡空化改变肿瘤灌注通常认为,在低声压下超声激励微泡产生稳态空化可增强肿瘤血供[17],在高声压下超声激励微泡产生惯性空化对临近微血管内皮产生点蚀及不可逆的损伤,阻断肿瘤血供[18]。本课题组前期[19]报道MI为0.25~0.3时(相当于峰值负压<0.4 MPa)产生稳态空化可以增强肿瘤血供。本次实验采用MI为0.28,占空比约为0.20%,治疗后超声造影结果显示B组(DOX+PL3.0+PRF2000)PI及AUC值均较治疗前增加19.3%和18.0%(P<0.05,P<0.05),该趋势与前期[19]研究结论一致,提示USMB可以增强肿瘤血供。然而,在相同低声压水平,选用较高PL和较低PRF组合,我们发现C组(DOX+PL34.5+PRF200)超声辐照治疗后PI及AUC值较治疗前分别下降16.0%和15.8%(P<0.05,P<0.05)。究其原因可能是在低声压强度下,较高的PL和较低PRF组合激励微泡空化可能产生惯性空化,阻断了肿瘤的血供。
3.3 超声激励微泡空化通过改变肿瘤组织微结构促进化疗药物释放PL是指单个脉冲持续时间或周期数,一般采用微秒或周期数表示;PRF是指每秒超声发射的脉冲总数量,采用赫兹(Hz)作为单位。一般情况下,PL越大,微泡谐振产生的惯性叠加越显著,振幅越大,意味着生物学效应越明显。然而,较高的PRF发射的脉冲较密集,作用于微泡时引起的空化效应较为稳定均匀;反之,较低的PRF产生的超声脉冲波相对稀疏,当PL较高时可致微泡内径非线性膨胀、振幅增大[20-21]。超声治疗时,微泡在较高PL和较低PRF声束作用中反复震荡产生非线性收缩膨胀,扩张的微泡内径迅速达到一定阈值后发生崩裂和坍塌[5, 22],对周围微血管壁可产生微射流、冲击波和剪切应力,最终引起肿瘤微血管破坏,血流灌注降低。病理结果也显示治疗后A组和B组肿瘤组织微血管轻度及中度扩张,而C组肿瘤组织微血管破裂,红细胞漏出于肿瘤间质。同时,治疗后,B组(DOX+PL3.0+PRF2000)的灌注面积百分比与治疗前相比增加了21.0%,而C组(DOX+PL34.5+PRF200)灌注面积由治疗前64.1%降至55.9%,与治疗后肿瘤超声造影PI和AUC值变化趋势一致。
治疗后,高效液相结果发现B组肿瘤组织DOX浓度是A组的5.0倍(P<0.05),说明较高的PRF和较低的PL组合激励微泡在肿瘤微血管内形成对流,有助于小分子化疗药物外渗,增加化疗药透过脉管系统释放入肿瘤间质。此外,B组肿瘤组织DOX药物浓度是C组的4.8倍,说明超声在较高PL和较低PRF时产生惯性空化,造成肿瘤部分微血管轻度破裂坍塌,增加了微循环的压力,阻塞化疗药物传输及释放。
3.4 总结与展望本研究的局限性在于:①占空比由中心频率、PRF和PL共同决定,由于超声设备调节的限制,本实验只能将占空比控制在近似0.2%,并使两组超声参数的中心频率和占空比存在细微差异,未能保持精确一致。这可能会对实验结果的准确性产生轻微的干扰,但由于参数间的差异甚微,因此,尚不能影响本实验的结论。②目前有研究报道[23],超声激励微泡空化可增强外周肌肉组织血流灌注,其原因主要与腺苷三磷酸(ATP)和一氧化氮(NO)、腺苷、前列腺素等舒血管因子释放相关,本次实验中肿瘤血供的增加是否通过相同路径,需在后期实验中进一步完善佐证。③本次实验未探讨肿瘤灌注改变的持续时间,这与化疗时间窗的选择密切相关,我们将在下一步实验中对此进行深入研究。
最后,本次实验证实在MI和占空比固定时,超声激励微泡空化在较高的PRF和较低PL组合中可增强肿瘤血流灌注,促进化疗药物释放,而较高的PL和较低PRF组合激励微泡空化可减少肿瘤血供,未能促进化疗药物释放。本研究结果为进一步优化超声激励微泡空化增强血供提供了相关声学参数依据,同时有利于超声辅助化疗技术向临床转化。
| [1] |
GRAHAM K, UNGER E. Overcoming tumor hypoxia as a barrier to radiotherapy, chemotherapy and immunotherapy in cancer treatment[J]. Int J Nanomed, 2018, 13: 6049-6058. |
| [2] |
JING X M, YANG F M, SHAO C C, et al. Role of hypoxia in cancer therapy by regulating the tumor microenvironment[J]. Mol Cancer, 2019, 18(1): 157. |
| [3] |
FILIPCZAK N, JOSHI U, ATTIA S A, et al. Hypoxia-sensitive drug delivery to tumors[J]. J Control Release, 2022, 341: 431-442. |
| [4] |
TRINER D, SHAH Y M. Hypoxia-inducible factors: a central link between inflammation and cancer[J]. J Clin Invest, 2016, 126(10): 3689-3698. |
| [5] |
DEPREZ J, LAJOINIE G, ENGELEN Y, et al. Opening doors with ultrasound and microbubbles: beating biological barriers to promote drug delivery[J]. Adv Drug Deliv Rev, 2021, 172: 9-36. |
| [6] |
SNIPSTAD S, VIKEDAL K, MAARDALEN M, et al. Ultrasound and microbubbles to beat barriers in tumors: improving delivery of nanomedicine[J]. Adv Drug Deliv Rev, 2021, 177: 113847. |
| [7] |
FERIL L B Jr, KONDO T, TAKAYA K, et al. Enhanced ultrasound-induced apoptosis and cell Lysis by a hypotonic medium[J]. Int J Radiat Biol, 2004, 80(2): 165-175. |
| [8] |
CHEN H, KREIDER W, BRAYMAN A A, et al. Blood vessel deformations on microsecond time scales by ultrasonic cavitation[J]. Phys Rev Lett, 2011, 106(3): 034301. |
| [9] |
POSTEMA M, GILJA O H. Contrast-enhanced and targeted ultrasound[J]. World J Gastroenterol, 2011, 17(1): 28-41. |
| [10] |
FENG S, QIAO W, TANG J W, et al. Chemotherapy augmentation using low-intensity ultrasound combined with microbubbles with different mechanical indexes in a pancreatic cancer model[J]. Ultrasound Med Biol, 2021, 47(11): 3221-3230. |
| [11] |
LI N S, TANG J W, YANG J, et al. Tumor perfusion enhancement by ultrasound stimulated microbubbles potentiates PD-L1 blockade of MC38 colon cancer in mice[J]. Cancer Lett, 2021, 498: 121-129. |
| [12] |
MARTIN K H, DAYTON P A. Current status and prospects for microbubbles in ultrasound theranostics[J]. Wiley Interdiscip Rev Nanomed Nanobiotechnol, 2013, 5(4): 329-345. |
| [13] |
CHOWDHURY S M, ABOU-ELKACEM L, LEE T, et al. Ultrasound and microbubble mediated therapeutic delivery: underlying mechanisms and future outlook[J]. J Control Release, 2020, 326: 75-90. |
| [14] |
TZU-YIN W, WILSON K E, MACHTALER S, et al. Ultrasound and microbubble guided drug delivery: mechanistic understanding and clinical implications[J]. Curr Pharm Biotechnol, 2013, 14(8): 743-752. |
| [15] |
KODAMA T, TOMITA Y, KOSHIYAMA K I, et al. Transfection effect of microbubbles on cells in superposed ultrasound waves and behavior of cavitation bubble[J]. Ultrasound Med Biol, 2006, 32(6): 905-914. |
| [16] |
KHOKHLOVA T D, HAIDER Y, HWANG J H. Therapeutic potential of ultrasound microbubbles in gastrointestinal oncology: recent advances and future prospects[J]. Ther Adv Gastroenterol, 2015, 8(6): 384-394. |
| [17] |
唐娜娇, 唐家伟, 张毅, 等. 微泡超声空化增强乏血供肿瘤血流灌注的实验研究[J]. 中华超声影像学杂志, 2021, 30(2): 167-172. TANG N J, TANG J W, ZHANG Y, et al. Perfusion augmentation in hypovascular tumor by ultrasound stimulated microbubble cavitation[J]. Chin J Ultrason, 2021, 30(2): 167-172. |
| [18] |
LI N S, LIAO Y Y, TANG J W. Characteristic blood-perfusion reduction of walker 256 tumor induced by diagnostic ultrasound and microbubbles[J]. Ultrasound Med Biol, 2020, 46(11): 3069-3079. |
| [19] |
冯爽, 乔伟, 益磋, 等. 不同机械指数诊断超声联合微泡对裸鼠胰腺癌移植瘤化疗的影响[J]. 中国介入影像与治疗学, 2019(2): 107-111. FENG S, QIAO W, YI C, et al. Impact of diagnostic ultrasound with different mechanical index enhanced by microbubbles on chemotherapy of nude mice bearing pancreatic tumor[J]. Chin J Interv Imaging Ther, 2019(2): 107-111. |
| [20] |
MORSE S V, MISHRA A, CHAN T G, et al. Liposome delivery to the brain with rapid short-pulses of focused ultrasound and microbubbles[J]. J Control Release, 2022, 341: 605-615. |
| [21] |
ARANGO-RESTREPO A, RUBI J M, KJELSTRUP S, et al. Enhancing carrier flux for efficient drug delivery in cancer tissues[J]. Biophys J, 2021, 120(23): 5255-5266. |
| [22] |
KELLER S, BRUCE M, AVERKIOU M A. Ultrasound imaging of microbubble activity during sonoporation pulse sequences[J]. Ultrasound Med Biol, 2019, 45(3): 833-845. |
| [23] |
MASON O R, DAVIDSON B P, SHEERAN P, et al. Augmentation of tissue perfusion in patients with peripheral artery disease using microbubble cavitation[J]. JACC Cardiovasc Imaging, 2020, 13(3): 641-651. |




