乙型肝炎病毒(hepatitis B virus,HBV)感染是当今全球性的重大公共卫生问题之一。全球约有2.57亿人感染HBV[1],我国是HBV感染的高流行区,感染人数约占全球的1/3。母婴传播是我国HBV感染的主要途径,感染年龄越小,慢性化比例越高。研究显示,1岁以下HBV感染者约90%发展为慢性感染,1~6岁为30%~50%,而6岁以上儿童和成人感染者仅有5%~10%转为慢性[2-3]。慢性HBV感染是肝硬化、肝衰竭、肝癌等的重要原因。新生儿出生后立即注射乙肝免疫球蛋白(hepatitis B immunoglobulin, HBIG)联合接种乙型肝炎疫苗,并对高病毒载量的HBV感染母亲于孕晚期启动核苷(酸)类似物[nucleos(t)ide analogues, NAs]抗病毒治疗,HBV母婴阻断仍有部分失败[4-5]。目前大多数研究将婴儿6月龄或7月龄HBsAg和/或HBV DNA阳性作为发生母婴传播的标准。研究发现,HBsAg、HBeAg、抗-HBe、抗-HBc等均可通过胎盘屏障进入新生儿体内[6-9],致HBV感染孕妇分娩婴幼儿HBV血清标志物(HBV markers, HBV-M) 的临床意义与成人HBV感染者不尽相同,且难以确定婴儿是否感染或感染过HBV。由于现有检测方法不能区分婴儿HBV-M来源,因此本研究通过对婴幼儿HBV-M的长期随访,以期阐明其动态变化规律及临床意义,丰富HBV母婴传播领域的认知,为临床决策提供依据。
1 资料与方法 1.1 研究对象以2016年1月至2020年4月于我院登记并孕检的HBV感染孕妇分娩的婴幼儿为研究对象,最终纳入302例,具体筛选流程见图 1。记录母婴人口信息学资料、孕妇HBV-M及抗病毒方案、分娩孕周、分娩方式、新生儿HBV免疫及喂养方式等信息。孕妇及婴幼儿符合以下入、排标准。
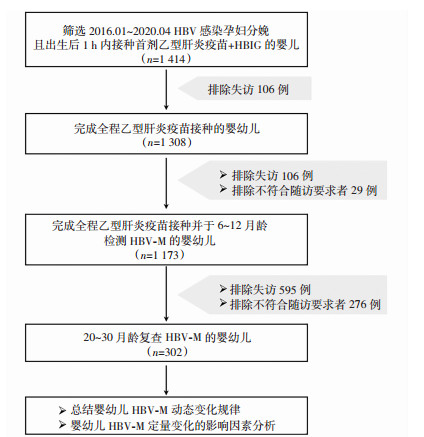
|
| 图 1 符合入、排标准的HBV感染孕妇分娩婴幼儿筛选流程图 |
纳入标准:①HBV感染孕妇符合慢性HBV感染诊断标准,即HBsAg阳性或HBV DNA阳性半年以上;②所有孕妇在我院进行规范产前检查并最终顺利分娩;③新生儿出生后按照我国《慢性乙型肝炎防治指南(2015年版)》(以下简称《指南》)[10]实施母婴阻断,完成HBIG注射+全程3针乙肝疫苗接种。
排除标准:①孕妇合并HCV、HIV、弓形虫、风疹病毒、巨细胞病毒等感染者,孕妇有妊高病、胎膜早破等病史;②孕妇妊娠期间行羊水穿刺等有创操作;③孕妇其他疾病引发的肝炎;④胎儿系统超声检查畸形、新生儿窒息等异常;未完成规律孕检的孕妇以及未在30月龄内按要求完成至少2次随访的婴幼儿。本研究经陆军军医大学第一附属医院伦理委员会批准[(B)KY2021202]。
1.2 HBV母婴阻断方案HBV感染孕妇若孕24~28周检测HBV DNA≥2×105IU/mL,以孕妇及家属自愿为原则,在其知情同意的基础上,予富马酸替诺福韦二吡呋酯(TDF)或替比夫定(LdT)抗病毒治疗。
所有新生儿在出生1 h内注射HBIG(100 IU),同时接种乙型肝炎疫苗(10 μg重组酵母疫苗),并在1月龄、6月龄时分别接种第2、3针乙型肝炎疫苗。
1.3 HBV血清学检测HBV感染孕妇血清标本均在本院实验室进行检测,部分婴幼儿血清HBV-M标本于外院检测。陆军军医大学第一附属医院实验室检测HBV-M方法为化学发光酶免疫分析法,使用全自动免疫发光分析仪(ARCHITECT i2000sr; 美国Abbott公司)检测。HBsAg>0.05 IU/mL为阳性,抗-HBs≥10 IU/L为阳性,HBeAg和抗-HBc>1 COI为阳性,抗-HBe <1 COI为阳性。外院HBV-M检测方法包括酶联免疫吸附剂测定、电化学发光法、化学发光法等。检测HBV DNA方法为HBV DNA磁珠法(上海星耀试剂盒),使用荧光定量PCR仪(伯乐CFX-96; 美国Bio-Rad公司),HBV DNA检测下限为50 IU/mL。
HBV感染孕妇HBV-M、HBV DNA于孕中晚期进行检测;婴幼儿HBV-M则分别于6~12月龄(时相点1,T1)及20~30月龄(时相点2,T2)进行检测。
1.4 疫苗应答的定义乙型肝炎疫苗接种成功:婴儿完成乙肝全程免疫接种1个月后检测,如果HBsAg阴性,且抗-HBs阳性(≥10 mIU/mL),表明疫苗接种成功。
疫苗强应答:婴儿完成乙肝全程免疫接种1个月后,抗-HBs≥1 000 mIU/mL。
疫苗中应答:婴儿完成乙肝全程免疫接种1个月后,100≤抗-HBs<1 000 mIU/mL。
疫苗低应答:婴儿完成乙肝全程免疫接种1个月后,10≤抗-HBs <100 mIU/mL。
疫苗无应答:婴儿完成乙肝全程免疫接种后血清学检测结果显示HBsAg阴性和抗-HBs<10 mIU/mL。
1.5 统计学分析采用SPSS 20.0、GraphPad Prism 8统计软件,分析HBV感染孕妇分娩婴幼儿HBV-M动态变化特征及其与母亲HBV-M、HBV DNA、是否抗病毒治疗、分娩孕周、分娩方式、喂养方式等因素的相关性。计数资料采用卡方检验。计量资料抗-HBs在T2点按转阴与否分为转阴组、未转阴组,上述组婴幼儿在T1点、T2点抗-HBs采用配对样本t检验,满足正态分布使用x±s表示,余采用非参数检验,使用中位数(四分位间距)即M(P25,P75)表示,P<0.05为差异有统计学意义。
2 结果 2.1 两个时相点婴幼儿血清HBV-M检出情况302例婴幼儿在2个随访时相点(T1、T2)HBsAg均阴性,HBV母婴阻断成功率100%。在T1时相点,共301例(99.67%)婴儿抗-HBs阳性(1例阴性,后续注射乙肝疫苗加强针后抗-HBs呈阳性),3例(0.99%)HBeAg阳性,46例(15.23%)抗-HBe阳性,207例(68.54%)抗-HBc阳性;在T2时相点,抗-HBs阳性率下降至93.05%,HBeAg、抗-HBe及抗-HBc均转阴,见表 1。
| HBsAg | 抗-HBs | 抗-HBe | 抗-HBc | HBeAg | T1(6~12月龄) | T2(20~30月龄) |
| - | + | - | + | + | 3(0.99) | 0(0.00) |
| - | + | + | + | - | 44(14.60) | 0(0.00) |
| - | + | + | - | - | 2(0.66) | 0(0.00) |
| - | + | - | + | - | 159(52.65) | 0(0.00) |
| - | + | - | - | - | 93(30.79) | 281(93.05) |
| - | - | - | + | - | 1(0.33) | 0(0.00) |
| - | - | - | - | - | 0(0.00) | 21(6.95) |
164例(54.30%)婴幼儿在2个时相点均于我科实验室使用化学发光酶免疫分析法行HBV-M定量检测。根据乙型肝炎疫苗接种应答情况,在T1时相点,将抗-HBs结果分为≥1 000 IU/L、100~ <1 000 IU/L、10~<100 IU/L、<10 IU/L共4组。164例婴儿中疫苗中强应答组的婴儿占98.17%(161/164),其中60.37%(99/164)抗-HBs≥1 000 IU/L;低应答比例1.83% (3/164)。在T2时相点,幼儿抗-HBs≥100 IU/L的比例降至59.15%(97/164),8例幼儿抗-HBs转阴,见表 2。
| 抗-HBs/ IU·L-1 | T1(6~12月龄) | T2(20~30月龄) |
| <10 | 0(0.00) | 8(4.88) |
| 10~<100 | 3(1.83) | 59(35.98) |
| 100~<1 000 | 62(37.80) | 76(46.34) |
| ≥1 000 | 99(60.37) | 21(12.80) |
3例HBeAg阳性的婴儿中有2例来自2位孕晚期HBeAg阳性、抗-HBe阴性的母亲,另外1例母亲孕晚期未行HBV DNA、HBV-M检测,所以追溯至孕早期。随年龄增长,幼儿HBeAg均于随访T2点转阴,3例婴儿及其母亲相关信息见表 3、4。
| 编号 | HBV-M | 喂养方式 | ||||
| HBsAg/IU·mL-1 | 抗-HBs/IU·L-1 | HBeAg(COI) | 抗-HBe(COI) | 抗-HBc(COI) | ||
| 1 | <0.05 | 1 000.00 | 1.66 | 1.72 | 2.10 | 混合 |
| 2 | <0.05 | 339.56 | 2.17 | 1.83 | 5.32 | 母乳 |
| 3 | <0.05 | 135.58 | 2.67 | 1.82 | 3.06 | 母乳 |
| 正常值范围:HBsAg<0.05 IU/mL、抗-HBs<10 IU/L、HBeAg<1 COI、抗-HBe>1 COI、抗-HBc<1 COI | ||||||
| 编号 | HBV-M | 孕晚期HBVDNA/IU·L-1 | 检测时间/周 | 是否药物阻断 | 分娩孕周/周 | 分娩方式 | ||||
| HBsAg/IU·mL-1 | 抗-HBs/IU·L-1 | HBeAg(COI) | 抗-HBe(COI) | 抗-HBc(COI) | ||||||
| 1 | 36 684.13 | 未查 | 1 485.85 | 58.19 | 未查 | 4.25×103 | 35 | 是 | 37 | 剖宫产 |
| 2 | 49 581.00 | 0.86 | 1 284.00 | 39.57 | 8.84 | 1.10×104 | 36 | 是 | 37 | 剖宫产 |
| 3 | 2 473.87 | 0.81 | 804.71 | 32.81 | 9.81 | 低于检测值下限 | 5 | 是 | 39 | 顺产 |
| 正常值范围:HBsAg<0.05 IU/mL,抗-HBs<10 IU/L,HBeAg<1 COI,抗-HBe>1 COI,抗-HBc<1 COI,HBV DNA<50 IU/L | ||||||||||
| 组别 | n | T1(6~12月龄) | T1(20~30月龄) | 下降速率/IU·L-1·月-1 | P值 |
| F组(<100 IU/L) | 3 | 24.79(20.14, 79.13) | 944.69(67.60,1 000.00) | - | 0.500 |
| E组(100~<250 IU/L) | 11 | 207.72(161.72, 218.29) | 15.61(7.86,144.52) | 11.30 | 0.320 |
| D组(250~<500 IU/L) | 17 | 339.56(298.67,463.26) | 42.17(14.64,190.97) | 17.49 | <0.001 |
| C组(500~<750 IU/L) | 13 | 632.16(572.09,946.95) | 32.78(27.38,188.31) | 35.26 | <0.001 |
| B组(750~<1 000 IU/L) | 21 | 838.19(785.59,946.95) | 76.51(37.63,218.96) | 44.80 | <0.001 |
| A组抗-HBs高于检测值上限(99例)无具体数据,未列入计算 | |||||
2.2 婴幼儿血清抗-HBs滴度的动态变化
分析164例均使用化学发光酶免疫分析法完成抗-HBs定量检测的婴幼儿,根据T1时相点婴儿的抗-HBs滴度,分为6组,A组:抗-HBs≥1 000 IU/L、B组:抗-HBs 750~<1 000 IU/L、C组:抗-HBs 500~<750 IU/L、D组:抗- HBs 250~<500 IU/L、E组:抗-HBs 100~<250 IU/L、F组:抗-HBs<100 IU/L。比较各组抗-HBs滴度变化,发现B~E组在2个时相点抗-HBs呈逐渐下降,其中B组下降速率最快,其次依次为C组、D组、E组,抗-HBs中位滴度也依次下降,而F组因注射加强乙型肝炎疫苗后抗-HBs显著增高,由于A组抗-HBs高于检测值上限(99例)无具体数据,所以未列入计算,具体如表 5所示。此外,T2点抗-HBs转阴的8例幼儿在T1点的滴度明显低于抗-HBs持续阳性幼儿[(422.93± 312.17)vs (836.18±273.86)IU/L,P < 0.05]。
2.3 幼儿在T2点抗-HBs滴度的影响因素分析164例完成抗-HBs定量检测的婴幼儿,参考对乙型肝炎疫苗的不同应答强度,将幼儿T2点的抗-HBs滴度分为<10 IU/L、10~<100 IU/L、100~<1 000 IU/L、≥1 000 IU/L共4组。结果显示,在T2点幼儿抗-HBs不同滴度与分娩方式、喂养方式、母亲是否联合抗病毒药物阻断以及抗病毒方案、母亲孕晚期HBeAg、HBV DNA状态等因素无关(表 6)。
| 影响因素 | <10 IU/L(n=8) | 10~<100 IU/L(n=59) | 100~<1 000 IU/L(n=76) | ≥1 000 U/L(n=21) | χ2值 | P值 |
| 分娩方式 | ||||||
| 顺产 | 6(7.14) | 29(34.52) | 37(44.05) | 12(14.29) | 7.062 | 0.315 |
| 剖宫产 | 1(1.35) | 27(36.49) | 37(50.00) | 9(12.16) | ||
| 不明 | 1(16.67) | 3(50.00) | 2(33.33) | 0(0) | ||
| 喂养方式 | ||||||
| 母乳/混合 | 5(3.91) | 47(36.72) | 59(46.09) | 17(13.28) | 2.650 | 0.851 |
| 奶粉 | 3(9.09) | 11(33.33) | 15(45.45) | 4(12.12) | ||
| 不明 | 0(0) | 1(33.33) | 2(66.67) | 0(0) | ||
| 药物阻断(母亲) | ||||||
| TDF | 5(.94) | 26(41.27) | 25(39.68) | 7(11.11) | 4.326 | 0.633 |
| LdT | 2(3.17) | 20(31.75) | 33(52.38) | 8(12.70) | ||
| 未使用 | 1(2.63) | 13(34.21) | 18(47.73) | 6(15.79) | ||
| HBV DNA(母亲孕晚期) | ||||||
| 阳性 | 6(6.59) | 32(35.16) | 38(41.76) | 15(16.48) | 6.496 | 0.370 |
| 阴性 | 2(3.39) | 21(35.39) | 32(54.24) | 4(6.78) | ||
| 不明 | 0(0) | 6(42.86) | 6(42.86) | 2(14.29) | ||
| HBeAg(母亲孕晚期) | ||||||
| 阳性 | 6(6.45) | 33(35.48) | 40(43.01) | 14(15.05) | 8.160 | 0.227 |
| 阴性 | 1(2.17) | 13(28.26) | 28(60.87) | 4(8.70) | ||
| 不明 | 1(4.00) | 13(52.00) | 8(32.00) | 3(12.00) | ||
2.4 抗-HBs阴转的幼儿及其母亲的信息特征
8例幼儿抗-HBs随年龄增长转阴,其中T1点婴儿HBV-M的模式为抗-HBs、抗-HBe、抗-HBc阳性1例,抗-HBs、抗-HBc阳性6例,抗-HBs阳性1例。随访至相点2,幼儿HBV-M均为全阴性,无HBV母婴阻断失败病例。8例幼儿中6例顺产、2例早产,5例母乳或混合喂养,6例母亲HBsAg、HBeAg双阳性。8例幼儿及其母亲相关信息见表 7、8。
| 编号 | HBV-M(6~12月龄) | 喂养方式 | ||||
| HBsAg/IU·mL-1 | 抗-HBs/IU·L-1 | HBeAg(COI) | 抗-HBe(COI) | 抗-HBc(COI) | ||
| 1 | <0.05 | 320.07 | 0.26 | 0.42 | 6.86 | 人工 |
| 2 | <0.05 | 218.29 | 0.59 | 1.91 | 1.57 | 混合 |
| 3 | <0.05 | 285.27 | 0.39 | 1.66 | 5.93 | 母乳 |
| 4 | <0.05 | 204.37 | 0.49 | 1.84 | 1.36 | 混合 |
| 5 | <0.05 | 216.50 | 0.38 | 1.88 | 0.90 | 人工 |
| 6 | <0.05 | 300.78 | 0.54 | 1.78 | 1.97 | 母乳 |
| 7 | <0.05 | 838.19 | 0.35 | 1.97 | 5.17 | 人工 |
| 8 | <0.05 | >1 000.00 | 0.46 | 1.63 | 4.51 | 混合 |
| 正常值范围:HBsAg<0.05 IU/mL、抗-HBs<10 IU/L、HBeAg<1 COI、抗-HBe>1 COI、抗-HBc<1 COI | ||||||
| 编号 | HBV-M | 孕晚期HBV DNA/IU·L-1 | 是否药物阻断 | 分娩孕周/周 | 分娩方式 | ||||
| HBsAg/IU·mL-1 | 抗-HBs/IU·L-1 | HBeAg(COI) | 抗-HBe(COI) | 抗-HBc(COI) | |||||
| 1 | 237.56 | 0.56 | 0.28 | 0.01 | 11.65 | 4.50×102 | 是 | 36 | 剖宫产 |
| 2 | 4 3137.56 | 0.35 | 1 227.20 | 51.40 | 8.42 | 7.25×103 | 是 | 42 | 顺产 |
| 3 | 573.87 | 未查 | 13.56 | 1.10 | 未查 | 低于检测下限 | 否 | 40 | 顺产 |
| 4 | 37 168.36 | 1.62 | 1 359.97 | 57.34 | 6.73 | 2.82×104 | 是 | 38 | 顺产 |
| 5 | 23 635.89 | 0.47 | 1 487.65 | 47.78 | 8.76 | 5.24×104 | 是 | 39 | 顺产 |
| 6 | 904.68 | 未查 | 未查 | 未查 | 未查 | 低于检测下限 | 是 | 41 | 顺产 |
| 7 | 1 321.00 | 2.00 | 1 927.00 | 10.11 | 0.05 | 5.24×104 | 是 | 36 | 剖宫产 |
| 8 | 21 628.00 | 0.74 | 1 672.88 | 50.75 | 7.96 | 4.77×104 | 是 | 不详 | 顺产 |
| 正常值范围:HBsAg<0.05 IU/mL,抗-HBs<10 IU/L,HBeAg<1 COI,抗-HBe>1 COI,抗-HBc<1 COI,HBV DNA<50 IU/L | |||||||||
2.5 婴儿与母亲HBV-M的相关性
婴儿于T1时相点及其母亲孕期均完成HBV-M各项定量检测的例数分别为HBsAg 264例、抗-HBs 215例、HBeAg 258例、抗-HBe 254例、抗-HBc 215例。母亲及婴儿HBV-M阳性例数、阳性率见表 9,其中2例母亲HBsAg虽为阴性,但其HBV DNA为阳性,6例母亲HBsAg和抗-HBs同时阳性。除抗-HBs外,婴儿T1时相点阳性的其他HBV-M均于T2点转阴。各项HBV-M指标婴儿阳性例数与母亲阳性例数分别为:HBsAg,0 vs 264;HBeAg,2 vs 173;抗HBe,38 vs 74;抗HBc,158 vs 214。由此可见,抗-HBc通过胎盘的效率高于抗-HBe;HBsAg、HBeAg在婴儿中比例均非常低,提示HBV母婴阻断的高效性。
| HBV-M | n | 孕妇妊娠晚期 | 婴儿T1时相点(6~12月龄) |
| HBsAg+ | 264 | 262(99.24) | 0(0.00) |
| 抗-HBs+ | 215 | 6(2.79) | 214(99.53) |
| HBeAg+ | 258 | 173(67.05) | 2(0.78) |
| 抗-HBe+ | 254 | 74(29.13) | 38(14.96) |
| 抗-HBc+ | 215 | 214(99.53) | 158(73.49) |
妊娠晚期HBeAg阴性孕妇分娩婴儿85例,其HBV-M阳性率分别为:HBeAg 0(0/85)、HBeAb 43.53%(37/85)、HBcAb 72.94%(62/85);HBeAg阳性孕妇分娩婴儿173例,其HBV-M阳性率分别为:HBeAg 1.16%(2/173)、HBeAb 0.58%(1/173)、HBcAb 67.05%(116/173);对比不同HBeAg状态分娩婴儿HBV-M阳性率,发现HBeAg阴性的孕妇所分娩婴儿抗-HBe阳性率明显高于HBeAg阳性的孕妇所分娩婴儿,差异有统计学意义(P < 0.05),见图 2。
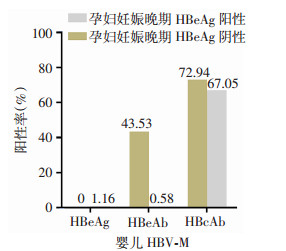
|
| 图 2 HBeAg不同状态孕妇分娩婴儿的抗HBe和抗HBc检出情况 |
3 讨论
HBV感染是世界性的公共卫生问题,我国是高流行区。目前我国广泛实施的阻断乙肝母婴传播的免疫策略为:孕妇在妊娠期进行HBV相关感染指标的检测,符合抗病毒指征者,于孕24~28周予以抗病毒,新生儿出生后12 h内接受HBIG和乙肝疫苗联合免疫,然后按程序接种第2、3剂疫苗[10]。了解HBV感染孕妇分娩婴幼儿经HBIG和乙肝疫苗联合免疫后血清HBV-M的意义、动态变化及转归情况,为乙肝母婴阻断临床决策提供依据。
本研究对2016年以来在本院行孕期检查及分娩的HBV感染孕妇及其分娩新生儿进行随访,最终共纳入302例进入研究,所有婴幼儿30月龄内的2次随访中未发现HBsAg阳性病例和母婴阻断失败的病例,提示当前针对HBV感染孕妇母婴阻断方案效果良好。有研究表明早期(出生后1 h内)使用HBIG和乙肝疫苗可以提供更好预防HBV母婴传播的保护效果[11],本研究中所有新生儿均在出生后1 h内注射HBIG和乙肝疫苗,母婴阻断成功率高应与此有关。
302例婴儿中, T1点婴儿抗-HBs阳性率为99.67%,T2点幼儿阳性率为93.05%,可见婴幼儿对乙肝疫苗的免疫应答良好,高于一般人群婴幼儿乙肝疫苗全程接种后的抗-HBs应答率[12];164例婴幼儿在两个时相点均采用化学发光酶免疫分析法检测HBV-M, 分析上述婴幼儿抗-HBs滴度, 本研究按照婴儿在T1点抗-HBs滴度分组,发现各组抗-HBs滴度随年龄增长逐渐下降,疫苗中、强应答的婴儿,抗-HBs滴度越高持续时间越长,但随年龄增长下降速率越快。T1时相点滴度在100~1 000 IU/L者,T2时相点中位滴度降至100 IU/L以下,其中8例[在T1时相点滴度为(422.93± 312.17)IU/L]于24月龄内转阴,建议该人群于24月龄再次复查抗-HBs滴度,必要时行乙肝疫苗加强剂接种。一些研究认为100 IU/L是抗-HBs具有保护作用的临界值,抗-HBs小于100 IU/L时,建议加强疫苗接种[13-14]。本研究中T1时相点滴度低于100 IU/L的婴儿,注射加强乙型疫苗的应答极强。此外,本研究发现T1时相点超过98%的婴儿抗-HBs水平≥100 IU/L,远高于既往重庆地区的报道(67.8%)[13],也略高于长春的报道(96.5%)[14]。这可能与我们入组的患者多为依从性较好的病例,且有规范化的管理和治疗方案等有关。父母HBV状态、孕妇HBV DNA、及时完整的干预、遗传效应和喂养方式是HBV疫苗应答的共同决定因素[13-16]。有研究表明,当父亲吸烟和新生儿出生低体质量时,婴儿与HBV疫苗接种反应不良的风险增加有关(OR=4.50,95%CI:2.52~8.03; OR=2.55,95%CI:1.33~4.87);更高的Apgar评分和在1岁内增加更多的体质量降低了这种风险;总的来说,遗传效应可以解释70%~90%的乙肝疫苗应答[16]。保护性血清转化(抗-HBs滴度的比例≥10 mIU/mL)的比例与母亲早产、儿童年龄和疾病等相关[17]。本研究中母亲在分娩方式、喂养方式、是否联合抗病毒药物阻断以及具体方案、孕晚期HBeAg及HBV DNA状态等因素与T2点幼儿抗-HBs不同滴度无关。
HBsAg是HBV的外壳蛋白,是判断HBV感染的主要标志,其分子量较大,不能直接穿过胎盘,但少部分可以通过以下细胞转移途径通过胎盘,人膜联蛋白可能作为HBsAg的特异性受体介导了HBV与胎盘绒毛滋养层细胞、绒毛间质细胞、毛细血管内皮细胞的粘附、内化等过程,完成了HBV细胞间的逐层传递,穿透胎盘屏障的最后一道防线——绒毛毛细血管内皮细胞[18]。本研究中婴儿未检测到HBsAg,首先考虑当前母婴阻断方案的高效性所致,其次考虑与HBsAg胎盘透过率低有关;HBeAg是判断HBV感染状态的重要标志,HBeAg有游离和结合两种形式,在血液中游离状态罕见,常与血清IgG蛋白结合,结合状态的HBeAg能通过胎盘屏障,到达胎儿血液循环,这与胎盘上存在IgG受体有关,在其作用下介导HBeAg通过胎盘[19]。本组T1时相点婴儿HBeAg阳性率为0.99%,T2点时全部转阴,结合HBsAg阴性,故判定T1时相点婴儿HBeAg来自母体的可能性大,并非HBV在婴儿体内复制产生;本研究中抗-HBe、抗-HBc阳性率呈逐渐下降,且最终均转为阴性,表明婴儿的抗-HBe、抗-HBc几乎均来自其母亲,但由于检测频次少,不能判断HBeAg、抗-HBe和抗-HBc的具体消失时间。HBeAg阳性孕妇抗-HBe为阴性,而HBeAg阴性孕妇的抗-HBe常为阳性。因此,不同HBeAg状态的孕妇分娩新生儿抗-HBe状态不同,本研究中HBeAg阳性孕妇分娩婴儿抗-HBe阳性率为0.58%,明显低于HBeAg阴性孕妇分娩婴儿的43.53%,进一步证实了婴儿抗-HBe来自母体。众多研究认为,抗-HBc阳性为既往感染的标志之一,但本研究证实20月龄内抗-HBc阳性并不一定代表感染,需要动态观察。本研究和其他研究均证实HBeAg、抗-HBe、抗-HBc能从母体进入胎儿体内[6-9],所以12月龄内婴儿单一HBeAg、抗-HBe、抗-HBc阳性对最终HBV感染与否无判断价值。
本研究为真实世界研究,HBV-M检测方法较多,稍显不足。但文中所分析的定量数据,均来自同一检测方法(化学发光酶免疫分析法),可比性强。新生儿检测HBV-M需要采静脉血,出于人道主义考虑,加之出生时的结果不能作为判定感染的依据,因此,我们未对新生儿出生时行HBV-M检测,所有纳入病例仍在随访中。
| [1] |
World Health Organization. Hepatitis B[R]. 2017-07-28.
|
| [2] |
GENTILE I, BORGIA G. Vertical transmission of hepatitis B virus: challenges and solutions[J]. Int J Womens Health, 2014, 6: 605-611. |
| [3] |
WANG T, WANG M Y, DUAN G H, et al. Discrepancy in impact of maternal milk on vertical transmission between hepatitis B virus and human cytomegalovirus[J]. Int J Infect Dis, 2015, 37: 1-5. |
| [4] |
BZOWEJ N H. Optimal management of the hepatitis B patient who desires pregnancy or is pregnant[J]. Curr Hepat Rep, 2012, 11(2): 82-89. |
| [5] |
YIN Y Z, WU L L, ZHANG J, et al. Identification of risk factors associated with immunoprophylaxis failure to prevent the vertical transmission of hepatitis B virus[J]. J Infect, 2013, 66(5): 447-452. |
| [6] |
马小艳, 孙继云, 蔡晧东. HBV感染母亲的血清病毒状态对新生儿HBV血清标志物的影响[J]. 中华实验和临床感染病杂志(电子版), 2014, 8(3): 352-355. MA X Y, SUN J Y, CAI H D. Effects of states of HBV infection in mothers' infected with hepatitis B virus on serum markers of HBV in neonates[J]. Chin J Exp Clin Infect Dis Electron Ed, 2014, 8(3): 352-355. |
| [7] |
WANG J S. Transformation of hepatitis B serologic markers in babies born to hepatitis B surface antigen positive mothers[J]. World J Gastroenterol, 2005, 11(23): 3582. |
| [8] |
崔恒春, 闫永平, 邵中军, 等. HBsAg阳性母亲的婴儿血乙型肝炎病毒标志物的动态变化[J]. 中华传染病杂志, 2009, 27(2): 118-122. CUI H C, YAN Y P, SHAO Z J, et al. Dynamic changes of hepatitis B virus markers in infants of HBsAg positive mothers[J]. Chin J Infect Dis, 2009, 27(2): 118-122. |
| [9] |
SHAO Z J, ZHANG L, XU J Q, et al. Mother-to-infant transmission of hepatitis B virus: a Chinese experience[J]. J Med Virol, 2011, 83(5): 791-795. |
| [10] |
王贵强, 王福生, 成军, 等. 慢性乙型肝炎防治指南(2015年版)[J]. 中国肝脏病杂志(电子版), 2019, 37(3): 1-18. WANG G Q, WANG F S, CHENG J, et al. The guidelines of prevention and treatment for chronic hepatitis B: a 2015 update[J]. Chin J Liver Dis(Electr Version), 2019, 37(12): 711-736. |
| [11] |
HUANG H Y, XU C Y, LIU L H, et al. Increased protection of earlier use of immunoprophylaxis in preventing perinatal transmission of hepatitis B virus[J]. Clin Infect Dis, 2021, 73(9): e3317-e3323. |
| [12] |
WHITFORD K, LIU B, MICALLEF J, et al. Long-term impact of infant immunization on hepatitis B prevalence: a systematic review and meta-analysis[J]. Bull World Health Organ, 2018, 96(7): 484-497. |
| [13] |
QAWASMI M, SAMUH M, GLEBE D, et al. Age-dependent decrease of anti-HBs titers and effect of booster doses using 2 different vaccines in Palestinian children vaccinated in early childhood[J]. Hum Vaccin Immunother, 2015, 11(7): 1717-1724. |
| [14] |
WANG C, WANG C, JIA Z F, et al. Protective effect of an improved immunization practice of mother-to-infant transmission of hepatitis B virus and risk factors associated with immunoprophylaxis failure[J]. Medicine, 2016, 95(34): e4390. |
| [15] |
YUE X, GE C, ZHUGE S, et al. Changes and analysis of anti-HBs titres after primary immunization in 1- to 16-year-old Chinese children: a hospital-based study[J]. J Viral Hepat, 2018, 25(4): 373-380. |
| [16] |
YAN K, CAI W, CAO F, et al. Genetic effects have a dominant role on poor responses to infant vaccination to hepatitis B virus[J]. J Hum Genet, 2013, 58(5): 293-297. |
| [17] |
JIANG M, ZHU B, YAO Q, et al. Anti-HBs levels in children under the age of two years born to HBV carrier mothers after immunoprophylaxis: a multicenter cross-sectional study[J]. BMC Pediatr, 2021, 21: 492. |
| [18] |
李淑红, 岳亚飞, 赵小鸽, 等. Human Annexin Ⅴ在不同胎盘中的表达的定量分析[J]. 中国优生与遗传杂志, 2005, 13(10): 31-33. LI S H, YUE Y F, ZHAO X G, et al. Quantification and expression of human annexin Ⅴ in kinds of placenta[J]. Chin J Birth Heal Hered, 2005, 13(10): 31-33. |
| [19] |
ARAKAWA K, TSUDA F, TAKAHASHI K, et al. Maternofetal transmission of IgG-bound hepatitis B e antigen[J]. Pediatr Res, 1982, 16(3): 247-250. |




