脓毒症是一种由于宿主对感染反应失调引起的疾病,晚期常发生危及生命的多器官功能障碍[1-3]。尽管现代医学在脓毒症治疗上已取得长足的进步,但脓毒症每年仍会导致许多患者死亡[4]。脓毒性心脏功能损伤是脓毒症最常见的并发症,一旦出现心功能障碍,其病死率可达70%[5]。因此,探究脓毒性心功能障碍的相关机制及有效的治疗策略,对治疗脓毒症有非常重要的意义。
SIRT1是一种保守的烟酰胺腺嘌呤二核苷酸(NAD+)依赖的组蛋白去乙酰化酶,参与多种细胞内信号,如衰老、凋亡、自噬和炎症[6-7]。研究显示SIRT1可通过抑制NF-κB的激活减少炎症介质的分泌,从而减轻炎症反应[8]。此外SIRT1对维持心肌细胞正常功能具有重要的作用[9]。既往研究表明,SIRT1在脓毒症小鼠心肌中含量降低,而激活SIRT1则可改善脓毒症引起的心功能障碍[10]。因此,SIRT1被认为是治疗脓毒性心功能障碍的靶点。
木犀草素(luteolin,LTN)是一种具有生物活性的类黄酮多酚化合物,可从许多蔬菜、水果和草本植物中分离出来[11]。LTN已被证明具有多种药理作用,包括抗氧化、抗癌和抗炎等生物学特性[12]。LTN可通过改善心肌收缩功能和减少细胞凋亡来减少大鼠心脏缺血再灌注损伤[13],也可通过发挥其抗炎作用减少脂毒性心肌损伤[14]。尽管越来越多的证据表明LTN具有心血管保护作用,但LTN对脓毒症引起的心功能障碍是否具有保护作用尚不明确。因此,本实验采用盲肠结扎穿孔术(caecal ligation perforation, CLP)建立小鼠脓毒症模型,探究LTN对脓毒性心脏损伤的作用及潜在机制,为临床治疗脓毒性心脏损伤提供新思路。
1 材料与方法 1.1 主要试剂SIRT1抗体(WL02995)、p-p65抗体(WL02169)、p65抗体(WL01980)、β-actin抗体(WL01372)和山羊抗兔二抗(WLA023)均购自沈阳万类生物科技有限公司。木犀草素(LTN,HY-N0162)购自美国MCE公司。LPS(S1732)、Mouse TNF-α ELISA Kit(PT512)、增强型ATP检测试剂盒(S0027)和DMSO(ST038-100 mL)均购自上海碧云天生物技术有限公司。MEM培养基(PM150410) 购自武汉普诺赛生命科技有限公司。DMEM高糖培养基(11965092)购自美国Gibco公司。胎牛血清(ST30-2602)购自德国PAN SERATECH公司。CCK-8试剂(B34304)购自上海毕傲图生物科技有限公司。
1.2 实验动物与细胞培养42只体质量约20 g的8周龄雄性C57BL/6小鼠购自重庆医科大学实验动物中心,饲养于SPF级别的动物房中,温度保持在20~22 ℃,光/暗12 h一循环,湿度保持在55%~60%,所有动物均可随意获取标准啮齿动物食物和水。本实验全过程严格遵循《实验动物保护条例》。将小鼠按随机数字表法分为3组:Sham组、CLP组和CLP+LTN组,每组14只。小鼠心肌细胞HL-1和小鼠巨噬细胞RAW 264.7购自武汉普诺赛生命科技有限公司。HL-1细胞培养在含10%胎牛血清的MEM培养基中,RAW 264.7细胞培养在含10%胎牛血清的DMEM高糖培养基中。LTN溶于DMSO用于处理HL-1和RAW 264.7细胞,在非LTN处理的细胞中加入同等体积的DMSO,防止溶剂产生影响。使用培养RAW 267.4的培养基处理HL-1细胞:将RAW 264.7接种于培养皿,处理时先更换新鲜的培养基。使用1 μg/mL LPS伴或不伴LTN、siSIRT1处理RAW 264.7细胞,LPS使用浓度参考文献[15]。待处理12 h后,收集培养基并离心吸取上清液用于ELISA检测或者处理HL-1细胞24 h。
1.3 盲肠结扎穿孔术使用2%异氟烷将小鼠麻醉,并放置在37 ℃操作平台上妥善固定,在左下腹做一约0.5 cm的切口。找到并取出盲肠,用4-0丝线在盲肠二分之一处结扎,再用21 g规格的针头将盲肠末端刺穿。挤压盲端确保穿孔处通畅,并还纳盲肠入腹中。逐层缝合切口后,按5 mL/100 g的剂量皮下注射温热的生理盐水以促进术后苏醒。Sham组接受同样的操作过程,但盲肠不结扎,不穿孔。用于动物实验的LTN溶于溶剂(10% DMSO、40%聚乙二醇、5%Tween-80、45%生理盐水)。CLP+LTN组小鼠术前1 h通过腹腔注射0.2 mg/kg LTN,剂量依据文献[16],每12小时再次给予0.2 mg/kg LTN,其他非LTN注射组小鼠注射同等体积溶剂。术后24 h,完善心脏超声检测,断颈法处死小鼠并取出心脏冻于液氮中备用。
1.4 生存实验总共30只小鼠用于术后48 h小鼠生存观察实验,每组10只。生存实验的小鼠不取材,不检查心脏超声,以防止任何多余操作对实验结果的影响。CLP+LTN组小鼠术前1 h予以0.2 mg/kg LTN腹腔注射,术后每12小时再次给予0.2 mg/kg LTN,除此之外无其他操作。期间小鼠可以自由获取水和标准啮齿动物食物。每12小时检查小鼠存活情况。
1.5 心脏超声使用Vivid E95 (GE Healthcare)超声仪进行心脏超声检测,使用2%异氟烷将小鼠麻醉,保持心率在400~500次/min区间且相互之间差异无统计学意义。心脏超声检测时,从乳头肌水平的短轴视图上获得二维导向M型测量。测量的参数包括左室射血分数和左室缩短系数。
1.6 Western blot检测用含1%PMSF和1%磷酸酶抑制剂的RIPA裂解液提取小鼠心肌、RAW 264.7细胞和HL-1细胞中的蛋白。用BCA法测定蛋白浓度并用RIPA裂解液配平蛋白。加入上样缓冲液后于100 ℃水浴锅加热10 min,得到可进行Western blot检测的样品。使用10%的SDS-PAGE凝胶分离样品蛋白并转印到PVDF膜上。用含5%脱脂奶粉的TBST于室温封闭膜1 h,再于4 ℃冰箱中孵育对应抗体。次日取出膜于室温中孵育二抗1.5 h,最后用ECL化学发光法检测蛋白表达。
1.7 Real-time PCR检测采用Real-time PCR的方法检测小鼠心肌组织和RAW 264.7细胞中的炎性因子mRNA表达水平。用RNA提取试剂盒提取总RNA,取1 μg提取的RNA进行逆转录。用SYBR green对逆转录的18个cDNA进行Real-time PCR扩增。引物序列如下:TNF-α正义链5′-GAGAAAGTCAACCTCCTCTCTG-3′,反义链5′-GAA-GACTCCTCCCAGGTATATG-3′;IL-1正义链5′-TTCAG-GCAGGCAGTATCACTC-3′,反义链5′-GAAGGTCCAC-GGGAAAGACAC-3′;IL-6正义链5′-GGAGCCCACCA-AGAACGATAGTCAA-3′,反义链5′-TGTCACCAGCAT-CAGTCCCAAGAAGG-3′;β-actin正义链5′-GCAAGCA-GGAGTACGATGAG-3′,反义链5′-CCATGCCAATGTT-GTCTCTT-3′。
1.8 细胞活力炎性损伤降低细胞活力,包括细胞数量和新陈代谢的降低[17-18]。采用CCK-8法对细胞活力进行检测,将细胞以1×104/孔接种于96孔板中。予以相应处理后,弃去孔中液体,每孔加入100 μL无血清培养基+10 μL CCK-8试剂,放入37℃敷箱孵育1~4 h,用酶标仪测定波长450 nm处的光密度值[D(450)]。
1.9 siRNA转染SIRT1 siRNA购自上海吉玛基因。转染时将SIRT1 siRNA+5 μL LipofectamineTM 3000+250 μL Opti-MEM混匀,使SIRT1 siRNA终浓度为50 nmol/L。阴性对照组中将SIRT1 siRNA换成等量的NC。将转染工作液加入培养皿中混匀。6 h后换新鲜的含10%胎牛血清培养基继续培养24 h再进行相关实验。
1.10 ELISA检测使用TNF-α ELISA检测试剂盒检测RAW 264.7细胞培养基中TNF-α的含量,具体方法参考说明书。将样品或标准品按每孔100 μL加入相应的孔中,封板后室温孵育2 h,洗板后每孔加入100 μL生物素化抗体室温孵育1 h,再次洗板后每孔加入100 μL辣根过氧化物酶标记Streptavidin室温避光孵育20 min。洗板后每孔加入100 μL显色剂室温避光孵育20 min。最后每孔加入50 μL终止液混匀,测量D(450)值。
1.11 ATP含量检测HL-1细胞内ATP含量检测使用增强型ATP检测试剂盒,具体方法参考说明书。HL-1细胞培养于6孔板,去培养基后,每孔加入200 μL裂解液充分裂解并吸入EP管,于4 ℃下12 000×g离心5 min,取上清液备用。取96孔板,每孔加入ATP检测工作液100 μL,室温放置5 min。每孔加入20 μL样品或标准品,后检测化学发光。
1.12 统计学分析数据以x±s表示,使用GraphPad Prism 8.0软件进行统计分析。组间差异采用单因素方差分析,然后进行Turkey检验。采用Kaplan-Meier生存曲线,并采用log-rank检验进行分析。P<0.05被认为差异具有统计学意义。
2 结果 2.1 LTN治疗可提高脓毒症小鼠生存率对小鼠实施CLP手术建立脓毒症模型,观测Sham组、CLP组和CLP+LTN组48 h生存情况,并记录死亡情况。结果显示:CLP组12 h出现2例死亡,24 h死亡达到50%,48 h生存率为0,与Sham组相比,生存率显著降低(P<0.05)。而CLP+LTN组的生存率得到改善,48 h生存率为50%,与CLP组相比,生存率显著提高(P<0.05),见图 1。提示LTN治疗明显提高CLP小鼠生存率。
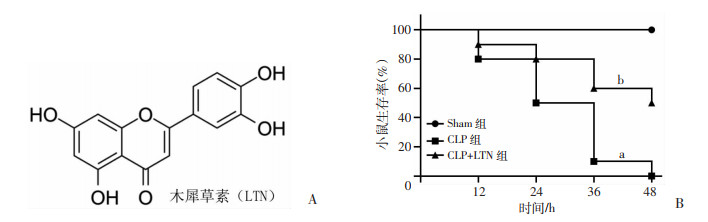
|
| A:LTN化学结构;B:小鼠生存率(n=10) a: P<0.05,与Sham组比较; b: P<0.05,与CLP组比较 图 1 LTN治疗提高脓毒症小鼠生存率 |
2.2 LTN治疗减少脓毒症导致的小鼠心功能障碍
CLP术后24 h,运用超声检测Sham组、CLP组和CLP+LTN组小鼠心脏功能。与Sham组相比,CLP组小鼠左室射血分数和左室缩短系数显著下降(P<0.05),而LTN治疗可部分逆转CLP对心脏功能的损伤(P<0.05),见图 2。提示LTN治疗可改善CLP小鼠心脏功能。
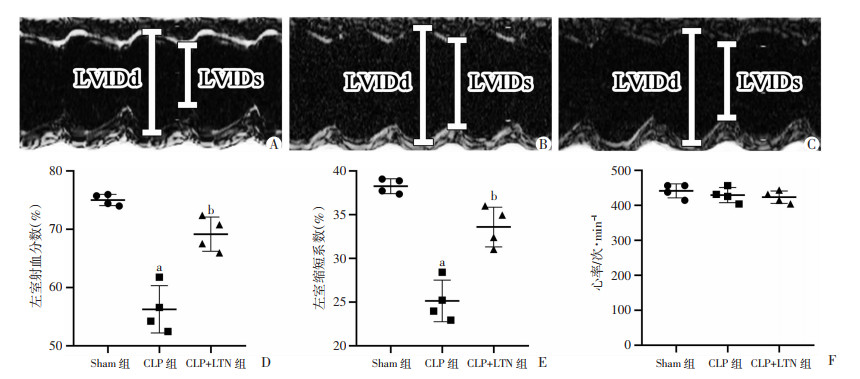
|
|
a: P<0.05,与Sham组比较; b: P<0.05,与CLP组比较 A~C:各组小鼠心脏M型超声图 A:Sham组;B:CLP组;C:CLP+LTN组;D:各组小鼠左室射血分数;E:各组小鼠左室缩短系数;F:各组小鼠心率 图 2 LTN治疗减少脓毒症导致的小鼠心功能障碍(n=4) |
2.3 LTN治疗防止脓毒症引起的小鼠心肌SIRT1表达下降,并降低炎症反应
CLP术后24 h,取各组心脏进行Western blot和PCR检测。与Sham组相比,CLP组SIRT1表达明显降低,p65磷酸化水平和TNF-α、IL-1、IL-6 mRNA表达水平明显提高(P<0.05)。而LTN治疗可逆转这些效应(P<0.05),见图 3。提示LTN治疗可能通过SIRT1/NF-κB途径降低脓毒症小鼠心脏炎症反应。

|
|
a: P<0.05,与Sham组比较; b: P<0.05,与CLP组比较 A:Western blot检测;B:SIRT1相对表达量;C:p65磷酸化水平;D:TNF-α mRNA相对表达量;E:IL-1 mRNA相对表达量;F:IL-6 mRNA相对表达量 图 3 LTN治疗防止脓毒症引起的小鼠心肌SIRT1表达下降并降低炎症反应(n=4) |
2.4 LTN减少LPS处理下RAW 264.7细胞TNF-α分泌,提高RLM处理下HL-1细胞活力
使用1 μg/mL LPS处理RAW 264.7细胞12 h后,检测培养基中TNF-α含量,结果见图 4A。LPS处理可显著提高培养基中TNF-α的含量(P<0.05),但可被LTN处理降低且呈浓度依赖(P<0.05)。收集RAW 264.7对照组培养基(RAW 264.7 Control Medium,RCM)和RLM处理HL-1心肌细胞24 h,并检测细胞活力。RCM模拟正常环境,RLM模拟脓毒症环境。在使用RLM处理的HL-1细胞中加入不同浓度的LTN,以判断脓毒症环境中LTN对心肌细胞活力的影响。与RCM处理相比,RLM可显著降低HL-1细胞的活力(P<0.05);但加入LTN处理后,细胞活力得到显著改善,且呈浓度依赖性(P<0.05),见图 4B。综合上述结果,选取8 μmol/L浓度的LTN用于后续细胞实验。

|
| A:RAW 264.7细胞培养基中TNF-α含量检测 a: P<0.05,与对照组比较; b: P<0.05,与LPS+0 μmol/L LTN组比较;B:HL-1细胞活力检测 a: P<0.05,与RCM组比较; b: P<0.05,与RLM+0 μmol/L LTN组比较 图 4 LTN减少炎性反应中巨噬细胞分泌TNF-α并提高心肌细胞活力(n=4) |
2.5 siSIRT1敲低RAW 264.7细胞和HL-1细胞中SIRT1表达效率验证
为验证siSIRT1敲低效率,使用Western blot检测Control组、NC组和siSIRT1组SIRT1表达。RAW 264.7细胞和HL-1细胞实验结果均显示:与Control组相比,NC组SIRT1表达差异无统计学意义;与NC组相比,siSIRT1组可显著降低SIRT1的表达(P<0.05),见图 5。
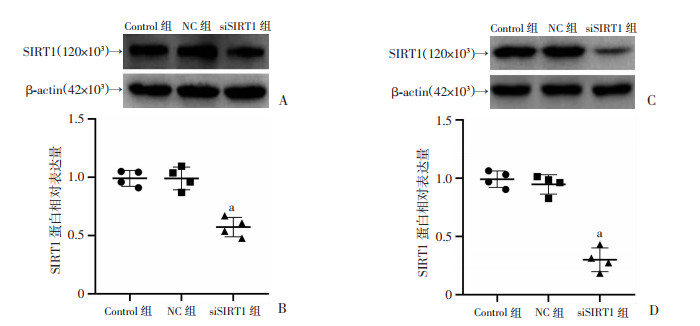
|
| A、B:Western blot检测RAW 264.7细胞中SIRT1的表达及半定量分析;C、D:Western blot检测HL-1细胞中SIRT1的表达及半定量分析 a: P<0.05,与NC组比较 图 5 siSIRT1敲低RAW 264.7细胞和HL-1细胞中SIRT1表达效率验证(n=4) |
2.6 LTN通过激活SIRT1抑制炎症反应
为探究LTN减轻炎症是否通过SIRT1起作用,使用siRNA敲低RAW 264.7细胞SIRT1表达。与Control组相比,LPS可明显降低SIRT1表达,提高p65磷酸化水平和TNF-α、IL-1、IL-6 mRNA表达(P<0.05)。LTN治疗可以部分逆转LPS的作用(P<0.05)。使用siSIRT1可使LTN的抗炎作用被抵消(P<0.05)。使用各个RAW 264.7细胞处理组的培养基处理HL-1细胞24 h,检测HL-1细胞ATP含量和细胞活力,结果显示,与RCM处理相比,RLM可显著减低HL-1的ATP含量和细胞活力(P<0.05),而使用RAW 264.7+LPS+LTN组的培养基(RLLM)处理的HL-1细胞的ATP含量和细胞活力较RLM组高(P<0.05),使用RAW 264.7+LPS+LTN+siSIRT1组的培养基(RLLSM)处理的HL-1细胞的ATP含量和细胞活力则低于RLLM处理组(P<0.05),见图 6。提示LTN通过改善SIRT1表达来降低炎症反应,进而减少心肌损伤。
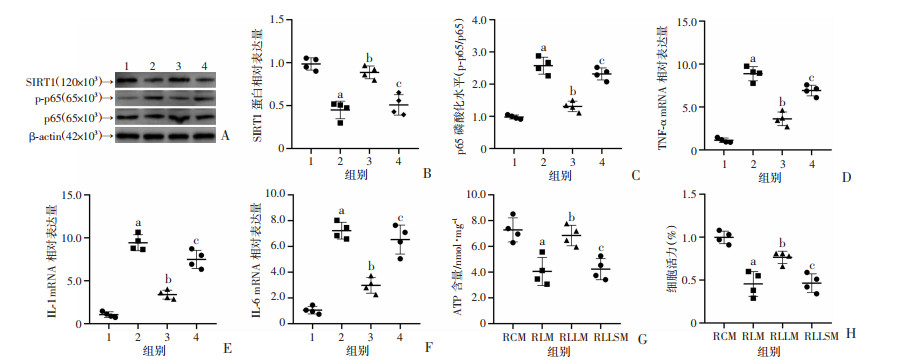
|
| 1:Control组;2:LPS组;3:LPS+LTN组;4:LPS+LTN+siSIRT1组;A:Western blot检测结果;B:SIRT1表达半定量分析;C:p65磷酸化水平半定量分析;D:TNF-α mRNA相对表达量;E:IL-1 mRNA相对表达量;F:IL-6 mRNA相对表达量 a: P<0.05,与Control组比较; b: P<0.05,与LPS组比较;c:P<0.05,与LPS+LTN组比较;G:HL-1细胞ATP含量;H:HL-1细胞活力 a: P<0.05,与RCM组比较; b: P<0.05,与RLM组比较;c:P<0.05,与RLLM组比较 图 6 LTN通过激活SIRT1抑制炎症反应(n=4) |
2.7 LTN通过激活SIRT1增强心肌细胞对抗炎性损伤的能力
为进一步探究LTN对心肌细胞自身对抗炎性损伤能力的影响,使用RCM、RLM、RLM+LTN和RLM+LTN+siSIRT1处理细胞,结果显示,与RCM组相比,RLM显著降低HL-1细胞SIRT1蛋白表达、ATP含量和细胞活力(P<0.05)。而LTN处理可以逆转上述作用(P<0.05),但LTN的保护作用可被siSIRT1抵消(P<0.05),见图 7。提示LTN可以通过激活SIRT1增强HL-1细胞自身对抗炎性损伤的能力,减少炎性损伤对功能和细胞活力的抑制。

|
|
1:RCM组;2:RLM组;3:RLM+LTN组;4:RLM+LTN+siSIRT1组;a: P<0.05,与RCM组比较; b: P<0.05,与RLM组比较;c:P<0.05,与RLM+LTN组比较 A:Western blot检测;B:SIRT1表达半定量分析;C:ATP含量;D:细胞活力 图 7 LTN通过激活SIRT1增强心肌细胞对抗炎性损伤的能力(n=4) |
3 讨论
脓毒症是一种非常严重的全身性疾病,是重症医学中较常见、病死率较高的疾病之一[19-20]。其病情进展快,常导致患者死亡[21]。本实验探究了LTN在脓毒性心肌损伤中的保护作用与相关机制。本研究首先发现LTN可以减少脓毒症小鼠的死亡率,保护心功能,减少炎症反应。在细胞实验中,敲低SIRT1表达可以抵消LTN在脓毒症中带来的抗炎和心肌细胞保护作用。本研究证明了LTN可以通过提高SIRT1表达来防止脓毒性心功能障碍。
本研究通过生存观察实验发现CLP小鼠24 h死亡率可达到50%,而48 h CLP小鼠全部死亡。但LTN治疗可明显提高CLP小鼠的生存率,降低脓毒症致死率。心功能障碍是脓毒症最常见的并发症,据报道,50%的脓毒症患者表现出脓毒性心功能障碍,而脓毒性心功能障碍与死亡率增加有关[22]。由于心脏的泵功能减弱,无法泵出足够多的血液参与血液循环,患者常常出现持续性的低血压甚至休克[5]。已有研究指出保护心脏功能对治疗脓毒症具有重要意义[23-24]。本研究发现LTN治疗可明显提高CLP小鼠的左室射血分数和左室缩短系数,表明在LTN治疗的脓毒症小鼠中,心脏泵功能得到改善。
研究表明SIRT1对心脏功能具有重要保护作用,是心功能障碍的重要治疗靶点[25-26]。近期有研究显示,提高SIRT1可以保护LPS诱导脓毒症小鼠心脏功能[27]。本研究结果显示,LTN治疗可以提高脓毒症小鼠心脏SIRT1表达,提示SIRT1或许在LTN抗脓毒性心肌损伤中具有重要的作用。
过度的炎症反应是造成脓毒性心肌损伤最为重要的原因之一,许多研究表明抑制炎症反应可以减少脓毒性心功能损伤[28-29]。NF-κB是一条非常经典的炎症反应通路,SIRT1被证实可通过抑制NF-κB减少炎症反应[30-31]。p65是NF-κB最重要的亚基。当p65发生磷酸化时,NF-κB转位入核进而启动炎症因子转录,如TNF-α、IL-1、IL-6等[32]。本研究发现LTN治疗的脓毒症小鼠心脏中p65磷酸化水平受到抑制,炎性因子的转录也减少。通过细胞实验加以验证,在小鼠巨噬细胞系RAW 264.7细胞实验中,发现LTN可以减少LPS引起的TNF-α分泌、NF-κB激活和相关炎症介质转录,而敲低SIRT1可以逆转LTN的抗炎作用。ATP是细胞的直接供能物质,心肌细胞需要消耗大量ATP来完成收缩舒张等生理功能,若ATP含量下降可以导致细胞功能下降[33-34]。本研究使用不同RAW 264.7细胞处理组的培养基刺激HL-1细胞,结果表明使用RLLM处理的HL-1细胞较RLM处理组有更高的ATP含量和细胞活力,这可能得益于LTN处理RAW 264.7细胞后减少了LPS引起的炎症反应。结果表明LTN治疗通过激活SIRT1来减少炎症反应,从而保护心肌细胞,提高心脏功能。
为了探究LTN治疗对提高心肌细胞自身抗炎性损伤的作用,以及SIRT1在其中的角色,本研究使用小鼠心肌细胞系HL-1进行了相关实验。结果显示LTN可以通过激活SIRT1来减少RLM处理引起的HL-1细胞ATP含量和细胞活力下降。这些结果表明LTN激活SIRT1不仅可以通过减轻炎症反应来保护心脏功能,还可通过提高心肌细胞自身对抗炎性损伤的能力来减少脓毒症引起的心功能障碍。
综上所述,本研究发现LTN治疗可以通过激活SIRT1来抑制NF-κB相关的炎症反应,并提高心肌细胞自身抗炎性损伤的能力,从而减少心功能障碍,改善脓毒症小鼠生存率,为临床治疗脓毒性心肌损伤提供了新的思路。
| [1] |
林源希, 李真玉. 糖萼在脓毒症血管内皮损伤中的变化及其修复策略研究进展[J/OL]. 解放军医学杂志, 2022. https://kns.cnki.net/kcms/detail/11.1056.R.20220318.1029.002.html. LIN Y X, LI Z Y. Changes of glycocalyx in sepsis with vascular endothelial injury and its repair strategy[J]. Med J Chin PLA, 2022. https://kns.cnki.net/kcms/detail/11.1056.R.20220318.1029.002.html. |
| [2] |
WALD E L, BADKE C M, HINTZ L K, et al. Vitamin therapy in sepsis[J]. Pediatr Res, 2022, 91(2): 328-336. |
| [3] |
HOLLENBERG S M, SINGER M. Pathophysiology of sepsis-induced cardiomyopathy[J]. Nat Rev Cardiol, 2021, 18(6): 424-434. |
| [4] |
PLEVIN R, CALLCUT R. Update in sepsis guidelines: what is really new?[J]. Trauma Surg Acute Care Open, 2017, 2(1): e000088. |
| [5] |
MERX M W, WEBER C. Sepsis and the heart[J]. Circulation, 2007, 116(7): 793-802. |
| [6] |
ZHANG W X, HE B M, WU Y, et al. Melatonin protects against sepsis-induced cardiac dysfunction by regulating apoptosis and autophagy via activation of SIRT1 in mice[J]. Life Sci, 2019, 217: 8-15. |
| [7] |
邵晓丽, 余江毅, 倪卫惠. 汉黄芩苷通过上调SIRT1表达减轻糖尿病视网膜病变引起的细胞和组织损伤[J]. 南方医科大学学报, 2022, 42(4): 463-472. SHAO X L, YU J Y, NI W H. Wogonoside alleviates high glucose-induced dysfunction of retinal microvascular endothelial cells and diabetic retinopathy in rats by up-regulating SIRT1[J]. J South Med Univ, 2022, 42(4): 463-472. |
| [8] |
SHI X J, JIN Y, XU W M, et al. MicroRNA-23a reduces lipopolysaccharide-induced cellular apoptosis and inflammatory cytokine production through Rho-associated kinase 1/sirtuin-1/nuclear factor-kappa B crosstalk[J]. Chin Med J (Engl), 2021, 134(7): 829-839. |
| [9] |
SAMOKHVALOV V, JAMIESON K L, VRIEND J, et al. CYP-epoxygenase metabolites of docosahexaenoic acid protect HL-1 cardiac cells against LPS-induced cytotoxicity through SIRT1[J]. Cell Death Discov, 2015, 1: 15054. |
| [10] |
HAN D, LI X, LI S, et al. Reduced silent information regulator 1 signaling exacerbates sepsis-induced myocardial injury and mitigates the protective effect of a liver X receptor agonist[J]. Free Radic Biol Med, 2017, 113: 291-303. |
| [11] |
储娜, 张璇, 陈思远, 等. 木犀草素显著减轻镉诱导的肺上皮Beas-2B细胞的损伤[J]. 南方医科大学学报, 2021, 41(5): 729-735. CHU N, ZHANG X, CHEN S Y, et al. Luteolin has a significant protective effect against cadmium-induced injury in lung epithelial Beas-2B cells[J]. J South Med Univ, 2021, 41(5): 729-735. |
| [12] |
LÓPEZ-LÁZARO M. Distribution and biological activities of the flavonoid luteolin[J]. Mini Rev Med Chem, 2009, 9(1): 31-59. |
| [13] |
XU T, LI D, JIANG D. Targeting cell signaling and apoptotic pathways by luteolin: cardioprotective role in rat cardiomyocytes following ischemia/reperfusion[J]. Nutrients, 2012, 4(12): 2008-2019. |
| [14] |
ABU-ELSAAD N, EL-KAREF A. The falconoid luteolin mitigates the myocardial inflammatory response induced by high-carbohydrate/high-fat diet in wistar rats[J]. Inflammation, 2018, 41(1): 221-231. |
| [15] |
RUAN W, JI X, QIN Y, et al. Harmine alleviated sepsis-induced cardiac dysfunction by modulating macrophage polarization via the STAT/MAPK/NF-κB pathway[J]. Front Cell Dev Biol, 2021, 9: 792257. |
| [16] |
RUNGSUNG S, SINGH T U, RABHA D J, et al. Luteolin attenuates acute lung injury in experimental mouse model of sepsis[J]. Cytokine, 2018, 110: 333-343. |
| [17] |
MATTOX T A, PSALTIS C, WEIHBRECHT K, et al. Prohibitin-1 is a dynamically regulated blood protein with cardioprotective effects in sepsis[J]. J Am Heart Assoc, 2021, 10(14): e019877. |
| [18] |
ZHANG W Q, WANG H J, LI Y Z, et al. Inhibition of microRNA-543 alleviates sepsis-induced acute kidney injury via targeting Bcl-2[J]. Eur Rev Med Pharmacol Sci, 2022, 26(7): 2305-2312. |
| [19] |
SALOMÃO R, FERREIRA B L, SALOMÃO M C, et al. Sepsis: evolving concepts and challenges[J]. Braz J Med Biol Res, 2019, 52(4): e8595. |
| [20] |
王鹏, 耿欢, 姜晔, 等. 中医辨治脓毒症合并心肌损伤探析[J]. 医学争鸣, 2021, 12(5): 47-49. WANG P, GENG H, JIANG Y, et al. Sepsis complicated with myocardial damage treated by traditional Chinese medicine based on syndrome differentiation[J]. Negative, 2021, 12(5): 47-49. |
| [21] |
孙立柱, 张晟, 马泽通, 等. 腺相关病毒介导的高迁移率族蛋白1抗体基因转导治疗小鼠脓毒症的效果[J]. 第二军医大学学报, 2021, 42(3): 249-254. SUN L Z, ZHANG S, MA Z T, et al. Effectiveness of adeno-associated virus-mediated gene transduction of high mobility group box-1 protein antibody for treatment of sepsis in mice[J]. Acad J Second Mil Med Univ, 2021, 42(3): 249-254. |
| [22] |
LEGER T, AZARNOUSH K, TRAORÉ A, et al. Antioxidant and cardioprotective effects of EPA on early low-severity sepsis through UCP3 and SIRT3 upholding of the mitochondrial redox potential[J]. Oxid Med Cell Longev, 2019, 2019: 9710352. |
| [23] |
L'HEUREUX M, STERNBERG M, BRATH L, et al. Sepsis-induced cardiomyopathy: a comprehensive review[J]. Curr Cardiol Rep, 2020, 22(5): 35. |
| [24] |
YANG C, XIA W, LIU X, et al. Role of TXNIP/NLRP3 in sepsis-induced myocardial dysfunction[J]. Int J Mol Med, 2019, 44(2): 417-426. |
| [25] |
CHEN W K, TSAI Y L, SHIBU M A, et al. Exercise training augments Sirt1-signaling and attenuates cardiac inflammation in D-galactose induced-aging rats[J]. Aging (Albany NY), 2018, 10(12): 4166-4174. |
| [26] |
D'ONOFRIO N, SERVILLO L, BALESTRIERI M L. SIRT1 and SIRT6 signaling pathways in cardiovascular disease protection[J]. Antioxid Redox Signal, 2018, 28(8): 711-732. |
| [27] |
XU Z H, SU X, YANG G, et al. Ganoderma lucidum polysaccharides protect against sepsis-induced cardiac dysfunction by activating SIRT1[J]. J Pharm Pharmacol, 2022, 74(1): 124-130. |
| [28] |
ZHANG J, LIU Y, LIU L. Hyperoside prevents sepsis-associated cardiac dysfunction through regulating cardiomyocyte viability and inflammation via inhibiting miR-21[J]. Biomed Pharmacother, 2021, 138: 111524. |
| [29] |
GUO H, TANG L, XU J, et al. MicroRNA-495 serves as a diagnostic biomarker in patients with sepsis and regulates sepsis-induced inflammation and cardiac dysfunction[J]. Eur J Med Res, 2019, 24(1): 37. |
| [30] |
DE GREGORIO E, COLELL A, MORALES A, et al. Relevance of SIRT1-NF-κB axis as therapeutic target to ameliorate inflammation in liver disease[J]. Int J Mol Sci, 2020, 21(11): 3858. |
| [31] |
CHEN M, CHEN Z, HUANG D, et al. Myricetin inhibits TNF-α-induced inflammation in A549 cells via the SIRT1/NF-κB pathway[J]. Pulm Pharmacol Ther, 2020, 65: 102000. |
| [32] |
TANAKA T, TSUCHIYA R, HOZUMI Y, et al. Reciprocal regulation of p53 and NF-κB by diacylglycerol kinase ζ[J]. Adv Biol Regul, 2016, 60: 15-21. |
| [33] |
CHENG Z, ZHANG M, HU J, et al. Cardiac-specific Mst1 deficiency inhibits ROS-mediated JNK signalling to alleviate Ang Ⅱ-induced cardiomyocyte apoptosis[J]. J Cell Mol Med, 2019, 23(1): 543-555. |
| [34] |
ZHOU D C, SU Y H, JIANG F Q, et al. CpG oligodeoxynucleotide preconditioning improves cardiac function after myocardial infarction via modulation of energy metabolism and angiogenesis[J]. J Cell Physiol, 2018, 233(5): 4245-4257. |




