2. 401120 重庆,重庆医科大学附属口腔医院预防保健科;
3. 030000 太原,中国人民解放军联勤保障部队第985医院口腔科;
4. 400042 重庆,陆军特色医学中心口腔科
2. Department of Preventive Health Care, Affiliated Stomatological Hospital of Chongqing Medical University, Chongqing, 401120;
3. Department of Stomatology, No. 985 Hospital of PLA Joint Logistic Support Force, Taiyuan, Shanxi Province, 030000;
4. Department of Stomatology, Army Medical Center of PLA, Chongqing, 400042, China
黑色素瘤相关抗原(Mage)家族蛋白因参与调控多种细胞生物学效应而成为目前的研究热点。黑色素瘤相关抗原D1(mdanoma associated antigen D1, Mage-D1),又名NRAGE或Dlxin-1,属于Mage家族Ⅱ类成员。现已有研究显示,Mage-D1可以与多种蛋白、受体等相互作用[1-3],参与细胞周期、增殖、凋亡等生理和病理过程,还与生物节律、学习记忆、抑郁行为密切相关,在机体发育、组织再生以及肿瘤的发生和转移中起着至关重要的作用。近年来,Mage-D1在牙发育中的表达规律与调控作用越来越受到学者的关注[4]。
有文献[5]指出,Mage-D1可以通过自身的六肽重复结构域,与同源异形盒基因Dlx/Msx结合,并调控其转录活性。而Dlx1、Msx1作为重要的转录因子,负责启动牙发育,影响着牙的形态发生[6]。同时有研究报道,小鼠Dlx1基因参与了牙齿釉质的形成[7],而Msx-1在牙齿发育硬组织形成过程中的表达部位[8]也提示其参与了牙釉质以及本质的发育。课题组前期研究发现,Mage-D1在胚胎期牙发育过程中的表达与Msx1、Dlx1同源盒基因在时空上具有高度一致性,并提出了Mage-D1-Dlx1、Msx1信号通路的猜想,但尚未探究在小鼠出生后不同牙发育阶段中三者之间的相关联系。
因此,本研究采用免疫组织化学染色和HE染色等手段,针对小鼠出生后牙发育过程中Mage-D1及其相关同源盒基因的表达进行研究。同时通过构建Mage-D1基因敲除小鼠进行表型观察及显微CT(Micro-CT)扫描,观察Mage-D1基因敲除后对小鼠牙发育的影响,从而推测Mage-D1在小鼠牙发育过程中的表达及作用。
1 材料与方法 1.1 实验动物和试剂4周龄Mage-D1基因敲除杂合子小鼠4只,由赛业模式生物研究中心(太仓)有限公司提供,许可证号:SCXK(苏)2018-0003。杂合子相交产生的子代用于后续实验。子代出生后,通过提取鼠尾的DNA进行基因型鉴定。将同窝的Mage-D1基因敲除纯合子小鼠(knock-out type mouse, KO)及野生型(wild type mouse, WT)小鼠纳入研究。
兔抗小鼠Mage-D1/Dlx1/Msx1多克隆抗体(biorbyt,英国),山羊抗兔二抗(北京博奥森生物技术有限公司,中国),DAB显色试剂盒(中杉金桥),HE染色试剂盒(北京索莱宝有限公司),Accurate Taq DNA聚合酶Mg2+(艾科瑞生物),基因鉴定引物由生工生物工程(上海)股份有限公司合成。
1.2 组织标本制备取2月龄Mage-D1基因敲除杂合子小鼠,以雌雄比2∶1合笼,以观察到小鼠出生后的早晨记为PN0.5,小鼠出生后剪取鼠尾做基因鉴定。选择PN1、PN4、PN7、PN11、PN15的野生型乳鼠,每个时间点3只,取其头部,仔细分离含有下颌第一磨牙的下颌骨,4%多聚甲醛固定过夜,流水冲洗24 h后置于10% EDTA溶液中,37 ℃脱钙,根据小鼠出生后的天数确定脱钙时间1~15 d。脱钙完成后流水冲洗24 h,梯度乙醇脱水,矢状向包埋下颌骨,6 μm连续切片。
选择出生后1、3月龄的KO小鼠、WT小鼠各6只,分离下颌骨,4%多聚甲醛固定后用于表型观察和显微CT扫描。
1.3 小鼠基因提取及鉴定小鼠基因型提取采用碱煮法:剪取鼠尾约2 mm至1.5 mL EP管中,加入200 μL 50 mmol/L NaOH溶液,98 ℃金属浴1 h,降至室温后,每EP管中加入20 μL已配好的1 mol/L Tris HCI(pH=8.0),4 ℃低温离心, 4 000 r/min×3min,吸取上清液至另一新的EP管中,即为所提取的模板DNA。
聚合酶链式反应(PCR)鉴定[9]:引物序列由模式动物公司提供,分别为:F1 5′-CCGAATCCTATTTCCCGACCTTG-3′,R1 5′-ATGTATTTTGCATGCCACTCTCAG-3′,F2 5′-CCGAATCCTATTTCCCGACCTTG-3′,R2 5′-GTTTCTGAGCCATAGCTCTCGT-3′。反应体系为25 μL体系,含有引物F1、R1/F2、R2各1 μL;2×Taq DNA聚合酶12.5 μL;无酶水9 μL;DNA模板1.5 μL。扩增程序如下:94 ℃变性3 min,94 ℃ 30 s,60 ℃ 35 s,72 ℃ 35 s,循环35次,72 ℃ 5 min。将得到的反应产物取5 μL进行1.2%琼脂糖凝胶电泳,曝光观察DNA条带。
1.4 HE染色观察出生后不同时间点小鼠牙齿发育形态特点染色前60 ℃烤片2 h防止脱片。将切片依次浸入二甲苯Ⅰ、Ⅱ各15 min脱蜡;梯度乙醇水化(100%、95%、85%、75%,从高到低),每个5 min,流水冲洗5 min;苏木精染色5 min,流水冲洗;1%盐酸酒精分化30 s,自来水浸泡15 min返蓝;伊红复染30 s,自来水冲洗,自来水浸泡5 min;梯度乙醇脱水(从低到高),每个1 min,二甲苯Ⅰ、Ⅱ透明,每次5 min;自然晾干后中性树胶封片,光学显微镜下观察,数字化切片扫描仪扫片记录。
1.5 免疫组织化学染色参照文献[10]实验步骤,脱蜡及水化同上,0.01 mol/L枸橼酸钠100 ℃ 10 min进行抗原修复,冷却至室温后,PBS洗3次×3 min;3%过氧化氢37 ℃孵育10 min,PBS洗3次×3 min;5%山羊血清37 ℃封闭30 min,甩干不洗,加入稀释好的一抗Mage-D1(1∶100)、Dlx1(1∶100)、Msx1(1∶100),以PBS代替一抗作为阴性对照,4 ℃孵育过夜;次日取出,室温下静置30 min,PBS洗3次×5 min,滴加二抗(1∶500),室温下孵育60 min,PBS洗3次×5 min,DAB显色,光镜下控制反应时间(约10 min),流水冲洗终止显色,PBS洗3次×3 min;苏木精染核1 min,流水冲洗5 min,1%盐酸酒精分化30 s,自来水浸泡15 min返蓝;剩余步骤同上。光镜下观察,数字化切片扫描仪扫片记录。
1.6 表型观察因Mage-D1基因伴X染色体遗传[4],故选择1、3月龄同窝野生型和敲除型雄鼠作为研究对象,每组6只。以同窝野生型小鼠作为对照,测量并记录两组小鼠的空腹体质量。随即将小鼠置于安乐箱中处死,相机拍摄小鼠平卧图、正面露齿图。解剖分离下颌骨,固定冲洗后于体式显微镜(放大40倍)下拍摄磨牙及切牙。
1.7 显微CT扫描上述过程结束后,应用Micro-CT(viva CT 40, Scanco Medical AG; Switzerland)扫描,采集图像,并用配套的Micro-CT V6.1软件计算牙本质和牙釉质密度,牙槽骨骨密度,骨体积分数(BV/TV),骨小梁数目(Tb.N),骨小梁厚度(Tb.Th)以及骨小梁分离度(Tb.Sp)。测量牙槽骨相关数据,选择根分叉区往下50层、固定面积作为感兴趣区域进行分析。同样的,在固定的部位选择连续10层画出牙本质和牙釉质的感兴趣区域,计算牙本质和牙釉质密度。
1.8 统计学处理实验数据以x±s表示,应用GraphPad Prism 8.0.1进行统计分析,采用双侧非配对t检验比较两组之间的差异, P < 0.05认为差异有统计学意义。
2 结果 2.1 HE染色观察出生后不同时间点小鼠牙齿发育过程小鼠出生后1 d,下颌第一磨牙处于钟状晚期,高柱状的内釉细胞诱导成牙本质细胞形成,未见明显的牙体硬组织。出生后4 d,成牙本质细胞与成釉细胞开始合成并分泌基质,进一步矿化,交替形成牙本质与牙釉质,牙冠开始发育成型。出生后7 d,牙冠发育完成,内釉上皮细胞和外釉上皮细胞在颈环处增生形成上皮根鞘,启动牙根发育。出生后11 d,釉质和冠部牙本质发育基本完成,牙根形成1/2,中间层、星网状层与内外釉上皮细胞层结合,缩余釉上皮形成。出生后15 d,牙根进一步发育,达到2/3以上,根尖逐步缩窄,牙骨质形成,此时牙仍未萌出。见图 1。

|
| ab:成釉细胞;ob:成牙本质细胞;dp:牙乳头;e:釉质;d:牙本质;HERS:上皮根鞘 图 1 小鼠出生后不同时间下颌第一磨牙HE染色观察 |
2.2 免疫组化染色观察Mage-D1在小鼠牙发育不同阶段的表达
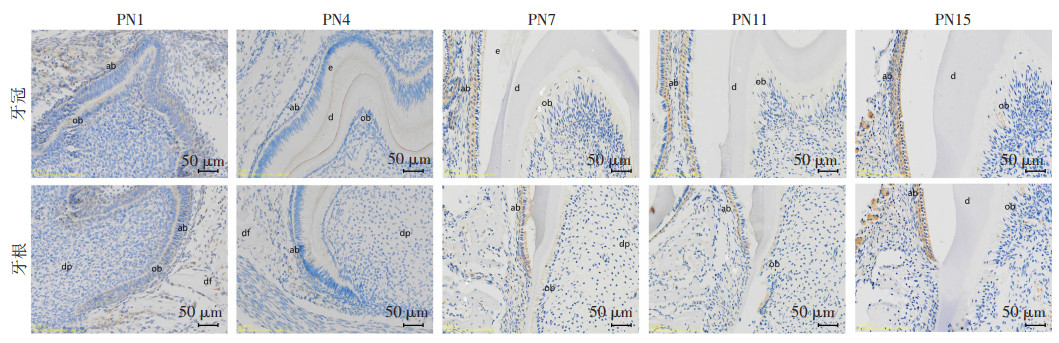
第1天时,牙胚组织中Mage-D1仅在成釉细胞、成牙本质细胞中呈弱阳性表达。第4天时,前期牙本质和成牙本质细胞中Mage-D1呈弱阳性表达。第7天时,Mage-D1在成牙本质细胞和成釉细胞中呈阳性表达,且表达增强。第11天时,缩余釉上皮中和成牙本质细胞中Mage-D1呈阳性表达,且在成牙本质细胞中表达减弱。第15天时,缩余釉上皮中Mage-D1仍呈阳性表达,成牙本质细胞中几乎没有表达,牙髓组织中出现阳性表达。见图 2。
|
| ab:成釉细胞;ob:成牙本质细胞;dp:牙乳头;e:釉质;d:牙本质;df:牙囊细胞 图 2 小鼠出生后不同时间下颌第一磨牙Mage-D1的表达 |
2.3 免疫组化染色观察同源盒基因Dlx1、Msx1在小鼠牙发育不同阶段的表达
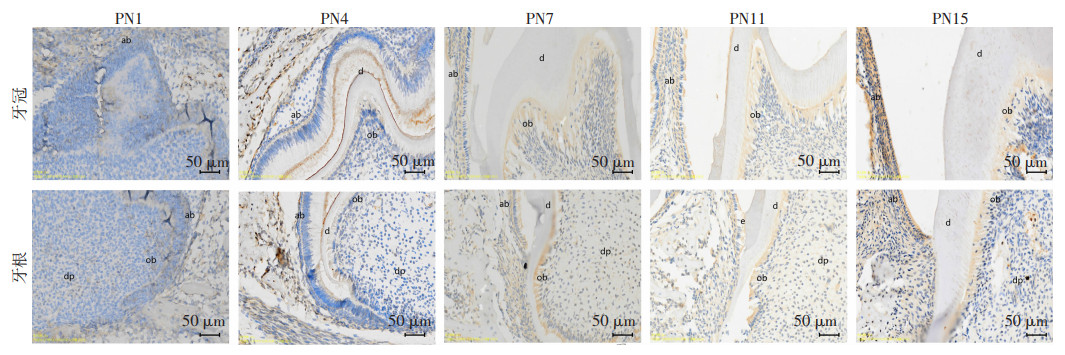
Dlx1、Msx1表达模式几乎一致。在小鼠出生后第1天时,牙胚组织中Dlx1、Msx1在牙乳头、成釉细胞、星网状层以及牙囊中有广泛表达。第4天时,成釉细胞、釉质、牙本质和成牙本质细胞中可见Dlx1、Msx1呈阳性表达。第7天时,Dlx1、Msx1在成牙本质细胞、成釉细胞以及牙髓中呈阳性表达,且表达增强。第11天时,缩余釉上皮、成牙本质细胞以及牙髓细胞Dlx1、Msx1呈阳性表达。第15天时,Dlx1、Msx1仍在缩余釉上皮、成牙本质细胞,在牙周膜中也出现阳性表达,牙髓细胞中阳性表达减弱。见图 3、4。
|
| ab:成釉细胞;ob:成牙本质细胞;dp:牙乳头;e:釉质;d:牙本质;df:牙囊细胞 图 3 小鼠出生后不同时间下颌第一磨牙Dlx1的表达 |

|
| ab:成釉细胞;ob:成牙本质细胞;dp:牙乳头;e:釉质;d:牙本质;df:牙囊细胞 图 4 小鼠出生后不同时间下颌第一磨牙Msx1的表达 |
2.4 Mage-D1敲除小鼠的基因型鉴定及表观观察
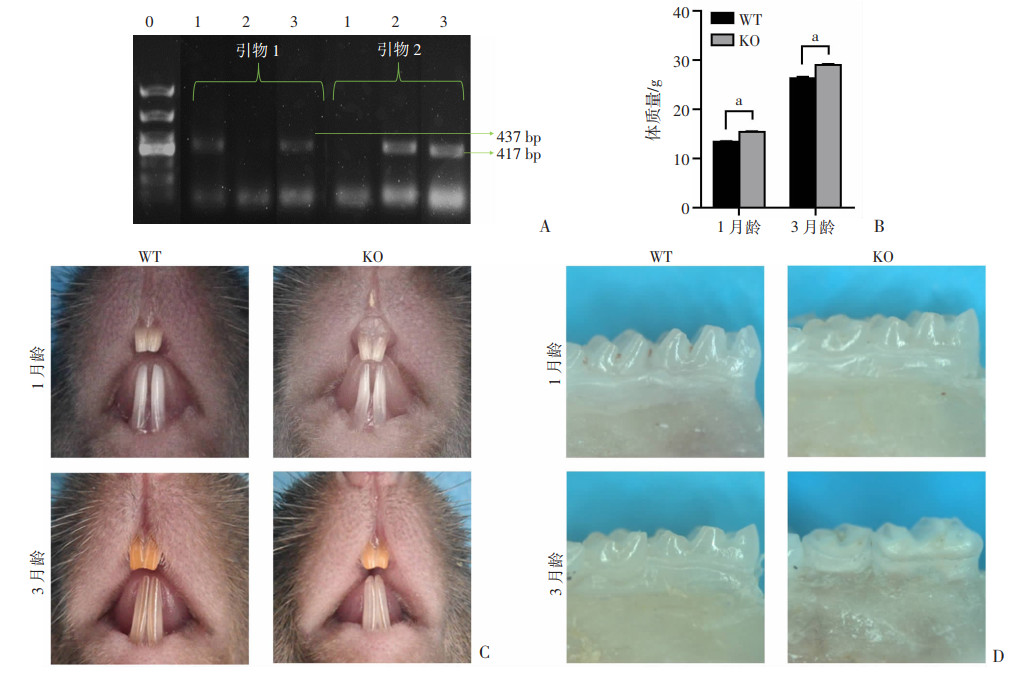
常规饲料喂养1个月或3个月后,与同窝野生型小鼠相比,Mage-D1纯合敲除小鼠体质量增加的差异有统计学意义(P < 0.05,图 5A、B)。与WT小鼠相比,KO小鼠在牙齿数量或外观方面没有明显差异。体式显微镜采图观察显示,3月龄KO小鼠的切牙为乳白色不透明(下切牙)或仅为浅黄色(上切牙),而WT小鼠的切牙为深黄色(图 5C),表明Mage-D1敲除降低了切牙的矿化程度和透明度。此外,磨牙色素沉着未受到显著影响,但与年龄匹配的WT对照组比较,磨牙尖部显示严重磨损(图 5D)。大多数磨牙牙釉质层在萌出后迅速被侵蚀,暴露了磨牙尖端的牙本质,表明KO小鼠磨牙的硬度和机械强度下降。
|
| A:基因型鉴定结果 0: 标准, 1: KO, 2: WT, 3: 杂合子;B:小鼠体质量比较(n=6,x±s) a:P < 0.05;C:正面切牙示意图;D:体式显微镜下切牙及磨牙形态观察(×40) 图 5 Mage-D1敲除小鼠的基因型鉴定及表型观察 |
2.5 下颌骨显微CT扫描及分析
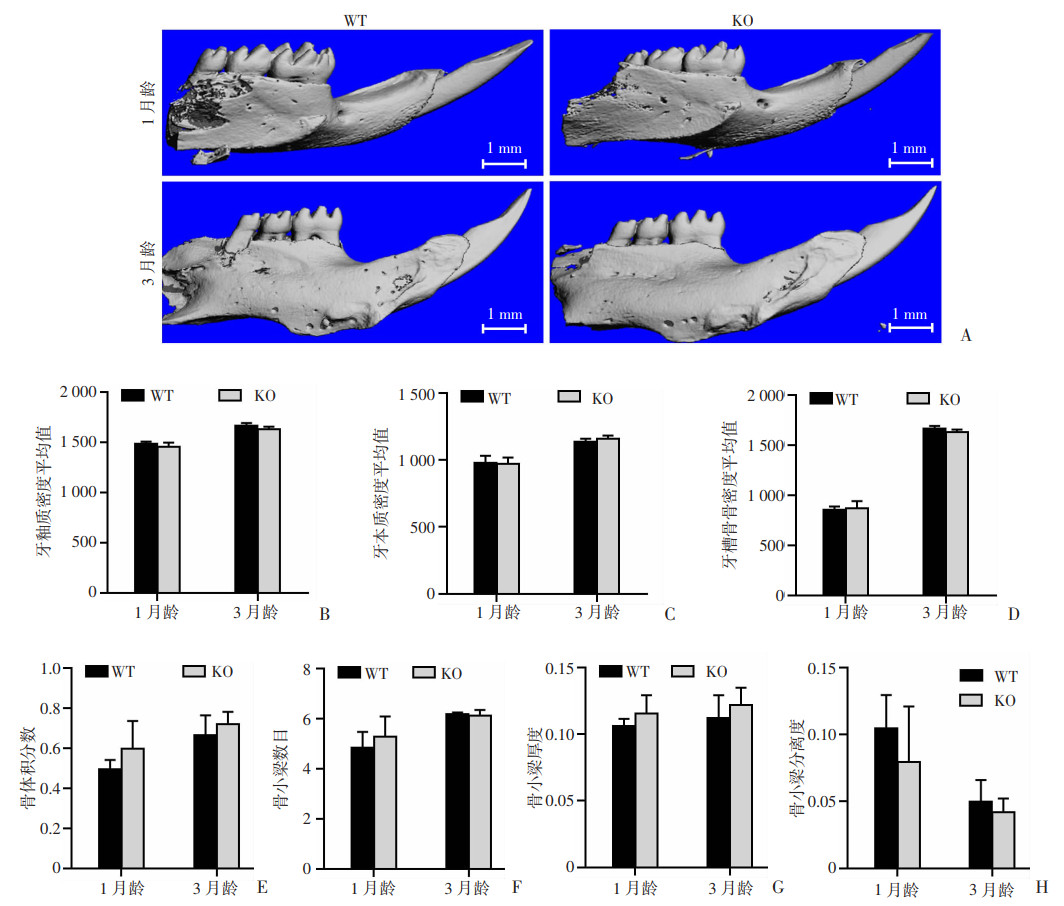
从下颌骨重建图来看,不论是1月龄还是3月龄,KO小鼠和WT小鼠的磨牙及下颌骨发育情况都无明显差异,见图 6A。而对牙本质和牙釉质密度、牙槽骨骨密度、骨体积分数(BV/TV)、骨小梁数目(Tb.N)、骨小梁厚度(Tb.Th)以及骨小梁分离度(Tb.Sp)进行分析发现,二者的差异亦无统计学意义(图 6B~H)。
|
| A:小鼠下颌骨micro-CT重建示意图;B~D分别为牙釉质、本质、颌骨密度定量分析;E~H分别为骨体积分数、骨小梁数目、骨小梁厚度、骨小梁分离度定量分析 图 6 1、3月龄小鼠Micro-CT重建示意图以及相关统计分析(n=6,x±s) |
3 讨论
牙齿的发生和发育是由多种信号分子和基因调控的复杂生物学过程,目前已经有300多种基因被发现在牙发育过程中表达,其中骨形成蛋白(BMPs)、成纤维细胞生长因子家族(FGFs)、Sonic hedgehog(Shh)家族和Wnt家族是研究最多最广泛的信号分子[11]。牙的发生发育起始于胚胎期,并一直持续到出生之后。在此过程中,任何的基因或者信号分子发生变化都可能会影响牙胚的发育和牙齿的形成。以往对牙发育的研究往往都集中在胚胎时期[12-14],而对出生后的牙齿形态研究较少。
作为黑色素瘤家族(Mage)Ⅱ类成员,Mage-D1在结构和功能上的特殊性使其参与了多种细胞生物学效应。自从1999年[15]被发现以来,国内外不少学者研究报道了其在神经系统[1, 16]、肿瘤的发生和转移[17-19]等方面的作用。近年来Mage-D1在口腔方面的研究日益增多,Mage-D1与牙发育之间似乎存在某种必然联系。QI等[20]学者报道,Mage-D1调控小鼠牙髓细胞增殖和成牙本质分化;WU等[21]也发现在人牙髓细胞和小鼠牙髓细胞系的周期和凋亡中,Mage-D1也起到了调节作用。而敲低Mage-D1能有效促进小鼠牙髓细胞成牙本质分化[22],且在小鼠体内彻底敲除Mage-D1后,可以促进自噬相关基因的表达从而加速牙周炎进程[23]。
颅神经嵴来源的外胚间充质干细胞(ectomesenchymal stem cell,EMSC)被认为是牙发育的始祖干细胞,杨琨等[24-25]学者通过研究发现Mage-D1正向调控EMSC的增殖能力,而负向调控其迁移能力。课题组前期利用EMSCs发现Mage-D1与同源盒基因Dlx1、Msx1在EMSCs成牙分化与矿化中的潜在联系。罗玉婷等[26]与ZHAO等[27]报道在EMSCs中用慢病毒干扰Mage-D1的表达后,同源盒基因Dlx1及Msx1表达水平也随之减少。
Mage-D1的基因表达图谱显示其在牙乳头及牙釉质上皮处高表达,同时其通过自身的六肽重复序列IRD与同源异型盒基因Dlx/Msx同源结构域结合[4],从而参与核转录调控,在胚胎时期颅面、四肢、神经系统的发育中发挥重要作用。同时研究指出Mage-D1与同源盒基因Dlx1/Msx1在胚胎期的表达模式具有高度相似性[27]。然而对于出生后小鼠牙发育过程中的Mage-D1以及Dlx1、Msx1的表达情况尚未有相关的报道。
本实验延续课题组前期的研究,对Mage-D1在出生后小鼠牙发育过程中的表达分布进行了免疫组织化学追踪,在小鼠出生后牙发育的不同时期,均可检测到Mage-D1的阳性表达,且具有时空特异性。在小鼠出生后1~15 d,Mage-D1在成釉细胞、成牙本质细胞中持续呈阳性表达,表明Mage-D1可能与成釉细胞、成牙本质细胞的分化、分泌有关,其在上皮根鞘中也呈阳性表达,表明Mage-D1还可能参与牙根发育。
对比同源盒基因Dlx1、Msx1的表达发现,Dlx1、Msx1均在出生后小鼠下颌第一磨牙发育的不同时期有表达,并且与Mage-D1的表达模式在时间和空间上具有相似性。二者在牙发育过程中广泛表达于牙乳头、成釉细胞、成牙本质细胞、根分叉区以及牙周膜中,提示Dlx1、Msx1与釉质、本质基质的分泌矿化有关,并可能调控了牙根、牙周组织的发生发展。Mage-D1与Dlx1、Msx1在同期小鼠牙胚成釉细胞和成牙本质细胞的阳性表达提示三者与牙釉质、牙本质的形成密切相关。
基因敲除技术是研究基因功能和实现基因功能精确缺失的最直接有效的手段。敲除小鼠是研究特定分子的作用和检查分子特征网络中潜在机制的一种有用的方法[27]。目前关于Mage-D1基因敲除小鼠的报道较少。MOURI等[28]报道发现敲除Mage-D1后小鼠会出现抑郁表型和昼夜节律障碍,LIU等[29]报道了Mage-D1基因敲除会导致小鼠骨质疏松表型,LIU等[23]报道在敲除该基因后加重了小鼠牙周炎的进程,而最新的研究又发现敲除Mage-D1会干扰小鼠对可卡因的敏感性[30]。但目前尚没有研究报道Mage-D1基因敲除对小鼠牙齿的影响。
小鼠出生后的生长发育主要分为3个阶段,快速生长期:出生后1 d到4周;缓慢生长期:4~12周;稳定期:12周以后。本研究选择出生后1月龄和3月龄的小鼠分别代表快速生长期和稳定期对敲除小鼠进行研究。通过Mage-D1敲除小鼠和野生型小鼠的比较发现,敲除小鼠的体质量较匹配年龄的野生型小鼠明显增加,与国外学者报道类似[31],Mage-D1敲除小鼠在晚期发生肥胖,表现为体质量增加、脂肪增加以及脂肪百分比增加。本研究发现,在牙齿的表型上,敲除小鼠切牙较野生型小鼠更白而不透明,不易着色,磨牙尖端则更易磨耗,提示Mage-D1参与了小鼠牙齿的矿化,并影响牙齿的硬度及强度。但Micro-CT扫描的结果显示,两组基因型小鼠下颌骨及牙齿的相关参数暂未有明显差异,这可能是由于Mage-D1在牙发育的过程中不是主要的影响因素,其功能的缺失可能由其他基因或信号分子予以补偿,后期可以增加电镜扫描、小动物活体成像等研究手段进一步补充。
综上,本研究通过对小鼠下颌第一磨牙牙发育的动态追踪观察,发现Mage-D1在出生后牙发育过程中具有时空特异性,提示Mage-D1可能参与了牙釉质、牙本质的基质分泌以及矿化过程。同时,Mage-D1与已知的牙发育相关同源盒基因Dlx1、Msx1的表达部位具有高度相似性,提示Mage-D1可能与Dlx1、Msx1共同调控了牙釉质及牙本质的形成,这对于课题组提出的牙发育相关的新的信号通路Mage-D1——Dlx1/Msx1提供了新的支撑依据,但是具体的调控机制还有待于进一步研究。敲除Mage-D1基因后,小鼠切牙的矿化程度、透明度以及磨牙的硬度、机械强度降低,但牙齿及牙槽骨的密度尚未发现明显差异,后期还需要进一步研究。
| [1] |
BRAGASON B T, PALSDOTTIR A. Interaction of PrP with NRAGE, a protein involved in neuronal apoptosis[J]. Mol Cell Neurosci, 2005, 29(2): 232-244. |
| [2] |
WILLIAMS M E, STRICKLAND P, WATANABE K, et al. UNC5H1 induces apoptosis via its juxtamembrane region through an interaction with NRAGE[J]. J Biol Chem, 2003, 278(19): 17483-17490. |
| [3] |
YANG Q Y, OU C, LIU M, et al. NRAGE promotes cell proliferation by stabilizing PCNA in a ubiquitin-proteasome pathway in esophageal carcinomas[J]. Carcinogenesis, 2014, 35(7): 1643-1651. |
| [4] |
余侠. Mage-D1的分子生物学特性及参与牙发育调控的研究进展[J]. 重庆医学, 2021, 50(5): 865-869. YU X. Mage-D1 molecular biological characteristics and research progress in the regulation of tooth development[J]. Chongqing Med, 2021, 50(5): 865-869. |
| [5] |
SASAKI A, MASUDA Y, IWAI K, et al. A RING finger protein Praja1 regulates Dlx5-dependent transcription through its ubiquitin ligase activity for the Dlx/Msx-interacting MAGE/Necdin family protein, Dlxin-1[J]. J Biol Chem, 2002, 277(25): 22541-22546. |
| [6] |
DAVIDEAU J L, DEMRI P, HOTTON D, et al. Comparative study of MSX-2, DLX-5, and DLX-7 gene expression during early human tooth development[J]. Pediatr Res, 1999, 46(6): 650. |
| [7] |
TAN Y F, TESTA J R. DLX genes: roles in development and cancer[J]. Cancers, 2021, 13(12): 3005. |
| [8] |
FENG X Y, WU X S, WANG J S, et al. Homeobox protein MSX-1 inhibits expression of bone morphogenetic protein 2, bone morphogenetic protein 4, and lymphoid enhancer-binding factor 1 via Wnt/β-catenin signaling to prevent differentiation of dental mesenchymal cells during the late bell stage[J]. Eur J Oral Sci, 2018, 126(1): 1-12. |
| [9] |
王莹莹, 储庆, 杨琨, 等. p75NTR敲除对小鼠股骨矿化发育的抑制作用[J]. 第三军医大学学报, 2017, 39(12): 1245-1250. WANG Y Y, CHU Q, YANG K, et al. Knocking out p75 neurotrophin receptor suppresses mineralization in the femurs of mice[J]. J Third Mil Med Univ, 2017, 39(12): 1245-1250. |
| [10] |
唐莹, 姜晓, 韩飞, 等. Sox30基因敲除致小鼠睾丸间质细胞增殖异常的研究[J]. 第三军医大学学报, 2021, 43(11): 1063-1073. TANG Y, JIANG X, HAN F, et al. Abnormal proliferation of Leydig cells in Sox30 knockout mice[J]. J Third Mil Med Univ, 2021, 43(11): 1063-1073. |
| [11] |
刘洁, 沈梅, 张晶晶, 等. 牙齿发育及其干细胞分化的调控机制[J]. 四川医学, 2020, 41(6): 653-661. LIU J, SHEN M, ZHANG J J, et al. Regulatory mechanisms of tooth development and stem cell differentiation[J]. Sichuan Med J, 2020, 41(6): 653-661. |
| [12] |
陈茜, 范志朋, 张琛. 组蛋白去甲基化酶KDM2B在小鼠磨牙及颌骨发育中的时空表达[J]. 北京口腔医学, 2018, 26(5): 241-245. CHEN Q, FAN Z P, ZHANG C. Spatial and temporal expression of histone demethylase KDM2B in the development of molar and mandible in mice[J]. Beijing J Stomatol, 2018, 26(5): 241-245. |
| [13] |
陈栋, 李晓聪, 鲁方丽, 等. 液泡分选蛋白4B在小鼠牙胚发育的时空表达[J]. 实用口腔医学杂志, 2018, 34(4): 442-445. CHEN D, LI X C, LU F L, et al. The spatio-temporal expression of VPS4 B during molar tooth germ development in mice[J]. J Pract Stomatol, 2018, 34(4): 442-445. |
| [14] |
杜文, 罗天, 于海洋. 机械应力相关调控蛋白在小鼠磨牙发育中的时空表达[J]. 四川大学学报(医学版), 2021, 52(1): 82-86. DU W, LUO T, YU H Y. The spatiotemporal expression patterns of mechanical-stress related regulatory proteins in mouse molar development[J]. J Sichuan Univ Med Sci Ed, 2021, 52(1): 82-86. |
| [15] |
POLD M, ZHOU J, CHEN G L, et al. Identification of a new, unorthodox member of the MAGE gene family[J]. Genomics, 1999, 59(2): 161-167. |
| [16] |
TEUBER J, MUELLER B, FUKABORI R, et al. The ubiquitin ligase Praja1 reduces NRAGE expression and inhibits neuronal differentiation of PC12 cells[J]. PLoS One, 2013, 8(5): e63067. |
| [17] |
ZHANG G, ZHOU H D, XUE X Y. Complex roles of NRAGE on tumor[J]. Tumour Biol, 2016, 37(9): 11535-11540. |
| [18] |
JIANG X D, JIANG X F, YANG Z. NRAGE confers poor prognosis and promotes proliferation, invasion, and chemoresistance in gastric cancer[J]. Gene, 2018, 668: 114-120. |
| [19] |
SHIMIZU D, KANDA M, SUGIMOTO H, et al. NRAGE promotes the malignant phenotype of hepatocellular carcinoma[J]. Oncol Lett, 2016, 11(3): 1847-1854. |
| [20] |
QI S, WU Q, MA J, et al. Effects of neurotrophin receptor-mediated MAGE homology on proliferation and odontoblastic differentiation of mouse dental pulp cells[J]. Cell Prolif, 2015, 48(2): 221-230. |
| [21] |
WU Q, QI S C, MA J, et al. The effect of NRAGE on cell cycle and apoptosis of human dental pulp cells and MDPC-23[J]. Int J Clin Exp Med, 2015, 8(7): 10657-10667. |
| [22] |
WU Q, LI J, SONG P P, et al. Knockdown of NRAGE induces odontogenic differentiation by activating NF-κB signaling in mouse odontoblast-like cells[J]. Connect Tissue Res, 2019, 60(2): 71-84. |
| [23] |
LIU H X, ZHANG X, YANG Q X, et al. Knockout of NRAGE promotes autophagy-related gene expression and the periodontitis process in mice[J]. Oral Dis, 2021, 27(3): 589-599. |
| [24] |
杨琨, 李骏, 丰奇昊, 等. MAGE-D1对大鼠牙胚来源外胚间充质干细胞增殖迁移能力的影响[J]. 遵义医学院学报, 2018, 41(5): 569-575. YANG K, LI J, FENG Q H, et al. The effects of MAGE-D1 on proliferation and migration of ectomesenchymal stem cells originated from rat teeth germ[J]. J Zunyi Med Univ, 2018, 41(5): 569-575. |
| [25] |
YANG K, WANG Y Y, JU Y X, et al. p75 neurotrophin receptor regulates differential mineralization of rat ectomesenchymal stem cells[J]. Cell Prolif, 2017. |
| [26] |
罗玉婷, 杨正艳, 李蒙, 等. Mage-D1与活化后的p75神经营养因子受体结合可正向调节大鼠外胚间充质干细胞的矿化[J]. 南方医科大学学报, 2021, 41(10): 1547-1553. LUO Y T, YANG Z Y, LI M, et al. Mage-D1 binding to activated p75NTR positively regulates mineralization of rat ectomesenchymal stem cells in vitro[J]. J South Med Univ, 2021, 41(10): 1547-1553. |
| [27] |
ZHAO M Z, WANG Y Y, LI G, et al. The role and potential mechanism of p75NTR in mineralization via in vivo p75NTR knockout mice and in vitro ectomesenchymal stem cells[J]. Cell Prolif, 2020, 53(2): e12758. |
| [28] |
MOURI A, SASAKI A, WATANABE K, et al. MAGE-D1 knockout mice express depressive endophenotypes associated with downrgulation of serotonin transporter ubiquitylation[J]. J Pharmacological Sci, 2012, 118: 99P-99P. |
| [29] |
LIU M, XU L J, MA X, et al. MAGED1 is a negative regulator of bone remodeling in mice[J]. Am J Pathol, 2015, 185(10): 2653-2667. |
| [30] |
DE BACKER J F, MONLEZUN S, DETRAUX B, et al. Deletion of Maged1 in mice abolishes locomotor and reinforcing effects of cocaine[J]. EMBO Rep, 2018, 19(9): 1-17. |
| [31] |
WANG Q H, TANG J, JIANG S J, et al. Inhibition of PPARγ, adipogenesis and insulin sensitivity by MAGED1[J]. J Endocrinol, 2018, 239(2): 167-180. |




