IgA肾病是全世界范围内最常见的原发性肾小球疾病,占全部肾活检病例的20%~50%[1]。IgA肾病临床和病理表现多样,导致预后差异极大。其中,有30%~40%的患者可在10~20年内发展至终末期肾病(end stage renal disease, ESRD)[2]。影响IgA肾病预后的危险因素较多,大量蛋白尿、肌酐水平、新月体形成、肾小球硬化以及间质纤维化等尤为突出[3]。其中蛋白尿水平与IgA肾病进展密切相关。研究发现,尿蛋白<0.3 g/d的患者发生肾脏复合终点事件的风险更低,预后更好[4]。因此,控制尿蛋白水平是治疗IgA肾病的核心环节。
与其他肾小球疾病不同,根据2021年最新的KIDGO指南,IgA肾病的管理集中于非免疫抑制策略,包含严格的血压控制、RAS的抑制、生活方式的改变等。ACEI/ARB作为肾素-血管紧张素-醛固酮系统(renin-angiotensin-aldosterone system,RAAS)的主要拮抗剂,具有降尿蛋白、延缓慢性肾脏病(chronic kidney disease, CKD)进展的作用,是目前IgA肾病治疗用药的基石[5]。但ACEI/ARB在控制尿蛋白具有量效关系,大剂量的ACEI/ARB会导致肌酐增加、血压降低和高钾血症的出现[6]。另外,对于高风险进展人群,联用糖皮质激素或者免疫抑制剂具有降低尿蛋白作用,但其出现感染的风险也显著增加[7-8]。因此,寻找其他非免疫抑制剂的治疗策略用于IgA肾病患者尿蛋白的控制具有极大的临床应用前景。
既往研究表明,盐皮质激素受体拮抗剂(mineralocorticoid receptor antagonists,MRA)作为RAAS的另外靶点,也具有一定的降尿蛋白作用,在ACEI/ARB的基础上加用MRA可延缓CKD进展[9-13]。HCQ是一种众所周知的免疫调节剂,近年来小样本的回顾性研究及随机对照试验发现,HCQ对IgA肾病有降尿蛋白的作用,相比于激素,安全性更佳[14-17]。但是,这些研究集中于HCQ或螺内酯作为RAASi的附加药物的作用,并排除了最近服用激素或免疫抑制剂的患者。因此,为进一步探讨IgA肾病最佳的非免疫抑制剂的治疗策略,本研究在充分RAASi治疗的基础上,比较接受HCQ治疗和接受螺内酯治疗对IgA肾病尿蛋白不达标患者的疗效及安全性,并进行亚组分析,探讨激素或免疫抑制剂对治疗的影响,为IgA肾病的治疗提供新的策略。
1 资料与方法 1.1 一般资料选取2019年4月至2021年3月陆军军医大学第二附属医院肾内科门诊IgA肾病患者172例,在RAASi治疗的基础上联合HCQ或螺内酯治疗,分为HCQ组(n=104)和双RAASi组(n=68)。再根据入组前和入组后是否使用激素或免疫抑制剂,分为4个亚组,其中99例患者入组前和入组后全程未使用激素或免疫抑制剂(HCQ组59例,双RAASi组40例),23例患者入组前使用激素或免疫抑制剂但入组后停用(HCQ组12例,双RAASi组11例),22例患者入组前未使用激素或免疫抑制剂但入组后加用(HCQ组13例,双RAASi组9例),以及28例患者入组前和入组后全程使用激素或免疫抑制剂(HCQ组20例,双RAASi组8例)。
纳入标准:①18~70岁经肾活检诊断为原发性IgA肾病的患者;②根据KDIGO指南,接受足量RAASi治疗至少3个月,尿蛋白肌酐比值(UPCR)>0.3 g/g的患者。排除标准:①妊娠或计划妊娠者,其他有使用ACEI/ARB禁忌或不耐受者;②合并有狼疮性肾病、糖尿病肾病或其他继发性肾病;③基线或随访数据缺失。
本研究通过陆军军医大学第二附属医院医学伦理委员会审批(2018-研第006-01)。参与研究的患者均自愿参加并签署知情同意书。
1.2 方法HCQ组在原有ACEI/ARB的基础上,HCQ剂量根据基线eGFR而变化,对于eGFR大于30 mL/(min·1.73 m2) 的患者,给予硫酸羟氯喹片100 mg,每天2次;对于eGFR在15~30 mL/(min·1.73 m2)的患者,给予硫酸羟氯喹片100 mg,每天1次。双RAASi组在原有ACEI/ARB的基础上,给予螺内酯片20 mg,每天1次。尿蛋白定量采用尿蛋白肌酐比值(UPCR)进行定量分析。收集两组患者的基线资料,包括年龄、性别、距肾活检时间、高血压、血肌酐、估算肾小球滤过率(eGFR)、白蛋白、ACEI/ARB治疗、Lee氏分级、牛津分型等,随访6个月。比较两组患者随访期间UPCR下降率、eGFR下降率等。进一步探讨免疫抑制剂的影响,并进行亚组分析。收集两组患者随访期间的不良反应事件,比较两组的用药安全性。研究流程如图 1所示。
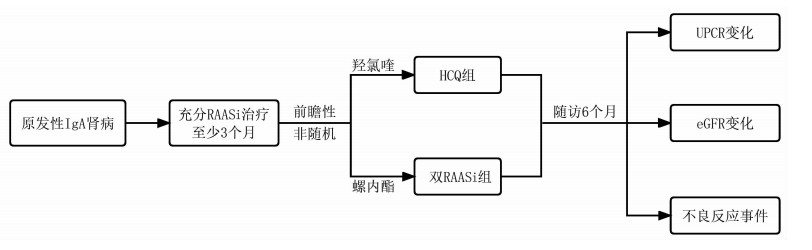
|
| 图 1 研究流程图 |
1.3 观察指标
UPCR下降率:定义为随访期间UPCR较基线百分比变化。eGFR下降率:定义为随访期间eGFR较基线百分比变化[16]。
1.4 统计学方法应用SPSS 26.0统计软件分析数据。计量资料正态分布数据以x±s表示,组间比较采用t检验;非正态分布数据以中位数M(P25,P75)表示,组间比较采用Wilcoxon秩和检验;计数资料用率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果 2.1 两组疗效比较两组基线特征如表 1所示,HCQ组104例患者和双RAASi组68例患者纳入研究进行分析。两组在年龄、性别、肾活检至入组时间、合并高血压比例、白蛋白水平、UPCR基线水平、ACEI/ARB治疗和牛津分型无统计学差异。而HCQ组肾功能水平较双RAASi组差,其肾小球滤过率(eGFR)显著低于双RAASi组(P<0.01)。且HCQ组Lee氏分级中Ⅲ~Ⅳ比例更高(P<0.05)。在共计6个月随访过程中,两组UPCR、eGFR变化水平及UPCR下降率、eGFR下降率如表 2所示。结果显示,HCQ组与双RAASi组在随访第3、6个月时的UPCR下降率差异无统计学意义,而HCQ组在随访第3、6个月时eGFR下降率显著低于双RAASi组(P<0.01)。
| 指标 | HCQ组(n=104) | 双RAASi组(n=68) | P值 |
| 年龄/岁 | 37.5±10.6 | 37.5±11.0 | 0.986 |
| 性别(男/女) | 39/65 | 17/51 | 0.087 |
| 距肾活检时间/年 | 2.14(0.79,4.38) | 1.58(0.65,4.08) | 0.571 |
| 高血压 | 34(32.6) | 16(23.5) | 0.196 |
| 肌酐/μmol·L-1 | 103.0±33.8 | 79.1±20.5 | <0.001 |
| eGFR/mL·(min·1.73 m2)-1 | 75.2±26.9 | 92.6±25.7 | <0.001 |
| 白蛋白/g·L-1 | 43.4±3.9 | 43.2±3.9 | 0.704 |
| UPCR/g·g-1 | 0.70(0.44,1.07) | 0.63(0.40,1.15) | 0.617 |
| ACEI/ARB | 35/69 | 31/37 | 0.116 |
| Lee氏分级 | 0.003 | ||
| Ⅱ | 22 | 18 | |
| Ⅲ | 60 | 48 | |
| Ⅳ | 22 | 2 | |
| 牛津分型 | |||
| M0/M1 | 0/104 | 1/67 | 0.215 |
| S0/S1 | 20/84 | 14/54 | 0.827 |
| E0/E1 | 100/4 | 64/4 | 0.535 |
| T0/T1/T2 | 73/26/5 | 57/11/0 | 0.056 |
| C0/C1/C2 | 83/18/3 | 52/16/0 | 0.244 |
| 指标 | HCQ组(n=104) | 双RAASi组(n=68) | P值 |
| eGFR/mL·(min·1.73 m2)-1 | |||
| 基线 | 75.2±26.9 | 92.6±25.7 | <0.001 |
| 3个月 | 74.3±26.7 | 88.5±27.7 | 0.001 |
| 6个月 | 72.4±27.3 | 83.0±27.6 | 0.015 |
| UPCR/g·g-1 | |||
| 基线 | 0.70(0.44,1.07) | 0.63(0.40,1.15) | 0.617 |
| 3个月 | 0.37(0.26,0.61) | 0.43(0.23,0.69) | 0.828 |
| 6个月 | 0.27(0.20,0.48) | 0.28(0.17,0.57) | 0.877 |
| eGFR下降率/% | |||
| 3个月 | -1.1(-7.5,6.3) | -3.5(-11.5,1.5) | 0.042 |
| 6个月 | -3.3(-11.6,2.3) | -11.5(-18.1,-1.9) | <0.001 |
| UPCR下降率/% | |||
| 3个月 | -42.6(-64.5,-20.1) | -37.9(-61.2,-11.2) | 0.475 |
| 6个月 | -54.7(-71.9,-36.3) | -52.0(-71.6,-24.6) | 0.551 |
2.2 亚组间疗效比较
各亚组间基线特征如表 3所示,随访期间各亚组间eGFR下降率和UPCR下降率如图 2、3所示。对于在入组前和入组后全程未使用激素或免疫抑制剂的患者,两组在年龄、性别、肾活检至入组时间、合并高血压比例和UPCR基线水平等均无统计学差异,HCQ组的血肌酐平均水平更高,eGFR更低,Lee氏分级中Ⅲ~Ⅳ比例更高,有统计学差异(P<0.05),而采用牛津分型,两组在各评价项无统计学差异。两组UPCR下降率在3个月和6个月随访时间点无统计学差异。而在eGFR下降率方面,随访3个月时两组无统计学差异,而在随访到6个月时,HCQ组eGFR下降率显著低于双RAASi组(P=0.020)。
| 指标 | 入组前(-),入组后(-) | 入组前(+),入组后(-) | 入组前(-),入组后(+) | 入组前(+),入组后(+) | |||||||||||
| HCQ组(n=59) | 双RAASi组(n=40) | P值 | HCQ组(n=12) | 双RAASi组(n=11) | P值 | HCQ组(n=13) | 双RAASi组(n=9) | P值 | HCQ组(n=20) | 双RAASi组(n=8) | P值 | ||||
| 年龄/岁 | 38.4±11.4 | 36.0±10.3 | 0.291 | 40.6±8.9 | 39.0±12.8 | 0.735 | 34.3±8.1 | 40.5±9.3 | 0.112 | 34.9±10.3 | 39.3±13.9 | 0.357 | |||
| 性别(男/女) | 25/34 | 10/30 | 0.076 | 4/8 | 2/9 | 0.408 | 1/12 | 3/6 | 0.125 | 9/11 | 2/6 | 0.328 | |||
| 距离活检时间/年 | 2.34(0.78,4.35) | 1.58(0.37,4.32) | 0.505 | 2.58(1.08,6.85) | 1.12(1.00,3.78) | 0.316 | 0.95(0.42,3.61) | 3.07(0.81,5.37) | 0.324 | 1.63(0.65,4.59) | 1.37(0.59,3.52) | 0.862 | |||
| 高血压 | 20(33.8) | 9(22.5) | 0.221 | 4(33.3) | 2(18.1) | 0.408 | 3(23.0) | 2(22.2) | 0.962 | 7(35.0) | 3(37.5) | 0.901 | |||
| 肌酐/μmol·L-1 | 100.8±31.1 | 78.5±20.9 | <0.001 | 110.7±41.5 | 78.0±26.4 | 0.037 | 89.6±30.5 | 82.4±14.7 | 0.523 | 113.3±37.0 | 79.7±18.1 | 0.022 | |||
| eGFR/mL·(min·1.73m2)-1 | 76.7±26.9 | 94.4±24.5 | 0.001 | 68.0±28.0 | 92.2±32.5 | 0.068 | 81.9±27.4 | 88.1±25.4 | 0.598 | 70.7±26.3 | 89.6±25.9 | 0.097 | |||
| 白蛋白/g·L-1 | 44.3±3.4 | 43.9±4.1 | 0.567 | 41.9±2.6 | 43.7±2.5 | 0.094 | 41.8±3.6 | 42.2±3.3 | 0.809 | 42.6±5.4 | 39.9±3.7 | 0.201 | |||
| UPCR/g·g-1 | 0.58(0.42,1.04) | 0.60(0.39,1.13) | 0.588 | 0.66(0.51,0.82) | 0.49(0.39,0.90) | 0.566 | 0.90(0.41,1.42) | 1.04(0.38,1.37) | 0.896 | 0.74(0.44,1.83) | 1.01(0.59,1.35) | 0.381 | |||
| ACEI/ARB | 20/39 | 20/20 | 0.109 | 7/5 | 2/9 | 0.049 | 6/7 | 5/4 | 0.665 | 2/18 | 4/4 | 0.020 | |||
| Lee氏分级 | 0.015 | 0.865 | 0.240 | 0.577 | |||||||||||
| Ⅱ | 15 | 12 | 2 | 2 | 2 | 3 | 3 | 1 | |||||||
| Ⅲ | 33 | 28 | 8 | 8 | 8 | 6 | 11 | 6 | |||||||
| Ⅳ | 11 | 0 | 2 | 1 | 3 | 0 | 6 | 1 | |||||||
| 牛津分型 | |||||||||||||||
| M0/M1 | 0/59 | 1/39 | 0.222 | 0/12 | 0/11 | - | 0/13 | 0/9 | - | 0/20 | 0/8 | - | |||
| S0/S1 | 10/49 | 7/33 | 0.943 | 3/9 | 5/6 | 0.304 | 2/11 | 1/8 | 0.774 | 5/15 | 1/7 | 0.466 | |||
| E0/E1 | 57/2 | 39/1 | 0.800 | 12/0 | 8/3 | 0.052 | 12/1 | 9/0 | 0.394 | 19/1 | 8/0 | 0.520 | |||
| T0/T1/T2 | 40/16/3 | 35/5/0 | 0.059 | 10/2/0 | 8/3/0 | 0.538 | 10/3/0 | 8/1/0 | 0.474 | 13/5/2 | 6/2/0 | 0.643 | |||
| C0/C1/C2 | 54/5/0 | 34/6/0 | 0.311 | 9/3/0 | 7/4/0 | 0.554 | 9/3/1 | 7/2/0 | 0.688 | 11/7/2 | 4/4/0 | 0.562 | |||
| +:使用激素或免疫抑制;-:未使用激素或免疫抑制剂 | |||||||||||||||
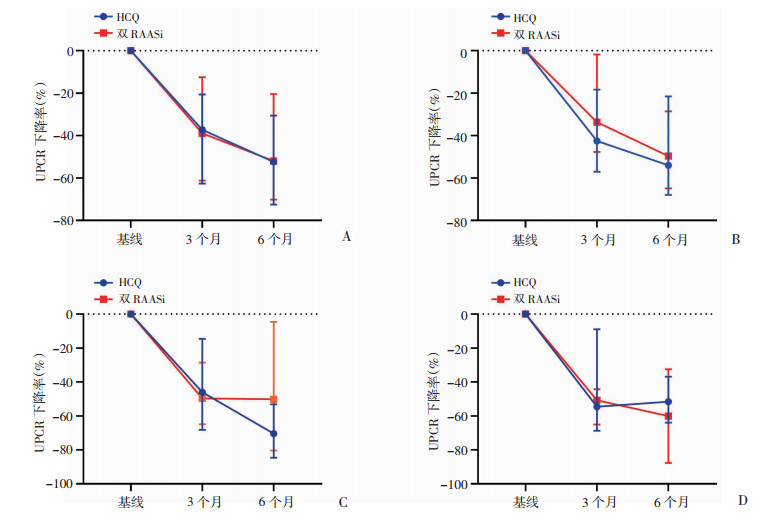
|
|
+:使用激素或免疫抑制;-:未使用激素或免疫抑制剂 A:入组前(-),入组后(-);B:入组前(+),入组后(-);C:入组前(-),入组后(+);D:入组前(+),入组后(+) 图 2 两组患者随访期间UPCR下降率比较 |
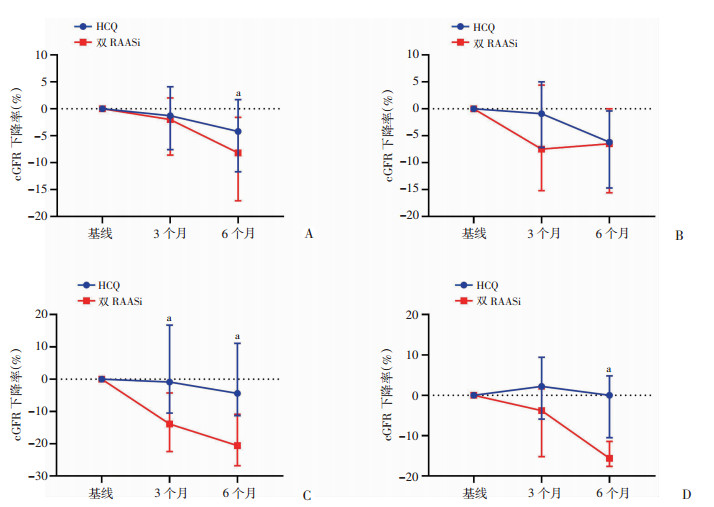
|
|
+:使用激素或免疫抑制;-:未使用激素或免疫抑制剂;a:P<0.05 A:入组前(-),入组后(-);B:入组前(+),入组后(-);C:入组前(-),入组后(+);D:入组前(+),入组后(+) 图 3 两组患者随访期间eGFR下降率比较 |
对于在入组前使用激素或免疫抑制剂但入组后停用的患者,两组在Lee氏分级、牛津分型、eGFR、UPCR基线水平等均无统计学差异,而HCQ组的血肌酐平均水平更高(P<0.05),两组在随访第3、6个月时的UPCR下降率、eGFR下降率均无统计学差异。
对于在入组前未使用激素或免疫抑制剂但入组后加用的患者,两组基线临床和病理资料比较差异无统计学意义,两组UPCR下降率在3个月和6个月随访时间点无统计学差异,而HCQ组在随访第3、6个月时的eGFR下降率显著低于双RAASi组(P<0.05)。
对于在入组前和入组后全程使用激素或免疫抑制剂的患者,HCQ组的血肌酐平均水平更高(P<0.05),而其他临床资料及病理资料均无统计学差异。两组随访第3、6个月时的UPCR下降率,以及随访第3个月时的eGFR下降率均无统计学差异,而HCQ组在随访第6个月时的eGFR下降率低于双RAASi组(P=0.016)。
2.3 安全性比较如表 4所示,在随访期间共计16例次不良事件发生,其中HCQ组10例(9.6%),双RAASi组6例(8.8%)。两组均无严重不良反应事件(SAE),两组不良反应事件发生率差异无统计学意义。在一般不良反应事件中,部分患者不止出现1个。HCQ组主要是胃肠道反应、皮肤瘙痒和失眠、头疼等。而双RAASi组不良反应事件主要包括低血压、AKI发生风险以及高钾血症。HCQ组未观察到视网膜病变患者,可能是由于给药剂量较少,而且持续时间比风湿病患者短。
| 不良反应 | HCQ组(n=104) | 双RAASi组(n=68) | P值 |
| 严重不良反应事件(SAE) | 0 | 0 | |
| 一般不良反应事件(AE) | 10(9.6) | 6(8.8) | 0.861 |
| 胃肠道反应:腹泻、腹痛、纳差、恶心 | 4 | 0 | |
| ALT/AST升高 | 1 | 0 | |
| AKI | 0 | 2 | |
| 低血压 | 0 | 3 | |
| 心悸 | 1 | 0 | |
| 皮肤表现:瘙痒、丘疹 | 2 | 0 | |
| 内分泌紊乱:乳房胀痛、月经失调 | 0 | 2 | |
| 高血钾 | 2 | 2 | |
| 神经系统症状:失眠、头痛 | 2 | 0 |
3 讨论
本研究比较了接受HCQ治疗和接受螺内酯治疗的IgA肾病患者的UPCR下降率、eGFR下降率等指标,发现HCQ组的基线血肌酐平均水平更高,eGFR更低,Lee氏分级中Ⅲ~Ⅳ比例更高,而随访期间两组尿蛋白下降水平相当,HCQ组肾功能下降速度较双RAASi组慢。在亚组分析中,发现不论是否使用激素或免疫抑制剂,在6个月时均能显著降低尿蛋白。除入组前使用激素或免疫抑制剂但入组后停用的人群外,其余人群HCQ组在随访第6个月时的eGFR下降率均显著低于双RAASi组。结果表明,对于已经充分RAASi治疗的IgA肾病患者,HCQ和螺内酯均能进一步有效降低尿蛋白,但对肾小球滤过率保护作用来看,HCQ较螺内酯有明显优势。
持续性蛋白尿是CKD进展的独立危险因素[18],其主要通过诱导足细胞损伤等导致肾小球硬化,以及通过直接毒性作用、激活补体和炎性小体、引起氧化应激和促进凋亡等途径导致肾小管间质炎症和纤维化,从而促进CKD进展[19]。临床研究发现,尿蛋白定量>1 g/d的IgA肾病患者肾功能恶化进展加速,且进展速度与尿蛋白量呈正相关,持续蛋白尿>3 g/d肾小球滤过率(GFR)丢失比<1 g/d快25倍[4]。因此,控制尿蛋白水平是治疗IgA肾病的核心环节。ACEI/ARB是IgA肾病的基本支持治疗,但长期应用ACEI/ARB的患者会出现醛固酮升高,即“醛固酮逃逸”[10, 20]。醛固酮通过促进肾小球和肾小管间质炎症和纤维化,导致尿蛋白增加和eGFR下降[9]。因此,应用MRA可能会获得ACEI/ARB治疗的额外收益。目前,关于MRA治疗慢性肾脏病蛋白尿的报道较多。CHRYSOSTOMOU等[21]的一项随机双盲对照试验证实,螺内酯联合RAASi可以持续减少尿蛋白。HCQ作为一种抗疟药物,广泛应用于类风湿关节炎、干燥综合征、系统性红斑狼疮等风湿免疫疾病[22-23]。由于其抗蛋白尿作用,最近被用于IgA肾病。北京大学第一医院肾内科张宏等[16]的一项大样本倾向性评分病例匹配的回顾性研究发现,已经接受最大耐受量RAS阻断剂的IgA肾病患者,使用HCQ与未使用的患者相比,在第6个月时,蛋白尿下降的百分比明显高于对照组。其后通过一项随机双盲对照研究证实了HCQ对于IgA肾病降低尿蛋白的作用[15]。目前,HCQ治疗IgA肾病已经纳入2021年KDIGO肾小球肾炎临床指南[24]。本研究发现,在RAASi基础上加用HCQ或螺内酯,在6个月时均能显著降低尿蛋白,但HCQ对eGFR的保护明显优于螺内酯。
既往IgA肾病的治疗重点是尿蛋白,但目前的观点进行了转变,最终是减小eGFR丢失的速度,延缓CKD的进展。对于IgA肾病的治疗,糖皮质激素的疗效及安全性一直存在争议。2012年KDIGO指南建议:对经过3~6个月优化支持治疗后,蛋白尿水平仍>1 g/d且eGFR>50 mL/(min·1.73 m2)的IgA肾病患者,可以使用6个月的糖皮质激素治疗。STOP-IgAN和TESTING研究表明,在RAASi治疗的基础上加用激素,可以显著减少蛋白尿,但严重不良事件风险显著增加[7-8]。STOP-IgAN研究发现,在高危IgA肾病患者中加用激素或免疫抑制剂不能阻止eGFR的下降[7]。这就引起我们思考,可能在今后IgA肾病的治疗过程中,既要控制尿蛋白,又要兼顾对eGFR的保护作用。本研究提示HCQ较螺内酯有更好的eGFR保护作用,但需要注意的是由于MRA的利尿作用和肾小球高滤过消失,eGFR最初会出现可逆性降低,主要在治疗第1个月,随后保持稳定,而初始eGFR下降预示着随后对尿蛋白的减少及肾功能的保护作用[25]。本研究仅仅观察了6个月,因此,需要更长的研究周期来验证目前的结果。
我们基于真实世界的研究发现,激素或免疫抑制剂在本研究中作为一个混杂因素处理。对于全程无激素无免疫抑制剂使用的患者,发现HCQ在6个月时对eGFR的保护作用优于螺内酯。此外,本研究发现无论入组前是否使用激素或免疫抑制剂,在入组后使用的人群中,HCQ组也优于螺内酯。而入组前给予激素或免疫抑制剂,入组后停用的这群患者,两组eGFR下降幅度无明显差异,可能与停用激素或免疫抑制剂有关。此外,作为一项非随机研究,选择偏倚不可避免,且随访时间短、样本量少,可能导致某些变异和偏倚。此前也有研究报道,对激素或免疫抑制剂反应不足的IgA肾病使用HCQ可以降低尿蛋白,延缓CKD进展[26]。HCQ可能通过抑制Toll样受体(TLR)刺激和减少细胞因子的产生来有效治疗IgA肾病[27]。激素或免疫抑制剂联合HCQ可能具有协同作用,HCQ将来可能成为IgA肾病的替代治疗或补充,以减少激素或免疫抑制剂的副作用。
综上所述,在充分RAASi治疗的基础上尿蛋白不达标的IgA肾病患者,HCQ和螺内酯控制尿蛋白水平效果相当,无严重不良事件,但HCQ在eGFR保护作用显著优于螺内酯。由于本研究是一项前瞻性、非随机对照研究,样本量小、随访时间短、存在偏倚等,因此,HCQ、螺内酯的长期疗效、对肾功的影响及其安全性仍需要进行多中心、大样本的随机对照试验进一步验证。
| [1] |
SCHENA F P, NISTOR I. Epidemiology of IgA nephropathy: a global perspective[J]. Semin Nephrol, 2018, 38(5): 435-442. |
| [2] |
LI X L, LIU Y X, LV J C, et al. Progression of IgA nephropathy under current therapy regimen in a Chinese population[J]. Clin J Am Soc Nephrol, 2014, 9(3): 484-489. |
| [3] |
COPPO R, D'AMICO G. Factors predicting progression of IgA nephropathies[J]. J Nephrol, 2005, 18(5): 503-512. |
| [4] |
AUCELLA F, NETTI G S, PIEMONTESE M, et al. Proteinuria in the prognosis of IgA nephropathy[J]. Minerva Urol Nefrol, 2009, 61(3): 235-248. |
| [5] |
CHENG J, ZHANG W, ZHANG X H, et al. ACEI/ARB therapy for IgA nephropathy: a meta analysis of randomised controlled trials[J]. Int J Clin Pract, 2009, 63(6): 880-888. |
| [6] |
JI Y, YANG K, XIAO B, et al. Efficacy and safety of angiotensin-converting enzyme inhibitors/angiotensin receptor blocker therapy for IgA nephropathy: a meta-analysis of randomized controlled trials[J]. J Cell Biochem, 2019, 120(3): 3689-3695. |
| [7] |
ROBERT T, CAMBIER A, HERTIG A. Intensive supportive care plus immunosuppression in IgA nephropathy[J]. N Engl J Med, 2016, 374(10): 991. |
| [8] |
O'SHAUGHNESSY M M, LAFAYETTE R A. Corticosteroids for IgA nephropathy: testing for benefit, discovering harm[J]. JAMA, 2017, 318(5): 429-431. |
| [9] |
BAUERSACHS J, JAISSER F, TOTO R. Mineralocorticoid receptor activation and mineralocorticoid receptor antagonist treatment in cardiac and renal diseases[J]. Hypertension, 2015, 65(2): 257-263. |
| [10] |
SARAFIDIS P A, MEMMOS E, ALEXANDROU M E, et al. Mineralocorticoid receptor antagonists for nephroprotection: current evidence and future perspectives[J]. Curr Pharm Des, 2018, 24(46): 5528-5536. |
| [11] |
ERRAEZ S, LÓPEZ-MESA M, GÓMEZ-FERNÁNDEZ P. Mineralcorticoid receptor blockers in chronic kidney disease[J]. Nefrologia, 2021, 41(3): 258-275. |
| [12] |
BARRERA-CHIMAL J, GIRERD S, JAISSER F. Mineralocorticoid receptor antagonists and kidney diseases: pathophysiological basis[J]. Kidney Int, 2019, 96(2): 302-319. |
| [13] |
PATEL V, JOHARAPURKAR A, JAIN M. Role of mineralocorticoid receptor antagonists in kidney diseases[J]. Drug Dev Res, 2021, 82(3): 341-363. |
| [14] |
GAO R T, WU W, WEN Y B, et al. Hydroxychloroquine alleviates persistent proteinuria in IgA nephropathy[J]. Int Urol Nephrol, 2017, 49(7): 1233-1241. |
| [15] |
LIU L J, YANG Y Z, SHI S F, et al. Effects of hydroxychloroquine on proteinuria in IgA nephropathy: a randomized controlled trial[J]. Am J Kidney Dis, 2019, 74(1): 15-22. |
| [16] |
YANG Y Z, CHEN P, LIU L J, et al. Comparison of the effects of hydroxychloroquine and corticosteroid treatment on proteinuria in IgA nephropathy: a case-control study[J]. BMC Nephrol, 2019, 20(1): 297. |
| [17] |
TANG C, LV J C, SHI S F, et al. Long-term safety and efficacy of hydroxychloroquine in patients with IgA nephropathy: a single-center experience[J]. J Nephrol, 2022, 35(2): 429-440. |
| [18] |
BARBOUR S J, REICH H N. Risk stratification of patients with IgA nephropathy[J]. Am J Kidney Dis, 2012, 59(6): 865-873. |
| [19] |
李艳艳, 范耀冰, 吴红赤. 蛋白尿在慢性肾脏病进展中的新认识[J]. 临床与病理杂志, 2021, 41(6): 1405-1410. LI Y Y, FAN Y B, WU H C. New understanding of proteinuria in the progression of chronic kidney disease[J]. J Clin Pathol Res, 2021, 41(6): 1405-1410. |
| [20] |
SATO A, SARUTA T. Aldosterone breakthrough during angiotensin-converting enzyme inhibitor therapy[J]. Am J Hypertens, 2003, 16(9 Pt 1): 781-788. |
| [21] |
CHRYSOSTOMOU A, PEDAGOGOS E, MACGREGOR L, et al. Double-blind, placebo-controlled study on the effect of the aldosterone receptor antagonist spironolactone in patients who have persistent proteinuria and are on long-term angiotensin-converting enzyme inhibitor therapy, with or without an angiotensin Ⅱ receptor blocker[J]. Clin J Am Soc Nephrol, 2006, 1(2): 256-262. |
| [22] |
BEN-ZVI I, KIVITY S, LANGEVITZ P, et al. Hydroxychloroquine: from malaria to autoimmunity[J]. Clin Rev Allergy Immunol, 2012, 42(2): 145-153. |
| [23] |
PONTICELLI C, MORONI G. Hydroxychloroquine in systemic lupus erythematosus (SLE)[J]. Expert Opin Drug Saf, 2017, 16(3): 411-419. |
| [24] |
TESAR V, TROYANOV S, BELLUR S, et al. Corticosteroids in IgA nephropathy: a retrospective analysis from the VALIGA study[J]. J Am Soc Nephrol, 2015, 26(9): 2248-2258. |
| [25] |
DOJKI F K, BAKRIS G. Nonsteroidal mineralocorticoid antagonists in diabetic kidney disease[J]. Curr Opin Nephrol Hypertens, 2017, 26(5): 368-374. |
| [26] |
TANG C, LV J C, SHI S F, et al. Effect of hydroxychloroquine in patients with IgA nephropathy with insufficient responses to immunosuppressive therapy: a retrospective case-control study[J]. BMC Nephrol, 2020, 21(1): 469. |
| [27] |
CIFERSKA H, HONSOVA E, LODEREROVA A, et al. Does the renal expression of Toll-like receptors play a role in patients with IgA nephropathy?[J]. J Nephrol, 2020, 33(2): 307-316. |




