2. 253899 河北 衡水,衡水市第八人民医院骨二科;
3. 100191 北京,北京航空航天大学生物医学工程高级创新中心生物科学与医学工程学院,生物力学与机械生物学教育部重点实验室
2. Second Department of Orthopedics, Hengshui Eighth People's Hospital, Hengshui, Hebei Province, 253899;
3. Key Laboratory for Biomechanics and Mechanobiology of Ministry of Education, School of Biological Science and Medical Engineering, Beijing Advanced Innovation Centre for Biomedical Engineering, Beihang University, Beijing, 100191, China
人工全膝关节置换术(total knee arthroplasty,TKA)是治疗终末期膝关节骨关节炎的有效方法,可明显缓解疼痛,改善畸形,提高生活质量[1]。TKA的成功取决于包括合适的假体型号、精确的截骨、准确的假体力线、适当的软组织平衡等在内的几个因素[2],而不良的假体力线则可能造成假体无菌性松动或磨损[3-4]。随着三维影像技术、计算机辅助技术和3D打印技术的进步,越来越多的学者开始尝试采用智能技术辅助TKA。3D打印个体化导向器(patient-specific instrumentation, PSI)辅助TKA具有提高手术截骨精度、缩短手术时间、减少出血量、减少脂肪栓塞发生率等优势[5],该技术可以在术前阶段通过计算机虚拟手术规划清晰显示关节畸形、提前规划术中使用假体的型号,并降低型号选择错误导致的股骨前皮质切割、屈伸膝间隙不平衡、假体覆盖不足或假体悬挂等并发症[6-7],还可以节约准备假体型号和手术器械的经济成本[8-10]。本研究旨在通过改良术前规划方案,经医师与工程师共同调整方案,对比术中使用假体型号与术前三维规划假体型号的差异,以探讨改良3D打印个体化导向器辅助人工全膝关节置换术的假体型号规划的一致性。
1 资料与方法 1.1 研究对象2018年3月至2021年6月北京大学国际医院采用改良3D打印个体化导向器辅助人工全膝关节置换术137膝(126人),其中男性17膝(16人),女性120膝(110人),左侧65膝,右侧72膝,年龄49~81(67.5±6.1)岁,体质量指数(27.53±3.82)kg/m2。手术由同一组医师应用相同的器械和操作方法进行,假体选择爱康宜诚公司A3假体。本研究经北京大学国际医院伦理委员会审批(2019-030BMR),并获得患者知情同意。
1.2 纳入标准和排除标准纳入标准:①符合初次全膝关节置换手术指征的患者,包括骨关节炎及类风湿性关节炎患者,膝骨关节炎Kellgren-Lawrence影像学分级为Ⅲ~Ⅳ级;②术前CT扫描无禁忌证;③同意使用3D打印个性化截骨板行关节置换术;④年龄≥18岁。
排除标准:①活动性、局部或全身感染;②明显的骨缺损,在手术过程中不能使用3D打印个体化导向器;③术侧已行人工膝关节置换者;④计划同时行双侧人工全膝关节置换术者。
1.3 改良3D打印个体化导向器的设计与制作 1.3.1 患肢数据获取和工程师主导的初始三维术前规划患者术前行三维CT薄层扫描(Siemens,德国,SOMATOM Definition AS),扫描时采用平卧位,患者保持最大伸直角度,扫描范围从患侧股骨头到踝关节,提取全部下肢数据,以DICOM格式保存,传送给工程师。工程师将患者数据导入UG软件(美国Siemens PLM Software公司),根据灰度阈值进行初始分割,重建整个下肢的三维立体模型,然后在三维图像上确定出股骨头中心、股骨远端膝关节中心、胫骨近端膝关节中心、踝关节中心等解剖标志点,然后根据上述解剖标志点确定股骨和胫骨侧力线,模拟手术中膝关节截骨和假体的置入、截骨量、假体大小、假体方位;初始设计完成后将设计方案以规划表及标准贴图保存(图 1)。
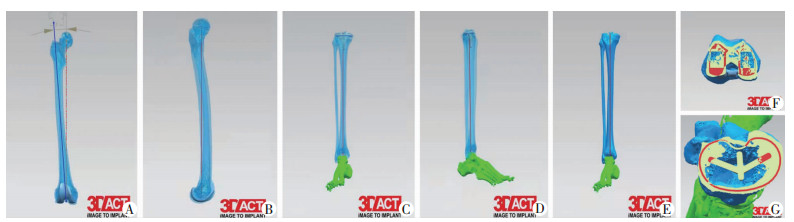
|
| A:股骨侧冠状位透视图;B:股骨侧矢状位透视图;C:胫骨侧冠状位透视图;D:胫骨侧矢状位透视图;E:胫骨侧三维实体力线示意图;F:股骨侧轴位透视图;G:胫骨侧轴位透视图 图 1 初始三维规划设计方案 |
初始三维术前规划的设计原则:股骨假体的冠状面和矢状面垂直于股骨侧机械轴,轴位外旋角度初始规划为3°,并标注后髁连线与股骨通髁线的实际夹角;股骨假体尽量与股骨横径匹配,假体边缘超出或未覆盖股骨边缘宽度小于2 mm,股骨前髁截骨无骨皮质切割;对于内翻膝患者股骨远端截骨量以股骨外髁远端最低点为参考点截骨9 mm(外翻膝患者以股骨内髁远端最低点为参考点截骨12 mm),完成初始规划后标注股骨前髁、股骨内外侧髁远端和后髁的截骨厚度。工程师规划完成后对上述参数进行标注,如遇到患者特殊解剖变异或特殊规划方案(如股骨异常的外翻角、前弓角、外旋角、截骨量、骨缺损等),需进行标记。
胫骨假体在冠状面上垂直于胫骨机械轴,在矢状面后倾5°,在轴位旋转轴为胫骨结节中内1/3至后交叉韧带胫骨止点连线;胫骨假体尽量最大程度覆盖胫骨近端骨面,胫骨假体以不超出胫骨边缘为宜,或超出胫骨边缘宽度小于2 mm;对于内翻膝患者,胫骨平台截骨量以胫骨外侧平台中心点为参考点截骨8 mm(对于外翻膝患者胫骨平台截骨量以胫骨内侧平台中心点为参考点截骨8 mm)。工程师规划完成后对上述参数进行标注,如遇到患者特殊解剖变异或特殊规划方案(胫骨内翻外翻畸形、胫骨异常旋转畸形、骨缺损、胫骨与股骨假体型号偏差超过2号等),需进行标记。
1.3.2 改良医工交互、调整初始术前设计方案在收到工程师的初设设计方案后,医师将根据患者体格检查及影像资料数据对方案进行调整:如截骨量不合适、导致屈伸间隙不平衡时,医师将调整假体型号或假体矢状位屈伸角度(截骨角度),以调整股骨、胫骨截骨量;工程师设计的假体安放位置不合适时,医师将调整假体内外侧放置位置;当工程师设计假体旋转轴与假体覆盖面积有矛盾时,医师将适当调整假体安放的旋转轴角度。除在术前规划中调整截骨角度和假体放置位置,医师也可以根据传统工具、手术经验进行个体化3D打印手术装置设计,如遇屈曲挛缩严重患者时,术者经验性判断存在增加截骨可能,工程师便会提前设计并制作常规截骨导向器和远端+2 mm截骨导向器,以适应术者术中需要;常规3D打印制作胫骨个性导向器-胫骨力线杆转接装置,连接装置上有插槽可连接导向器,同时连接装置中孔洞可穿过胫骨力线杆(孔洞直径与力线杆直径公差极小,可保证力线杆稳定),术者在术中便可多次验证下肢力线情况,确保截骨精度;工程师在设计截骨导向器的同时也会设计、制作以下模型:带有截骨线标记的股骨、胫骨模型,模拟截取骨片模型,此设计可让医师在术中将实际截骨线和截下的骨片与术前设计进行比对,及时确认手术精确度。
1.3.3 确认最终设计方案并3D打印个体化手术导向器医师与工程师确定方案后,将设计文件发送给制造商,进行导向器3D打印制作。
1.3.4 改良3D打印个体化导向器的设计和制作本课题组设计了新型导向器(图 2)。①增加导向器与骨面的接触面积:股骨侧、胫骨的导向器3个接触点均增加接触面积;②增加导向器辅助定位装置:如导向器与通髁线、胫骨结节、胫骨前脊等解剖标志的对应的位置增加标志点、线;③增加术中误差校准辅助工具:如3D打印术前规划截骨后骨片、3D打印股骨截骨后模型、胫骨侧导向器的辅助力线杆等(图 3)。根据上述确认设计方案,完成导向器设计过程,再采用激光快速成型打印机进行制作。
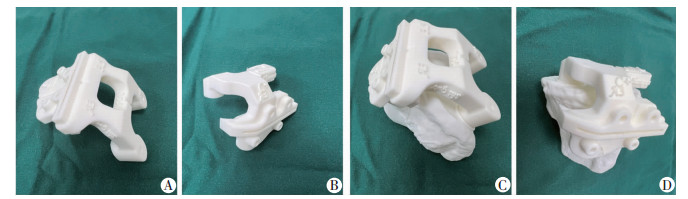
|
| A:股骨侧导向器;B:胫骨侧导向器;C:股骨导向器附着于股骨块;D:胫骨导向器附着于胫骨块 图 2 改良个体化导向器 |
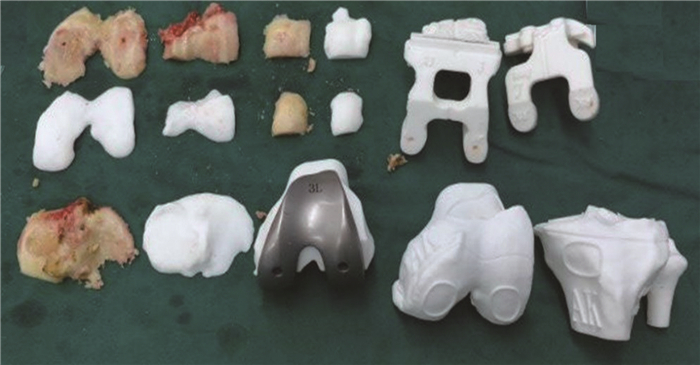
|
| 图 3 改良个体化导向器术中误差校准辅助工具 |
1.4 手术方法
手术前,外科医师先将规划型号的试模与3D打印股骨模型相匹配,通过匹配程度以提前验证规划假体型号是否合适、截骨量是否合适、假体内外侧安装位置是否合适(图 4)。
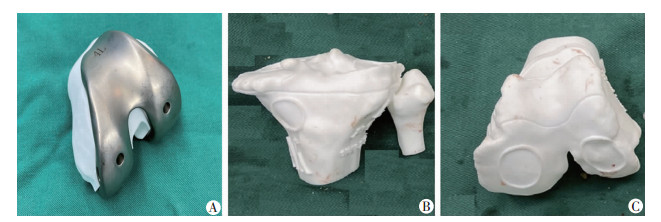
|
| A:预计型号的试模与打印出的股骨截骨块进行匹配;B:3D打印胫腓骨模型,可见术前规划的截骨线,也可见胫骨平台、胫骨前方的导向器附着点位置;C:3D打印股骨模型,模型中标记规划截骨线,同时标记股骨远端、股骨前皮质的导向器附着点 图 4 手术精度验证装置 |
常规选择椎管内麻醉,麻醉后患肢上止血带,压力260~300 mmHg;取膝前正中切口,髌旁内侧入路常规暴露膝关节;分别刮除股骨、胫骨截骨导向器附着点处软骨,安放导向器行股骨远端、胫骨近端截骨。完成截骨后修整增生骨赘,切除半月板,进行必要的软组织松解,安装股骨及胫骨垫试模,复位,测量下肢力线和旋转对线情况,取出试模,冲洗,涂抹骨水泥,安装假体及衬垫;待骨水泥固化后,修整髌骨(不置换髌骨),放置引流,逐层关闭切口并包扎(图 5)。
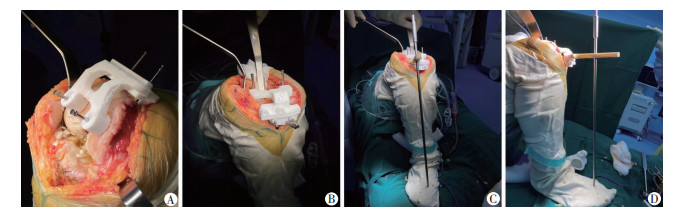
|
| A:股骨远端个体化导向器和两组垂直固定钉;B:胫骨平台个体化导向器和两组垂直固定钉;C:个体化导向器结合力线杆验证冠状面力线;D:个体化导向器结合力线杆验证矢状面力线 图 5 改良个体化导向器术中操作 |
1.5 术后治疗及康复治疗
术后常规进行预防感染、抗凝、镇痛、冰敷等治疗。回病房后患者开始进行踝泵锻炼及股四头肌锻炼。拔除引流管后下床功能锻炼,每日在康复师指导下行伸直、屈曲、肌力训练。
1.6 数据记录术中及术后需要记录的内容:实际使用假体型号与术前规划型号的差异,术中是否放弃PSI改为传统工具截骨,术中和围手术期并发症。
1.7 统计学分析使用Excel电子表格记录所有数据。采用SPSS 22.0统计软件进行分析。连续性变量首先进行Shapiro-Wilk正态性检验,正态分布的连续型变量表示为x±s,组间比较采用独立样本t检验或配对样本t检验;非正态分布的连续性变量以中位数(四分位数间距)形式表示,非正态分布的二分变量以病例数和频率表示,组间比较采用Wilcoxon检验。P<0.05为差异有统计学意义。
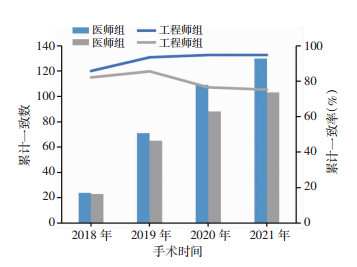
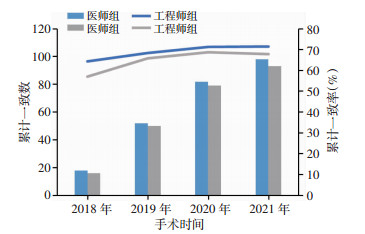
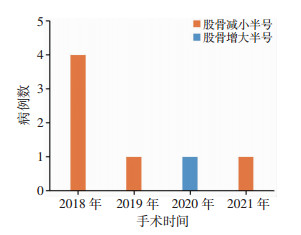
2 结果股骨侧假体:术中实际使用型号与经过医师调整方案型号有差异的7例,但差异无统计学意义。术中实际使用型号与工程师初始设计方案有差异的25例,差异有统计学意义(P<0.01),经过医师调整的工程师初始设计方案为19例,差异有统计学意义(P<0.01)。胫骨侧假体:术中实际使用型号与经过医师调整后方案假体型号有差异的39例,术中实际使用型号与工程师初始设计方案有差异的44例,经过医师调整的工程师初始设计方案为5例,但差异无统计学意义(表 2)。根据手术日期进行累计,假体型号累计一致数和一致率见图 6、7,假体型号调整病例数分布见图 8、9。术中无改良导向器转为传统工具案例,围手术期无严重并发症发生。
| 组别 | 调整例数(%) | P值 |
| 股骨 | ||
| 医师调整后/实际使用 | 7(5.11) | 0.059 |
| 工程师初始设计/实际使用 | 25(18.25) | <0.01 |
| 工程师初始设计/医师调整后 | 19(13.87) | <0.01 |
| 胫骨 | ||
| 医师调整后/实际使用 | 39(28.47) | 0.556 |
| 工程师初始设计/实际使用 | 44(32.12) | 0.660 |
| 工程师初始设计/医师调整后 | 5(3.65) | 0.739 |
|
| 图 6 股骨侧假体型号累计一致数(柱状图)和累计一致率(折线图) |
|
| 图 7 胫骨侧假体型号累计一致数(柱状图)和累计一致率(折线图) |
|
| 图 8 股骨假体型号调整病例分布 |
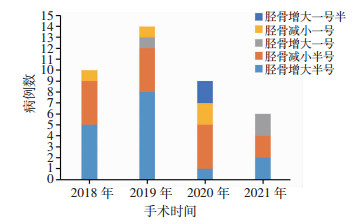
|
| 图 9 胫骨假体型号调整病例分布 |
3 讨论
随着膝关节骨关节炎患者数量的增加,人工全膝关节置换术的需求也在逐渐上升。良好的下肢力线可以延长假体寿命,而不良的力线会导致早期的无菌性松动和假体磨损,使得患者不得不接受关节翻修手术。3D打印个体化导向器(PSI)辅助全膝关节置换术可获得良好的力线[11-14],但也存在一些争议[15-17]。有研究发现,PSI因完善了详细的术前规划和术前准备,通过提前规划手术及准确的规划方案,可以降低关节假体厂商物流备货成本、节省医师手术时间、减少手术室工作准备等,从而改善经济效益[18-20]。但有研究也指出了PSI的缺点,例如截骨工具的设计会增加患者的额外费用,CT检查将增加患者的医疗负担和放射线暴露,等待截骨工具的生产会增加时间成本和经济负担[21-23]。
本研究结果显示,三维术前规划假体使用型号与实际使用假体型号有较高的一致性,且将工程师初始设计及医师调整后假体型号分为2组,与实际使用型号比较,发现经过医师调整后的假体型号累计一致数高于工程师初始设计,且随着时间推演、医师对手术技术的熟练,经调整后的假体型号准确率更加高于工程师组。本研究的术前规划高一致率体现在股骨侧假体型号,分析其原因可能是在术前规划中,股骨的冠状位、矢状位、旋转截骨面及角度均已确定,个性化导向器可以很好地复制术前规划,使得调整病例数少。
股骨侧医师调整后型号与工程师初始型号比较有统计学差异,证明术前规划需要医师根据患者解剖特点和医师手术经验进行调整;医师调整后型号与实际使用型号对比无统计学差异,说明医师调整后的规划方案可靠,手术中可直接复制术前规划,经工程师设计、医工沟通、医师调整的术前规划模式值得进行。股骨侧工程师初始设计与实际使用型号比较有统计学差异,说明如果单纯依赖工程师的设计而复制手术,术中很可能会调整假体型号,造成不良的规划准确性,其也间接证明了医工沟通、共同设计的重要性。
胫骨侧工程师初始方案、医师调整方案、实际使用方案两两对比,均无统计学差异,说明医师对工程师初始方案不需为调整假体型号而做显著修改,也说明工程师初始设计和医师调整方案相对可靠,应用到手术中无需进行显著调整。
分析主要原因:(1)术前规划由医师主导,最终的规划方案由医师决定。回顾已报道的术前规划与实际使用假体型号匹配程度的研究,大部分研究均得到了较好的结果。CUCCHI等[8]分析45例PSI手术患者,发现相比于最终应用的假体型号,通过术者调整的术前规划匹配度显著优于单纯工程师的规划。SCHOTANUS等[10]回顾性分析293例基于CT或MRI的PSI系统的TKA手术患者,发现工程师设计的假体型号在股骨侧和胫骨侧的匹配度分别可达78.8%和82.6%;而术者调整后的股骨和胫骨假体型号匹配度最终为93.9%和91.1%。工程师利用CT图像进行三维规划,将患者下肢全长图像中提取的数据信息传递给医师,医师从三维视角更精确地了解患者解剖形态和病理特征,并且结合自身临床经验,通过假体型号、截骨量、截骨角度进行微调,工程师也可以在医师的指导下提供更精准的图像信息、规划结果,并可以实时根据医师的调整方案给予数据反馈和支持。这种改良的医工交互流程不仅提高该技术精准度及一致性,也使得医师在手术前便对患者信息和手术方案做到心中有数,降低手术中实际与规划不符的可能,减少假体型号调整。(2)对3D打印个体化手术导向器的改良。YAMAMURA等[24]改良了所用个体化导向器设计,降低了手术后不良力线的发生率。本中心对导向器进行了以下优化改良:①股骨和胫骨均为三点附着设计,附着点周围设计钉孔用于金属钉固定导向器,同时3个附着点均增加了导板与骨面的接触面积,附着点位置设计参考患者骨性结构,适当增大的附着点可更稳定附着于骨表面,增加导向器的附着稳定性,减少在截骨过程中造成的导向器微动,避免导向器中截骨槽微动造成的截骨误差。②增加导向器辅助定位装置,如导向器表面标记骨旋转轴,该旋转轴在术中可指导医师放置截骨导向器的方向,减少因导向器旋转造成截骨槽旋转的可能,避免截骨误差。③本团队设计了3D打印术中误差校准辅助工具,使导向器可转接传统工具,如胫骨侧导向器设计组配式连接器,连接器一端插入胫骨导向器,另一端可通过胫骨力线杆,截骨导向器结合力线杆可让医师在术中多次验证胫骨力线准确性,避免因导向器放置位置不良而造成的截骨误差。以上改良均可减少手术中截骨误差,精确复制术前规划进行截骨,不仅可以实现精准的下肢力线,也实现了术前规划假体型号的高度一致性。(3)手术中验证方法。本研究在手术前提前设计与打印了截骨前骨模型(标记导向器附着点、标记截骨线位置)、截骨后骨模型、截骨后骨片模型(股骨远端、股骨前髁、股骨后内后外髁、胫骨平台骨片),并进行无菌消毒用于手术中。在手术开始前,医师便可将股骨试模套放在截骨后模型中,确认股骨假体型号是否合适、截骨量是否合适、假体内外侧安放位置,指导手术中操作及验证;在手术中放置导向器前,应用打印截骨前模型确定及验证附着点位置,放置、固定导向器后与打印模型上截骨线进行比对,验证截骨线位置准确性;完成截骨后将截取骨片与术前打印骨片进行比对,若无明显厚度误差,则可再次验证截骨精准。以上验证流程均在三维术前规划时完成,再次证明良好的术前规划可以完成精准的术中验证,避免截骨误差与手术误差,提高手术精度。
通过改良导向器,取得了较好的规划一致率,但部分病例仍存在调整型号的情况,分析术前规划与实际使用型号出现偏差的原因如下:①术前规划所致的误差。膝关节周围的骨赘可能会影响对于骨质边缘界限的判别,尤其是在本手术方式早期进行时,工程师医学知识不足发生设计误差,胫骨假体减小半号可由于此原因造成。本课题组早期对于调整设计方案的手段认识不充分,术前设计方案可能存在股骨远端与后髁截骨量不平衡、股骨前方皮质切割等情况,需要术中进行实时调整,造成了实际使用假体型号的改变,导致股骨侧假体在早期调整半号病例数较多;此外,术前规划方案是通过截图和三维图像展现给医师,由于视角的偏差,医师对于设计方案的判定可能存在误差,当术中实际操作时可能进行调整,从而造成实际使用假体型号的改变。②术中操作误差。既往研究和本研究均发现,使用个体化导向器操作过程中存在一定的误差,这些误差可能来源于导向器与患者骨质表面的匹配不佳、操作工具误差和操作手法误差,这些误差导致实际截骨的厚度和方向与术前规划间发生误差,导致股骨、胫骨假体覆盖面积变化,这可能造成术中调整假体型号。③术者习惯所致。因不同术者对于截骨厚度、截骨角度、假体安放方位和覆盖面积等操作和认知差异,术中对于规划方案进行调整,可导致实际使用型号与规划型号的偏差。术中胫骨平台截骨厚度增加使得平台面积减小,平台面积减小为胫骨假体型号减小原因之一。反之若截骨厚度不足,则造成平台面积增大,造成胫骨假体型号增大。④患者病理变化所需。术中需要对截骨量、骨赘去除量等进行调整,可导致实际使用型号与术前规划型号的偏差。本研究中1例胫骨增大1号、2例增大1.5号,由于胫骨平台内侧面积严重大于外侧,工程师严格按照旋转原则设计,平台覆盖面积参考外侧平台,而医师在术中为求平台覆盖面积而参考内侧平台选择假体,导致增大假体型号。⑤现有理论不足所致的误差。由于目前对于三维立体空间的下肢对位对线规律理解还不完善,尤其是对假体在矢状位和轴位安放位置缺乏确定的三维理论依据,导致设计方案缺乏统一标准,也可能造成实际使用假体型号的偏差。
个体化导向器在既往研究中存在增加经济成本、增加等待3D打印制作时间、增加患者辐射暴露等不足,但我们的经验是,从获取CT图像到完成导向器制作所需时间不到2周,并不会增加等待制作的时间成本。在本研究中,术前规划和假体成本也不昂贵,不会给患者带来过重的经济负担。同时,单次下肢全长CT的辐射剂量在人体辐射暴露安全范围内,不会因一次的CT检查而导致过量放射暴露。
本研究也存在一些局限性。首先,本研究是一项回顾性研究,报告了PSI系统在全膝关节置换术前规划假体型号的可靠性,缺乏对患者术后下肢力线及功能评分的回顾分析。其次,本研究缺乏与传统工具手术的比较,是一项非对照研究,可能存在由外科医师和患者带来的选择偏倚。另外,本文仅研究了一个PSI系统,不能代表全部PSI技术。最后,股骨前皮质和五合一截骨块因假体限制仍使用传统工具,未来可进一步设计出3D打印相应个体化导向器。
综上,本研究提示改良3D打印个体化导向器辅助人工全膝关节置换术的假体型号规划可靠,经医师调整后的规划一致性更高。医工结合的规划模式可以增加规划精确性,简化手术步骤,更好地指导医师手术操作。
利益冲突声明 本文所有作者与关节假体厂家无相关利益冲突
| [1] |
BERGER R A, ROSENBERG A G, BARDEN R M, et al. Long-term followup of the Miller-Galante total knee replacement[J]. Clin Orthop Relat Res, 2001(388): 58-67. |
| [2] |
INSALL J N, BINAZZI R, SOUDRY M, et al. Total knee arthroplasty[J]. Clin Orthop Relat Res, 1985, 192: 13-22. |
| [3] |
RITTER M A, KEATING E M, SUEYOSHI T, et al. Twenty-five-years and greater, results after nonmodular cemented total knee arthroplasty[J]. J Arthroplasty, 2016, 31(10): 2199-2202. |
| [4] |
ARNHOLT C M, MACDONALD D W, MALKANI A L, et al. Corrosion damage and wear mechanisms in long-term retrieved CoCr femoral components for total knee arthroplasty[J]. J Arthroplasty, 2016, 31(12): 2900-2906. |
| [5] |
杨滨, 袁亮, 张克, 等. 新型改良3D打印个体化导向器辅助全膝关节置换术的精准度研究[J]. 中华骨科杂志, 2021, 41(2): 67-75. YANG B, YUAN L, ZHANG K, et al. The accuracy of bony resection and component size planning of total knee arthroplasty assisted with a novel designed patient-specific instrumentation[J]. Chin J Orthop, 2021, 41(2): 67-75. |
| [6] |
NOBLE J W Jr, MOORE C A, LIU N. The value of patient-matched instrumentation in total knee arthroplasty[J]. J Arthroplasty, 2012, 27(1): 153-155. |
| [7] |
PIETSCH M, DJAHANI O, ZWEIGER C, et al. Custom-fit minimally invasive total knee arthroplasty: effect on blood loss and early clinical outcomes[J]. Knee Surg Sports Traumatol Arthrosc, 2013, 21(10): 2234-2240. |
| [8] |
CUCCHI D, MENON A, COMPAGNONI R, et al. Significant differences between manufacturer and surgeon in the accuracy of final component size prediction with CT-based patient-specific instrumentation for total knee arthroplasty[J]. Knee Surg Sports Traumatol Arthrosc, 2018, 26(11): 3317-3324. |
| [9] |
ISSA K, RIFAI A, MCGRATH M S, et al. Reliability of templating with patient-specific instrumentation in total knee arthroplasty[J]. J Knee Surg, 2013, 26(6): 429-433. |
| [10] |
SCHOTANUS M G M, SCHOENMAKERS D A L, SOLLIE R, et al. Patient-specific instruments for total knee arthroplasty can accurately predict the component size as used peroperative[J]. Knee Surg Sports Traumatol Arthrosc, 2017, 25(12): 3844-3848. |
| [11] |
GONG S, XU W H, WANG R Y, et al. Patient-specific instrumentation improved axial alignment of the femoral component, operative time and perioperative blood loss after total knee arthroplasty[J]. Knee Surg Sports Traumatol Arthrosc, 2019, 27(4): 1083-1095. |
| [12] |
IVIE C B, PROBST P J, BAL A K, et al. Improved radiographic outcomes with patient-specific total knee arthroplasty[J]. J Arthroplasty, 2014, 29(11): 2100-2103. |
| [13] |
HEYSE T J, TIBESKU C O. Improved femoral component rotation in TKA using patient-specific instrumentation[J]. Knee, 2014, 21(1): 268-271. |
| [14] |
HEYSE T J, TIBESKU C O. Improved tibial component rotation in TKA using patient-specific instrumentation[J]. Arch Orthop Trauma Surg, 2015, 135(5): 697-701. |
| [15] |
KE S, RAN T F, HE Y Q, et al. Does patient-specific instrumentation increase the risk of notching in the anterior femoral cortex in total knee arthroplasty? A comparative prospective trial[J]. Int Orthop, 2020, 44(12): 2603-2611. |
| [16] |
CHAREANCHOLVANICH K, NARKBUNNAM R, PORN-RATTANAMANEEWONG C. A prospective randomised controlled study of patient-specific cutting guides compared with conventional instrumentation in total knee replacement[J]. Bone Joint J, 2013, 95-B(3): 354-359. |
| [17] |
NUNLEY R M, ELLISON B S, ZHU J J, et al. Do patient-specific guides improve coronal alignment in total knee arthroplasty?[J]. Clin Orthop Relat Res, 2012, 470(3): 895-902. |
| [18] |
ZOMAR B O, VASARHELYI E M, SOMERVILLE L E, et al. A randomized trial investigating the cost-utility of patient-specific instrumentation in total knee arthroplasty in an obese population[J]. J Arthroplasty, 2021, 36(9): 3078-3088. |
| [19] |
CHRISTEN B, TANNER L, ETTINGER M, et al. Comparative cost analysis of four different computer-assisted technologies to implant a total knee arthroplasty over conventional instrumentation[J]. J Pers Med, 2022, 12(2): 184. |
| [20] |
ATTARD A, TAWY G F, SIMONS M, et al. Health costs and efficiencies of patient-specific and single-use instrumentation in total knee arthroplasty: a randomised controlled trial[J]. BMJ Open Qual, 2019, 8(2): e000493. |
| [21] |
KOSSE N M, HEESTERBEEK P J C, SCHIMMEL J J P, et al. Stability and alignment do not improve by using patient-specific instrumentation in total knee arthroplasty: a randomized controlled trial[J]. Knee Surg Sports Traumatol Arthrosc, 2018, 26(6): 1792-1799. |
| [22] |
VAN LEEUWEN J A M J, SNORRASON F, RÖHRL S M. No radiological and clinical advantages with patient-specific positioning guides in total knee replacement[J]. Acta Orthop, 2018, 89(1): 89-94. |
| [23] |
NUNLEY R M, ELLISON B S, RUH E L, et al. Are patient-specific cutting blocks cost-effective for total knee arthroplasty?[J]. Clin Orthop Relat Res, 2012, 470(3): 889-894. |
| [24] |
YAMAMURA K, MINODA Y, SUGAMA R, et al. Design improvement in patient-specific instrumentation for total knee arthroplasty improved the accuracy of the tibial prosthetic alignment in the coronal and axial planes[J]. Knee Surg Sports Traumatol Arthrosc, 2020, 28(5): 1560-1567. |




