2. 400038 重庆,陆军军医大学(第三军医大学)基础医学院:大队15队;
3. 400042 重庆,陆军特色医学中心骨科
2. Squadron 15, Battalion 5, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Orthopedics, Army Medical Center of PLA, Chongqing, 400042, China
协调机体处于适宜的觉醒状态,对保证运动行为的精确发生具有重要意义[1]。近年研究发现:腹内侧丘脑(ventromedial thalamus,VM)可能是协调觉醒水平与运动发生的关键神经结构。一方面,VM神经元可以向前外侧运动皮层发出兴奋性投射,影响运动皮层神经元的持续放电活动,进而参与运动准备[2]和启动[3]。另一方面,VM神经元还可以投射至大脑皮层的广泛区域,调控大脑皮层浅层神经元的兴奋活动[4-5],提升机体的觉醒水平[6]。此外,VM神经元接受内侧前额叶皮层、运动皮层、纹状体和小脑等的信号输入[2, 7-8]。因此,VM处于一个有利的解剖学位置,使其能够整合机体运动和本体感觉等信息,进而通过轴突支配来协调觉醒水平与运动发生。尽管现有证据表明,VM具有促进觉醒的作用,但VM神经元在不同脑功能状态(如觉醒和睡眠)下的活动特征目前仍不完全清楚。探索这一问题将为揭示VM是如何整合信息并参与觉醒状态调控提供基本认识。由于VM形状细长、所处位置较深,准确记录大量VM神经元在觉醒-睡眠过程中的活动比较困难[6]。在前期精确定位小鼠VM的基础上[9],本研究拟将可推进微电极阵列植入VM,以连续监测该区域神经元的放电活动,并比较其与腹外侧丘脑(ventrolateral thalamus,VL)区神经元在不同觉醒-睡眠脑状态及其相互转换过程中的活动差异。
1 材料与方法 1.1 实验动物采用雄性、3月龄C57/BL6野生型小鼠4只,体质量20~25 g [购于重庆恩斯维尔生物科技有限公司,SYXK(渝)2017-0002]。在手术前适应、术后恢复以及记录实验期间,小鼠被置于光照∶黑暗为12 h ∶12 h、温度20~25 ℃的单笼标准饲养环境中。所有实验操作符合陆军军医大学动物福利伦理审查指南要求。
1.2 微电极阵列制作剪取一段绝缘后直径25 μm、长约25 cm的钨丝(California Fine Wire,美国)。钨丝对折之后,夹住两端并对称挂于铁架台上。对折使钨丝变成4股垂直于实验桌面,其下端悬挂一根铁质磁力搅棒。利用磁力使搅棒旋转,转速500 r/min。用热风枪固定形成4股螺旋状的钨丝tetrode电极。每组tetrode具有4个通道(Ch1~4)。将制备好的4组tetrode电极依次穿入平行排列的石英管(Polymicro Technologies,美国)。每组tetrode电极间距160 μm。而后各组tetrode电极连接微推进器和Omnetics电信号接头。
1.3 微电极阵列植入手术将小鼠放入麻醉诱导盒中,使用1%~1.5%异氟烷麻醉小鼠。在麻醉诱导成功后,将小鼠头部固定于脑立体定位仪上。调节异氟烷浓度使小鼠的呼吸频率控制在60~90次/min。调整颅骨水平,测量左、右对称位置高度,使二者高度差 < 100 μm;测量前、后囟高度差,使二者高度差 < 200 μm。在双侧小脑上方对称位置,钻2个圆形小孔,植入2颗不锈钢螺丝,分别作为地线与参考连接电极连接位点。在右侧顶叶颅骨,植入1颗不锈钢螺丝(坐标,前囟后:1.9 mm,旁开:1.7 mm),以记录皮层脑电活动。根据小鼠脑定位图谱,在左侧丘脑上方植入由4组tetrode钨丝电极所组成的阵列,坐标如下:①VM区,前囟后1.6 mm、旁开0.3 mm、初始植入深度3.9 mm;②VL区,前囟后1.6 mm、旁开0.7 mm、初始植入深度3.9 mm。术后小鼠恢复5~7 d,待体质量成功恢复标准即术前水平后,再开始进行适应和电生理记录。
1.4 电生理信号记录手术恢复后对小鼠进行记录环境和操作流程适应训练,共2 d。在此期间,通过微推进器将阵列电极尖端以70~105 μm/d的速度缓慢向VM或VL区域推进,直到可以稳定记录到VM或VL区神经元的放电活动。用RHD2 000(Intan Technologies,美国)神经数据采集器、以20 kHz采样频率对VM或VL神经元单位放电信号、右侧顶叶脑电信号进行采样。电生理信号通过Neuro scope软件实时监测。电生理记录均在当日10:00~14:00开展。每次记录时间至少2.5 h。每只小鼠记录2~3次。每次记录结束后,微电极阵列需推进70~105 μm,以便在下一记录日能够记录到新的VM或VL神经元。
1.5 大脑觉醒-睡眠状态判定利用顶叶皮层的脑电活动和头颈部三维加速度来反映小鼠的大脑觉醒-睡眠状态。定义标准如下:①觉醒(wakefulness,Wake):顶叶皮层呈现明显的theta频带(5~10 Hz)振荡,且小鼠头颈部三维加速度明显增加,持续时间>10 s。②非快速动眼(non-rapid eye movement,NREM)睡眠:顶叶皮层呈现高振幅、低频(1~4 Hz)振荡活动,且小鼠头颈部无明显的三维加速现象,状态持续时间>10 s。③快速动眼(rapid eye movement,REM)睡眠:顶叶皮层呈现明显theta频带(5~10 Hz)振荡,但小鼠无头颈部三维加速现象,且持续时间>10 s。
1.6 峰电位甄选离线情况下对记录到的原始数据进行带通滤波(0.8~6.0 kHz)处理。使用KlustaKwik软件对每组tetrode电极上所采集到的单位放电信号进行自动甄选并归为不同特征的峰电位集群。再通过Klusters软件进行手动判别和甄选,筛除KlustaKwik软件在自动甄选过程中误判的噪声(表现为不典型的动作电位波形),最终获得高信度的VM或VL神经元峰电位信号。
1.7 记录位点验证在全部记录实验完成之后,利用直流电(总时程:10 s,强度:30 μA)损毁记录电极尖端处脑组织。损毁48 h后,给小鼠腹腔注射致死剂量的戊巴比妥钠(注射量:0.4 mL,浓度:3%)。再经心脏灌注生理盐水和4%多聚甲醛溶液各100 mL。将剥离后的脑组织置于4%多聚甲醛溶液中固定12 h,然后再转移至30%蔗糖溶液中脱水24 h。使用冰冻切片机(CM1900,Leica,德国),将脱水后的脑组织制成50 μm厚的冠状切片。经DAPI染色后,在荧光显微镜(BX53,Olympus,日本)下观察电极尖端的位置。只有损毁位点明确在VM或VL区小鼠的生理记录信号数据才可以被纳入数据的统计和分析。
1.8 数据分析将甄选出的VM和VL神经元放电峰电位,按照小鼠脑功能状态进行分类,分别计算VM和VL神经元在不同脑功能状态下的平均放电频率,以及在不同状态转换时的放电频率变化。此外,每个VM和VL神经元的Wake-NREM调控指数由如下公式算得:(Wake状态下平均放电频率-NREM睡眠状态下平均放电频率)/(Wake状态下平均放电频率+NREM睡眠状态下平均放电频率)。每个VM和VL神经元的REM-NREM调制指数则由如下公式算得:(REM睡眠状态下平均放电频率-NREM睡眠状态下平均放电频率)/(REM睡眠状态下平均放电频率+NREM睡眠状态下平均放电频率)。
1.9 统计学分析数据以x±s表示,使用SPSS 13.0软件进行统计分析。VM和VL区神经元平均放电频率以及峰电位谷-峰宽度的比较采用独立样本t检验。同一神经元在不同大脑活动状态下的平均放电频率比较采用配对样本t检验。脑状态转换时不同放电模式神经元比例分布比较采用Pearson χ2检验。P < 0.05为差异具有统计学意义。
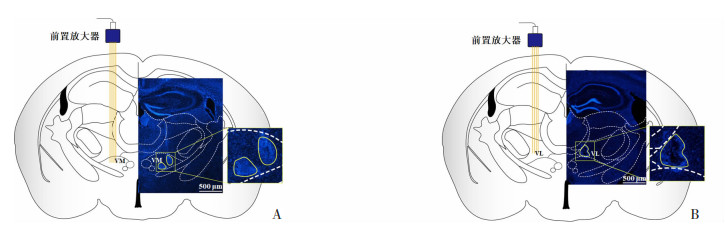
2 结果 2.1 小鼠腹侧丘脑区神经元的在体电生理记录和特性区分为了确定VM神经元在觉醒-睡眠周期中的放电活动特征及其变化,将微电极阵列植入到小鼠腹侧丘脑。所有电生理记录完成后的组织学鉴定结果显示:在2只小鼠中,微电极阵列准确植入到VM区,见图 1A。而在另外2只小鼠中,微电极阵列植入到VL区域,见图 1B。本实验的在体微电极多通道记录均在日间时相开展,每次记录的平均时间为(168.2±18.8)min。
|
| A:VM区域;B:VL区域 黄色实线:示4组tetrode电极;虚线:示不同脑区的分界 图 1 小鼠VM和VL区在体tetrode电极记录位点的组织学鉴定(DAPI染色× 200) |
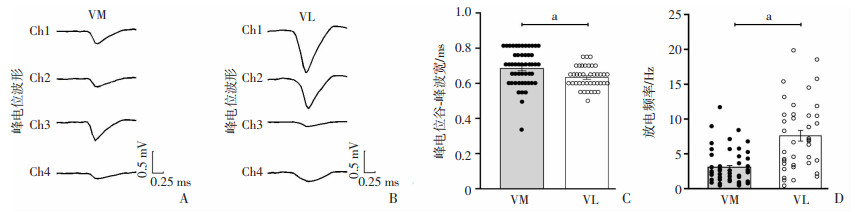
进一步对小鼠VM和VL神经元的电生理学特点进行研究。实验共记录和甄选出50个VM神经元和40个VL神经元的单位放电活动。结果显示:VM神经元和VL神经元峰电位的谷-峰波宽均较宽,前者波宽为(0.68±0.01) ms(n=50),见图 2A,后者波宽为(0.63±0.01) ms(n=40),见图 2B。统计学分析显示:VM神经元峰电位的谷-峰波宽较VL神经元更宽(t=1.975,P=0.004),见图 2C。此外,VM神经元的平均放电频率为(2.98±0.36)Hz,VL神经元平均放电频率为(7.58±0.79) Hz。统计学分析显示,VM神经元的放电频率显著低于VL神经元(t=-5.721,P < 0.01),见图 2D。以上实验结果表明,VM和VL神经元具有不同的在体电生理学特性。
|
| A:Tetrode电极记录的代表性VM神经元单位发放的峰电位波形(Ch1~4,通道1~4);B:Tetrode电极记录的代表性VL神经元单位发放的峰电位波形(Ch1~4,通道1~4);C:VM神经元(n=50)与VL神经元(n=40)峰电位谷-峰波宽的比较;D:VM神经元(n=50)与VL神经元(n=40)平均放电频率的比较 a:P < 0.01 图 2 小鼠VM和VL区神经元在体电生理学特性比较 |
2.2 小鼠VM和VL神经元在不同脑功能状态下的放电活动特征
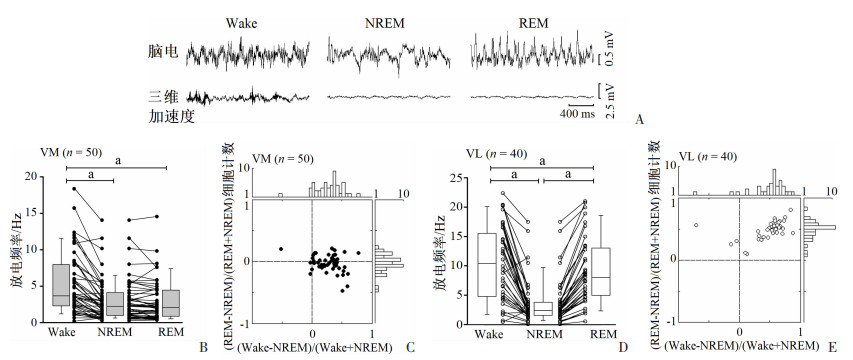
研究进一步对小鼠VM神经元在觉醒-睡眠等不同大脑功能状态下的活动进行分析。根据小鼠顶叶皮层脑电振荡的频率状态及其头颈部三维加速情况,可对觉醒和睡眠状态进行判别。如图 3所示:觉醒状态时,小鼠顶叶皮层会呈现出theta频带(5~10 Hz)的振荡,且头颈部三维加速度明显增加。当处于NREM睡眠状态时,小鼠顶叶皮层呈现高振幅、低频(0.5~4.5 Hz)振荡活动,但头颈部无明显的三维加速现象。REM睡眠状态时,小鼠顶叶皮层呈现明显的theta频带(5~10 Hz)振荡,但无头颈部三维加速现象,见图 3A。统计学结果显示:VM神经元在觉醒状态下的放电频率[(4.13±0.47) Hz]显著高于NREM睡眠期[(2.46±0.34)Hz,t=7.541,P < 0.01]和REM睡眠期[(2.35±0.32)Hz,t=7.917,P < 0.01],见图 3B。觉醒状态下的放电频率高于NREM和REM睡眠期的VM神经元数量占记录到VM神经元总数的94%(47/50),6%的VM神经元未表现出这种特性。VM神经元在NREM和REM睡眠期间的放电频率差异则无统计学意义(t=-1.172,P=0.246)。VM神经元的Wake-NREM调制指数(FWake-FNREM)/(FWake+ FNREM)和REM-NREM调制指数(FREM-FNREM)/(FREM+FNREM)(F是神经元在某状态下的平均发放频率)分析显示:VM神经元Wake-NREM调制指数呈以0.28为平均重心的单峰分布,与觉醒状态相对应。而REM-NREM调制指数则呈以0为平均重心的分布,表明其与REM睡眠不相关(图 3C)。以上结果提示:VM神经元的放电活动与觉醒状态相关。
|
| A:觉醒、NREM睡眠和REM睡眠状态的区分;B:3种脑功能状态下VM神经元放电频率的比较(x±s) a:P < 0.01;C:VM神经元Wake-NREM和REM-NREM调制指数分布;D:3种脑功能状态下VL神经元放电频率的比较(x±s) a:P < 0.01;E:VL神经元的Wake-NREM和REM-NREM调制指数分布 图 3 小鼠VM和VL区神经元在不同脑状态下放电活动的比较 |
与VM神经元不同,VL神经元放电频率在觉醒状态[(10.42±1.03) Hz,t=8.570,P < 0.01]和REM睡眠期[(8.95±0.89) Hz,t=11.279,P < 0.01]均高于NREM睡眠期[(3.68±0.62)Hz],见图 3D。觉醒状态下的放电频率高于NREM睡眠期的VL神经元数量占记录到VL神经元总数的92.5%(37/40),7.5%的VL神经元未表现出这种特性。VL神经元的Wake-NREM调制指数(FWake-FNREM)/(FWake+FNREM)和REM-NREM调制指数(FREM-FNREM)/(FREM+FNREM)分析显示,VL神经元Wake-NREM调制指数呈以0.51为平均重心的单峰分布,而REM-NREM调制指数则呈以0.49为平均重心的单峰分布(图 3E)。以上结果提示:不同于VM神经元,VL神经元的放电活动可能与觉醒和REM睡眠两种状态均相关。
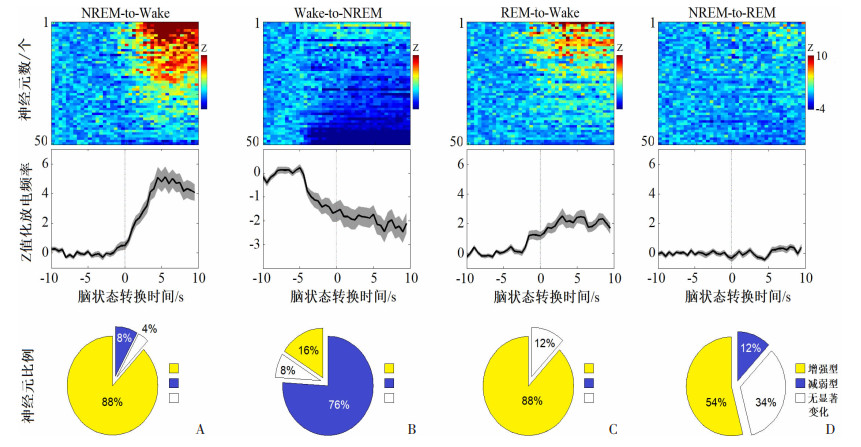
2.3 小鼠VM和VL神经元在不同脑功能状态转换过程中的放电活动变化研究进一步探究VM神经元是否会在大脑状态转换过程中发生活动变化。如图 4A所示,在从NREM睡眠向觉醒状态的转换过程中,88%(n=44)的VM神经元表现出放电频率的显著增加(t=-7.971,P < 0.01)。当从觉醒向NREM睡眠转换时,76%的VM神经元表现出放电频率显著降低(t=4.934,P < 0.01),见图 4B。当由REM睡眠向觉醒状态转换时,VM神经元放电活动也会显著增强(t=6.742,P < 0.01),见图 4C。其中,发放频率增强的细胞占总数的88%。但在从NREM睡眠向REM睡眠转换的过程中,VM神经元的放电活动无明显的变化(t=-0.901,P=0.372),见图 4D。
|
| A:NREM睡眠向觉醒转换时VM神经元放电活动的变化及其类型和比例;B:觉醒向NREM睡眠转换时VM神经元放电活动的变化及其类型和比例;C:REM睡眠向觉醒转换时VM神经元放电活动的变化及其类型和比例;D:NREM睡眠向REM睡眠转换时VM神经元放电活动的变化及其类型和比例 图 4 小鼠VM区神经元在不同脑功能状态转换时的放电活动变化(n=50) |
研究还对VL神经元在觉醒-睡眠转换过程中的活动变化进行了分析。结果显示:在从NREM睡眠向觉醒状态转换过程中,88%的VL神经元表现出放电频率显著增加(t=-6.153,P < 0.01),见图 5A。当从觉醒状态向NREM睡眠转换时,94%VM神经元表现出放电频率显著降低(t=9.429,P < 0.01),见图 5B。在从NREM睡眠向REM睡眠的转换过程中,VL神经元的放电活动显著增强(t=-5.928,P < 0.01),见图 5D。而当由REM睡眠向觉醒状态转换时,VL神经元放电活动则无明显的变化(t=-1.559,P=0.126),见图 5C。
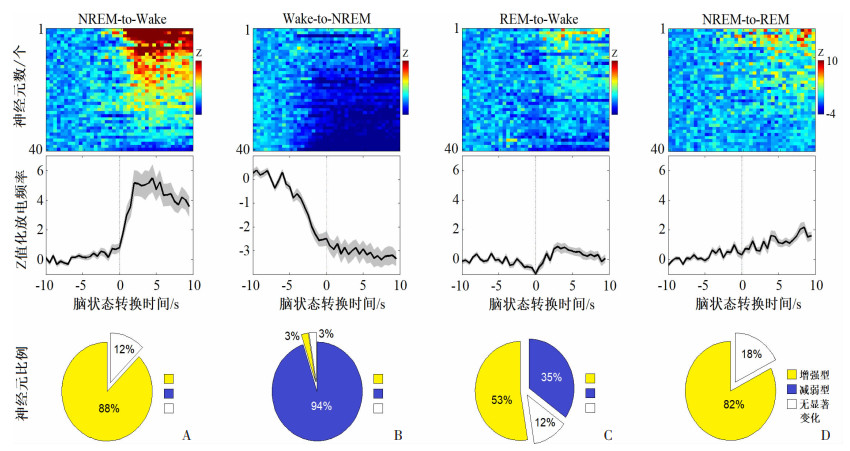
|
| A:NREM睡眠向觉醒转换时VL神经元放电活动的变化及其类型和比例;B:觉醒向NREM睡眠转换时VL神经元放电活动的变化及其类型和比例;C:REM睡眠向觉醒转换时VL神经元放电活动的变化及其类型和比例;D:NREM睡眠向REM睡眠转换时VL神经元放电活动的变化及其类型和比例 图 5 小鼠VL区神经元在不同脑功能状态转换时的放电活动变化(n=40) |
3 讨论
为确定VM参与机体状态调控的细胞活动机制,首先必须了解VM神经元在诸如觉醒-睡眠过程中的放电活动特征。为此,本研究利用在体多通道记录技术,观察VM神经元在小鼠觉醒-睡眠周期中的放电活动,结果发现:VM神经元在觉醒状态下的放电活动最强,而在NREM与REM睡眠状态下的放电活动无显著差异。在NREM睡眠与觉醒状态转换的过程中,VM神经元具有显著的放电活动变化。VM神经元在觉醒-睡眠周期及其转换过程中的活动特征与VL神经元不同。
本研究结果显示:小鼠VM神经元的放电活动与觉醒状态密切相关。此外,VM神经元在从NREM睡眠向觉醒转换的过程中放电活动显著增加,而在从觉醒向NREM睡眠转换的过程中放电活动显著降低。近年研究报道,刺激VM神经元可以促进NREM睡眠向觉醒转换[6],结合本研究结果表明:VM可能具有促进觉醒的功能。由于VM神经元还可投射支配前外侧运动皮层参与运动发起[2-3],故其可能是协调觉醒与运动发生的关键神经结构,发挥协调觉醒水平与运动发生相适应的作用。
那么,VM又是如何调节觉醒状态的呢?前已述及,VM神经元可广泛投射并支配大脑皮层浅层[4]。进一步的研究则发现,VM神经元与大脑皮层中的锥体细胞和中间神经元建立特异性的突触联系[5]。本课题组前期的工作发现:刺激VM神经元可以增强以扣带皮层为代表的大脑皮层神经元的兴奋性[9]。综上表明,VM可以通过调控广泛大脑皮层浅层神经元的兴奋性来调控觉醒状态。作为上游信号输入结构,前额叶皮层、运动皮层、纹状体和小脑等则可分别将运动信息、本体感觉和痛觉等信息传入VM[2, 7-8]。因此,VM可能整合上述信息,进而影响大脑皮层神经元的兴奋性,参与觉醒状态的调控。今后需要进一步探索VM神经元的觉醒相关放电活动又是如何被运动皮层、小脑皮层等区信号输入所调控。
一直以来,VL被认为是联系低位运动中枢(如脑干和脊髓)与运动皮层的纽带[10]。VL神经元的放电活动与运动计划、动作行为密切相关[11]。本研究发现:VM与VL神经元在觉醒-睡眠周期中的活动模式不同。前者与中线丘脑相类似,低频放电活动仅与觉醒相关。而后者的高频放电活动则是与觉醒和REM睡眠两种状态均相关。近年有研究发现,刺激小脑投射至VM和VL的末梢,产生的兴奋效应也不同[12]。因此,尽管均是位于腹侧丘脑,VM和VL在功能以及电生理特性上存在较大的区别。今后的研究需关注这些区别与哪些生理功能相对应。
本研究表明:在生理条件下,VM神经元具有与觉醒相关的放电活动。结合既往研究发现,小脑功能异常的患者或动物表现出觉醒减少、睡眠增多的现象[13-16],以及小脑可整合多种信息并传递至VM的解剖学特点[7],故在今后有必要确定小脑-VM通路是否在觉醒状态的调控过程中发挥作用。所得结果可能对拓展关于小脑非运动功能的新认识有重要意义。
| [1] |
LIU D Q, DAN Y. A motor theory of sleep-wake control: arousal-action circuit[J]. Annu Rev Neurosci, 2019, 42: 27-46. |
| [2] |
GUOZ V, INAGAKI H K, DAIE K, et al. Maintenance of persistent activity in a frontal thalamocortical loop[J]. Nature, 2017, 545(7653): 181-186. |
| [3] |
TAKAHASHI N, MOBERG S, ZOLNIKT A, et al. Thalamic input to motor cortex facilitates goal-directed action initiation[J]. Curr Biol, 2021, 31(18): 4148-4155. |
| [4] |
KURAMOTO E, OHNO S, FURUTA T, et al. Ventral medial nucleus neurons send thalamocortical afferents more widely and more preferentially to layer 1 than neurons of the ventral anterior-ventral lateral nuclear complex in the rat[J]. Cereb Cortex, 2015, 25(1): 221-235. |
| [5] |
GUO K H, YAMAWAKI N, SVOBODA K, et al. Anterolateral motor cortex connects with a medial subdivision of ventromedial thalamus through cell type-specific circuits, forming an excitatory thalamo-cortico-thalamic loop via layer 1 apical tuft dendrites of layer 5B pyramidal tract type neurons[J]. J Neurosci, 2018, 38(41): 8787-8797. |
| [6] |
HONJOH S, SASAI S, SCHIERECKS S, et al. Regulation of cortical activity and arousal by the matrix cells of the ventromedial thalamic nucleus[J]. Nat Commun, 2018, 9(1): 2100. |
| [7] |
KEBSCHULLJ M, RICHMAN E B, RINGACH N, et al. Cerebellar nuclei evolved by repeatedly duplicating a conserved cell-type set[J]. Science, 2020, 370(6523): eabd5059. |
| [8] |
TANAKAY H, TANAKA Y R, KONDO M, et al. Thalamocortical axonal activity in motor cortex exhibits layer-specific dynamics during motor learning[J]. Neuron, 2018, 100(1): 244-258. |
| [9] |
ZHANG J, CHEN H, ZHANGL B, et al. Ventromedial thalamus-projecting DCN neurons modulate associative sensorimotor responses in mice[J]. Neurosci Bull, 2022, 2022J. |
| [10] |
SCHÄFER C B, GAO Z Y, DE ZEEUW C I, et al. Temporal dynamics of the cerebello-cortical convergence in ventro-lateral motor thalamus[J]. J Physiol, 2021, 599(7): 2055-2073. |
| [11] |
GAO Z Y, DAVIS C, THOMAS A M, et al. A cortico-cerebellar loop for motor planning[J]. Nature, 2018, 563(7729): 113-116. |
| [12] |
GORNATIS V, SCHÄFER C B, EELKMAN ROODA O H J, et al. Differentiating cerebellar impact on thalamic nuclei[J]. Cell Rep, 2018, 23(9): 2690-2704. |
| [13] |
DESSEILLES M, DANG-VU T, SCHABUS M, et al. Neuroimaging insights into the pathophysiology of sleep disorders[J]. Sleep, 2008, 31(6): 777-794. |
| [14] |
JOOE Y, NOH H J, KIM J S, et al. Brain gray matter deficits in patients with chronic primary insomnia[J]. Sleep, 2013, 36(7): 999-1007. |
| [15] |
PEDROSOJ L, BRAGA-NETO P, ESCORCIO-BEZERRA M L, et al. Non-motor and extracerebellar features in spinocerebellar Ataxia type 2[J]. Cerebellum, 2017, 16(1): 34-39. |
| [16] |
YUAN X Q, OU R W, HOU Y B, et al. Extra-cerebellar signs and non-motor features in Chinese patients with spinocerebellar Ataxia type 3[J]. Front Neurol, 2019, 10: 110. |




