2. 400037 重庆,陆军军医大学(第三军医大学)第二附属医院消化内科;
3. 637000 四川 南充,川北医学院:附属医院消化内科
2. Department of Gastroenterology, Second Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400037, China;
3. Department of Gastroenterology, Affiliated Hospital, North Sichuan Medical College, Nanchong, Sichuan Province, 637000
已有研究表明肠道菌群失调与胆汁淤积性肝病(cholestatic liver diseases, CLD)密切相关[1-4],但现有研究多集中在细菌方面[5-6]。肠道真菌是肠道菌群的重要组成部分,与细菌菌群一样,真菌菌群在疾病状态下也经常发生改变[7]。肝脏和肠道经胆管、门静脉和体循环进行双向交流[8],肠道真菌失调可能通过肠-肝轴引起肝脏的炎症性疾病[9]。已有研究发现肝硬化患者存在肠道真菌菌群失调[10],且肠道真菌菌群失调可促进酒精性肝病(alcohol-associated liver disease, ALD) [11-13]。目前关于胆汁淤积性肝病患者中肠道真菌的研究尚无报道,故本研究通过研究胆汁淤积性肝病患者和健康对照人群的肠道真菌菌群构成,寻找胆汁淤积性肝病患者肠道真菌中的生物标记,为临床诊疗提供理论和实验依据。
1 材料与方法 1.1 研究对象收集在陆军军医大学第二附属医院消化内科就诊的20名胆汁淤积性肝病的患者,以2009年《欧洲肝病学会临床实践指南:胆汁淤积性肝病的治疗》为诊断依据;并招募了与其年龄性别相匹配的22名健康对照人群。排除标准:近14 d有抗生素或微生态制剂服用史;合并其他慢性性疾病的患者,如病毒性肝炎、糖尿病、甲亢等;胃肠道手术史患者;妊娠期或哺乳期者;有严重原发性疾病及精神疾病等无法配合者;不愿参与者。本临床研究方案经中国人民解放军陆军军医大学第二附属医院医学伦理委员会批准(伦理审查编号:2022-研第010-01)。所有受试者提供书面知情同意。
1.2 临床数据的收集通过查阅病历收集临床数据。记录以下数据:身高,体重,吸烟史、喝酒史,家族史,糖尿病高血压史。对于健康人群,在收集粪便时进行血清学肝功能检查,包括谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)、碱性磷酸酶(alkaline phosphatase, ALP)、γ-谷氨酰转移酶(gamma-glutamyl transpeptidase, GGT)、血清总胆红素(total bilirubin, TBIL)和直接胆红素(direct bilirubin, DBIL)。
1.3 粪便收集和DNA提取将新鲜粪便收集在无菌采样管中,立即送至实验室并将其等份分装到1.5 mL无菌EP管中;液氮速冻后保存于-80 ℃。采用CTAB/SDS法提取样本的总基因组DNA。在1%琼脂糖凝胶上监测DNA的浓度和纯度。根据浓度,用无菌水将DNA稀释至1 μg/μL。
1.4 ITS2 DNA测序采用特异性ITS2引物扩增ITS基因,改良的Illumina宏基因组学方案[14]。在Qubit@2.0 Fluorometer (Thermo Scientific) 和Agilent Bioanalyzer 2100 system上进行评估文库质量。
1.5 ITS2序列分析使用QIIME V.1.9.1软件包对序列进行质量过滤。在99%相似度下聚类得到操作分类单元(operational taxonomic units, OTU)并去除嵌合体序列。使用UNITE ITS数据库对真菌进行分类。
1.6 统计分析患者性别、吸烟、饮酒、糖尿病、高血压表示为n(%),其他特征表示为中位数(最小值-最大值),使用Mann-Whitney U检验或χ2检验进行比较。采用GraphPad Prism 8.3.0制作和分析图表。通过Shannon指数、Simpson指数和Chao1指数来评估Alpha多样性。Beta多样性由Bray-Curtis距离矩阵测量,并用于构建主坐标分析图。使用Wilcox秩和检验和非配对的t检验比较组间群落差异。使用Spearman相关系数进行肠道菌群与临床参数间相关性分析。在所有统计分析中,P < 0.05认为存在显著差异。
2 结果 2.1 研究人群的特征研究人群包括:胆汁淤积性肝病患者20名(男性10名,女性10名)和健康对照人群22名(男性11名,女性11名)。两组的年龄,性别构成,BMI,吸烟、饮酒情况,糖尿病史,高血压史均无统计学差异(P>0.05);临床血清学指标均有统计学差异(P < 0.01)。见表 1。
| 组别 | n | 年龄/岁 | 男/女 | BMI/kg·m-2 | 吸烟n(%) | 饮酒n(%) | 糖尿病n(%) | 高血压n(%) |
| 胆汁淤积性肝病患者 | 20 | 49(28~72) | 10/10 | 24.5(17.0~29.3) | 11(55.0) | 12(60.0) | 5(25.0) | 7(35.0) |
| 健康受试者 | 22 | 46.5(24~69) | 11/11 | 24.8(17.0~33.1) | 6(28.0) | 9(40.9) | 1(4.5) | 3(13.6) |
| P值 | 0.1259 | >0.9999 | 0.4025 | 0.0675 | 0.2165 | 0.0585 | 0.1045 | |
| 组别 | ALT/U.L-1 | AST/U.L-1 | ALP/U.L-1 | GGT/U.L-1 | TBIL/μmol.L-1 | DBIL/μmol.L-1 | ||
| 胆汁淤积性肝病患者 | 348.4(27.4~1 217.0) | 132.7(33.0~1 475.0) | 172.9(89.7~761.4) | 215.0(123.1~2 299.0) | 73.7(19.8~564.4) | 29.9(5.6~328.9) | ||
| 健康受试者 | 17.4(10.7~37.6) | 19.3(11.8~28.8) | 68.0(31.8~99.5) | 18.25(10.4~66.3) | 11.1(5.8~47.3) | 2.4(0.7~5.4) | ||
| P值 | < 0.000 1 | 0.003 7 | 0.000 5 | 0.003 5 | 0.002 4 | 0.004 4 | ||
| 中位数(最小值-最大值);BMI,体重指数;ALT,谷丙转氨酶;AST,谷草转氨酶;ALP,碱性磷酸酶;GGT,γ-谷氨酰转移酶;TBIL,总胆红素;DBIL,直接胆红素 | ||||||||
2.2 组间肠道真菌菌群差异分析 2.2.1 多样性分析
从42例样本中过滤低质量和短长度后共获得3 079 314条近全长18s rRNA序列,平均每个样本73 317条,其中病例组共得到1 467 931条,对照组1 611 383条。以99%的序列相似性聚类得到3 252 OTUs。通过Bray-Curtis距离算法的主坐标分析(Principal co-ordinates analysis, PCoA) 评估Beta多样性,使用Anosim非参数检验显示对照组与病例组之间的Beta多样性具有统计学差异(P < 0.01)(图 1A)。采用Shannon(反映样本分类总数及其占比)指数、Simpson(表征物种分布的多样性和均匀度)指数和Chao1(估计样本中的物种总数)指数评估Alpha多样性;分析表明两组间的差异没有统计学意义(图 1B~D)。
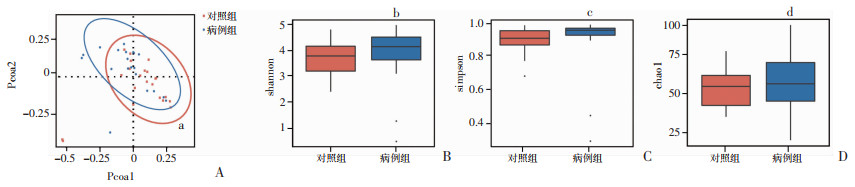
|
| A:通过Bray-Curtis距离算法的主坐标分析评估Beta多样性;B:Shannon指数;C:Simpson指数;D:Chao1指数 a:P < 0.01,b:P=0.16,c:P=0.06,d:P=0.44,与对照组比较 图 1 胆汁淤积性肝病患者与健康受试者肠道真菌菌群多样性分析 |
2.2.2 结构分析
在门水平上,两组肠道真菌均以Ascomycota (子囊菌门)和Basidiomycota(担子菌门)为主(图 2A、B)。为进一步探讨两组菌群构成的差异,分析了属水平上丰度前15个优势菌属,依次是Candida(假丝酵母属)、Diutina、Eurotium(散囊菌属)、Phlogicylindrium、Blumeria(布氏白粉菌属)、Humicola(腐质霉属)、Trichoderma(木霉属)、Wickerhamomyces(威克汉姆酵母属)、Apiotrichum、Issatchenkia(伊萨酵母属)、Lysurus(散尾鬼笔属)、Myceliophthora(嗜热毁丝霉属)、Vermiculariopsiella、Gibberella(赤霉属)、Aspergillus(曲霉属);其中Diutina在对照组中相对丰度高,与病例组比较具有统计学差异(P < 0.01)。有意思的是,本研究发现Myceliophthora有且仅存在于病例组中,且与对照组相比有统计学差异(P < 0.01)。肠道中的Candida常被认为是肠道主要的条件致病真菌,虽然在本项研究中两组间Candida的丰度无统计学差异(P=0.089),但是病例组中Candida的相对丰度有明显增加的趋势(图 2C、D)。为了进一步确定组间差异显著的物种,本研究进行了线性判别分析(linear discriminant analysis effect size, LEfSe)来寻找具有显著差异的生物标志物。基于线性回归分析(linear discriminant analysis, LDA)的LEfSe分析发现,两组共富集了20种显著差异的物种,其中病例组富集了11种;对照组富集了9种(图 2E)。与对照组相比,病例组在门水平上具有显著差异的物种是Chytridiomycota(壶菌门)。在属水平上主要是Myceliophthora(嗜热毁丝霉属)和Neocosmospora(新赤壳属);在种水平上,分别对应Myceliophthora_sepedonium和Neocosmospora_tenuicristata。与病例组相比,对照组在属水平上具有显著差异的物种主要是Diutina和Eurotium(散囊菌属);在种水平上,分别对应Diutina_catenulata和Eurotium_sp。
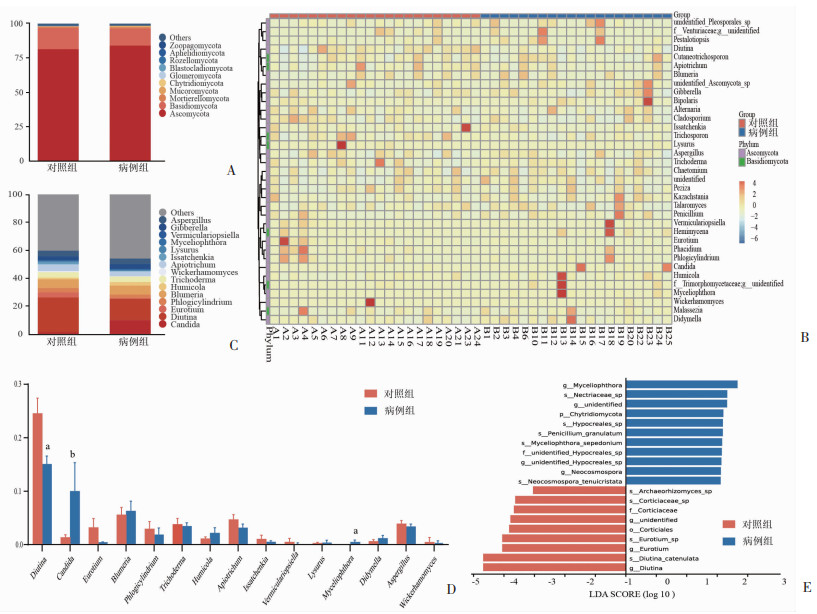
|
| A:门水平物种相对丰度柱状图;B:属水平物种聚类热图;C:属水平物种相对丰度柱状图;D:属水平优势菌柱状图 a:P < 0.01,b:P=0.089,与对照组比较;E:LDA值分布柱状图(阈值=2) 图 2 胆汁淤积性肝病患者与健康受试者肠道真菌菌群结构分析 |
2.2.3 功能特征
FUNguild预测可以从生态功能角度研究真菌。基于FUNguild预测,观察到两组肠道真菌的主要营养方式是腐生(Saprotroph)和病理寄生(Pathotroph)(图 3A)。在病例组中腐生-共生(Saprotroph-Symbiotroph)菌的丰度显著低于对照组(P < 0.05)(图 3B);且病理寄生-腐生(Pathotroph-Saprotroph)菌和病理寄生-腐生-共生(Pathotroph-Saprotroph-Symbiotroph)菌在病例组中相对丰度增加,但差异无统计学意义(P>0.05)(图 3A)。进一步对其进行guild分类,发现两组中肠道真菌的guild种类主要包括植物病原菌(Plant Pathogen)、木质腐生菌(Wood Saprotroph)、土壤腐生菌(Soil Saprotroph)、排泄物腐生菌(Dung Saprotroph)、真菌寄生菌(Fungal Parasite)、动物病原菌(Animal Pathogen)以及部分未明确归属的菌(图 3C)。主成分分析(Principal Component Analysis, PCA)结果显示两组在guild分类上无显著差异(P>0.05)(图 3D)。
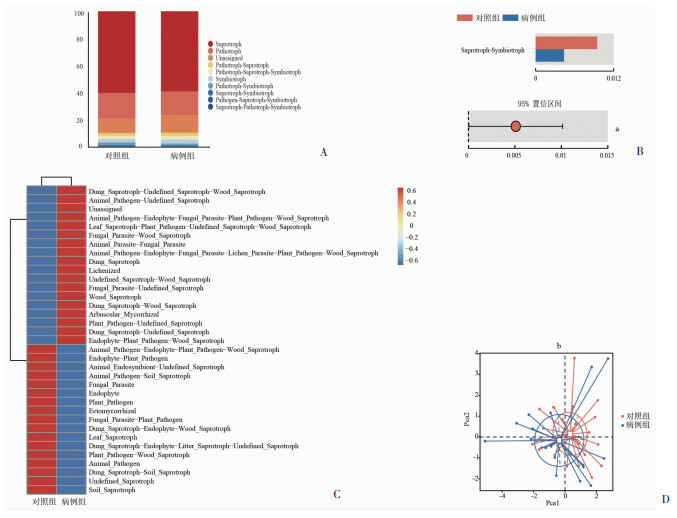
|
| A:营养方式分类柱状图;B:腐生-共生(Saprotroph-Symbiotroph) 菌相对丰度误差线图;C:功能分组聚类热图;D:主成分分析评估功能分组差异性 a:P < 0.05;b:P=0.43,与对照组比较 图 3 胆汁淤积性肝病患者与健康受试者肠道真菌菌群功能特征 |
2.3 肠道真菌与临床参数间相关性分析
为了进一步研究肠道真菌菌群与临床参数的相关性,结合两组样本的临床血清学指标和肠道菌群构成进行了Spearman相关系数分析。分析结果显示,Myceliophthora与ALT(P < 0.05)、AST、ALP、GGT、TBIL、DBIL(P < 0.01)均呈正相关;Candida与ALP呈正相关(P < 0.05);Eurotium与ALT、ALP(P < 0.05)、AST、TBIL(P < 0.01)呈负相关;Diutina与GGT、DBIL呈负相关(P < 0.05);Vermiculariopsiella与TBIL呈负相关(P < 0.05)(图 4)。
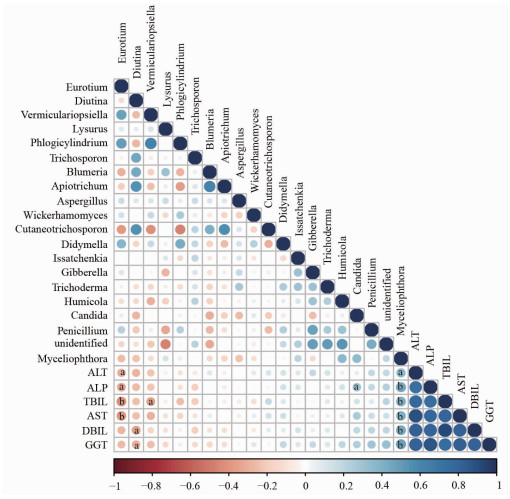
|
| 蓝色表示正相关,红色表示负相关;圆圈大小表示相关性,圆圈越大代表相关性数值越高;a:P < 0.05;b:P < 0.01 图 4 肠道真菌与临床参数间相关性分析 |
3 讨论
既往研究表明,炎症性肠病[15]、结直肠癌[16]、胰腺导管腺癌[14]等疾病中存在肠道真菌菌群失调。但胆汁淤积性肝病患者的肠道真菌变化尚未有研究。本研究通过ITS2高通量测序方法检测了胆汁淤积性肝病组和健康人群对照组的肠道真菌菌群。其结果表明两组间Alpha多样性无显著差异(P>0.05),Beta多样性具有统计学差异(P < 0.01),提示胆汁淤积性肝病患者肠道真菌菌群多样性及构成改变。Candida(假丝酵母属)常被认为是人类肠道中重要的定植真菌[17]。然而,Candida在人体内定植的作用是双向的:一方面,在健康人的肠道内Candida可以协助宿主抵抗肠道病原微生物入侵及维持自身的免疫稳定[18]。另一方面,肠道的Candida是传播念珠菌病的主要来源[19],Candida会在多种条件下转化,具有致病性并破坏肠道屏障,导致致命的侵入性血液感染[20]。本研究发现胆汁淤积性肝病患者组Candida丰度有明显增加的趋势,但差异无统计学意义(P=0.089),本研究纳入病例数目有限,还需进一步研究。Diutina catenulata 是一种从人类、动物和环境中分离出来的子囊菌酵母,是乳制品的污染物,并与人类和动物的表面感染和侵入性感染有关[21]。Diutina catenulata感染主要发生在免疫功能低下的老年男性患者中[22],还有研究结果表明鸡源性的Diutina catenulata具有益生性[23]。本研究中胆汁淤积性肝病组Diutina catenulata丰度显著低于健康人群对照组(P < 0.01),目前未见相关报道,仍需要进一步研究。本研究还发现Myceliophthora(嗜热毁丝霉属)有且只存在于胆汁淤积性肝病患者中。Myceliophthora是一种腐生性嗜热霉菌,广泛存在于环境中,可以有效地降解木材和植物生物质并产生耐热酶[24],有研究报道中性粒细胞减少症患者中侵袭性Myceliophthora感染[25],由于其相关研究十分有限,尚无胆汁淤积性肝病患者Myceliophthora报道。本研究通过LEfSe分析表明Myceliophthora在胆汁淤积性肝病患者组显著富集;结合肠道真菌与临床参数间的相关性分析,发现Myceliophthora与ALT(P < 0.05)、AST、ALP、GGT、TBIL、DBIL(P < 0.01)均呈显著的正相关。
总之,本研究分析了胆汁淤积性肝病患者显著差异与健康对照人群的肠道真菌组成。通过LEfSe分析找到了其中重要的显著差异的生物标志物Myceliophthora,并结合了肠道真菌与临床参数间的相关性分析,发现Myceliophthora与胆汁淤积性肝病患者疾病严重程度密切相关。但由于本研究纳入患者数量有限,未对胆汁淤积性肝病患者肠道真菌及肠道细菌的网络交互关系进行探索。文献表明,清除肠道真菌可显著抑制小鼠胰腺导管腺癌进展[17],提示肠道真菌可能是促进许多重要疾病进展的关键原因。但本研究仅项单中心、横断面、观察性研究,其结果表明胆汁淤积性肝病患者的肠道真菌多样性及构成改变,尚不足以阐明因果关系,具有一定的局限性。但我们前期过动物实验对肠道真菌在胆汁淤积性肝病中的作用机制进行了初步地探索。其结果表明,使用可溶性两性霉素B清除小鼠肠道真菌,可以显著减轻胆管结扎术(Bile-duct ligation, BDL)诱导的小鼠胆汁淤积性肝损伤(结果未展示),其潜在的机制还需要进一步深入探索。
| [1] |
ZHOU R R, FAN X G, SCHNABL B. Role of the intestinal microbiome in liver fibrosis development and new treatment strategies[J]. Transl Res, 2019, 209: 22-38. |
| [2] |
LI Y, TANG R Q, LEUNG P S C, et al. Bile acids and intestinal microbiota in autoimmune cholestatic liver diseases[J]. Autoimmun Rev, 2017, 16(9): 885-896. |
| [3] |
KUMMEN M, HOV J R. The gut microbial influence on cholestatic liver disease[J]. Liver Int, 2019, 39(7): 1186-1196. |
| [4] |
ISAACS-TEN A, ECHEANDIA M, MORENO-GONZALEZ M, et al. Intestinal microbiome-macrophage crosstalk contributes to cholestatic liver disease by promoting intestinal permeability in mice[J]. Hepatology, 2020, 72(6): 2090-2108. |
| [5] |
SCHNEIDER K M, CANDELS L S, HOV J R, et al. Gut microbiota depletion exacerbates cholestatic liver injury via loss of FXR signalling[J]. Nat Metab, 2021, 3(9): 1228-1241. |
| [6] |
LIAO L J, SCHNEIDER K M, GALVEZ E J C, et al. Intestinal dysbiosis augments liver disease progression via NLRP3 in a murine model of primary sclerosing cholangitis[J]. Gut, 2019, 68(8): 1477-1492. |
| [7] |
LIMON J J, SKALSKI J H, UNDERHILL D M. Commensal fungi in health and disease[J]. Cell Host Microbe, 2017, 22(2): 156-165. |
| [8] |
TRIPATHI A, DEBELIUS J, BRENNER D A, et al. The gut-liver axis and the intersection with the microbiome[J]. Nat Rev Gastroenterol Hepatol, 2018, 15(7): 397-411. |
| [9] |
LI X V, LEONARDI I, ILIEV I D. Gut mycobiota in immunity and inflammatory disease[J]. Immunity, 2019, 50(6): 1365-1379. |
| [10] |
BAJAJ J S, LIU E J, KHERADMAN R, et al. Fungal dysbiosis in cirrhosis[J]. Gut, 2018, 67(6): 1146-1154. |
| [11] |
SUN S S, WANG K, SUN L, et al. Therapeutic manipulation of gut microbiota by polysaccharides of Wolfiporia cocos reveals the contribution of the gut fungi-induced PGE 2 to alcoholic hepatic steatosis[J]. Gut Microbes, 2020, 12(1): 1830693. |
| [12] |
YANG A M, INAMINE T, HOCHRATH K, et al. Intestinal fungi contribute to development of alcoholic liver disease[J]. J Clin Invest, 2017, 127(7): 2829-2841. |
| [13] |
GAO W K, ZHU Y X, YE J, et al. Gut non-bacterial microbiota contributing to alcohol-associated liver disease[J]. Gut Microbes, 2021, 13(1): 1984122. |
| [14] |
AYKUT B, PUSHALKAR S, CHEN R N, et al. The fungal mycobiome promotes pancreatic oncogenesis via activation of MBL[J]. Nature, 2019, 574(7777): 264-267. |
| [15] |
ILIEV I D. Mycobiota-host immune interactions in IBD: coming out of the shadows[J]. Nat Rev Gastroenterol Hepatol, 2022, 19(2): 91-92. |
| [16] |
WANG T T, FAN C G, YAO A R, et al. The adaptor protein CARD9 protects against colon cancer by restricting mycobiota-mediated expansion of myeloid-derived suppressor cells[J]. Immunity, 2018, 49(3): 504-514.e4. |
| [17] |
KUMAMOTO C A, GRESNIGT M S, HUBE B. The gut, the bad and the harmless: Candida albicans as a commensal and opportunistic pathogen in the intestine[J]. Curr Opin Microbiol, 2020, 56: 7-15. |
| [18] |
KONG H H, SEGRE J A. Cultivating fungal research[J]. Science, 2020, 368(6489): 365-366. |
| [19] |
ALLERT S, FÖRSTER T M, SVENSSON C M, et al. Candida albicans-induced epithelial damage mediates translocation through intestinal barriers[J]. mBio, 2018, 9(3): e00915-e00918. |
| [20] |
TAN T G, LIM Y S, TAN A, et al. Fungal symbionts produce prostaglandin E 2 to promote their intestinal colonization[J]. Front Cell Infect Microbiol, 2019, 9: 359. |
| [21] |
O′BRIEN C E, MCCARTHY C G P, WALSHE A E, et al. Genome analysis of the yeast Diutina catenulata, a member of the Debaryomycetaceae/Metschnikowiaceae (CTG-Ser) clade[J]. PLoS One, 2018, 13(6): e0198957. |
| [22] |
CHEN X F, ZHANG W, FAN X, et al. Antifungal susceptibility profiles and resistance mechanisms of clinical Diutina catenulata isolates with high MIC values[J]. Front Cell Infect Microbiol, 2021, 11: 739496. |
| [23] |
魏斓. 鸡源酵母筛选、抗菌组分分析及应用[D]. 泰安: 山东农业大学, 2018. WEI L. Isolation & exploration of probiotics of chicken yeast, study of antibacterial components and application[D]. Tai′an: Shandong Agricultural University, 2018. |
| [24] |
ARNTZEN M Ø, BENGTSSON O, VÁRNAI A, et al. Quantitative comparison of the biomass-degrading enzyme repertoires of five filamentous fungi[J]. Sci Rep, 2020, 10(1): 20267. |
| [25] |
MORIO F, FRAISSINET F, GASTINNE T, et al. Invasive Myceliophthora thermophila infection mimicking invasive aspergillosis in a neutropenic patient: a new cause of cross-reactivity with the Aspergillus galactomannan serum antigen assay[J]. Med Mycol, 2011, 49(8): 883-886. |




