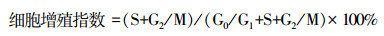口腔癌为常见的头颈部恶性肿瘤,约90%为鳞状细胞癌[1]。虽然目前包括手术、放疗和化疗等各种治疗手段取得了很大进步,但由于口腔鳞癌发病机制不清,近30年来患者的5年生存率仍未得到明显提高[2-3]。研究证明,人体生理活动表现出约以24 h为周期的节律性振荡,称为昼夜节律[4-5]。昼夜节律是由细胞内一系列生物钟基因在转录-翻译水平上构成复杂的正负反馈环路而形成[4-5],揭示生物体内细胞的生理活动和相关基因表达是呈24 h为周期的节律性振荡,而不是每天保持在一个固定的水平[6-7]。中值、振幅和峰值相位是反映24 h昼夜节律振荡特征的3个维度[8]。昼夜节律通过以上3个维度协调细胞内众多复杂的生理过程和基因表达在时间和空间上保持协同有序,对于维持细胞生理稳态至关重要[9-10]。昼夜节律异常改变或紊乱与多种癌症的发生发展密切相关[6-7],深入研究昼夜节律可能为治疗癌症提供新的思路和方法。
细胞增殖和凋亡平衡的失调是癌症发生的根本原因[11]。PCNA是促细胞增殖基因,BAX和BCL2分别为促凋亡基因和抑凋亡基因,其异常改变导致细胞增殖和凋亡平衡失调,与癌症的发生发展密切相关[11]。目前发现在多种细胞中PCNA、BAX和BCL2的表达具有昼夜节律[12-13],但其调控机制不清楚。PER1是重要的核心生物钟基因[5],我们前期研究发现,PER1在口腔鳞癌中表达降低,与患者临床分期和生存时间显著相关,具有重要的抑癌作用[14],并且其表达具有昼夜节律性[15]。在此基础上,本研究通过建立沉默或过表达PER1的口腔鳞癌细胞,探索口腔鳞癌细胞内PER1表达改变后其自身昼夜节律表达特征改变情况,以及对口腔鳞癌细胞增殖、凋亡和细胞中PCNA、BAX和BCL2表达的昼夜节律的调控作用,希望为基于昼夜节律发展治疗口腔鳞癌的新策略提供依据。
1 材料与方法 1.1 试剂与仪器人口腔鳞癌细胞系TSCCA和SCC15购自上海中桥新舟生物科技有限公司,PER1过表达慢病毒和PER1-shRNA干扰慢病毒购自上海吉凯基因化学公司;RNA提取试剂盒、逆转录试剂盒购自日本TaKaRa公司;RIPA裂解液购自中国碧云天公司,PER1抗体购自美国GeneTex公司,BAX和BCL2抗体购自美国Proteintech公司,PCNA和β-actin抗体购自美国CST公司;梯度PCR仪购自美国Bio-Rad公司,ECL-Advance蛋白质印迹检测系统购自美国Bio-Rad公司,流式细胞仪购自美国FACSVantage公司。
1.2 PER1过表达和沉默载体的构建与转染用过表达PER1的慢病毒感染SCC15细胞,构建稳转过表达PER1的SCC15细胞(OE-PER1-SCC15细胞),用不含PER1基因序列的慢病毒感染SCC15细胞作为阴性对照(NC-SCC15细胞)。用PER1-shRNA慢病毒感染TSCCA细胞,构建稳转沉默PER1的TSCCA细胞(RNAi-PER1-TSCCA细胞),以不含PER1片段的scramble质粒慢病毒感染TSCCA细胞作为阴性对照(scramble-TSCCA细胞)。详细方法见我们前期报道[16]。
1.3 细胞培养和细胞昼夜节律同步化实验前先行细胞昼夜节律同步化处理。将生长状态良好的各组细胞(OE-PER1-SCC15、NC-SCC15、RNAi-PER1-TSCCA和Scramble-TSCCA)接种于含完全培养液的培养皿内,当细胞生长达60%左右时,将完全培养液替换成不含血清含有终浓度为1 μmol/L地塞米松培养液,置于细胞培养箱孵育2 h后替换为完全培养基,把这一时间点设置为授时时间0点(zeitgeber time 0,ZT 0),继续培养,每隔4 h设置ZT 4、ZT 8、ZT 12、ZT 16、ZT 20、ZT 24这6个不同时间点,收集细胞,提取RNA和蛋白质。其中ZT 0~ZT 12代表主观白天,ZT 12~ZT 24代表主观夜晚。
1.4 实时荧光定量PCR(RT-qPCR)① RNA提取:根据TaKaRa RNAiso Plus试剂盒的说明书提取总RNA。用显微分光光度法测定总RNA的纯度和浓度。② cDNA合成:用逆转录试剂盒将RNA反转录为cDNA。反应条件为:37 ℃ 15 min,85 ℃ 5 s,4 ℃恒温。③ RT-qPCR反应:目的基因PER1、BAX、BCL2、PCNA和β-actin的引物用Oligo 7.0软件设计,引物序列见表 1。根据TB Green® Premix Ex Taq (Tli RNaseH Plus)说明书进行RT-qPCR。反应条件为:95 ℃预变性1.5 min,95 ℃变性10 s,60 ℃退火延伸30 s,扩增40个循环。每个样品设置3个复孔。以β-actin为参照,按2-△△Ct计算目的基因的mRNA相对表达量。
| 基因 | 序列(5′→3′) |
| PER1 | 正义链:GACACCACTGCCGATCC 反义链:TTCAGCCCGAGGGTTCT |
| BAX | 正义链:TGCGTCCACCAAGAAGC 反义链: TCCAGTTCGTCCCCGAT |
| BCL2 | 正义链:TTTGTGGAACTGTACGGCCC 反义链:TCACTTGTGGCCCAGATAGG |
| PCNA | 正义链:AAGCACCAAACCAGGAGA 反义链:GCAAATTCACCAGAAGGC |
| β-actin | 正义链:CTTCTACAATGAGCTGCGTGTG 反义链:AGAGGCGTACAGGGATAGCACAG |
1.5 蛋白免疫印迹实验(Western blot)
用裂解液裂解细胞,冰上裂解30 min,离心15 min (4 ℃, 12 000 r/min) 后收集上清液,用BCA法测定蛋白浓度。蛋白(20~30 μg)经8%~12%的SDS-PAGE凝胶电泳分离后,通过湿转法转移到0.45 μm PVDF膜上。PVDF膜在含有5%脱脂奶粉的封闭液中室温封闭1.5 h。并与PER1、BAX、BCL2、PCNA和β-actin的一抗接触,在4 ℃孵育过夜。然后将PVDF膜浸泡在HRP标记的二抗稀释液中,室温孵育1 h。加入超敏化学发光液后曝光,采集图像。以β-actin作为对照。使用Image 5.0软件对蛋白质条带进行灰度分析。
1.6 流式细胞术细胞增殖检测:细胞经同步化处理后时间设置为ZT 0,分别在ZT 4、ZT 8、ZT 12、ZT 16、ZT 20和ZT 24时间点用0.25%胰酶消化,PBS洗涤2次,并重悬于100 μL PBS和900 μL预冷的75%乙醇中固定,4 ℃过夜。然后,PBS洗涤2次,并加入400 μL碘化丙啶染色液和100 μL RNase (100 μg/mL), 于4 ℃避光孵育30 min,用流式细胞仪检测细胞周期分布,并通过细胞周期拟合软件ModFit分析。
细胞凋亡检测:细胞经同步化处理后时间设置为ZT 0,分别在ZT 4、ZT 8、ZT 12、ZT 16、ZT 20和ZT 24时间点用0.25%胰酶消化,PBS洗涤2次,用PBS将细胞数调节至1×106/mL。将200 μL的Annexin V-APC染色液加入1 mL细胞悬液中,室温避光孵育15 min。然后加入200 μL碘化丙啶染色液混合。采用流式细胞仪进行细胞计数。
1.7 统计学分析采用GraphPad Prism 8.0软件进行方差分析,检验昼夜6个时间点各基因的差异性表达。用Matlab 8.6(美国,MathWorks)软件中的Cosinor程序包对数据进行余弦拟合分析,拟合方程为Y = M+Acos [w(t-Φ)],其中M表示中值,A表示振幅、w表示角频率、Φ表示峰值相位,t代表时间点。同时满足单因素方差分析(P<0.05)和余弦分析(P<0.05)表明该基因的表达具有昼夜节律[17]。用CircaCompare程序包比较不同余弦曲线间中值和振幅的差异[18],P<0.05被认为差异有统计学意义。
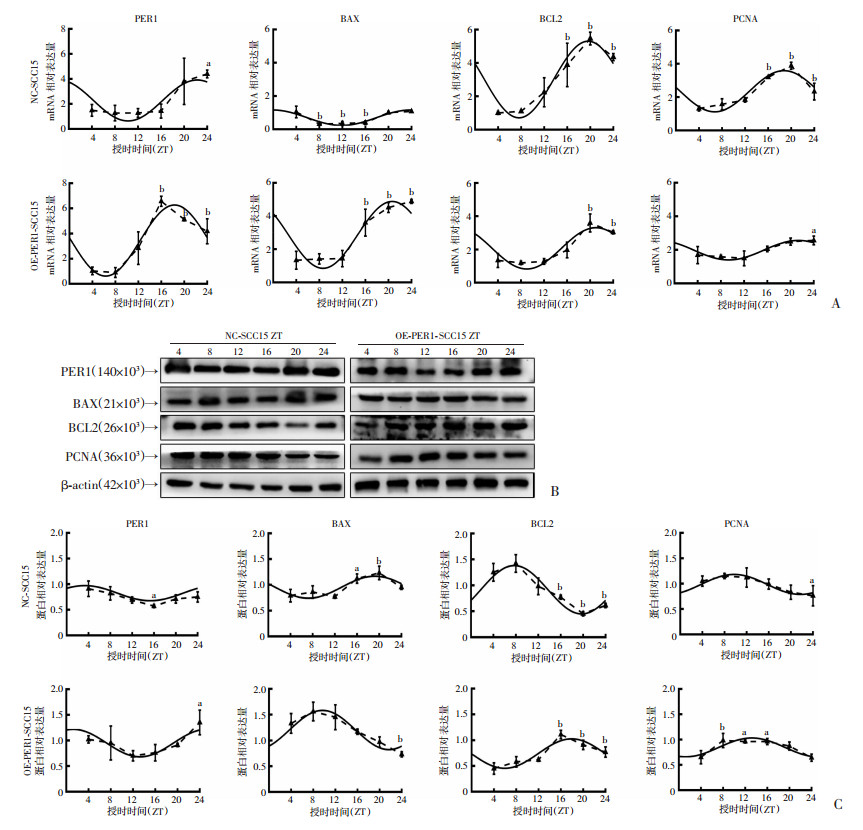
2 结果 2.1 过表达PER1对细胞增殖和凋亡及细胞内BAX、BCL2和PCNA昼夜节律表达的调控为探索PER1表达改变对细胞增殖和凋亡昼夜节律的调控作用,在过表达PER1的口腔鳞癌SCC15细胞(OE-PER1-SCC15)中检测细胞增殖、凋亡及生物钟基因PER1、促凋亡基因BAX、抑凋亡基因BCL2和增殖基因PCNA表达的昼夜节律情况。流式细胞、RT-qPCR和Western blot检测结果表明,在OE-PER1-SCC15细胞和NC-SCC15细胞中细胞增殖指数和凋亡指数及PER1、BAX、BCL2和PCNA mRNA和蛋白表达均具有昼夜节律(单因素方差分析:P<0.05;余弦分析:P<0.05),见图 1、2和表 2、3。

|
| A:流式细胞术检测NC-SCC15和OE-PER1-SCC15细胞在24 h内不同时间点的增殖指数;B:NC-SCC15和OE-PER1-SCC15细胞增殖指数在24 h内不同时间点实际检测均值和昼夜节律的余弦拟合曲线;C:流式细胞术检测NC-SCC15和OE-PER1-SCC15细胞在24 h内不同时间点的凋亡指数;D: NC-SCC15和OE-PER1-SCC15细胞凋亡指数在24 h内不同时间点实际检测均值和昼夜节律变化的余弦拟合曲线实线:余弦拟合曲线;虚线:昼夜不同时间点的实际均值连线;a: P<0.05,b: P<0.01,与ZT 4比较 图 1 NC-SCC15和OE-PER1-SCC15细胞增殖指数和凋亡指数的昼夜节律变化和余弦拟合曲线 |
|
| A: RT-qPCR检测NC-SCC15和OE-PER1-SCC15细胞中PER1、BAX、BCL2和PCNA mRNA表达及其余弦拟合曲线;B、C:Western blot检测NC-SCC15和OE-PER1-SCC15细胞中PER1、BAX、BCL2和PCNA蛋白表达及其余弦拟合曲线实线:余弦拟合曲线;虚线:昼夜不同时间点的实际均值连线;a: P<0.05,b: P<0.01,与ZT 4比较 图 2 PER1、BAX、BCL2和PCNA mRNA和蛋白在NC-SCC15和OE-PER1-SCC15细胞中表达的昼夜节律变化和余弦拟合曲线 |
| 检测项目 | 细胞 | 中值 | 振幅 | 峰值相位(ZT) | 峰值 | 谷值 | P值 |
| 增殖指数 | NC-SCC15 | 30.98 | 4.06 | 14.54 | 35.04 | 26.92 | 0.016 |
| OE-PER1-SCC15 | 28.59 | 3.24 | 17.01 | 31.83 | 25.35 | 0.026 | |
| 凋亡指数 | NC-SCC15 | 6.35 | 1.77 | 11.21 | 8.12 | 4.58 | 0.004 |
| OE-PER1-SCC15 | 7.01 | 2.42 | 8.47 | 9.43 | 4.59 | 0.003 |
| 检测项目 | 基因名称 | 细胞 | 中值 | 振幅 | 峰值相位(ZT) | 峰值 | 谷值 | P值 |
| mRNA | PER1 | NC-SCC15 | 2.27 | 1.64 | 22.27 | 3.91 | 0.63 | 0.032 |
| OE-PER1-SCC15 | 3.44 | 2.82 | 18.31 | 6.26 | 0.62 | 0.019 | ||
| BAX | NC-SCC15 | 0.69 | 0.47 | 23.89 | 1.16 | 0.22 | 0.029 | |
| OE-PER1-SCC15 | 2.86 | 2.01 | 20.65 | 4.87 | 0.85 | 0.041 | ||
| BCL2 | NC-SCC15 | 3.00 | 2.29 | 19.63 | 5.29 | 0.71 | 0.015 | |
| OE-PER1-SCC15 | 2.07 | 1.24 | 21.01 | 3.31 | 0.83 | 0.036 | ||
| PCNA | NC-SCC15 | 2.35 | 1.23 | 18.74 | 3.58 | 1.12 | 0.027 | |
| OE-PER1-SCC15 | 1.97 | 0.58 | 21.35 | 2.55 | 1.39 | 0.022 | ||
| 蛋白 | PER1 | NC-SCC15 | 0.74 | 0.14 | 4.39 | 0.88 | 0.60 | 0.032 |
| OE-PER1-SCC15 | 0.95 | 0.27 | 1.26 | 1.22 | 0.68 | 0.025 | ||
| BAX | NC-SCC15 | 0.95 | 0.21 | 19.19 | 1.16 | 0.74 | 0.044 | |
| OE-PER1-SCC15 | 1.20 | 0.38 | 9.69 | 1.58 | 0.82 | 0.035 | ||
| BCL2 | NC-SCC15 | 0.91 | 0.47 | 7.75 | 1.38 | 0.44 | 0.019 | |
| OE-PER1-SCC15 | 0.74 | 0.29 | 17.95 | 1.03 | 0.45 | 0.025 | ||
| PCNA | NC-SCC15 | 0.98 | 0.20 | 9.74 | 1.18 | 0.78 | 0.017 | |
| OE-PER1-SCC15 | 0.85 | 0.19 | 13.25 | 1.04 | 0.66 | 0.022 |
与NC-SCC15细胞组相比,OE-PER1-SCC15细胞增殖指数的中值显著降低(P<0.01),而振幅无显著改变(P>0.05),峰值相位延后2.47 h,由主观夜晚的早期(ZT 14.54)后移到主观夜晚的中期(ZT 17.01),见图 1A、B和表 2;细胞凋亡指数的中值和振幅显著升高(P<0.05),峰值相位虽然提前2.74 h(从ZT 11.21前移到ZT 8.47),但仍位于主观白天的晚期(图 1C、D和表 2)。
与对照组相比,OE-PER1-SCC15细胞中PER1 mRNA表达的中值显著升高(P<0.05),而振幅无显著改变(P>0.05),峰值相位前移3.96 h,由主观夜晚的晚期(ZT 22.27)提前到主观夜晚的中期(ZT 18.31)。BAX mRNA表达的中值和振幅显著升高(P<0.05),峰值相位虽然提前3.24 h(从ZT 23.89前移到ZT 20.65),但仍位于主观夜晚的晚期。BCL2 mRNA表达的中值和振幅显著降低(P<0.05),峰值相位滞后1.38 h,由主观夜晚中期(ZT 19.63)延后到主观夜晚晚期(ZT 21.01)。PCNA mRNA表达的中值和振幅显著降低(P<0.05),峰值相位滞后2.61 h,由主观夜晚中期(ZT 18.74)后移到主观夜晚晚期(ZT 21.35),见图 2A和表 3。从蛋白表达比较,PER1蛋白表达的中值显著升高(P<0.05),而振幅无显著差异(P>0.05),峰值相位前移3.13 h,由主观白天的中期(ZT 4.39)提前到主观白天的早期(ZT 1.26)。BAX蛋白表达的中值显著升高(P<0.05),而振幅无显著改变(P>0.05),峰值相位前移9.50 h,由主观夜晚的中期(ZT 19.19)提前到主观白天的晚期(ZT 9.69)。BCL2蛋白表达的中值显著降低(P<0.05),而振幅无显著差异(P>0.05),峰值相位滞后10.20 h,由主观白天的中期(ZT 7.75)后移到主观夜晚的中期(ZT 17.95)。PCNA蛋白表达的中值显著降低(P<0.05),而振幅无显著改变(P>0.05),峰值相位滞后3.51 h,由主观白天的晚期(ZT 9.74)后移到主观夜晚的早期(ZT 13.25),见图 2B、C和表 3。
上述结果表明:PER1过表达后其自身昼夜节律表达特征发生改变,同时调控口腔鳞癌细胞的增殖和凋亡及细胞内BAX、BCL2、PCNA mRNA和蛋白昼夜节律表达特征改变。
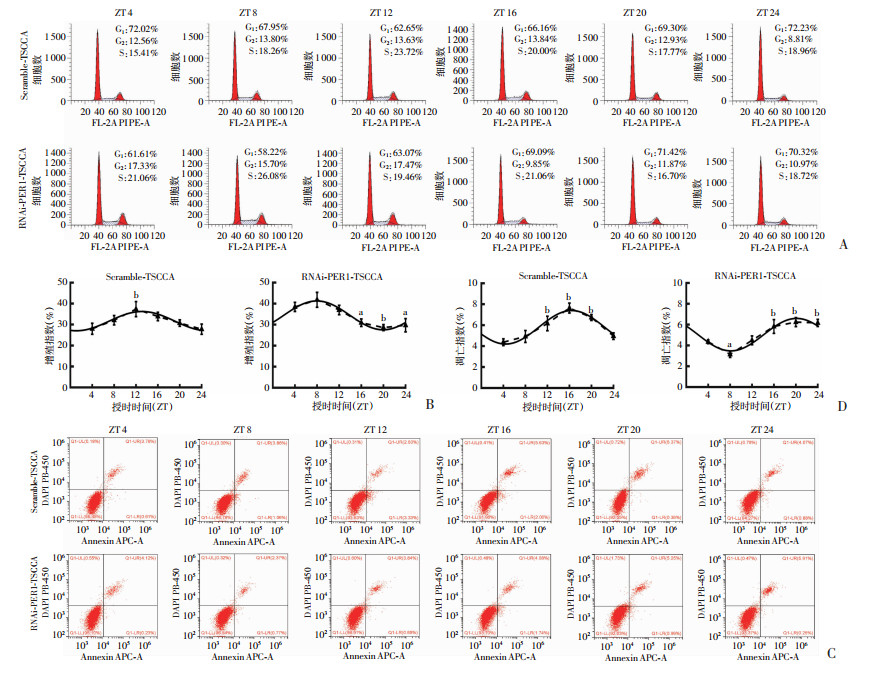
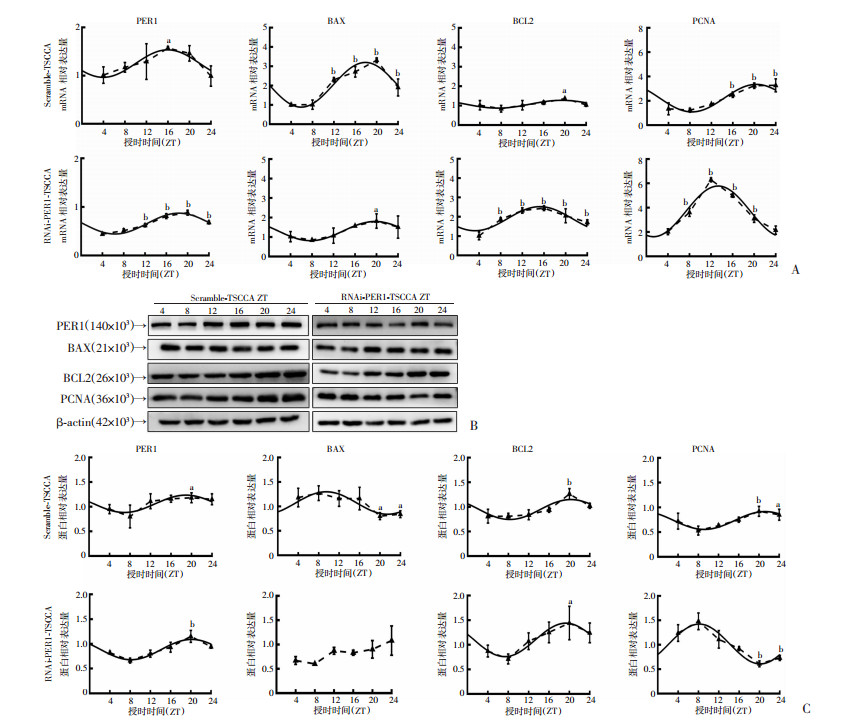
2.2 敲减PER1对细胞增殖和凋亡及细胞内BAX、BCL2和PCNA昼夜节律表达的调控作用在敲减PER1的口腔鳞癌TSCCA细胞(RNAi-PER1-TSCCA)中检测细胞增殖和凋亡及PER1、BAX、BCL2和PCNA表达的昼夜节律情况。流式细胞检测结果表明,在RNAi-PER1-TSCCA细胞和对照组Scramble-TSCCA细胞中细胞增殖指数和凋亡指数均具有昼夜节律(单因素方差分析:P<0.05;余弦分析:P<0.05),见图 3、表 4。RT-qPCR检测结果表明,PER1、BAX、BCL2和PCNA mRNA表达均具有昼夜节律(单因素方差分析: P<0.05; 余弦分析: P<0.05),见图 4A、表 5。Western blot检测结果表明,PER1、BCL2和PCNA蛋白表达均具有昼夜节律, BAX蛋白在Scramble-TSCCA细胞具有昼夜节律(单因素方差分析:P<0.05;余弦分析:P<0.05),但在RNAi-PER1-TSCCA细胞中发生昼夜节律紊乱(P>0.05,图 4B、C和表 5)。
|
| A: 流式细胞术检测Scramble-TSCCA和RNAi-PER1-TSCCA细胞在24 h内不同时间点的增殖指数;B:Scramble-TSCCA和RNAi-PER1-TSCCA细胞增殖指数在24 h内不同时间点实际检测均值和昼夜节律的余弦拟合曲线;C:流式细胞术检测Scramble-TSCCA和RNAi-PER1-TSCCA细胞在24 h内不同时间点的凋亡指数;D: Scramble-TSCCA和RNAi-PER1-TSCCA细胞凋亡指数在24 h内不同时间点实际检测均值和昼夜节律的余弦拟合曲线实线:余弦拟合曲线;虚线:昼夜不同时间点的实际均值连线;a: P<0.05,b: P<0.01,与ZT 4比较 图 3 Scramble-TSCCA和RNAi-PER1-TSCCA细胞增殖指数和凋亡指数的昼夜节律变化和余弦拟合曲线 |
| 检测项目 | 细胞 | 中值 | 振幅 | 峰值相位(ZT) | 峰值 | 谷值 | P值 |
| 增殖指数 | Scramble-TSCCA | 31.62 | 4.59 | 13.10 | 36.21 | 27.03 | 0.014 |
| RNAi-PER1-TSCCA | 34.38 | 6.86 | 7.96 | 41.24 | 27.52 | 0.005 | |
| 凋亡指数 | Scramble-TSCCA | 5.79 | 1.60 | 16.41 | 7.39 | 4.19 | 0.004 |
| RNAi-PER1-TSCCA | 5.03 | 1.56 | 20.14 | 6.59 | 3.47 | 0.012 |
|
| A: RT-qPCR检测Scramble-TSCCA和RNAi-PER1-TSCCA细胞中PER1、BAX、BCL2和PCNA mRNA表达及其余弦拟合曲线;B, C:Western blot检测Scramble-TSCCA和RNAi-PER1-TSCCA细胞中PER1、BAX、BCL2和PCNA蛋白表达及其余弦拟合曲线实线:余弦拟合曲线;虚线:昼夜不同时间点的实际均值的连线;a: P<0.05, b: P<0.01,与ZT 4比较 图 4 PER1、BAX、BCL2和PCNA在Scramble-TSCCA和RNAi-PER1-TSCCA细胞中表达的昼夜节律变化和余弦拟合曲线 |
| 检测项目 | 基因名称 | 细胞 | 中值 | 振幅 | 峰值相位(ZT) | 峰值 | 谷值 | P值 |
| mRNA | PER1 | Scramble-TSCCA | 1.25 | 0.29 | 15.95 | 1.54 | 0.96 | 0.047 |
| RNAi-PER1-TSCCA | 0.66 | 0.21 | 18.36 | 0.87 | 0.45 | 0.008 | ||
| BAX | Scramble-TSCCA | 2.05 | 1.16 | 17.83 | 3.21 | 0.89 | 0.016 | |
| RNAi-PER1-TSCCA | 1.31 | 0.49 | 19.78 | 1.80 | 0.82 | 0.000 | ||
| BCL2 | Scramble-TSCCA | 1.07 | 0.20 | 19.39 | 1.27 | 0.87 | 0.034 | |
| RNAi-PER1-TSCCA | 1.90 | 0.62 | 15.24 | 2.52 | 1.28 | 0.042 | ||
| PCNA | Scramble-TSCCA | 2.21 | 1.13 | 20.37 | 3.34 | 1.08 | 0.030 | |
| RNAi-PER1-TSCCA | 3.69 | 2.08 | 13.33 | 5.77 | 1.61 | 0.017 | ||
| 蛋白 | PER1 | Scramble-TSCCA | 1.06 | 0.18 | 18.92 | 1.24 | 0.88 | 0.037 |
| RNAi-PER1-TSCCA | 0.88 | 0.21 | 20.17 | 1.09 | 0.67 | 0.024 | ||
| BAX | Scramble-TSCCA | 1.07 | 0.23 | 9.46 | 1.30 | 0.84 | 0.024 | |
| RNAi-PER1-TSCCA | - | - | - | - | - | 0.330 | ||
| BCL2 | Scramble-TSCCA | 0.95 | 0.20 | 20.27 | 1.15 | 0.75 | 0.034 | |
| RNAi-PER1-TSCCA | 1.10 | 0.34 | 19.32 | 1.44 | 0.76 | 0.009 | ||
| PCNA | Scramble-TSCCA | 0.73 | 0.18 | 21.18 | 0.91 | 0.55 | 0.006 | |
| RNAi-PER1-TSCCA | 1.02 | 0.41 | 8.15 | 1.43 | 0.61 | 0.016 | ||
| -:无昼夜节律 | ||||||||
与对照组相比,RNAi-PER1-TSCCA细胞增殖指数的中值和振幅显著升高(P<0.05),峰值相位前移5.14 h,由主观夜晚的早期(ZT 13.10)提前到主观白天的中期(ZT 7.96),见图 3A、B和表 4;细胞凋亡指数的中值显著降低(P<0.01),而振幅无显著差异(P>0.05),峰值相位滞后3.73 h,由主观夜晚的中期(ZT 16.41)后移到主观夜晚的晚期(ZT 20.14),见图 3C、D和表 4。
与对照组相比,RNAi-PER1-TSCCA细胞PER1 mRNA表达的中值显著降低(P<0.001),而振幅无显著差异(P>0.05),峰值相位滞后2.41 h,由主观夜晚的早期(ZT 15.95)后移到主观夜晚的中期(ZT 18.36)。BAX mRNA表达的中值和振幅显著降低(P<0.01),峰值相位虽然滞后1.95 h(从ZT 17.83后移到ZT 19.78),但仍位于主观夜晚的中期。BCL2 mRNA表达的中值和振幅显著升高(P<0.05),峰值相位前移4.15 h,由主观夜晚的中期(ZT 19.39)提前到主观夜晚的早期(ZT 15.24)。PCNA mRNA表达的中值和振幅显著升高(P<0.05),峰值相位前移7.04 h,由主观夜晚的晚期(ZT 20.37)提前到主观夜晚的早期(ZT 13.33),见图 4A、表 5。从蛋白水平比较,PER1蛋白表达的中值显著降低(P<0.01),而振幅无显著改变(P>0.05),峰值相位滞后1.25 h,由主观夜晚的中期(ZT 18.92)后移到主观夜晚的晚期(ZT 20.17)。BAX蛋白在RNAi-PER1-TSCCA细胞中发生节律紊乱。BCL2蛋白表达的中值显著升高(P<0.05),而振幅无显著差异(P>0.05),峰值相位前移0.95 h,由主观夜晚的晚期(ZT 20.27)提前到主观夜晚的中期(ZT 19.32)。PCNA蛋白表达的中值和振幅显著升高(P<0.05),峰值相位前移13.03 h,由主观夜晚的晚期(ZT 21.18)提前到主观白天的晚期(ZT 8.15),见图 4B、C和表 5。
上述结果表明:PER1敲减后其自身昼夜节律表达特征发生改变,同时调控口腔鳞癌细胞增殖和凋亡及细胞内BAX、BCL2和PCNA mRNA和蛋白昼夜节律表达特征改变。
3 讨论人体细胞中几乎都存在生物钟基因[6-7],这些生物钟基因通过形成正负反馈环路而产生昼夜节律振荡[5, 19]。机体正常生理稳态的维持依靠各种细胞生理活动或基因表达在时间和空间上保持动态平衡[20-21]。昼夜节律是调控体内众多复杂的生理过程或基因表达能在时间和空间上保持协同有序的重要管理方式[20-22],昼夜节律异常改变与肿瘤等多种疾病的发生发展密切相关[7, 10]。PER1是核心生物钟基因之一[5],本研究结果显示,口腔鳞癌细胞中PER1表达改变能导致其自身的昼夜节律改变,并对细胞增殖和凋亡以及细胞内BAX、BCL2、PCNA mRNA和蛋白表达的昼夜节律具有重要的调控作用。中值、振幅和峰值相位是反映24 h昼夜节律振荡特征的3个维度[8]。中值代表 24 h节律性振荡的平均值;振幅代表节律振荡高于或低于中值的程度,是反映基因的稳健性和同步化能力的重要指标;峰值相位代表节律振荡达到顶峰的时间点,反映该基因呈节律性的最大“开启”时间。因此,对昼夜节律的研究不仅会补充对癌症发生机制的深入理解,也可能为基于昼夜节律发展治疗癌症的新策略提供依据。
无限增殖和抵抗凋亡是恶性肿瘤两大基本特征[11]。PCNA是一种增殖细胞核抗原。WEIGL等[12]发现,雄性BALB/c小鼠肝脏和食管中PCNA mRNA表达存在昼夜节律。BCL2和BAX是凋亡的重要调控因子,BAX为促凋亡基因,BCL2为抑凋亡基因[11]。GRANDA等[13]研究表明,BCL2和BAX蛋白在骨髓组织中的表达具有昼夜节律,且其昼夜节律呈相反模式。我们前期研究证明[16],在3株人口腔鳞癌细胞系TSCCA、SCC15和CAL27中,PER1 mRNA和蛋白表达均显著低于正常口腔上皮细胞。为了探索口腔鳞癌细胞中PER1对PCNA、BCL2和BAX表达昼夜节律的调控作用,本研究在这3株口腔鳞癌细胞系中选择PER1表达最低的SCC15细胞建构稳定过表达PER1的SCC15细胞(OE-PER1-SCC15),选择PER1表达最高的TSCCA细胞构建稳定沉默PER1的TSCCA细胞(RNAi-PER1-TSCCA)。结果发现:在OE-PER1-SCC15中,PER1、BAX、BCL2和PCNA mRNA和蛋白的表达具有昼夜节律性;PER1和BAX mRNA和蛋白表达的中值显著升高,BCL2和PCNA mRNA和蛋白表达的中值显著降低;BAX mRNA表达的振幅显著升高,BCL2和PCNA mRNA表达的振幅显著降低;PER1和BAX mRNA和蛋白表达的峰值相位前移,BCL2和PCNA mRNA和蛋白表达的峰值相位后移。在RNAi-PER1-TSCCA中,BAX蛋白的表达发生昼夜节律紊乱,但PER1、BCL2和PCNA mRNA和蛋白以及BAX mRNA的表达具有昼夜节律, 其昼夜节律特征与OE-PER1-SCC15中相反。表明口腔鳞癌细胞中BAX、BCL2和PCNA mRNA和蛋白的表达在中值、振幅和峰值相位3个维度上的平衡失调与癌症的发生发展密切相关,PER1对BAX、BCL2和PCNA表达的昼夜节律具有重要调控作用。如果能进一步对SCC15和TSCCA两种口腔鳞癌细胞分别既沉默又过表达,其结果会更加全面。
昼夜节律研究也为癌症的时间精准治疗提供了依据。因为基因表达包括转录产生mRNA和翻译产生蛋白等不同层面的动态过程[23],昼夜节律的最大优势就是不仅能获得基因表达在不同层面的中值和振幅水平,同时也能获得基因表达在不同层面的最大高峰或低谷时间,即峰值相位。本研究从mRNA和蛋白两个层面获得PER1、PCNA、BAX和BCL2表达的昼夜节律改变规律,结果表明PER1、PCNA、BAX和BCL2 mRNA表达的峰值相位与各基因蛋白表达的峰值相位之间存在数小时的时间差。这一结果提示,针对PER1、PCNA、BAX和BCL2的mRNA靶向制剂或蛋白靶向制剂获得最佳疗效的给药时间是不相同的。这种时间精准治疗在癌症治疗中具有很好的临床应用前景[24]。
总之,本研究结果显示,在口腔鳞癌细胞中,生物钟基因PER1表达改变能导致其自身的昼夜节律改变,并从中值、振幅和峰值相位3个维度调控细胞增殖和凋亡及细胞内BAX、BCL2和PCNA mRNA和蛋白表达的昼夜节律特征改变。本研究结果不仅加深对口腔鳞癌发生机制更全面和更精细的认识,同时也提示基于昼夜节律的研究可能为治疗口腔鳞癌提供新的策略。
| [1] |
CHI A C, DAY T A, NEVILLE B W. Oral cavity and oropharyngeal squamous cell carcinoma: an update[J]. CA Cancer J Clin, 2015, 65(5): 401-421. |
| [2] |
CRAMER J D, BURTNESS B, LE Q T, et al. The changing therapeutic landscape of head and neck cancer[J]. Nat Rev Clin Oncol, 2019, 16(11): 669-683. |
| [3] |
GIRALDI L, LEONCINI E, PASTORINO R, et al. Alcohol and cigarette consumption predict mortality in patients with head and neck cancer: a pooled analysis within the International Head and Neck Cancer Epidemiology (INHANCE) Consortium[J]. Ann Oncol, 2017, 28(11): 2843-2851. |
| [4] |
DIBNER C, SCHIBLER U, ALBRECHT U. The mammalian circadian timing system: organization and coordination of central and peripheral clocks[J]. Annu Rev Physiol, 2010, 72: 517-549. |
| [5] |
TAKAHASHI J S. Transcriptional architecture of the mammalian circadian clock[J]. Nat Rev Genet, 2017, 18(3): 164-179. |
| [6] |
KIM Y H, LAZAR M A. Transcriptional control of circadian rhythms and metabolism: a matter of time and space[J]. Endocr Rev, 2020, 41(5): 707-732. |
| [7] |
TUREK F W. Circadian clocks: not your grandfather's clock[J]. Science, 2016, 354(6315): 992-993. |
| [8] |
TAN X M, YE H, YANG K, et al. Circadian variations of clock gene Per2 and cell cycle genes in different stages of carcinogenesis in golden hamster buccal mucosa[J]. Sci Rep, 2015, 5: 9997. |
| [9] |
GUAN D Y, XIONG Y, TRINH T M, et al. The hepatocyte clock and feeding control chronophysiology of multiple liver cell types[J]. Science, 2020, 369(6509): 1388-1394. |
| [10] |
KORONOWSKI K B, SASSONE-CORSI P. Communicating clocks shape circadian homeostasis[J]. Science, 2021, 371(6530): eabd0951. |
| [11] |
HANAHAN D, WEINBERG R A. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144(5): 646-674. |
| [12] |
WEIGL Y, ASHKENAZI I E, PELEG L. Rhythmic profiles of cell cycle and circadian clock gene transcripts in mice: a possible association between two periodic systems[J]. J Exp Biol, 2013, 216(Pt 12): 2276-2282. |
| [13] |
GRANDA T G, LIU X H, SMAALAND R, et al. Circadian regulation of cell cycle and apoptosis proteins in mouse bone marrow and tumor[J]. FASEB J, 2005, 19(2): 304-306. |
| [14] |
YANG G J, YANG Y X, TANG H, et al. Loss of the clock gene Per1 promotes oral squamous cell carcinoma progression via the AKT/mTOR pathway[J]. Cancer Sci, 2020, 111(5): 1542-1554. |
| [15] |
ZHAO N B, YANG K, YANG G L, et al. Aberrant expression of clock gene period1 and its correlations with the growth, proliferation and metastasis of buccal squamous cell carcinoma[J]. PLoS One, 2013, 8(2): e55894. |
| [16] |
GONG X B, TANG H, YANG K. PER1 suppresses glycolysis and cell proliferation in oral squamous cell carcinoma via the PER1/RACK1/PI3K signaling complex[J]. Cell Death Dis, 2021, 12(3): 276. |
| [17] |
LIU Y, LANG H D, ZHOU M, et al. The preventive effects of pterostilbene on the exercise intolerance and circadian misalignment of mice subjected to sleep restriction[J]. Mol Nutr Food Res, 2020, 64(11): e1900991. |
| [18] |
PARSONS R, PARSONS R, GARNER N, et al. CircaCompare: a method to estimate and statistically support differences in mesor, amplitude and phase, between circadian rhythms[J]. Bioinformatics, 2020, 36(4): 1208-1212. |
| [19] |
FARSHADI E, VAN DER HORST G T J, CHAVES I. Molecular links between the circadian clock and the cell cycle[J]. J Mol Biol, 2020, 432(12): 3515-3524. |
| [20] |
SULLI G, LAM M T Y, PANDA S. Interplay between circadian clock and cancer: new frontiers for cancer treatment[J]. Trends Cancer, 2019, 5(8): 475-494. |
| [21] |
VOIGT R M, FORSYTH C B, KESHAVARZIAN A. Circadian rhythms: a regulator of gastrointestinal health and dysfunction[J]. Expert Rev Gastroenterol Hepatol, 2019, 13(5): 411-424. |
| [22] |
DAVIS K, RODEN L C, LEANER V D, et al. The tumour suppressing role of the circadian clock[J]. IUBMB Life, 2019, 71(7): 771-780. |
| [23] |
BUCCITELLI C, SELBACH M. mRNAs, proteins and the emerging principles of gene expression control[J]. Nat Rev Genet, 2020, 21(10): 630-644. |
| [24] |
杨凯, 郭伟, 孙沫逸, 等. 口腔鳞状细胞癌时辰化疗中国专家共识[J]. 中国口腔颌面外科杂志, 2019, 17(1): 7-12. YANG K, GUO W, SUN M Y, et al. Chinese expert consensus on chrono-chemotherapy for oral squamous cell carcinoma[J]. China J Oral Maxillofac Surg, 2019, 17(1): 7-12. |