2. 400038 重庆,陆军军医大学(第三军医大学): 基础医学院生理学教研室,脑与智能研究院;
3. 857000 西藏 日喀则,陆军第 953 医院急诊医学科
2. Department of Physiology, College of Basic Medical Sciences, Army Medical University (Third Military Medical University), Chongqing, 400038;
3. Department of Emergency Medicine, No. 953 Hospital of PLA Army, Shigatse, Tibet Autonomous Region, 857000, China
呼吸活动是对生命维持不可或缺的重要行为,其节律产生于延髓呼吸中央模式发生器并最终通过脊髓运动神经元兴奋使吸气肌收缩,从而始动肺部通气实现呼吸运动[1]。哺乳动物在平静状态下,膈肌是主要的吸气肌,其接受脊髓膈运动神经元兴奋并主动收缩产生跨膈压以实现肺部通气[2]。此外,膈肌收缩还参与咳嗽、咯痰以保持呼吸道通畅,并且与吞咽、发声行为密切相关[1-2]。当膈运动神经元和膈肌组成的运动单位功能障碍时,会导致吸气动力和气道排泄能力减弱,甚至引起呼吸衰竭[3]。
既往研究发现膈运动神经元分布于颈髓,在不同的物种中表现出相似的分布模式[4]。例如,膈运动神经元位于大鼠C3~C6节段的脊髓前角[5-9]、小鼠的C3~C6节段[10]、猫的C4~C6节段[11]和人类的C3~C6节段[12]。膈运动神经元聚集分布在与脊髓前正中裂平行的离散细胞纵柱中[6, 7, 10-13]。但是,膈运动神经元在每个颈髓节段中的数目和位置尚无详细描述。此外,脊髓前角中还存在许多支配非呼吸肌的运动神经元,如向三角肌发出投射的运动神经元[14]。同时,脊髓中也分布着支配另一重要的呼吸肋间肌的呼吸肋间运动神经元[15-16]。在有序而复杂的呼吸运动程序中,膈运动神经元与脊髓非呼吸相关的运动神经元以及呼吸肋间运动神经元的空间分布模式有无差异并不清楚。因此,本研究采用从外周到中枢的逆行示踪技术,鉴定成年小鼠支配膈肌的呼吸膈运动神经元的详细分布,同时比较膈运动神经元与非呼吸相关的三角肌运动神经元以及与呼吸肋间运动神经元的空间分布特征, 以期为呼吸运动的进一步功能研究奠定解剖学基础。
1 材料与方法 1.1 实验动物使用雄性8~12周龄的C57BL/6小鼠(25~30 g)共46只,购自陆军军医大学实验动物中心。3~5只小鼠同笼饲养,自由摄食和饮水,环境温度保持在(20±1)℃。实验得到陆军军医大学实验动物福利和伦理委员会批准,并按照动物福利指南进行。
1.2 逆行示踪手术用1%~2%的异氟烷对小鼠进行持续吸入麻醉,并将其仰卧位置于腹部手术板上。剃除胸腹部的毛发及皮肤进行消毒后,沿着前正中线小心地切开胸腹部皮肤,分离皮肤与皮下组织,充分暴露膈肌。用Hamilton注射器(针头PST2型,30 mm,Hamilton,瑞士)抽取10 μL的CTB Alexa Fluor TM555(CTB555,C34776,1 mg/μL,ThermoFisher,美国)或2 μL的编码增强型绿色荧光蛋白的PRV(PRV-EGFP)(p03001,≥2.00×109 PFU/mL,BrainVTA,武汉)注射到右侧膈肌。其中CTB555是从神经末梢到胞体的不跨突触的经典逆行示踪剂, 感染7~14 d即可稳定标记神经元胞体[17];PRV-EGFP是可跨多级突触传递的逆行示踪病毒,其逆向跨突触的级数取决于其在动物体内的感染时间[18]。由于小鼠的膈肌是一个薄的肌纤维结构,我们首先通过CTB在不同区域选择3个注射点比较标记神经元的数量,发现以肋骨部(sternal)-中间(central)-膈肌脚部(crural)区域均匀3个点的注射方式标记神经元的数量比其他注射区域3个注射点的更多。所以选择肋骨部-中间-脚部区域的3点注射方式,以0.2 μL/min的速度缓慢注射,整个注射过程中没有穿透膈肌。注射后,针头停留5 min以让示踪病毒充分扩散。拔针后用干棉签擦拭渗出的血液和液体,避免示踪剂泄漏和扩散。再次对手术区消毒,并缝合皮肤。3~5只小鼠被安置在1个笼子里,提供充足的食水。密切观察小鼠状态。
颈髓中除了存在支配膈肌的膈运动神经元,还存在支配非呼吸肌的运动神经元,比如有研究报道支配上肢肌肉的臂丛神经也来自于颈髓节段[19]。为了同时对比标记非呼吸相关的三角肌运动神经元和膈运动神经元,以同样的方式将等量的霍乱毒素Alexa Fluor TM488(CTB488,C34775,ThermoFisher,USA)以及CTB555注射到同侧的三角肌和膈肌(实验动物样本量:n=3)。
在呼吸过程中,膈肌和肋间肌都是重要的吸气泵肌,它们协同收缩始动肺部通气[20-22]。为了标记呼吸肋间运动神经元,对小鼠第1~12肋间肌(每个肋间肌实验动物样本量:n=3)注射6 μL CTB555逆行示踪,感染10 d后,取注射的对应肋间肌(包括相邻的上下肋骨)和脊髓组织。观察肌肉组织切片,对于CTB555颗粒覆盖整个肋间肌但没有超过上下肋骨的小鼠, 进一步观察其脊髓组织标本切片。
1.3 切片制作与免疫荧光检测CTB注射10 d或PRV-EGFP注射2.0~2.5 d后,用异氟烷麻醉小鼠,然后用4%多聚甲醛(PFA)的磷酸盐缓冲液(PBS)进行心脏灌注。仔细取出小鼠脊髓组织,置于4%PFA中固定12 h,然后转移到含30%蔗糖的PBS中进行脱水,直到脊髓组织完全沉底。包埋和冷冻后,将脊髓从头端到尾端以40 μm的厚度连续冠状切片,或从背侧到腹侧以40 μm的厚度纵向切片。收集的切片在荧光显微镜下观察(BX53,Olympus,日本)。胆碱乙酰转移酶(cholinergic acetyltransferase, ChAT)免疫荧光染色按照以前描述的方法进行[23-24]。将带有CTB标记的运动神经元的冠状脊髓片用PBST(PBS中含0.1%Triton X-100)清洗3次,每次10 min,并在37 ℃下用封闭液(Beyotime,中国)孵育40 min。然后用抗ChAT一抗(AMAb91130,1∶1 000,Sigma-Aldrich,美国)在4 ℃下孵育24~48 h。之后将切片漂洗3次,用PBS稀释的Alexa Fluor 647结合的驴抗鼠IgG二抗(A31571,1∶800,Invitrogen,美国)在室温下黑暗中孵育2 h。最后,这些切片用核染料4, 6-二脒基-2-苯基吲哚(nuclear dye 4, 6-diamidino-2-phenylindole,DAPI,F6057,Sigma-Aldrich,美国)染色,并盖上盖玻片待自然风干后置4 ℃中避光保存。
所有被CTB或PRV-EGFP标记的脊髓片采用奥林巴斯显微镜的4×和20×物镜拍摄,或采用共聚焦显微镜(Zeiss,德国)在10×、20×和63×放大率下成像。
1.4 神经元计数每80微米选取1张脊髓片连续贴片。对于标记的脊髓运动神经元,记录从头端到尾端第1张标记切片与最后1张标记切片之间的距离。根据脊髓图谱[25],确定这些标记的运动神经元在脊髓前角中的位置并进行人工计数。
1.5 单个神经元大小和径向距离测量采用Image J软件(ImageJ Software Inc, 美国)测量随机选择的阳性标记神经元的细胞大小和径向距离。每只小鼠从脊髓相应节段随机选择1~2个冠状切片(颈髓对应节段12张切片,胸髓对应节段36张切片),并从对应节段的切片中选择1~2个有清晰细胞形态的神经元。神经元的大小以长径和短径表示(膈运动神经元:n=31,三角肌运动神经元:n=14)。神经元的径向分布通过测量其前角内的运动神经元与后角的垂直距离(dorsal-ventral axis, D-V)(膈运动神经元:n=13,三角肌运动神经元:n=6)、神经元与脊髓中线的垂直距离(medial-lateral axis, M-L)(膈运动神经元:n=13,三角肌运动神经元:n=6)以及神经元与脊髓外侧灰质的垂直距离(lateral-medial axis, L-M)来确定(每个对应的脊髓节段:n=3)。
1.6 统计学分析使用GraphPad Prism 8.0软件进行统计分析。用SigmaPlot12.5 (Systat Software Inc., 德国)和Origin 9.1 (Origin Lab, Northampton, 美国)软件绘制统计图表。用平均值±标准误(x±sx)来表示实验结果,组间的数据比较采用配对/非配对t检验或单因素方差分析。P < 0.05被认为差异有统计学意义。
2 结果 2.1 CTB和PRV介导的膈运动神经元逆行标记的比较为了准确定位脊髓膈运动神经元的位置,将不同的逆行示踪剂注射到小鼠右侧膈肌并比较它们的标记效率。首先将CTB555注射到右侧膈肌(图 1A),在CTB555注射10 d后,于颈髓中观察到标记的膈运动神经元,且这些神经元局限于前角第9板层膈运动神经元(phrenic motoneurons of lamina 9,Ph9)区域(图 1B)。同样,将PRV-EGFP注射到右侧膈肌,在PRV-EGFP感染后的不同时间收集脊髓和脑组织,发现感染2.0~ 2.5 d只标记了脊髓运动神经元(图 1C)。PRV-EGFP标记的神经元也见于颈髓对应节段的前角Ph9区域(图 1D)。进一步比较CTB555和PRV-EGFP对膈运动神经元的感染效率,其中C3~C6节段荧光标记距离以及每个节段阳性神经元比例差异均无统计学意义(图 1E、F)。
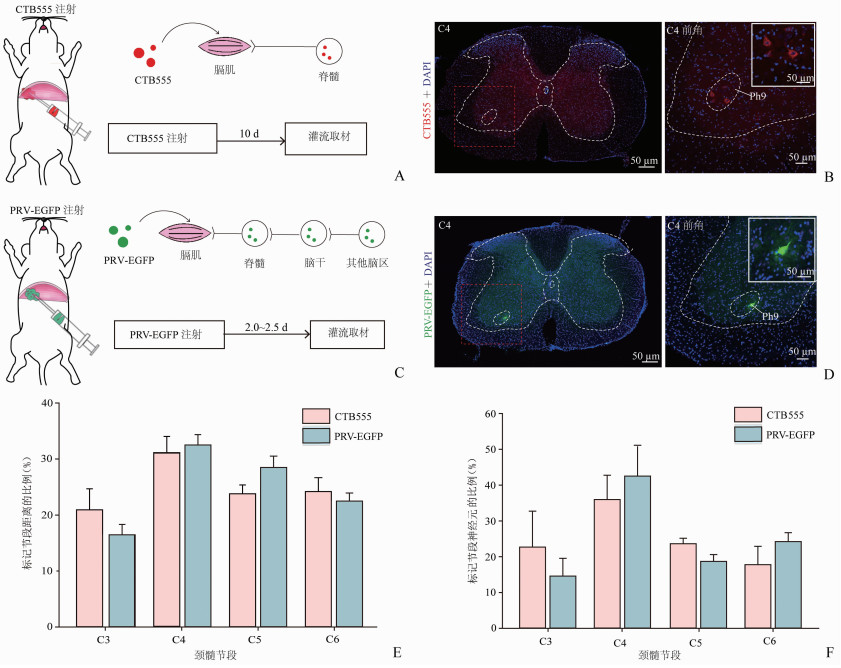
|
| A: 膈肌CTB555注射示意图;B: 代表性冠状图像显示CTB555标记的神经元在颈髓C4节段;C: 膈肌PRV-EGFP注射示意图;D: 代表性冠状切片图像显示PRV-EGFP标记的神经元在颈髓C4节段; E: 比较膈肌注射CTB555或PRV-EGFP在脊髓中C3~C6节段标记的距离;F: 比较膈肌注射CTB555或PRV-EGFP在脊髓中C3~C6节段标记的阳性细胞比例 图 1 CTB和PRV介导的膈运动神经元逆行标记的比较 |
因此,这两种示踪剂都可以用于膈肌到脊髓的逆行示踪研究。但考虑到PRV-EGFP对小鼠的毒力强、实验环境要求高(P2实验室)、不同感染时间跨突触水平差异大,而CTB注射具有方便性及稳定性的优点,所以在随后的实验中,选择CTB555进一步探索脊髓运动神经元的分布。
2.2 膈运动神经元的分布特征为了进一步探究支配膈肌的膈运动神经元的空间分布,利用CTB555逆行示踪,并从纵切面和冠状面观察标记的神经元(图 2A)。在纵切面上,在同侧的颈髓灰质中发现CTB555标记的膈运动神经元沿脊髓前正中裂纵向分布(图 2B)。在冠状面上,我们也在颈髓C3~C6节段的脊髓前角发现膈运动神经元,并且进一步发现这些神经元位于Ph9区域(图 2C)。进一步分析所有CTB555标记的神经元首尾端分布距离和每个节段标记的神经元数量。在C3~C6节段中,标记的神经元的总纵向跨度为(1.44±0.12)mm, C3~C6分别为(0.40±0.08)、(0.59±0.05)、(0.45±0.05)、(0.45± 0.03) mm,共标记到膈肌运动神经元(76.00±1.73)个,C3~C6分别为(17.00±7.57)、(27.33±5.24)、(18.00±1.53)、(13.67±4.23)个,其中膈运动神经元在C4节段分布最集中(图 2D、E)。
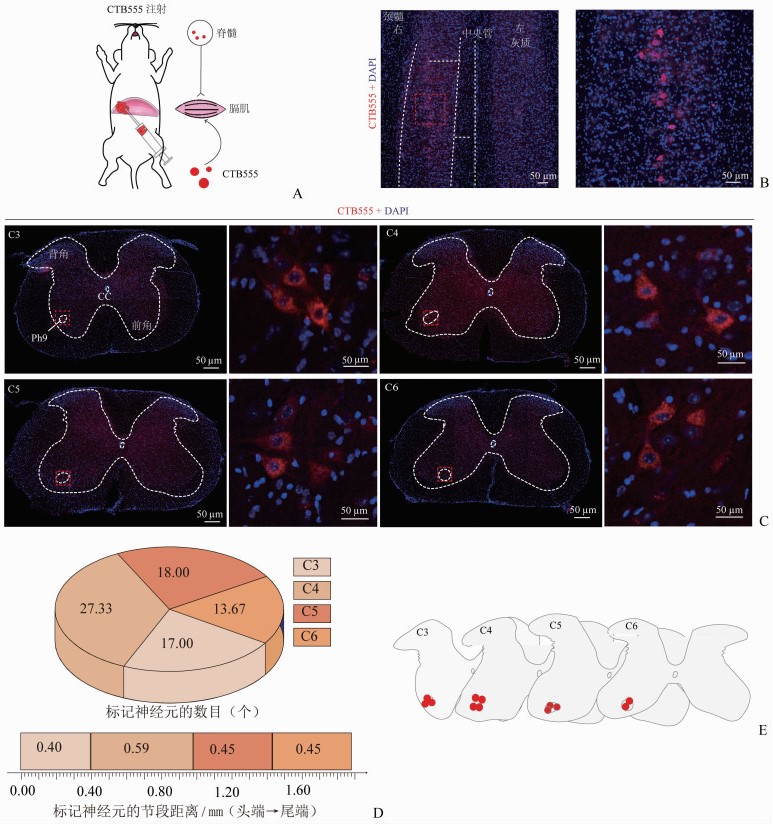
|
| A: 膈肌CTB555注射示意图; B: 脊髓纵向切片代表性图像;C:膈运动神经元在脊髓冠状切面的分布特征(头端→尾端);D:膈运动神经元细胞数目和C3~C6距离(n=3);E:膈运动神经元在颈髓中的分布示意图 1个红点表示6个CTB555标记的膈运动神经元 图 2 膈运动神经元的分布特征 |
2.3 膈运动神经元与非呼吸相关的三角肌运动神经元分布特征的比较
为了进一步探究颈髓中这些运动神经元是否会共同支配膈肌和非呼吸肌,将等量的CTB488和CTB555分别注射到同侧的三角肌和膈肌中(图 3A)。在C5、C6节段的同侧前角发现了由CTB488标记的支配三角肌的运动神经元和CTB555标记的膈运动神经元,然而这些神经元分布在不同的位置。CTB488标记的三角肌运动神经元主要位于第9板层三角肌运动神经元(deltoid motoneurons of lamina 9,De9)区域,而CTB555标记的膈运动神经元主要位于Ph9区域(图 3B、D)。但是这些神经元均能和胆碱能神经元标记物ChAT共标(图 3C),提示这些运动神经元都可能通过释放乙酰胆碱递质来发挥功能。
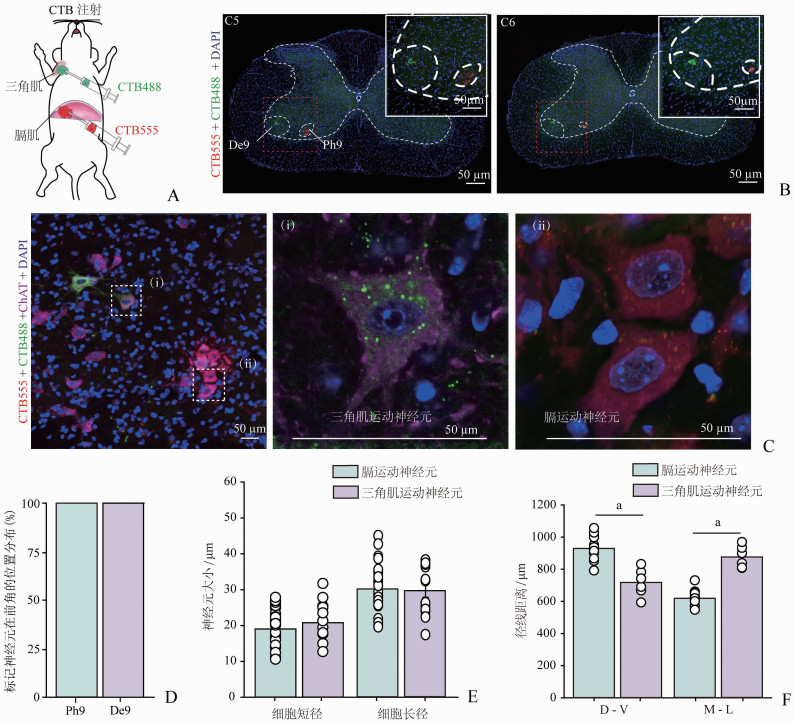
|
| A: 膈肌CTB555和同侧三角肌CTB488同时注射的示意图;B: 膈运动神经元和三角肌运动神经元在脊髓前角的分布位置;C: 膈运动神经元和三角肌运动神经元的ChAT免疫荧光染色 i:左图方框中三角肌运动神经元;ii:左图方框中膈运动神经元; D: 神经元的分布区域的统计分析(n=3);E: 神经元细胞大小比较(膈运动神经元:n=31,三角肌运动神经元:n=14);F:径向距离比较(膈运动神经元:n=13,三角肌运动神经元:n=6) a:P < 0.000 1 图 3 膈运动神经元与非呼吸相关的三角肌运动神经元分布特征的比较 |
为了进一步比较膈运动神经元和三角肌运动神经元的分布模式,测量了冠状切片中的神经元大小和它们的径向距离(D-V,M-L)。膈运动神经元和三角肌运动神经元的细胞大小(短径和长径)均没有明显的差异(图 3E)。此外,膈运动神经元的D-V距离大于三角肌运动神经元,而M-L距离较小(P < 0.000 1, 图 3F)。这些结果进一步表明:颈髓的膈运动神经元和非呼吸三角肌运动神经元在脊髓中具有不同的空间分布模式。
2.4 膈运动神经元与呼吸肋间运动神经元分布模式的比较为了研究支配不同呼吸肌的呼吸运动神经元在分布模式上的特点,对膈运动神经元和肋间运动神经元的分布特点进行进一步比较。通过向成年小鼠的同侧1~12肋间肌注射CTB555,发现肋间运动神经元分布在胸髓T1~T11节段,而膈运动神经元则分布在C3~C6节段(图 4A、B)。此外,膈运动神经元C3~C6节段神经元密度分布比较均匀(图 4A)。而T1~T11节段中的肋间运动神经元分布密度则以T2节段最为集中,且存在首尾端递减的趋势(P < 0.000 1,图 4B)。为了进一步比较这两组呼吸神经元柱的具体分布,测量了这些神经元离前角外侧边缘的垂直距离(L-M)(图 4C),发现颈髓的膈运动神经元柱从C3到C6逐渐向内侧的前角移动(图 4D),而肋间运动神经元柱则主要分布前角外侧区域,没有明显的转移(图 4E)。这两组呼吸运动神经元在脊髓中分布特征的差异,可能与呼吸肌的功能有关。
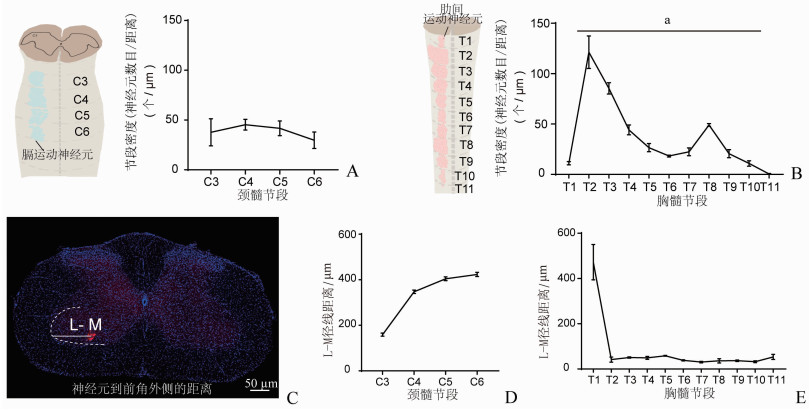
|
| A: 颈髓中膈运动神经元的节段细胞密度; B: 胸髓中呼吸肋间运动神经元的节段细胞密度 a: P < 0.000 1;C: 脊髓运动神经元距前角侧缘的径向距离(L-M)示意图; D: 膈运动神经元的L-M距离的分布;E: 肋间运动神经元的L-M距离的分布 图 4 膈运动神经元与肋间运动神经元分布特征的比较(n=3) |
3 讨论
脊髓呼吸运动神经元是呼吸运动的关键枢纽,它们接受上游呼吸中枢的传入信号,并传出兴奋调节吸气泵肌始动吸气[1-2, 24-25]。其中膈运动神经元和膈肌组成的运动单位是呼吸神经网络重要的组成部分[2]。为了更好地了解脊髓呼吸运动神经元在呼吸过程中的功能以及由其功能障碍引起的疾病的发病机理,有必要阐明脊髓呼吸运动神经元的详细解剖分布特征。因此,本研究对支配膈肌的膈运动神经元形态学分布特征进行了研究。首先比较了CTB555和PRV-EGFP对膈运动神经元的标记效率,但没有发现明显差异。PRV是外周至中枢神经系统中的一种新型示踪病毒[21, 26-27],考虑到其毒力作用强,在小鼠中的感染时间长短不一,以及需要在P2实验室中处理,而实验中对比研究发现CTB555介导的示踪结果更稳定,所以选择CTB555进行进一步实验。将CTB555注射到成年小鼠膈肌,发现膈运动神经元位于同侧脊髓灰质C3~C6节段,这与以前在大鼠和其他物种中的描述相似[5-12, 28-29],同时进一步发现这些神经元均位于C3~ C6节段的Ph9区,其M-L距离为(515.70±12.47)μm,D-V距离为(930.00±21.24)μm。另一个与之前描述一致的结果是膈运动神经元池在C3~C6节段中呈纵柱(束状)分布,且其逐渐向前角内侧偏移[10]。本研究在成年小鼠中共标记到(76.00±1.73)个膈运动神经元(73.00~79.00),最大密度出现在C4节段。然而在以前的报道中观察到膈运动神经元的数量(300~700)则更多[11],且主要集中在C3~C4节段[10, 15-16]。这种差异可能与我们的计数方式(80 μm计数1张脊髓片的标记神经元)有关,也可能是因为种属差异或者我们膈肌注射CTB的方法未能标记整个膈运动神经元池。目前已经报道的胸膜腔注射示踪方法可作为膈肌注射逆行示踪的替代方法[29],但是这种胸膜腔注射的方法并不适用于非呼吸肌比如上肢肌肉的逆行示踪。
平静呼吸过程中,除了膈运动神经元和膈肌以外,肋间运动神经元和肋间肌也是另一个重要的呼吸运动单位[30]。本研究发现成年小鼠支配所有肋间肌的肋间运动神经元位于同侧脊髓灰质T1~T11节段的纵柱中,而与膈运动神经元的呼吸神经元柱相比,膈运动神经元在C3~C6节段中逐渐向前角内侧偏移。膈运动神经元相对于颈髓前角的偏移分布可能是由于随着颈髓膨大,脊髓灰质的横向扩展[12]。此外,膈肌运动神经元在C3~C6节段的分布密度相对均匀,但在T1~T11节段的肋间运动神经元的分布密度则并不一致。这种不同的分布特征可能与膈运动神经元支配整个膈肌[31-32],而肋间运动神经元能同时支配着一个到多个肋间肌,且可能与这些不同的呼吸肌在呼吸运动中贡献的功能不同相关[33]。
颈髓中同时存在支配膈肌的膈运动神经元和支配非呼吸肌比如三角肌的运动神经元[14]。本研究比较了同侧的非呼吸相关的三角肌,发现三角肌运动神经元与膈运动神经元共同存在于C5~C6脊髓节段,然而膈运动神经元则位于颈髓前角更腹内侧的位置。虽然它们都释放乙酰胆碱递质,但其空间分布完全不同。这种空间分布模式可能与前角的脊髓运动神经元对应支配的肌肉的活动密切相关[2, 30, 34-36]。然而,不同的脊髓运动神经元的分布特征与其支配肌肉功能之间的具体联系还需要进一步研究。
综上所述,本研究通过膈肌注射不同的逆行示踪剂,绘制膈运动神经元在脊髓中的空间分布位置。成年小鼠膈运动神经元分布在颈髓的C3~C6节段前角Ph9区域,对比颈髓中对应节段的非呼吸相关的三角肌运动神经元,其分布在三角肌运动神经元更腹内侧的位置;对比胸髓中的呼吸肋间运动神经元,膈运动神经元的分布模式则更加均一。这些发现为探索脊髓中呼吸运动神经元调节呼吸回路的机制提供了新的视角,也为呼吸中枢神经系统的功能研究奠定了解剖学基础。
| [1] |
DEL NEGRO C A, FUNK G D, FELDMAN J L. Breathing matters[J]. Nat Rev Neurosci, 2018, 19(6): 351-367. |
| [2] |
FOGARTY M J, MANTILLA C B, SIECK G C. Breathing: motor control of diaphragm muscle[J]. Physiology (Bethesda), 2018, 33(2): 113-126. |
| [3] |
SIECK G C, MANTILLA C B. Effect of mechanical ventilation on the diaphragm[J]. N Engl J Med, 2008, 358(13): 1392-1394. |
| [4] |
LANE M A. Spinal respiratory motoneurons and interneurons[J]. Respir Physiol Neurobiol, 2011, 179(1): 3-13. |
| [5] |
ALVAREZ-ARGOTE S, GRANSEE H M, MORA J C, et al. The impact of midcervical contusion injury on diaphragm muscle function[J]. J Neurotrauma, 2016, 33(5): 500-509. |
| [6] |
MANTILLA C B, ZHAN W Z, SIECK G C. Retrograde labeling of phrenic motoneurons by intrapleural injection[J]. J Neurosci Methods, 2009, 182(2): 244-249. |
| [7] |
PRAKASH Y S, MANTILLA C B, ZHAN W Z, et al. Phrenic motoneuron morphology during rapid diaphragm muscle growth[J]. J Appl Physiol (1985), 2000, 89(2): 563-572. |
| [8] |
RANA S, SIECK G C, MANTILLA C B. Diaphragm electromyographic activity following unilateral midcervical contusion injury in rats[J]. J Neurophysiol, 2017, 117(2): 545-555. |
| [9] |
SMITH J C, ELLENBERGER H H, BALLANYI K, et al. Pre-Bötzinger complex: a brainstem region that may generate respiratory rhythm in mammals[J]. Science, 1991, 254(5032): 726-729. |
| [10] |
QIU K, LANE M A, LEE K Z, et al. The phrenic motor nucleus in the adult mouse[J]. Exp Neurol, 2010, 226(1): 254-258. |
| [11] |
WEBBER C L Jr, WURSTER R D, CHUNG J M. Cat phrenic nucleus architecture as revealed by horseradish peroxidase mapping[J]. Exp Brain Res, 1979, 35(3): 395-406. |
| [12] |
KESWANI N H, HOLLINSHEAD W H. The phrenic nucleus. Ⅲ. Organization of the phrenic nucleus in the spinal cord of the cat and man[J]. Proc Staff Meet Mayo Clin, 1955, 30(24): 566-577. |
| [13] |
GOSHGARIAN H G, RAFOLS J A. The phrenic nucleus of th albino rat: a correlative HRP and Golgi study[J]. J Comp Neurol, 1981, 201(3): 441-456. |
| [14] |
FOURNIER H D, MERCIER P, MENEI P. Spinal repair of ventral root avulsions after brachial plexus injuries: towards new surgical strategies?[J]. Neuro-Chirurgie, 2006, 52(4): 357-366. |
| [15] |
SUNSHINE M D, SUTOR T W, FOX E J, et al. Targeted activation of spinal respiratory neural circuits[J]. Exp Neurol, 2020, 328: 113256. |
| [16] |
ZHOLUDEVA L V, QIANG L, MARCHENKO V, et al. The neuroplastic and therapeutic potential of spinal interneurons in the injured spinal cord[J]. Trends Neurosci, 2018, 41(9): 625-639. |
| [17] |
LEYRER-JACKSON J M, HOLTER M, OVERBY P F, et al. Accumbens cholinergic interneurons mediate cue-induced nicotine seeking and associated glutamatergic plasticity[J]. eNeuro, 2021, 8(1): ENEURO.0276-ENEURO.0220.2020. |
| [18] |
REN S C, WANG Y L, YUE F G, et al. The paraventricular thalamus is a critical thalamic area for wakefulness[J]. Science, 2018, 362(6413): 429-434. |
| [19] |
WATSON C, PAXINOS G, KAYALIOGLU G, et al. The spinal cord[M]//Atlas of the mouse spinal Cord. San Diego: Academic Press, 2009: 308-379. DOI: 10.1016/B978-0-12-374247-6.50020-1.
|
| [20] |
CONTE W L, KAMISHINA H, REEP R L. Multiple neuroanatomical tract-tracing using fluorescent Alexa Fluor conjugates of cholera toxin subunit B in rats[J]. Nat Protoc, 2009, 4(8): 1157-1166. |
| [21] |
YAO J W, ZHANG Q C, LIAO X, et al. A corticopontine circuit for initiation of urination[J]. Nat Neurosci, 2018, 21(11): 1541-1550. |
| [22] |
FANG J T, YANG J T, YANG Y, et al. A novel rat model of brachial plexus injury with nerve root stumps[J]. J Neurosci Methods, 2018, 295: 1-9. |
| [23] |
DIMARCO A F, SUPINSKI G S, BUDZINSKA K. Inspiratory muscle interaction in the generation of changes in airway pressure[J]. J Appl Physiol, 1989, 66(6): 2573-2578. |
| [24] |
HAN J N, GAYAN-RAMIREZ G, DEKHUIJZEN R, et al. Respiratory function of the rib cage muscles[J]. Eur Respir J, 1993, 6(5): 722-728. |
| [25] |
SABOISKY J P, GORMAN R B, DE TROYER A, et al. Differential activation among five human inspiratory motoneuron pools during tidal breathing[J]. J Appl Physiol (1985), 2007, 102(2): 772-780. |
| [26] |
SMITH B N, BANFIELD B W, SMERASKI C A, et al. Pseudorabies virus expressing enhanced green fluorescent protein: a tool for in vitro electrophysiological analysis of transsynaptically labeled neurons in identified central nervous system circuits[J]. Proc Natl Acad Sci USA, 2000, 97(16): 9264-9269. |
| [27] |
STANLEY S, PINTO S, SEGAL J, et al. Identification of neuronal subpopulations that project from hypothalamus to both liver and adipose tissue polysynaptically[J]. Proc Natl Acad Sci USA, 2010, 107(15): 7024-7029. |
| [28] |
HOLLINSHEAD W H, KESWANI N H. Localization of the phrenic nucleus in the spinal cord of man[J]. Anat Rec, 1956, 125(4): 683-699. |
| [29] |
VANDEWEERD J M, HONTOIR F, DE KNOOP A, et al. Retrograde neuroanatomical tracing of phrenic motor neurons in mice[J]. JoVE, 2018(132). |
| [30] |
GIRAUDIN A, CABIROL-POL M J, SIMMERS J, et al. Intercostal and abdominal respiratory motoneurons in the neonatal rat spinal cord: spatiotemporal organization and responses to limb afferent stimulation[J]. J Neurophysiol, 2008, 99(5): 2626-2640. |
| [31] |
DIMARCO A F, KOWALSKI K E. Activation of inspiratory muscles via spinal cord stimulation[J]. Respir Physiol Neurobiol, 2013, 189(2): 438-449. |
| [32] |
SIECK G C, ROY R R, POWELL P, et al. Muscle fiber type distribution and architecture of the cat diaphragm[J]. J Appl Physiol Respir Environ Exerc Physiol, 1983, 55(5): 1386-1392. |
| [33] |
SUNSHINE M D, GANJI C N, REIER P J, et al. Intraspinal microstimulation for respiratory muscle activation[J]. Exp Neurol, 2018, 302: 93-103. |
| [34] |
LEMON R N. Descending pathways in motor control[J]. Annu Rev Neurosci, 2008, 31: 195-218. |
| [35] |
RAMÍREZ-JARQUÍN U N, TAPIA R. Excitatory and inhibitory neuronal circuits in the spinal cord and their role in the control of motor neuron function and degeneration[J]. ACS Chem Neurosci, 2018, 9(2): 211-216. |
| [36] |
LASKOWSKI M B, SANES J R. Topographic mapping of motor pools onto skeletal muscles[J]. J Neurosci, 1987, 7(1): 252-260. |




