肝细胞癌(hepatocellular carcinoma, HCC)是目前癌症相关死亡的第三大原因,并且持续处于高发生率和高死亡率。目前对于肝癌的治疗手段包括手术、化疗、放疗、生物靶向治疗等;对于晚期肝癌患者,目前缺乏有效的治疗手段[1]。索拉非尼(sorafenib, Sor)是一种小分子药物,可抑制肿瘤细胞增殖和肿瘤血管生成,并在多种肿瘤模型中增加肿瘤细胞的凋亡率[2]。它通过抑制丝氨酸-苏氨酸激酶(Raf-1、B-Raf)以及血管内皮生长因子受体(vascular endothelial growth factors receptors,VEGFRs)和血小板衍生生长因子受体β(platelet-derived growth factor receptor β,PDGFR-β)的受体酪氨酸激酶活性发挥作用,是治疗晚期肝癌的一线药物[2]。胆红素(bilirubin,Bil)是血液中衰老红细胞分解代谢的产物,在健康的肝细胞中胆红素可与葡萄糖醛酸结合并排泄到肠道。在肝细胞损伤的情况下,胆红素可以释放到血液中,与血清白蛋白紧密结合,因此,血胆红素水平在临床上也被用作肝功能的重要预测指标[3]。最近的研究发现,胆红素能够结合到过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor, PPARα)上,发挥代谢功能[4]。PPARα通过上调在过氧化物酶体和线粒体中的脂肪酸转运蛋白从而促进摄取、利用、代谢脂肪酸。
研究表明,升高的胆红素是索拉非尼治疗肝癌预后的一个不良预测因子[5-6]。但胆红素是否会影响索拉非尼对肝癌的治疗效果目前尚不清楚。本研究以人肝癌细胞株(Huh7细胞株)为研究对象,观察胆红素对索拉非尼诱导肝癌细胞凋亡的影响,并探讨胆红素发挥作用与PPARα/CPT1A信号途径的关系,为肝癌的防治提供新的证据。
1 材料与方法 1.1 主要材料与试剂胎牛血清购自ABW公司;结晶紫染色液、RIPA细胞裂解液、BCA蛋白浓度测定试剂盒、SDS PAGE蛋白上样缓冲液均购自碧云天公司;二甲基亚砜、CCK-8试剂盒购自索莱宝公司;兔抗人CPT1A、PPARα、β-actin抗体购自三鹰抗体公司;山羊抗兔二抗及山羊抗鼠抗体购自Affinity公司;PCR引物购自上海生工;逆转录试剂盒、SYBR Green购自Vazyme公司;细胞周期与细胞凋亡检测试剂盒购自贝博公司;胆红素、索拉非尼、乙莫克舍(etomoxir,Eto)、PEG400均购自上海陶术生物技术有限公司;DMEM培养基、青链霉素溶液(×100)、0.25% 胰蛋白酶均购自HyClone公司;PVDF膜购自赛默飞公司。
1.2 细胞培养人肝癌细胞Huh7细胞购自American Type Culture Collection(ATCC)。用含有10%胎牛血清和1%青链霉素培养基的DMEM培养基放在37 ℃、含5%CO2的孵箱中培养。
1.3 CCK-8法检测细胞增殖将Huh7细胞以3 000/孔接种在96孔板上。24 h后,Sor(0、2、4、8、16、32 μmol/L)、Bil(0、2.5、5、10、20、40 μmol/L)分别处理Huh7细胞24、48、72 h;随后将两者一起共同培养Huh7细胞(0、2、4、8、16、32 μmol/L的Sor分别加20 μmol/L Bil)孵育48 h,用PBS洗2遍,每孔加入10 μL CCK-8染料溶液与90 μL DMEM混合液,在37 ℃下培养2 h。使用酶标仪读取波长450 nm处的光密度值[D(450)]。细胞存活率计算公式如下。
细胞存活率=[D(450)药物处理样品-D(450)空白样本]/[D(450)对照样品-D(450)空白样本] ×100%
1.4 克隆形成实验Huh7细胞按1 500/孔接种于6孔板中,贴壁培养24 h。分别设置Bil(0、10和20 μmol/L)和Bil(0、10和20 μmol/L)+4 μmol/L Sor培养;每隔3 d换液1次,维持药物浓度,直到出现肉眼可见的细胞集落后,用甲醇固定15 min,结晶紫染色5 min后拍照。
1.5 细胞周期与细胞凋亡检测实验Huh7细胞按约5×104/孔接种于96孔板中,贴壁24 h后用无血清的DMEM培养16 h,设置4组,分别为:Con组、Bil组(20 μmol/L)、Sor组(4 μmol/L)、Bil(20 μmol/L)+ Sor(4 μmol/L)组,培养48 h。细胞周期实验:用PBS洗2遍,胰酶消化细胞后离心,用冷PBS洗2遍后,重新加入500 μL冷PBS重悬细胞,随后缓慢滴加1 500 μL预冷的无水乙醇,达到无水乙醇的终浓度为75%,4 ℃过夜。离心沉淀细胞后,再用冷PBS洗1次;500 μL冷PBS重悬细胞后加入20 μL Rnase A 37 ℃水浴30 min,400目网筛过滤。加入400 μL PI染液,轻轻混匀后4 ℃避光孵育1 h;上机,最大激发波长为488 nm。
1.6 裸鼠异种移植瘤模型雄性BALB/c裸鼠16只(5~6周龄,体质量20~22 g),收集培养的Huh7细胞并重悬于PBS中,然后皮下注射100 μL(含2×106个Huh7细胞) 细胞悬液于裸鼠的右腹股沟。植瘤10 d后,按S型抽样方法,分为4组:Con组、Bil组(25 mg·kg-1·d-1)、Sor组(15 mg· kg-1·d-1),Bil(25 mg·kg-1·d-1)+Sor(15 mg·kg-1·d-1)联用组,每组4只,给药方式均采用腹腔注射。监测动物活动及一般状况,每3天测量1次裸鼠体质量和肿瘤大小,并根据公式计算肿瘤体积。肿瘤体积=(a×b2)/2(a为长边,b为短边)。药物干预24 d后,处死小鼠,取肿瘤称量。
1.7 Western blot检测将药物处理过的细胞用冷PBS洗2遍,加入适量的RIPA裂解液在冰上分别提取Con组、Bil组、Sor组、Bil+Sor组的细胞。用碧云天BCA浓度试剂盒检测蛋白浓度后,每孔按照25 μg、10 μL体系进行上样;用80 V电泳20 min,随后用120 V电压电泳,当蛋白上样缓冲液到玻璃板底即停止。随后进行转膜。PVDF孔径为0.45 μm,甲醇激发,然后恒流250 mA、90 min在冰水混合物中转膜。转膜完毕,用5%BSA在摇床上室温封闭2 h。CPT1A(1 ∶1 000)、PPARα(1 ∶1 000)、β-actin(1 ∶5 000)按比例配置后4 ℃摇床过夜,PBST洗3次,每次5 min,第2天用Affinity二抗(1 ∶5 000)室温孵育2 h,PBST洗3次,每次5 min,用碧云天高敏ECL显影液在机器上曝光。
1.8 荧光定量PCR检测将药物处理过的细胞用PBS洗2遍,6孔板每孔加入1 mL TRIzol, 随后用TRIzol法提取总RNA,用分光光度计测量RNA浓度,随后按照诺维赞反转录说明书进行反转录。反转录完毕进行荧光定量PCR。CPT1A上游: 5′-GAGTGCCAGGAGGTCATAGATGC-3′,下游: 5′-CAGTCTCTGTCCTCCCTTCTCG-3′;ACOX1上游:5′-CTTGCTTCACCAGGCAACTG -3′,下游:5′-CTGTCTGGGCATAAGTGCCA-3′;PPARα上游:5′-GATGCGCTGACAGATGGAGA-3′,下游:5′-TAGAGACGGCTCTTCTGCCT-3′;GAPDH上游:5′-GAAGGCTGGGGCTCATTT-3′,下游:5′-CAGGAGGCATTGCTGATGAT-3′。
1.9 统计学分析采用GraphPad prism 8.3.0进行统计分析。实验重复3次,实验数据以x±s表示,两组间比较采用t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 Bil对Sor诱导的肝癌细胞生长活力的影响首先,以不同浓度Sor(0、2、4、8、16、32 μmol/L)处理Huh7细胞株24、48、72 h后,CCK-8法结果显示:随着Sor作用时间和浓度的增加,细胞活力下降,呈明显的时间和剂量依赖关系(P < 0.05,图 1A)。其次,以不同浓度Bil(0、2.5、5、10、20、40 μmol/L) 处理Huh7细胞株24、48、72 h后,CCK-8法结果显示:随着Bil作用时间和浓度的增加,细胞活力无明显变化(图 1B)。随后,以不同浓度Sor(0、2、4、8、16、32 μmol/L)与Bil(20 μmol/L)共同处理Huh7细胞48 h,CCK-8法结果显示:与单用Sor相比,Bil+Sor细胞活力增加(P < 0.05,图 1C)。
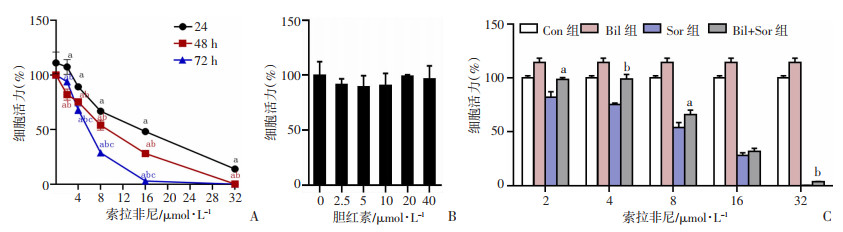
|
| A:不同Sor浓度对Huh7细胞活力的影响 a:P < 0.05,与同时间点前一浓度比较;b:P < 0.05,与同浓度24 h比较;c:P < 0.05,与同浓度48 h比较;B:不同Bil浓度对Huh7细胞活力的影响;C:不同浓度Sor浓度联合20 μmol/L Bil对Huh7细胞活力的影响 a: P < 0.05,b:P < 0.01,与Sor组比较 图 1 CCK-8法检测不同浓度Sor、Bil及Bil+Sor对人肝癌细胞系Huh7活力的影响(n=4) |
2.2 Bil对Sor诱导的细胞增殖抑制的影响
以不同浓度Bil(0、10、20 μmol/L)、Bil(0、10、20 μmol/L)联合4 μmol/L Sor处理Huh7细胞14 d,克隆形成实验结果显示:与Con组相比,单用Sor组的细胞克隆数减少(P < 0.01,图 2)。与单用Sor组相比,Bil+Sor组细胞克隆数增多(P < 0.05,图 2)。
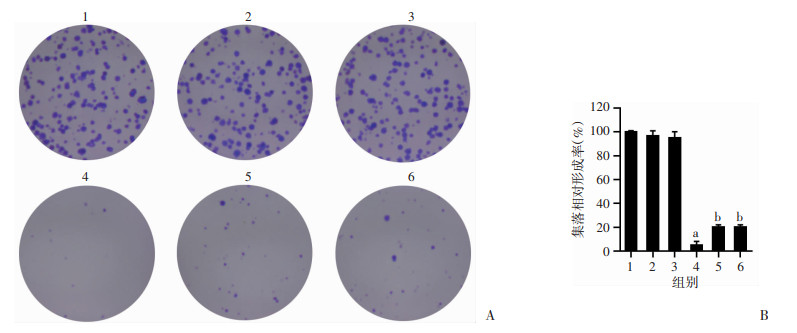
|
|
1:Con组;2:10 μmol/L Bil组;3:20 μmol/L Bil组;4:4 μmol/L Sor组;5:10 μmol/L Bil+Sor 4 μmol/L组;6:20 μmol/LBil+Sor 4 μmol/L组 a: P < 0.01, 与Con组比较;b: P < 0.05,与Sor组比较 A:克隆形成实验;B: 细胞克隆相对形成率(n=3) 图 2 克隆形成实验检测各组细胞增殖的情况 |
2.3 Bil对Sor诱导的肝癌细胞周期的影响
为了探究Bil减弱Sor诱导的肝癌细胞生长抑制作用与细胞周期调控的相关性,采用流式细胞仪进行检测分析。结果显示,各组细胞处理48 h后,与Sor组相比,Bil+Sor组S期细胞数目减少(P < 0.05,图 3)。
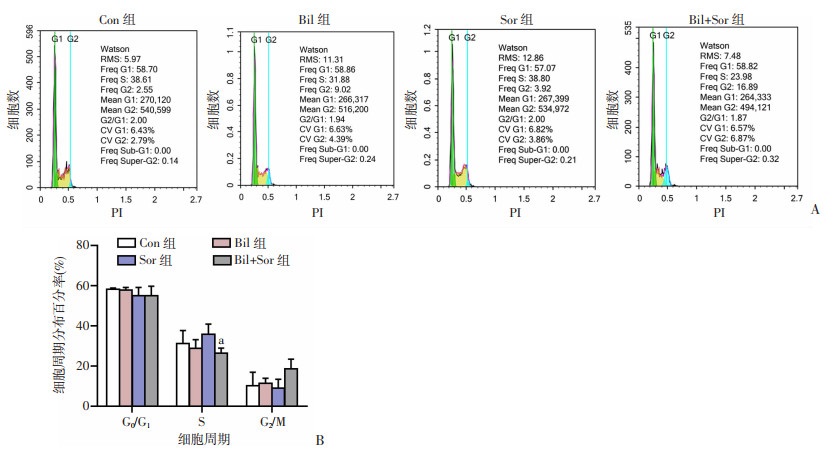
|
| A: 细胞周期实验; B: 细胞周期分布百分率(n=3) a: P<0.05, 与Sor组比较 图 3 流式细胞仪检测各组细胞周期的变化 |
2.4 Bil对Sor诱导的肝癌细胞体内生长抑制作用的影响
为了进一步研究Bil是否能在体内消除Sor的抗癌作用,以Huh7细胞(2×106)皮下注射到5~6周无胸腺裸鼠体内,Sor(15 mg·kg-1·d-1)、Bil(25 mg·kg-1·d-1)或Bil(25 mg·kg-1·d-1)联合Sor(15 mg·kg-1·d-1)处理。结果显示,Sor组的肿瘤体积和质量、肿瘤生长速率均低于Con组(P < 0.01,图 4),并且这种抗肿瘤作用在体内被Bil治疗逆转(P < 0.05,图 4)。
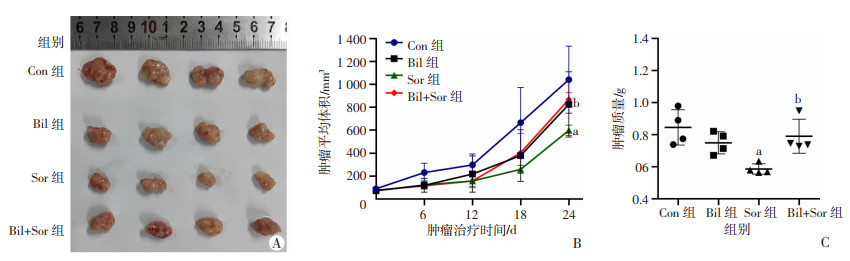
|
| A:裸鼠成瘤实验;B:肿瘤生长曲线;C:肿瘤质量 a: P < 0.01,与Con组比较;b: P < 0.05,与Sor组比较 图 4 裸鼠成瘤实验观测各组体内肝癌生长情况 |
2.5 Bil损害Sor诱导的肝癌细胞的生长抑制作用与激活PPARα/CPT1A有关
为了验证Bil削弱Sor诱导的肝癌细胞的生长抑制作用与脂肪酸氧化的相关性。通过检测是否共处理Bil情况下,Sor处理的Huh7细胞中脂肪酸氧化关键酶PPARα、CPT1A表达情况。Western blot检测结果显示,与单用Sor组相比,Bil+Sor组PPARα、CPT1A的表达量增加(P < 0.05, 图 5A、B)。荧光定量PCR结果也显示,与Sor组相比,Bil+Sor组Huh7细胞的PPARα、CPT1A、ACOX1的mRNA相对表达量明显升高(P < 0.01,图 5C)。
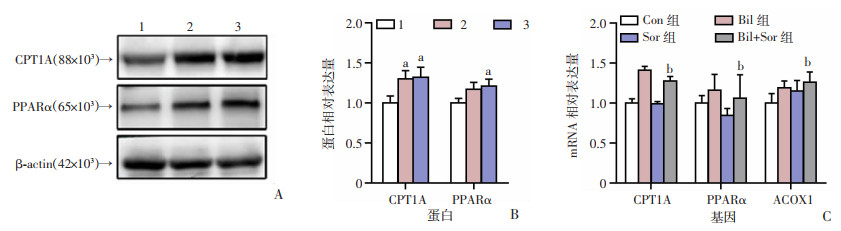
|
| A、B:Western blot检测蛋白表达及半定量分析 1:Sor(4 μmol/L)组;2:Bil(10 μmol/L)+Sor(4 μmol/L)组;3:Bil(20 μmol/L)+Sor(4 μmol/L)组 a: P < 0.05,与Sor组(4 μmol/L)比较;C:荧光定量PCR检测脂肪酸氧化相关关键基因CPT1A、PPARα、ACOX1的mRNA表达 b: P < 0.01,与Sor组比较 图 5 各组脂肪酸氧化相关基因在蛋白及mRNA水平表达情况 |
2.6 PPARα/CPT1A参与胆红素减弱索拉非尼诱导的肝癌细胞的生长抑制作用
为了进一步验证Bil降低Huh7细胞对Sor的敏感性是否与PPARα/CPT1A有关。CPT1A抑制剂Eto(75 μmol/L)与Sor(4 μmol/L)和Bil(10 μmol/L)共处理后,再次检测细胞增殖及克隆形成情况。结果显示:与Con组相比,Sor组细胞活力和克隆形成率均明显降低(P < 0.01,图 6);而Bil+Sor组细胞活力和克隆形成率较Sor组明显升高(P < 0.01,图 6);而Bil+Sor+Eto组细胞活力和克隆形成率较Bil+Sor组明显降低(P < 0.05,图 6)。
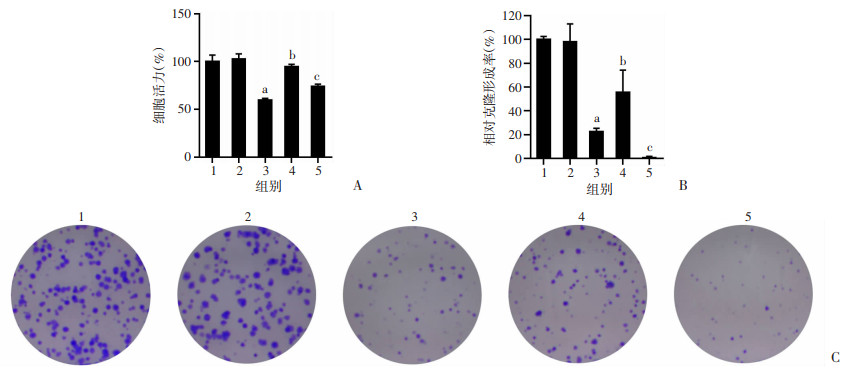
|
| A:CCK-8检测加入CPT1A抑制剂后细胞活力;B:相对集落形成率 1:Con组;2:Eto组;3:Sor组;4:Bil+Sor组;5:Bil+Sor+Eto组 a:P < 0.01,与Con组比较;b:P < 0.01,与Sor组比较;c:P < 0.05,与Bil+Sor组比较;C: 加入CPT1A抑制剂后细胞克隆形成能力检测 图 6 加入CPT1A抑制剂后细胞活力、克隆形成能力的变化 |
3 讨论
本研究通过体内外实验探讨胆红素在索拉非尼诱导的肝癌细胞增殖抑制中的作用。结果表明,胆红素减弱Huh7细胞在体内外对索拉非尼的敏感性。此外,实验结果进一步表明PPARα/CPT1A信号通路可能参与了胆红素减弱索拉非尼诱导的生长抑制作用;并且在胆红素存在下,使用CPT1A抑制剂增强索拉非尼诱导的HCC细胞凋亡。这些发现提示在胆红素升高的患者中,联合使用CPT1A抑制剂和索拉非尼对HCC患者可能具有一定的治疗价值。
索拉非尼是一种口服多激酶抑制剂,已被临床批准用于治疗晚期HCC患者。然而, 与索拉非尼治疗相关的生存益处约3个月[1-2]。而进展期肝癌在一般情况下都会有肝功能障碍,伴随胆红素升高[7]。本研究发现,使用不同浓度索拉非尼作用肝癌细胞时,加用胆红素处理,细胞活力增加10%~35%。这表明在胆红素存在条件下,HCC细胞对索拉非尼的敏感性减弱。
能量代谢的重新编程已经被认为是癌症的一个重要标志[8-9]。癌细胞将有氧糖酵解作为主要的能量来源,也可以利用其他物质如谷氨酰胺、脂肪酸等提供三磷酸腺苷(ATP)、烟酰胺腺嘌呤二核苷酸磷酸(NADPH)和癌细胞中其他重要大分子合成代谢物质[10-12]。在β-连环蛋白突变的肝癌、膀胱癌以及白血病的发生过程中观察到脂肪酸吸收和脂肪酸氧化(FAO)增强,并且在膀胱癌和急性白血病中使用CPT1A抑制剂能够抑制其增殖[13-15]。胆红素由体内衰老红细胞产生,很长一段时间被认为是肝脏疾病的潜在危险信号[3]。最近的研究显示胆红素也可以作为过氧化物酶体增殖物激活受体(PPARα)的激动剂[16]。PPARα是一种核受体,通过配体激活与数千个基因的启动子结合,以增加脂肪燃烧,减少脂肪储存[17]。PPARα通过调控转运脂肪酸进入线粒体进行β氧化对关键靶基因CPT1A发挥作用。乙莫克舍是CPT1A的抑制剂,已经用于心脏病和糖尿病的治疗,可以不可逆的抑制CPT1A的表达[18]。本研究通过Western blot和RT-qPCR探讨了胆红素减弱索拉非尼对HCC生长抑制的分子机制,胆红素可以增加索拉非尼治疗下PPARα、CPT1A的表达,相反,加入CPT1A抑制剂后,CCK-8实验和集落形成实验显示:乙莫克舍阻断了胆红素与索拉非尼潜在的分子机制方面的联系,使HCC细胞对索拉非尼敏感性增加。
综上所述,本研究结果表明,胆红素作为一个代谢调控物,通过促进脂肪酸氧化,从而减弱索拉非尼对肝癌的疗效,同时发现靶向脂肪酸氧化通路PPARα/CPT1A可以提高索拉非尼对肝癌细胞的抑制作用。但还需要更多的应用及毒理学研究来阐明联用效果、机制及毒副作用,将有助于在胆红素升高情况下增加晚期肝癌患者对索拉非尼的敏感性提供新的证据。
| [1] |
SUNG H, FERLAY J, SIEGEL R L, et al. Global cancer statistics 2020:GlOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA A Cancer J Clin, 2021, 71(3): 209-249. |
| [2] |
ZIOGAS I A, TSOULFAS G. Evolving role of sorafenib in the management of hepatocellular carcinoma[J]. World J Clin Oncol, 2017, 8(3): 203-213. |
| [3] |
HAMOUD A R, WEAVER L, STEC D E, et al. Bilirubin in the liver-gut signaling axis[J]. Trends Endocrinol Metab, 2018, 29(3): 140-150. |
| [4] |
STEC D E, JOHN K, TRABBIC C J, et al. Bilirubin binding to PPARα inhibits lipid accumulation[J]. PloS ONE, 2016, 11(4): e0153427. |
| [5] |
KUO Y H, WANG J H, HUNG C H, et al. Albumin-bilirubin grade predicts prognosis of HCC patients with sorafenib use[J]. J Gastroenterol Hepatol, 2017, 32(12): 1975-1981. |
| [6] |
NGUYEN T T H, NGUYEN V H, NGUYEN V H, et al. Role of baseline albumin-bilirubin grade on predict overall survival among sorafenib-treated patients with hepatocellular carcinoma in Vietnam[J]. Cancer Control, 2019, 26(1): 1073274819865269. |
| [7] |
TADA T, KUMADA T, TOYODA H, et al. Impact of albumin-bilirubin grade on survival in patients with hepatocellular carcinoma who received sorafenib: an analysis using time-dependent receiver operating characteristic[J]. J Gastroenterol Hepatol, 2019, 34(6): 1066-1073. |
| [8] |
FAUBERT B, SOLMONSON A, DEBERARDINIS R J. Metabolic reprogramming and cancer progression[J]. Science, 2020, 368(6487): eaaw5473. |
| [9] |
WANG Y G, XIA Y, LU Z M. Metabolic features of cancer cells[J]. Cancer Commun, 2018, 38(1): 65. |
| [10] |
BENSINGER S J, CHRISTOFK H R. New aspects of the Warburg effect in cancer cell biology[J]. Semin Cell Dev Biol, 2012, 23(4): 352-361. |
| [11] |
KOPPENOL W H, BOUNDS P L, DANG C V. Otto Warburg's contributions to current concepts of cancer metabolism[J]. Nat Rev Cancer, 2011, 11(5): 325-337. |
| [12] |
CAIRNS R A, HARRIS I S, MAK T W. Regulation of cancer cell metabolism[J]. Nat Rev Cancer, 2011, 11(2): 85-95. |
| [13] |
CHENG S T, WANG G, WANG Y, et al. Fatty acid oxidation inhibitor etomoxir suppresses tumor progression and induces cell cycle arrest via PPARγ-mediated pathway in bladder cancer[J]. Clin Sci (lond), 2019, 133(15): 1745-1758. |
| [14] |
SENNI N, SAVALL M, CABRERIZO GRANADOS D, et al. Β-catenin-activated hepatocellular carcinomas are addicted to fatty acids[J]. Gut, 2019, 68(2): 322-334. |
| [15] |
RICCIARDI M R, MIRABILⅡ S, ALLEGRETTI M, et al. Targeting the leukemia cell metabolism by the CPT1a inhibition: functional preclinical effects in leukemias[J]. Blood, 2015, 126(16): 1925-1929. |
| [16] |
MONTAGNER A, POLIZZI A, FOUCHÉ E, et al. liver PPARα is crucial for whole-body fatty acid homeostasis and is protective against NAFlD[J]. Gut, 2016, 65(7): 1202-1214. |
| [17] |
GORDON D M, BLOMQUIST T M, MIRUZZI S A, et al. RNA sequencing in human HepG2 hepatocytes reveals PPAR-α mediates transcriptome responsiveness of bilirubin[J]. Physiol Genomics, 2019, 51(6): 234-240. |
| [18] |
LOPASCHUK G D, WALL S R, OLLEY P M, et al. Etomoxir, a carnitine palmitoyltransferase Ⅰ inhibitor, protects hearts from fatty acid-induced ischemic injury independent of changes in long chain acylcarnitine[J]. Circ Res, 1988, 63(6): 1036-1043. |




