2. 400016 重庆,重庆医科大学附属第一医院:重大代谢性疾病转化医学重点实验室
2. Key Laboratory of Translational Medicine for Major Metabolic Diseases, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
髓系白血病是一类起源于骨髓造血干细胞的克隆性增殖的恶性肿瘤,其中以急性髓系白血病(acute myeloid leukemia,AML)发病为主,慢性粒细胞白血病(chronic myeloid leukemia,CML)其次[1-2]。根据SEER回顾研究发现髓系白血病确诊时中位年龄为68岁左右[3],这意味着老年患者仍面临化疗不耐受及较差的预后。与此同时,相较于原发AML而言,由骨髓增生异常综合征(myelodysplastic syndromes,MDS)等血液系统疾病所继发急性髓系白血病(secondary acute myeloid leukemia,sAML)发病率随着年龄增长也逐渐增高,且同时伴随更高复发率及更差预后[4]。因此,目前仍然亟待探索针对sAML的新治疗方案。近年来,联合用药已被认为是一种毒性低、副作用少的治疗策略,可用于提高单药治疗的疗效。
近年来,研究发现表观遗传学及免疫功能失调等诸多因素参与了MDS及sAML发生发展。西达本胺(chidamide,CDM)是一类新型组蛋白去乙酰化酶(histone deacetylase,HDAC)抑制剂,而吗替麦考酚酯(mycophenolate mofetil,MMF)是一类造血干细胞移植术后常用免疫抑制剂。本研究旨在探究CDM联合MMF对sAML细胞增殖的影响,为全面探究CDM联合MMF治疗sAML的作用及潜在作用机制提供理论依据。
1 材料与方法 1.1 细胞培养以慢性髓系白血病急变期细胞株K562及MDS转白细胞株SKM-1为研究模型,细胞培养用RPMI1640培养基(美国赛默飞世尔公司),含10%胎牛血清(德国PAN seratech公司)和1%青-链霉素(中国碧云天公司),在37 ℃恒温、5%CO2孵箱中孵育,取对数生长期细胞进行实验。
1.2 药物及处理方式CDM购自深圳微芯生物,MMF购自瑞士罗氏公司。CDM和MMF均以二甲基亚砜(DMSO)溶解为50 mmol/L浓度,分装保存在-20 ℃备用。
1.3 CCK-8法检测细胞增殖细胞以5×103/孔接种到96孔板中,并加入CDM单药(0.25、0.5、1、2、4 μmol/L),MMF单药(0.5、1、2、4、8 μmol/L)及联合用药(CDM∶MMF=1∶2),在37 ℃,5%CO2孵箱中分别孵育24、48、72 h后,加入CCK-8试剂,孵育2 h。然后用Multiskan光谱(美国赛默飞世尔公司)在450 nm读取D(450)值。细胞抑制率=[D(450)对照组-D(450)用药组]/[D(450)对照组-D(450)空白组]×100%。
1.4 流式细胞学检测细胞凋亡及周期将细胞随机分为对照组、单药CDM(1 μmol/L)、单药MMF(2 μmol/L)、联合用药组(1 μmol/L CDM+2 μmol/L MMF)进行干预,并在37 ℃、5%CO2条件下孵育72 h后,PBS洗涤。细胞凋亡分析用5 mL Annexin V-FITC和10 mL PI(德国BD Biosciences),2~8 ℃避光孵育20 min后检测。细胞周期则用75%乙醇(-20 ℃)固定,-4 ℃过夜,50 mg/mL含RNase的PI染色30 min,BD流式细胞仪分析检测。采用FlowJo 10.6.2软件对细胞凋亡率及各周期细胞比例进行分析。
1.5 CDM、MMF药物及继发性急性髓系白血病候选作用靶点筛选利用PubChem数据库得到CDM及MMF药物化学结构及其相关标准延时格式(Standard Delay Format,SDF)文件。选用SEA、Swiss Target Predict、TargetNe及PharmMapper等4个网络药理学数据库来筛选候选靶点。将上述各自候选靶点分别汇总去重后获得CDM和MMF的药物作用靶点。利用OMIM、DisGeNet及GeneCard等3个数据库,获得与sAML相关疾病靶点,进行汇总去重后得到相关疾病靶点。
1.6 蛋白-蛋白互作(protein-protein interaction,PPI)网络构建及分析将上述药物及疾病共同候选靶点上传至STRING平台(https://string-db.org/),最低相互作用阈值≥0.9,得到PPI网络图。同时利用MCODE插件对PPI网络进行聚类分析及拓扑分析,分别筛选得到12个拓扑数据,进而筛选出最佳关键核心靶点。
1.7 基因本体(GO)和KEGG通路富集分析利用DAVID在线富集分析网站(https://david.ncifcrf.gov/)对上述PPI候选靶点进行基因本体论(gene ontology,GO)和京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)途径富集分析,涉及生物过程(biological process,BP)、细胞组分(cellular component,CC)、分子功能(molecular function,MF)及信号通路(Pathway)等,并通过微生信网站进行数据可视化(http://www.bioinformatics.com.cn/)。
1.8 统计学分析采用GraphPad Prism8.01软件进行统计分析,结果用x±s表示,多组间比较采用one-way ANOVA分析,两因素比较采用two-way ANOVA分析,然后Tukey’s事后检验,P<0.05表示差异有统计学意义。联合用药协同作用评估使用CompuSyn软件计算联合指数(CI),CI<1表示协同作用;CI=1表示相加作用;CI>1表示拮抗作用。所有实验为3次独立实验。
2 结果 2.1 CDM和MMF对继发性急性髓系白血病细胞增殖作用的影响CDM及MMF无论是单药还是联合方案,都呈现以时间依赖性及浓度依赖性的方式抑制细胞生长。干预72 h后,CDM单药和MMF单药对K562细胞的IC50分别为(5.782±5.459)μmol/L和(3.924±1.051)μmol/L,而SKM-1细胞中分别为(1.138±0.261)μmol/L和(1.267±0.193)μmol/L(图 1A、B)。干预72 h后,与单药作用相比较,在K562细胞中不同浓度组的联合用药方案细胞抑制率均明显增高(P<0.01),在SKM-1细胞中仅1 μmol/L CDM+2 μmol/L MMF组细胞抑制率同时高于CDM及MMF单药组(P<0.01,图 1C)。CompuSyn分析显示,K562细胞的CI在0.324 61~0.782 77之间,而SKM-1中除0.25 μmol/L CDM+0.5 μmol/L MMF组外,其余CI在0.630 98~0.929 04之间,表明联合方案具有较好协同效应(图 1D)。1 μmol/L CDM+2 μmol/L MMF浓度方案在K562和SKM-1组中的细胞抑制率均明显优于CDM和MMF单药组,故以此浓度方案进行后续实验。

|
| A、B:CCK-8法检测不同处理下各时间点K562、SKM-1细胞增殖抑制率;1~5分别对应药物浓度:CDM 0.25、0.5、1、2、4 μmol/L,MMF 0.5、1、2、4、8 μmol/L及联合用药CDM∶MMF=1∶2 C:西达本胺与吗替麦考酚酯处理72 h后K562、SKM-1细胞抑制率;1~5分别对应药物浓度:CDM 0.25、0.5、1、2、4 μmol/L,MMF 0.5、1、2、4、8 μmol/L及联合用药CDM∶MMF=1∶2 a:P<0.05,与CDM组比较;b:P<0.05,与MMF组比较;D:CompuSyn软件分析CI计算结果 图 1 CCK-8法检测西达本胺与吗替麦考酚酯处理下各时间点K562、SKM-1细胞增殖抑制率(n=3,x±s) |
2.2 CDM和MMF对继发性急性髓系白血病细胞凋亡的影响
药物处理72 h后,与对照组相比,K562细胞(图 2A、C)及SKM-1细胞(图 2B、D)中,联合用药组早期、晚期及总凋亡细胞(Annexin V阳性)比例明显增高(P<0.05),MMF单药组总凋亡率均增高(P<0.05)。而CDM组仅在SKM-1细胞中提示晚期、总凋亡率增高(P<0.05)。与CDM单药组比较,联合用药组在K562细胞中早期、晚期及总凋亡率都增高(P<0.05),在SKM-1细胞中无统计学差异。与MMF单药组相比,联合用药组在K562细胞中早期及总凋亡率增高(P<0.05),而SKM-1细胞中无统计学差异。
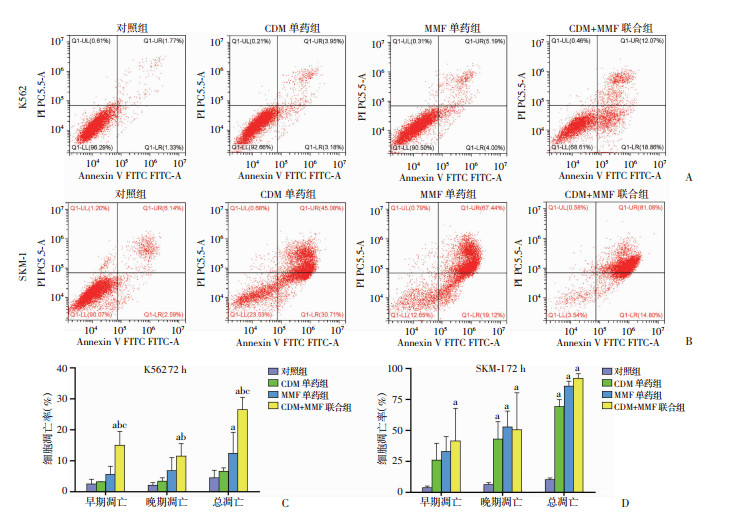
|
| A、B:流式细胞学检测K562、SKM-1细胞凋亡率;C、D:K562、SMK-1细胞凋亡率统计分析;a:P<0.05,与对照组比较;b:P<0.05,与CDM组比较;c:P<0.05,与MMF组比较 图 2 西达本胺与吗替麦考酚酯对K562、SKM-1细胞凋亡的影响(n=3,x±s) |
2.3 CDM和MMF对继发性急性髓系白血病细胞周期的影响
药物处理72 h后,与对照组相比,单药CDM及联合用药方案在K562细胞(图 3A、C)和SKM-1细胞(图 3B、D)中均出现显著G0/G1周期比例增高(P<0.05),S期比例下降(P<0.01),提示出现G0/G1期阻滞。而单药MMF组仅在K562细胞中出现S期比例增高(P<0.05)及G2/M期比例降低(P<0.05),提示S期阻滞。相较于单药组,联合用药组在K562及SKM-1中均较MMF单药组出现显著G0/G1周期比例增高(P<0.01),与CDM单药组间无统计学差异。
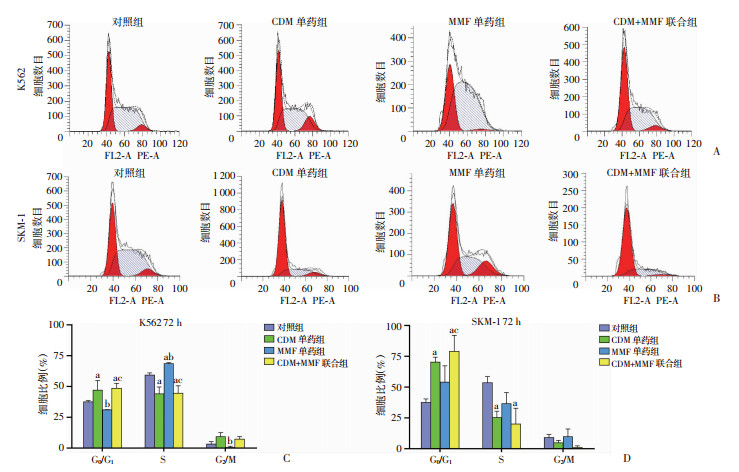
|
| A、B:流式细胞学检测K562、SKM-1细胞周期变化;C、D:K562、SKM-1细胞周期统计分析a:P<0.05,与对照组比较;b:P<0.05,与CDM组比较;c:P<0.05,与MMF组比较 图 3 西达本胺与吗替麦考酚酯对K562、SKM-1细胞周期的影响(n=3,x±s) |
2.4 CDM和MMF药物候选作用靶点及疾病相关靶点的获取与筛选
为了进一步研究CDM和MMF联合治疗sAML的作用机制,通过已知药物及疾病数据库的网络药理学策略,分别从SEA数据库得到CDM 38个及MMF 38个靶点、PharmMapper数据库得到CDM 89个及MMF 136个靶点、Swiss Target Predict数据库得到CDM 102个及MMF 109个靶点、TargetNet数据库得到CDM 56个和MMF 27个靶点。汇总剔重后,分别得到CDM 246个、MMF 244个药物作用靶点。从OMIM数据库、DisGeNet数据库及GeneCards数据库分别获取sAML相关靶点117、385、11 250个,最终汇总剔重得到11 308个疾病相关靶点。如图 4所示,CDM-MMF-sAML三者共有98个潜在作用靶点交集。

|
| 紫红色:示CDM-MMF-sAML三者共同靶点;紫色:示sAML-MMF二者单独作用共同靶点;粉色:示sAML-CDM二者单独作用共同靶点;蓝色:示CDM-MMF二者单独作用共同靶点 图 4 西达本胺及吗替麦考酚酯药物靶点与继发性急性髓系白血病疾病相关CDM-MMF-sAML候选靶点网络图 |
2.5 CDM联合MMF作用于继发性急性髓系白血病相关PPI网络构建
将上述98个靶点上传至STRING数据分析平台构建PPI网络图,除去孤立靶点后,利用Cytoscape软件成功构建共同作用靶点PPI网络图(图 5A),包括66个节点、222条边。利用MCODE算法进一步筛选出5个聚类子网络图,按照其评分高低,分别如图 5B~F排列,评分越高其相对作用越关键。该子网络PPI网络主要聚类于细胞分化、磷脂酰肌醇介导的信号、肽基酪氨酸磷酸化、血小板激活等生物功能,而其中最重要的聚类集合主要影响细胞周期相关通路。为了进一步探究PPI网络中核心枢纽靶点,利用Cytoscape中CytoHubba插件对整个网络进行拓扑学分析,根据12个拓扑学指标筛选出了9个核心靶点,分别为CDK1、CDK2、CDK4、CDK6、CDK9、SYK、BTK、KDR、PIK3CB(表 1)。

|
| A:CDM-MMF-sAML药物-疾病相关PPI网络图(包括66个节点、222条边);B:聚类子网络1(包括10个结节,43条边,得分9.556);C:聚类子网络2(包括4个结节,5条边,得分3.333);D:聚类子网络3(包括8个结节,11条边,得分3.143);E:聚类子网络4(包括3个结节,3条边,得分3);F:聚类子网络5(包括3个结节,3条边,得分3);MCODE算法聚类筛选出PPI网络中功能聚合最显著的5个子网络,并根据其log10(P)值列出其各自主要涉及的BP及KEGG通路 图 5 西达本胺联合吗替麦考酚酯作用于继发性急性髓系白血病相关PPI构建 |
| 基因 | MCC | DMNC | MNC | 节点度 | EPC | BottleNeck | EcCentricity | 亲和度 | 辐射度 | 中间性 | 应力 | Clustering Coefficient |
| KDR | 30 | 0.402 46 | 7 | 7 | 13.899 | 1 | 0.308 08 | 30.5 | 3.619 95 | 22.650 61 | 186 | 0.523 81 |
| BTK | 84 | 0.466 52 | 8 | 8 | 14.012 | 1 | 0.231 06 | 29.083 33 | 3.435 1 | 15.682 88 | 86 | 0.571 43 |
| CDK9 | 40 326 | 0.715 99 | 9 | 9 | 15.94 | 2 | 0.231 06 | 29.5 | 3.435 1 | 35.818 55 | 226 | 0.833 33 |
| CDK6 | 5 776 | 0.542 98 | 11 | 11 | 17.283 | 6 | 0.231 06 | 31.75 | 3.589 14 | 83.826 91 | 526 | 0.581 82 |
| CDK4 | 46 104 | 0.587 56 | 13 | 13 | 17.671 | 1 | 0.231 06 | 33.833 33 | 3.727 78 | 145.883 68 | 854 | 0.589 74 |
| CDK2 | 46 105 | 0.712 66 | 11 | 12 | 17.027 | 1 | 0.231 06 | 31.5 | 3.542 93 | 108.974 64 | 452 | 0.636 36 |
| CDK1 | 46 142 | 0.493 58 | 16 | 16 | 18.843 | 5 | 0.308 08 | 35.833 33 | 3.835 61 | 206.594 02 | 1 082 | 0.458 33 |
| PIK3CB | 108 | 0.477 33 | 9 | 9 | 15.646 | 1 | 0.231 06 | 30.583 33 | 3.542 93 | 21.395 35 | 164 | 0.555 56 |
| SYK | 96 | 0.453 46 | 9 | 9 | 15.594 | 1 | 0.231 06 | 29.583 33 | 3.465 91 | 15.968 11 | 104 | 0.527 78 |
| MCC:最大集团中心度;DMNC:最大邻域分量密度;MNC:最大邻域分量;EPC:边缘渗透分量 | ||||||||||||
2.6 潜在治疗靶点的GO及KEGG通路富集分析
通过DAVID数据库对上述66个作用靶点进行富集分析,分别得到GOBP富集条目257条、GOCC富集条目45条、GOMF富集条目57条、KEGG富集条目94条,对上述富集结果前20条进行可视化(图 6A~D)。发现共同靶点主要涉及蛋白质磷酸化、肽基丝氨酸、苏氨酸、酪氨酸等磷酸化、信号转导、T细胞受体信号通路、磷脂酰肌醇介导信号通路、细胞增殖、凋亡调控、血管内皮生长因子受体信号通路、p53类介质对信号转导的调控、磷脂酰肌醇3-激酶(PI3K)信号转导的调节、细胞分裂等多种生物进程,主要在胞质、PI3K复合物、细胞周期蛋白依赖性蛋白激酶全酶复合物(CDKs)、中心体、质膜、线粒体、与CDK2相关的细胞周期复合物等细胞成分中,发挥了激酶活性、ATP结合、蛋白质结合、细胞周期蛋白激酶活化、蛋白激酶结合、蛋白酪氨酸激酶活化、PI3K活化、MAPK活化、细胞周期蛋白结合等分子功能。而通过对其KEGG通路富集分析结果判读,发现与sAML相关潜在通路可能涉及FOXO信号通路、肿瘤相关通路、病毒致癌作用、PI3K-AKT信号通路、细胞周期、血小板激活、癌症相关蛋白多糖通路等。

|
| A:生物学进程富集分析图;B:细胞成分富集分析图;C:分子功能富集分析图;D:KEGG通路富集分析图(图中圆圈大小代表富集的基因数目,颜色由蓝至红,越红代表P值越小,显著性越高);E:核心靶点基因所富集的相关重要生物进程及信号通路桑基图(图中方块大小代表其富集数目的大小,反映其重要程度) 图 6 潜在治疗靶点的前20位GO及KEGG通路富集分析 |
如图 6E所示,通过进一步评估PPI网络中9个核心靶点在GO及KEGG中的富集情况,发现蛋白质磷酸化(CDK4、CDK6、CDK9、SYK、BTK)、有丝分裂细胞周期的G1/S过渡(CDK1、CDK2、CDK4、CDK6)及细胞分化(CDK1、CDK2、CDK4、CDK6)为核心靶点主要富集生物进程,而与sAML相关性最高的富集通路为PI3K-AKT信号通路(CDK1、CDK2、CDK4、CDK6、SYK、PIK3CB)。
3 讨论白血病是一类起源于造血干细胞的最常见的恶性血液系统疾病,其中以AML占比最高,其次是CML,目前中位确诊年龄在68岁左右[3]。随着老龄化的进展,近年来髓系白血病的发病率呈现上升趋势[5],尤其对于老年或健康状况不佳的AML患者而言,他们往往很难耐受常规化疗等治疗手段[6]。同时,相较于原发性AML患者,sAML或CML急变期的患者可能面临更低的整体治疗缓解率、更短的生存期,以及极差的整体预后[4, 7]。因此,目前仍亟待寻找高效、低毒且耐受性好的治疗方案。
3.1 CDM及MMF抑制sAML细胞增殖MMF是一种非竞争性的肌苷-5′-单磷酸脱氢酶(inosine monophosphate dehydrogenase,IMPDH)抑制剂,目前被广泛用于预防移植术后的移植物抗宿主病(graft versus-host disease,GVHD)[8-9]。有研究发现,IMPDHⅡ型的表达量在白血病细胞中是正常细胞的15~42倍[10],由于IMPDH是一种通过将IMP转化为XMP来催化从头合成嘌呤的关键限速酶,其在白血病中具有潜在的抗肿瘤活性[11-12]。有针对CML急变期的Ⅰ/Ⅱ期临床试验发现,患者对于非竞争性IMPDH抑制剂噻唑羧胺核苷(Tiazofurin)的客观应答率(ORR)为48%,为此Tiazofurin也在2000年被美国FDA批准为该病的孤儿药[13]。这一结果也为探究MMF用于AML的治疗潜力提供了理论依据。有研究[14]报道,在人B细胞淋巴瘤、T细胞白血病、T淋巴母细胞瘤、胰腺癌、结肠腺癌和非小细胞肺腺癌的裸鼠移植瘤模型和同基因小鼠B细胞淋巴瘤转移模型的相关实验中,MMF均表现出显著的抗肿瘤生长作用。另有研究[15-16]报道,MMF不仅可诱导骨髓瘤细胞、人结肠癌细胞G1~S期细胞周期阻滞,还能激活Caspase依赖通路促进细胞凋亡。与前述报道一致,本研究表明,单药MMF确实可以抑制K562、SKM-1细胞株增殖,且呈时间依赖性及浓度依赖性;同样,MMF可能进一步诱导K562细胞S期阻滞。结合其后的网络药理学分析结果,不难发现CDM与MMF联合作用的9个核心靶点中,CDK1、CDK2、CDK4、CDK6、CDK9均与细胞周期直接相关。这一结果再次佐证了MMF很可能主要通过靶向细胞周期相关通路的核心靶点,达到抗肿瘤增殖的作用。除了本研究所涉及的肿瘤增殖、凋亡及周期等功能外,有研究发现MMF可能通过降低结肠癌及前列腺癌细胞的黏附力,进一步帮助降低实体肿瘤侵袭能力[17]。同时值得留意的是,还有研究发现MMF可以通过降低细胞内GTP水平,诱导HL-60和U937细胞以及一些具有中度成熟倾向的新鲜白血病细胞发生分化[18]。综上所述,可以推测MMF很可能成为sAML的潜在抗肿瘤新药,本研究结果为未来进一步探寻其用于临床研究的可能性提供了一定的理论依据。
由于恶性肿瘤疾病的复杂性和异质性,单一抗肿瘤药物的治疗效果往往较为有限,故本研究就MMF联合一种新型表观遗传修饰靶向药物共同用于sAML治疗的可行性进行了探究。CDM作为一种新型口服HDAC抑制剂,其主要作用机制为抑制HDAC去除组蛋白和非组蛋白赖氨酸残基上的乙酰化的能力,从而导致固缩的染色质展开,进而诱导先前沉默的抑癌基因转录激活[19]。此外,HDAC抑制剂还能介导癌细胞的死亡、分化、周期停滞等功能,且对健康细胞的毒性较小[20]。前期本课题组研究发现,CDM单药可能通过降低p-PI3K和p-AKT水平,抑制PI3K/AKT信号通路的激活、诱导K562细胞G0/G1细胞周期阻滞和凋亡,从而抑制细胞增殖[21]。多项研究表明,CDM不仅可以通过Hedgehog信号通路抑制伊马替尼耐药K562细胞株增殖并诱导凋亡[22],还可以通过上调H2AX蛋白磷酸化及下调ATM和BRCA1蛋白磷酸化水平,逆转CML阿霉素耐药细胞株对柔红霉素的耐药性[23]。除此之外,还有多项白血病治疗的基础及临床研究发现,CDM在与诸如地西他滨、维奈托克等多种药物联合治疗时,表现出较好的安全性及有效性[24-27]。结合本研究结果表明,CDM联合MMF方案在抑制sAML细胞生长方面优于单药治疗,主要表现在显著提高了细胞凋亡率,其中以早期凋亡为主。就细胞周期而言,联合方案与CDM单药方案均以G0/G1细胞周期阻滞为主要表现,二者无统计学差异,这意味着在联合方案对细胞周期的阻滞表现中,CDM可能发挥了主要作用。上述结果提示小剂量CDM联合MMF可能是一种用于sAML的潜在有效的治疗方案。
3.2 药物-疾病作用机制本研究整合多个药物-疾病数据库信息,利用网络药理学系统探究并阐述了CDM联合MMF用于sAML治疗的潜在作用机制[28]。如上述结果所示,联合药物-疾病相关靶点PPI中有66个节点、222条边。其GO及KEGG富集分析表明,CDM联合MMF治疗sAML的机制主要通过细胞质、细胞核质、PI3K复合物、质膜、中心体、CDKs、线粒体等细胞成分,参与蛋白质磷酸化、细胞增殖、信号转导、凋亡调控、转录因子活性调节等生物进程,发挥ATP结合、蛋白质结合、蛋白激酶活化、PI3K活化、CDK活化、MAPK活化等分子功能。进一步探究发现,PPI网络KEGG信号通路富集诸如FOXO信号通路、肿瘤相关信号途径、PI3K-AKT信号通路、癌症相关蛋白多糖通路等多条信号通路。
同时,结合拓扑学分析筛选出9个药物-疾病潜在核心作用靶点(CDK1、CDK2、CDK4、CDK6、CDK9、SYK、BTK、KDR、PIK3CB)。值得关注的是,上述核心靶点富集最高的信号通路为PI3K-AKT信号通路(CDK1、CDK2、CDK4、CDK6、SYK、PIK3CB),该结果与本课题组前期研究结果及文献证据相符。此外,核心靶点CDK2,是细胞从G1期向S期转变所必需的重要蛋白,而CDK4控制G1期,二者都是细胞周期的正调控因子[29]。有研究发现,可以通过下调CDK2、CDK6等表达抑制CDK4、CDK6的表达,并上调促凋亡蛋白Bax和Caspase-3表达,从而促进白血病细胞凋亡,抑制细胞增殖[30]。同样,CDK4抑制剂也会诱导白血病细胞G0/G1周期阻滞并促进细胞凋亡,从而抑制细胞增殖[31]。结合前述本课题组前期CDM研究发现,CDM主要通过抑制CDK2、CDK4及上调p21蛋白表达,诱导G0/G1细胞周期阻滞[21]。这也再次佐证了此次网络药理学分析的结果,CDK2及CDK4富集多条相关生物功能及通路,提示二者可能是CDM联合MMF用于sAML治疗的关键核心靶点。本研究结果为后续实验验证CDM联合MMF作用机制提供了理论依据,该作用机制也将是我们下一步深入研究的重点方向。
综上所述,本研究通过实验发现CDM联合MMF协同诱导sAML细胞凋亡,并显著抑制其增殖。结合网络药理学研究初探了CDM联合MMF可能通过多靶点、多信号通路在sAML中发挥抗肿瘤作用,为后续进一步临床研究提供了一定理论基础。
志谢 感谢法国巴黎大学Fernando Rodrigues-lima教授为本课题研究提供的帮助| [1] |
JABBOUR E, KANTARJIAN H. Chronic myeloid leukemia: 2020 update on diagnosis, therapy and monitoring[J]. Am J Hematol, 2020, 95(6): 691-709. |
| [2] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. |
| [3] |
NATIONAL CANCER INSTITUTE. SEER cancer statistics review(CSR) 1975-2016[EB/OL]. [2020-04-09]. https://seer.cancer.gov/csr/1975_2016/.
|
| [4] |
董悦昕. 继发性急性髓系白血病和粒细胞缺乏性发热的临床分析[D]. 上海: 上海交通大学, 2020. DONG Y X. Clinical study of secondary acute myeloid leukemia and febrile neutropenia[D]. Shanghai: Shanghai Jiaotong University, 2020. |
| [5] |
NCCN. NCCN clinical practice guidelines in oncology acute myeloid leukemia Version 3.2020[EB/OL]. [2020-12-21]. http://www.nccn.org.
|
| [6] |
WALTER R B, ESTEY E H. Management of older or unfit patients with acute myeloid leukemia[J]. Leukemia, 2015, 29(4): 770-775. |
| [7] |
JAIN P, KANTARJIAN H M, GHORAB A, et al. Prognostic factors and survival outcomes in patients with chronic myeloid leukemia in blast phase in the tyrosine kinase inhibitor era: cohort study of 477 patients[J]. Cancer, 2017, 123(22): 4391-4402. |
| [8] |
PAVIGLIANITI A, LABOPIN M, BLAISE D, et al. Comparison of mycophenolate mofetil and calcineurin inhibitor versus calcineurin inhibitor-based graft-versus-host-disease prophylaxis for matched unrelated donor transplant in acute myeloid leukemia. A study from the ALWP of the EBMT[J]. Bone Marrow Transplant, 2021, 56(5): 1077-1085. |
| [9] |
VILLARROEL M C, HIDALGO M, JIMENO A. Mycophenolate mofetil: an update[J]. Drugs Today (Barc), 2009, 45(7): 521-532. |
| [10] |
JAYARAM H N, COONEY D A, GRUSCH M, et al. Consequences of IMP dehydrogenase inhibition, and its relationship to cancer and apoptosis[J]. Curr Med Chem, 1999, 6(7): 561-574. |
| [11] |
KOFUJI S, HIRAYAMA A, EBERHARDT A O, et al. IMP dehydrogenase-2 drives aberrant nucleolar activity and promotes tumorigenesis in glioblastoma[J]. Nat Cell Biol, 2019, 21(8): 1003-1014. |
| [12] |
KOEHL G E, WAGNER F, STOELTZING O, et al. Mycophenolate mofetil inhibits tumor growth and angiogenesis in vitro but has variable antitumor effects in vivo, possibly related to bioavailability[J]. Transplantation, 2007, 83(5): 607-614. |
| [13] |
NAFFOUJE R, GROVER P, YU H Y, et al. Anti-tumor potential of IMP dehydrogenase inhibitors: a century-long story[J]. Cancers, 2019, 11(9): 1346. |
| [14] |
TRESSLER R J, GARVIN L J, SLATE D L. Anti-tumor activity of mycophenolate mofetil against human and mouse tumors in vivo[J]. Int J Cancer, 1994, 57(4): 568-573. |
| [15] |
栗若兰, 郑智慧, 路新华, 等. 霉酚酸对人结肠癌SW620细胞凋亡的诱导作用及其机制[J]. 河北师范大学学报(自然科学版), 2013, 37(5): 519-523. LI R L, ZHENG Z H, LU X H, et al. Induction effect of mycophenolic acid on apoptosis of human colon cancer cell line SW620 and its mechanism[J]. J Hebei Norm Univ Nat Sci Ed, 2013, 37(5): 519-523. |
| [16] |
TAKEBE N, CHENG X F, FANDY T E, et al. IMP dehydrogenase inhibitor mycophenolate mofetil induces caspase-dependent apoptosis and cell cycle inhibition in multiple myeloma cells[J]. Mol Cancer Ther, 2006, 5(2): 457-466. |
| [17] |
ENGL T, MAKAREVIĆ J, RELJA B, et al. Mycophenolate mofetil modulates adhesion receptors of the beta1 integrin family on tumor cells: impact on tumor recurrence and malignancy[J]. BMC Cancer, 2005, 5: 4. |
| [18] |
INAI K, TSUTANI H, YAMAUCHI T, et al. Differentiation induction in non-lymphocytic leukemia cells upon treatment with mycophenolate mofetil[J]. Leuk Res, 2000, 24(9): 761-768. |
| [19] |
XU W S, PARMIGIANI R B, MARKS P A. Histone deacetylase inhibitors: molecular mechanisms of action[J]. Oncogene, 2007, 26(37): 5541-5552. |
| [20] |
SANAEI M, KAVOOSI F. Histone deacetylases and histone deacetylase inhibitors: molecular mechanisms of action in various cancers[J]. Adv Biomed Res, 2019, 8: 63. |
| [21] |
LIANG S M, ZHOU X J, CAI D, et al. Chidamide inhibits cell proliferation via the PI3K/AKT pathway in K562 cells based on network pharmacology and experimental validation[J]. Curr Pharm Des, 2021, 27(26): 2990-2998. |
| [22] |
张黎琴. 西达本胺对K562/G01细胞增殖抑制、凋亡及Hedgehog信号通路相关机制的研究[D]. 太原: 山西医科大学, 2018. ZHANG L Q. Study of the effects of chidamide on proliferation, apoptosis and related mechanism of hedgehog signaling in K562/G01 cells[D]. Taiyuan: Shanxi Medical University, 2018. |
| [23] |
王世广, 司旭艳, 李晓婷, 等. 西达本胺增加慢性髓系白血病耐药株K562/ADM细胞对柔红霉素的敏感性[J]. 解剖学报, 2019, 50(6): 754-760. WANG S G, SI X Y, LI X T, et al. Enhancing effect of chidamide on the sensibility of human chronic myeloid leukemia K562/ADM cells to daunorubicin[J]. Acta Anat Sin, 2019, 50(6): 754-760. |
| [24] |
XU F F, GUO H G, SHI M Y, et al. A combination of low-dose decitabine and chidamide resulted in synergistic effects on the proliferation and apoptosis of human myeloid leukemia cell lines[J]. Am J Transl Res, 2019, 11(12): 7644-7655. |
| [25] |
CHEN K, YANG Q Y, ZHA J, et al. Preclinical evaluation of a regimen combining chidamide and ABT-199 in acute myeloid leukemia[J]. Cell Death Dis, 2020, 11(9): 778. |
| [26] |
LI X, YAN X, GUO W J, et al. Chidamide in FLT3-ITD positive acute myeloid leukemia and the synergistic effect in combination with cytarabine[J]. Biomed Pharmacother, 2017, 90: 699-704. |
| [27] |
HUANG H, YANG W B, DONG A S, et al. Chidamide enhances the cytotoxicity of cytarabine and sorafenib in acute myeloid leukemia cells by modulating H3K9me3 and autophagy levels[J]. Front Oncol, 2019, 9: 1276. |
| [28] |
刘洋. 雷公藤治疗口腔鳞状细胞癌的网络药理学分析和分子对接研究[D]. 太原: 山西医科大学, 2021. LIU Y. Network pharmacology analysis and molecular docking study of Tripterygium wilfordii Hook. F. in the treatment of oral squamous cell carcinoma[D]. Taiyuan: Shanxi Medical University, 2021. |
| [29] |
LIM S, KALDIS P. Cdks, cyclins and CKIs: roles beyond cell cycle regulation[J]. Dev Camb Engl, 2013, 140(15): 3079-3093. |
| [30] |
周俊, 单慧蓉, 王小龙, 等. CDK4/6对急性白血病细胞增殖及凋亡的影响[J]. 江苏医药, 2017, 43(17): 1209-1212. ZHOU J, SHAN H R, WANG X L, et al. Influence of CDK4/6 on proliferation and apoptosis of acute leukemia cells[J]. Jiangsu Med J, 2017, 43(17): 1209-1212. |
| [31] |
舒可. CDK4抑制剂及FLT3抑制剂的设计、合成与生物活性评价[D]. 杭州: 浙江大学, 2019. SHU K. Design, synthesis and bioactivity evaluation of CDK4 inhibitors and FLT3 inhibitors[D]. Hangzhou: Zhejiang University, 2019. |




