胆汁酸(bile acids, BAs)是胆固醇的衍生物,是胆汁的主要成分,在营养吸收和新陈代谢中起着重要作用[1]。胆汁淤积是一种常见的肝脏临床综合征,其特征性的病理生理学改变是胆汁流量减少和胆汁酸积聚。慢性胆汁淤积性肝病可逐渐进展为肝纤维化、肝硬化及终末期肝病[2]。在胆汁淤积状态下,胆汁酸在肝脏内过度积累,使肝细胞氧化应激和线粒体损伤,释放大量炎症因子和招募大量免疫细胞,从而导致肝实质细胞死亡[3]。其中,C-X-C基序趋化因子配体2(C-X-C motif chemokine ligand 2, Cxcl2)在胆汁淤积性肝病患者或动物模型的肝脏和血清中增加,Cxcl2招募和激活的中性粒细胞通过释放各种炎性介质来加速肝脏炎症,有研究在胆汁淤积动物模型上验证拮抗Cxcl2可减轻肝损伤[4-5]。因此,炎症反应在胆汁淤积这一病理过程中至关重要,是治疗胆汁淤积性肝损伤的新靶点。
褪黑素(melatonin, Mel)几乎存在于从细菌到动物的每一种生物,主要在大脑中由松果体合成,还能在视网膜、骨髓、肾和胃肠道(包括胆道上皮)等外周组织中产生。褪黑素参与胆道功能的调节,并通过褪黑素受体来发挥其作用。这些受体在肝脏上的肝细胞和胆管细胞上均有所表达[6-7]。褪黑素具有强大的抗氧化、抗凋亡等功能,能在如酒精、药物、肿瘤等病因引起的肝损伤中发挥保护作用[8]。但褪黑素抑制胆汁酸诱导的趋化因子Cxcl2这一作用和分子机制尚不明确。本研究设计体外实验,验证褪黑素是否通过抑制Cxcl2的表达来减轻胆汁淤积诱导的炎症反应,分离并培养小鼠原代肝细胞,进一步探讨褪黑素是否通过抑制c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)/ c-Jun信号通路以减少趋化因子Cxcl2的产生。
1 材料与方法 1.1 材料与试剂胆酸(cholic acid, CA)、褪黑素(M5250)、牛磺胆酸(taurocholic acid, TCA)、牛磺鹅去氧胆酸(taurochenodeoxycholic acid, TCDCA)购自Sigma Aldrich公司,TRIzol试剂购自Invitrogen公司,逆转录试剂盒、TB Green Premix Ex Taq Ⅱ购自TaKaRa公司,HE染色试剂盒购自Solarbio公司,免疫组织化学试剂盒购自中杉金桥公司,JNK激动剂Anisomycin(ANI,Cat#HY-18982)购自MedChemExpress公司,p-c-Jun(#3270)、c-Jun(#9165)、p-JNK(#9255)抗体及辣根过氧化酶标记的抗兔、抗鼠二抗购自Cell Signaling Technology公司,GAPDH (10494-1-AP)、Mpo(66177-1-Ig)抗体购自Proteintech公司,JNK(SC-7345)抗体购自Santa Cruz公司。
1.2 动物模型雄性C57BL/6J小鼠,8周龄,体质量20~23 g,购自陆军军医大学实验动物中心。所有动物实验和方案已经过陆军军医大学实验动物福利伦理审查委员会批准,批准编号:AMUWEC20211902。小鼠按随机数字表法分为3组,每组5只,分别为对照组、1%CA组及1%CA+Mel组。除对照组以常规饲料喂食外,其他组以1%CA饲料喂食。1%CA+Mel组小鼠腹腔注射100 mg/kg溶于生理盐水的褪黑素溶液,对照组、1%CA组小鼠腹腔注射等量生理盐水,连续2周。禁食过夜后处置小鼠,留取肝组织冻存或固定。
1.3 分离、培养及处理小鼠原代肝细胞小鼠原代肝细胞通过胶原酶灌注从10~20周龄C57BL/6J小鼠中分离出,然后培养在5%FBS-Williams E培养基中[9]。将结合型胆汁酸TCA、TCDCA、褪黑素、JNK激动剂Anisomycin溶于DMSO。使用褪黑素(10 μmol/L)、褪黑素(10 μmol/L)联合JNK激动剂Anisomycin(ANI,5 μmol/L)预处理小鼠原代肝细胞30 min,然后加入25 μmol/L结合型胆汁酸TCA或TCDCA,对照组均加入等体积的DMSO。处理12 h或24 h后,提取总RNA或总蛋白。
1.4 总RNA提取、逆转录及Real-time qPCR使用TRIzol试剂提取小鼠肝组织或小鼠原代肝细胞的总RNA,然后将1 μg RNA通过逆转录试剂盒逆转录成cDNA。利用TB Green Premix Ex Taq Ⅱ进行qPCR,检测体系(10 μL)为:TB Green 5 μL,上下游引物分别0.5 μL,cDNA 2 μL,无酶水2 μL。引物序列如下:18S上游5′-GGGAGCCTGAGAAACGGC-3′,下游5′-GGGTCGGGAGTGGGTAATTT-3′;β-actin上游5′-GTTGGAGCAAACATCCCCCA-3′,下游5′-ACGCGAC-CATCCTCCTCTTA-3′;Cxcl2上游5′-AGGCATCTGCTTCGGGGACTCTGGC-3′,下游5′-GCAAACTCAGCCACAGGGGCGAAGG-3′;Cxcr2上游5′-GCACCTGCTCTG-TCACCGATGTCT-3′,下游5′-AGAATATCTTGCACAGG-GTTGAGCC-3′;c-Jun上游5′-CATTGCCGCCTCCAAG-TGCC-3′,下游5′-GCGTTAGCATGAGTTGGCACCC-3′。
1.5 Western blot检测参考课题组前期报道方法[10-11],提取小鼠肝组织和小鼠原代肝细胞蛋白。蛋白样本由10%SDS-PAGE分离后转入PVDF膜。孵育一抗及其浓度如下:GAPDH (1 ∶5 000)、Mpo (1 ∶1 000)、p-c-Jun (1 ∶1 000)、c-Jun (1 ∶1 000)、p-JNK (1 ∶2 000)、JNK (1 ∶1 000)。
1.6 HE染色及免疫组织化学染色小鼠肝样本由4%多聚甲醛溶液固定,石蜡包埋肝组织制备病理切片。脱蜡后使用HE染色试剂盒染色,根据Scheuer系统对炎症活动度进行评分。使用c-Jun抗体(1 ∶200)对肝组织切片进行免疫组织化学染色,具体步骤参考该抗体说明书。
1.7 统计学分析所有数据由GraphPad Prism, version 6.01进行统计,均以x±s表示。多组之间比较使用单因素方差分析,P < 0.05为差异有统计学意义。
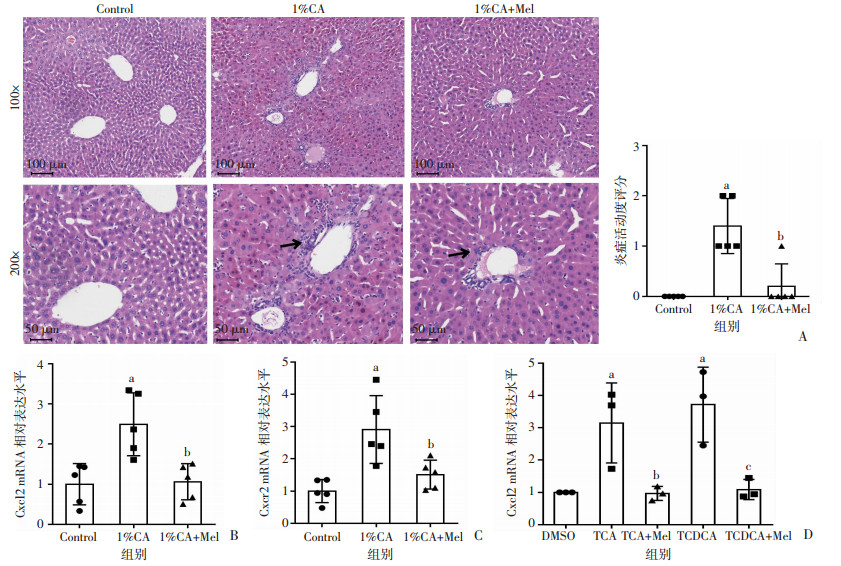
2 结果 2.1 褪黑素显著抑制胆汁淤积小鼠肝脏内和胆汁酸诱导的小鼠原代肝细胞内趋化因子Cxcl2表达病理组织学分析结果显示,与对照组相比,1%CA组小鼠肝内炎性浸润增加;与1%CA组相比,1%CA+Mel组小鼠肝内炎性浸润减少。1%CA+Mel组小鼠肝内炎症活动度较1%CA组小鼠肝内明显降低(P < 0.05,图 1A)。利用Real-time qPCR检测褪黑素对胆汁淤积状态下小鼠肝内和小鼠原代肝细胞内Cxcl2 mRNA水平的影响。如图 1B、C所示,与对照组相比,1%CA组小鼠肝内趋化因子Cxcl2及其受体Cxcr2 mRNA水平显著升高(P < 0.05);与1%CA组相比,1%CA+Mel组小鼠肝内Cxcl2及其受体Cxcr2 mRNA水平显著降低(P < 0.05)。体外实验结果与上述结果一致,结合型胆汁酸TCA、TCDCA诱导肝细胞内Cxcl2 mRNA的表达(P < 0.05),而褪黑素可抑制胆汁酸诱导的Cxcl2表达(P < 0.05,图 1D)。
|
| A:各组小鼠肝组织病理学表现及炎症活动度评分(HE),箭头示炎性细胞浸润;B、C:各组小鼠肝脏内趋化因子Cxcl2及其受体Cxcr2 mRNA水平;a:P < 0.05,与对照组比较;b:P < 0.05,与1%CA组比较;D:各组小鼠原代肝细胞Cxcl2 mRNA水平;a:P < 0.05,与DMSO组比较;b:P < 0.05,与TCA组比较;c:P < 0.05,与TCDCA组比较 图 1 褪黑素对胆汁淤积小鼠肝脏内和小鼠原代肝细胞内Cxcl2表达水平的影响 |
2.2 褪黑素显著减少胆汁淤积小鼠肝脏内中性粒细胞浸润和转录因子c-Jun的表达
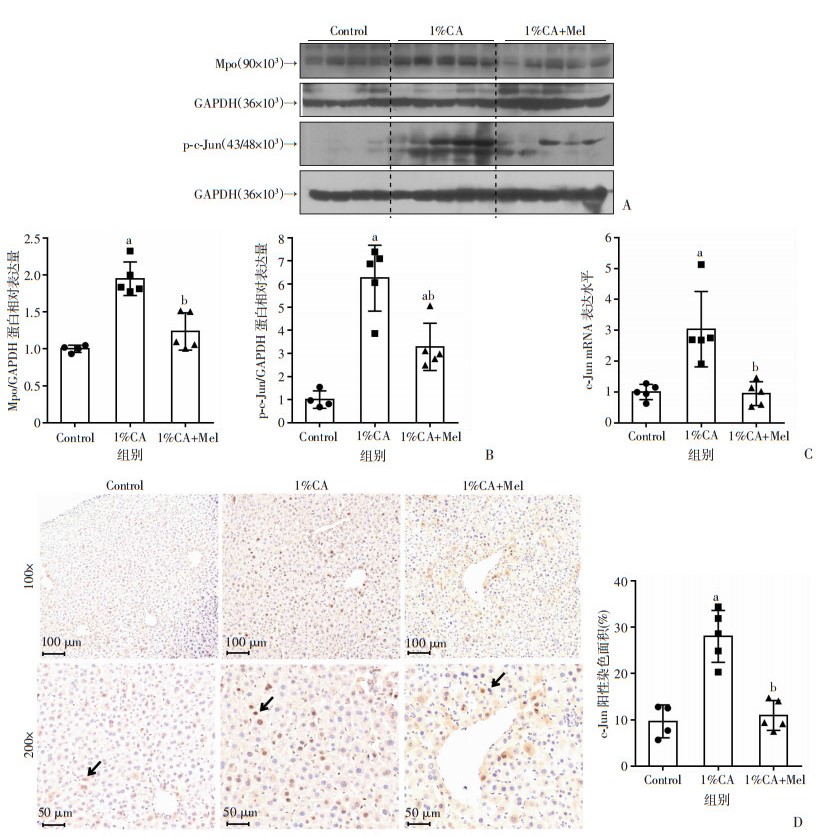
图 2A、B显示,1%CA+Mel组小鼠肝脏内中性粒细胞标志物Mpo表达较1%CA组降低,且差异具有统计学意义(P < 0.05)。检测褪黑素对1%CA喂养小鼠肝脏内c-Jun、p-c-Jun水平的影响,结果发现褪黑素可显著减少1%CA喂养小鼠肝脏内c-Jun mRNA和p-c-Jun蛋白的表达(P < 0.05,图 2A~C)。免疫组织化学检测结果也显示,与对照组相比,1%CA组小鼠肝细胞核c-Jun表达明显增多;与1%CA组相比,1%CA+Mel组小鼠肝细胞核c-Jun表达明显减少(P < 0.05,图 2D)。
|
| A、B:各组小鼠肝组织p-c-Jun、Mpo蛋白水平;C:各组小鼠肝组织c-Jun mRNA水平;D:免疫组织化学检测各组小鼠肝组织中c-Jun的表达及半定量分析,箭头示c-Jun阳性区域;a:P < 0.05,与对照组比较,b:P < 0.05,与1%CA组比较 图 2 褪黑素对喂养1%CA小鼠肝脏内c-Jun、p-c-Jun、Mpo表达水平的影响 |
2.3 褪黑素抑制结合型胆汁酸激活JNK/c-Jun通路
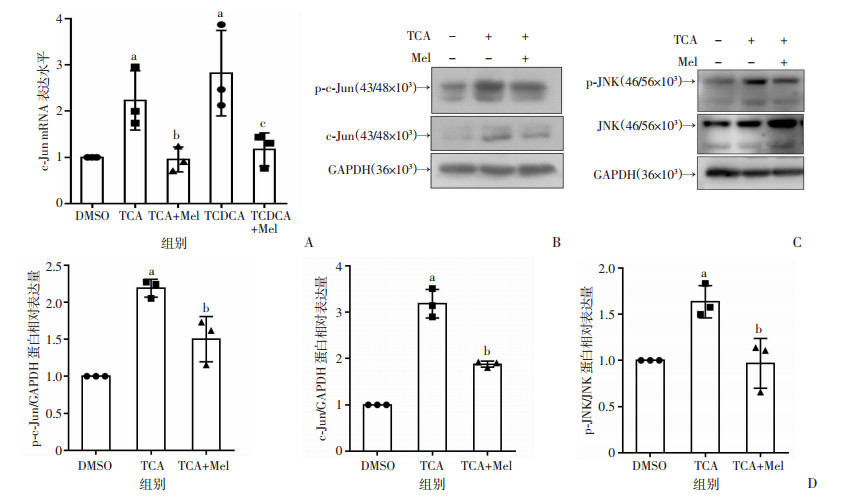
在小鼠原代肝细胞上进一步检测褪黑素对结合型胆汁酸诱导下原代小鼠肝细胞内JNK/c-Jun通路的影响。结果显示,结合型胆汁酸TCA、TCDCA明显增加了原代小鼠肝细胞内转录因子c-Jun mRNA的表达,而褪黑素显著减轻了这种改变(P < 0.05)。Western blot检测结果也显示,与DMSO组相比,TCA组p-c-Jun、c-Jun、p-JNK蛋白水平显著升高;与TCA组相比,TCA+Mel组p-c-Jun、c-Jun、p-JNK蛋白水平显著降低(P < 0.05,图 3)。
|
| A:各组原代小鼠肝细胞Cxcl2 mRNA水平;B~D:各组原代小鼠肝细胞p-JNK、JNK、p-c-Jun、c-Jun蛋白水平;a:P < 0.05,与DMSO组比较;b:P < 0.05,与TCA组比较;c:P < 0.05,与TCDCA组比较 图 3 褪黑素对结合型胆汁酸诱导下原代小鼠肝细胞内JNK/c-Jun通路的影响 |
2.4 褪黑素通过JNK信号通路调控TCA诱导的Cxcl2表达
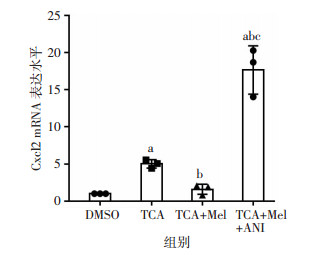
为了验证褪黑素是通过抑制JNK/c-Jun信号通路来减少胆汁淤积小鼠肝细胞内Cxcl2的表达,采用JNK特异激动剂Anisomycin和褪黑素联合预处理原代小鼠肝细胞,结果发现Anisomycin极大程度地逆转了褪黑素对TCA诱导Cxcl2 mRNA的抑制作用(P < 0.05,图 4)。因此,褪黑素可通过抑制JNK/c-Jun信号通路而减少胆汁淤积小鼠肝细胞内Cxcl2的表达来发挥抗炎作用。
|
| a:P < 0.05,与DMSO组比较;b:P < 0.05,与TCA组比较;c:P < 0.05,与TCA+Mel组比较 图 4 JNK激动剂逆转褪黑素对TCA诱导的Cxcl2的抑制作用 |
3 讨论
本研究发现1%CA喂养小鼠肝组织炎症活动度、趋化因子Cxcl2及其受体Cxcr2的表达显著升高,随后对Cxcl2趋化的中性粒细胞标志物Mpo和调控Cxcl2的转录因子c-Jun进行检测,发现1%CA喂养小鼠肝内Mpo和c-Jun的表达也明显增加,而褪黑素给药可以减轻这些改变。在体外实验上进一步研究分子机制发现,褪黑素是通过抑制JNK/c-Jun信号通路来减少结合型胆汁酸诱导的小鼠原代肝细胞内Cxcl2的表达,以此发挥其抗炎和护肝作用。
褪黑素是一种免疫调节剂,在脓毒症、缺血/再灌注和脑损伤等炎症病理状态下可观察到其强大的抗炎作用。褪黑素可通过降低Mpo活性来抑制炎症细胞的激活,并且能够在多种重度炎症模型中减少促炎症细胞因子(如IL-6、TNF-α等)的产生[12]。有研究表明,褪黑素合成酶5-羟色胺N-乙酰基转移酶(arylalkylamine N-acetyltransferase,AANAT)过表达或褪黑素给药,可通过抑制BDL大鼠和Mdr2基因敲除小鼠的时钟基因和miR-200b,减轻胆汁淤积诱导的导管反应和肝纤维化[13]。炎症反应在胆汁淤积性肝损伤的病理过程中发挥着重要作用。胆汁淤积状态下的肝细胞通过释放趋化因子Cxcl2参与炎症反应,中性粒细胞收到化学信号后向炎症部位迁移,以其强大的细胞毒性对肝细胞造成破坏[14-16]。有研究发现,小鼠肝细胞特异性Tlr9基因敲除能通过减少Cxcl2的产生以减轻BDL诱导的胆汁淤积性肝损伤[5]。Cxcl2与中性粒细胞上表达的受体Cxcr2结合,导致中性粒细胞募集到损伤部位。小鼠Cxcr2基因敲除能减轻BDL诱导的中性粒细胞浸润和肝损伤[17]。为了探索褪黑素对胆汁淤积引起的肝脏炎症的作用,本研究构建1%CA喂养小鼠模型。1%CA喂养小鼠是一种用于诱导胆汁酸稳态失衡和胆汁淤积的广泛应用的疾病模型,其血清和肝内总胆汁酸显著升高[18]。本研究对其肝组织切片进行病理学评分,结果显示褪黑素可明显减轻1%CA喂养小鼠模型肝内炎性细胞浸润和炎症活动度。然后检测其肝内Cxcl2及其受体Cxcr2的表达量,发现褪黑素可显著减少1%CA喂养小鼠模型肝内Cxcl2及其受体Cxcr2的表达。褪黑素抑制胆汁淤积状态下肝内Cxcl2的产生,减少中性粒细胞的浸润,Cxcr2主要表达于中性粒细胞表面,因此中性粒细胞减少,Cxcr2也随之减少。TCA是小鼠体内主要的内源性胆汁酸,在肝内过多积聚后刺激肝细胞释放大量趋化因子Cxcl2,引起肝组织炎性浸润及坏死[19]。有研究报道TCA显著增加Cxcl2在小鼠肝细胞的表达,而不增加Cxcl2在肝内非实质细胞或胆管细胞上的表达,因此本研究中分离并培养原代小鼠肝细胞,验证褪黑素对胆汁淤积下肝细胞的抗炎作用,结果与体内实验保持一致,褪黑素确实能够明显减少结合型胆汁酸TCA/TCDCA诱导的原代小鼠肝细胞内Cxcl2的产生。
已有文献报道Cxcl2的转录受c-Jun调控,在炎症性疾病中起重要作用[20]。为了进一步研究褪黑素减少胆汁淤积下肝细胞内Cxcl2的分子机制,本研究通过体内外实验检测褪黑素对转录因子c-Jun的影响,结果显示褪黑素显著抑制1%CA喂养小鼠肝内和结合型胆汁酸TCA/TCDCA诱导的原代小鼠肝细胞内c-Jun的表达。已知c-Jun能被JNK介导的信号通路激活。本研究结果也表明,褪黑素能有效减少TCA诱导的原代小鼠肝细胞内p-JNK的蛋白水平。褪黑素减少TCA诱导的肝细胞内Cxcl2的作用被JNK特异激动剂Anisomycin逆转,证明褪黑素需要通过抑制JNK/c-Jun信号通路来减少胆汁淤积下肝细胞内Cxcl2的表达。本研究仅构建一种胆汁淤积小鼠模型,尚未利用其他胆汁淤积小鼠模型进行验证。褪黑素是否能通过其他信号通路对趋化因子Cxcl2进行干预或者通过其他途径减轻炎症反应也还未阐明,需后续工作进行探索。
综上所述,本研究表明褪黑素能够通过抑制JNK/c-Jun信号通路来减少胆汁淤积小鼠肝细胞内Cxcl2的表达,为褪黑素作为治疗胆汁淤积性肝病的潜在药物提供理论依据。
| [1] |
CHIANG J Y L, FERRELL J M. Bile acids as metabolic regulators and nutrientsensors[J]. Annu Rev Nutr, 2019, 39: 175-200. |
| [2] |
WAGNER M, ZOLLNER G, TRAUNER M. New molecular insights into the mechanisms ofcholestasis[J]. J Hepatol, 2009, 51(3): 565-580. |
| [3] |
CAI S Y, BOYER J L. The role of bile acids incholestatic liver injury[J]. Ann Transl Med, 2021, 9(8): 737. |
| [4] |
QIN C C, LIU Y N, HU Y, et al. Macrophage inflammatory protein-2 as mediator of inflammation in acute liver injury[J]. World J Gastroenterol, 2017, 23(17): 3043-3052. |
| [5] |
CAI S Y, OUYANG X S, CHEN Y L, et al. Bile acids initiatecholestatic liver injury by triggering a hepatocyte-specific inflammatory response[J]. JCI Insight, 2017, 2(5): e90780. |
| [6] |
CIPOLLA-NETO J, AMARAL F G D. Melatonin as a hormone: new physiological and clinicalinsights[J]. Endocr Rev, 2018, 39(6): 990-1028. |
| [7] |
GLASER S, HAN YY, FRANCIS H, et al. Melatonin regulation of biliary functions[J]. Hepatobil Surg Nutr, 2014, 3(1): 35-43. |
| [8] |
BAIOCCHI L, ZHOU T H, LIANGPUNSAKUL S, et al. Possible application of melatonin treatment in human diseases of the biliary tract[J]. Am J Physiol Gastrointest Liver Physiol, 2019, 317(5): G651-G660. |
| [9] |
CAI S Y, GAUTAM S, NGUYEN T, et al. ATP8B1 deficiency disrupts the bilecanalicular membrane bilayer structure in hepatocytes, but FXR expression and activity are maintained[J]. Gastroenterology, 2009, 136(3): 1060-1069. |
| [10] |
CHAI J, CAI S Y, LIU X C, et al. Canalicular membrane MRP2/ABCC2 internalization is determined by Ezrin Thr567 phosphorylation in human obstructive cholestasis[J]. J Hepatol, 2015, 63(6): 1440-1448. |
| [11] |
CHAI J, HE Y, CAI S Y, et al. Elevated hepatic multidrug resistance-associated protein 3/ATP-binding cassette subfamily C3 expression in human obstructive cholestasis is mediated through tumor necrosis factor alpha and c-Jun NH2-terminal kinase/stress-activated protein kinase-signaling pathway[J]. Hepatology, 2012, 55(5): 1485-1494. |
| [12] |
HARDELAND R. Melatonin and inflammation—Story of a double-edgedblade[J]. J Pineal Res, 2018, 65(4): e12525. |
| [13] |
WU N, MENG F Y, ZHOU T H, et al. Prolonged darkness reduces liver fibrosis in a mouse model of primarysclerosing cholangitis by miR-200b down-regulation[J]. FASEB J, 2017, 31(10): 4305-4324. |
| [14] |
ZHANG Y C, HONG J Y, ROCKWELL C E, et al. Effect of bile duct ligation on bile acid composition in mouse serum and liver[J]. LiverInt, 2012, 32(1): 58-69. |
| [15] |
ALLEN K, JAESCHKE H, COPPLE B L. Bile acids induce inflammatory genes in hepatocytes: a novel mechanism of inflammation during obstructivecholestasis[J]. Am J Pathol, 2011, 178(1): 175-186. |
| [16] |
LI M, CAI S Y, BOYER J L. Mechanisms of bile acid mediated inflammation in the liver[J]. Mol Aspects Med, 2017, 56: 45-53. |
| [17] |
KONISHI T, SCHUSTER R M, GOETZMAN H S, et al. Cell-specific regulatory effects of CXCR2 oncholestatic liver injury[J]. Am J Physiol Gastrointest Liver Physiol, 2019, 317(6): G773-G783. |
| [18] |
LI J N, DAWSON P A. Animal models to study bile acidmetabolism[J]. Biochim Biophys Acta Mol Basis Dis, 2019, 1865(5): 895-911. |
| [19] |
CAI S Y, GE M X, MENNONE A, et al. Inflammasome is activated in the liver of cholestatic patients and aggravates hepatic injury in bile duct-ligated mouse[J]. Cell Mol Gastroenterol Hepatol, 2020, 9(4): 679-688. |
| [20] |
OH S, WOO J I, LIM D J, et al. ERK2-dependent activation of c-Jun is required fornontypeable Haemophilus influenzae-induced CXCL2 upregulation in inner ear fibrocytes[J]. J Immunol, 2012, 188(7): 3496-3505. |




