2. 400038 重庆,陆军军医大学(第三军医大学):药学与检验医学系临床生物化学教研室;
3. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院核医学科
2. Department of Clinical Biochemisty, Faculty of Pharmacy and Laboratory Medicine; Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Department of Nuclear Medicine, First Affiliated Hospital; Army Medical University (Third Military Medical University), Chongqing, 400038, China
肝细胞癌(hepatocellular carcinoma, HCC)是世界上常见的人类恶性肿瘤之一,也是全世界癌症死亡的主要原因之一。临床上除手术、放疗、全身化疗等治疗手段外,经动脉插管栓塞化疗(transcatheter arterial chemoembolization, TACE)也是中晚期肝癌治疗的首选方法[2]。作为一种常规的抗肿瘤药,表柔比星(epirubicin, EPI)常被用于肝癌TACE化疗的一线治疗方案[3]。然而,在长期的表柔比星单药治疗过程中,HCC细胞会对表柔比星耐药,从而导致HCC的复发和预后不良[4]。因此,寻找增强表柔比星杀伤HCC效果的策略对于改善HCC基于表柔比星的化疗具有重要的临床意义。
左旋棉酚[(-)-gossypol, (-)-G]是棉籽提取物中的一种有效成分,由于能够抑制精子发生和精子活动,曾在临床上被用作男性避孕药[5]。而近年来,左旋棉酚被证明对肝癌细胞在内的多种癌细胞系具有抗癌作用[6-8]。除单独使用发挥一定抗癌作用外,左旋棉酚还可增敏多种化疗药物的抗癌效应[9-11],而左旋棉酚是否能够增敏表柔比星尚不清楚。因此,本研究将探讨左旋棉酚能否增强表柔比星杀伤HCC细胞的能力及其可能的机制,以期为临床上提升表柔比星对HCC的疗效提供实验依据。
1 材料与方法 1.1 材料商品化的人来源HCC细胞系Hep3B、HuH7购于中国科学院细胞库,由陆军军医大学基础医学院生物化学与分子生物学教研室保存。0.25%胰酶、DMEM高糖培养基、MEM培养基购于美国HyClone公司;胎牛血清购于江苏依科赛公司;表柔比星购于美国Selleck公司;左旋棉酚购于美国Sigma公司;CCK-8试剂购于美国MedChem Express公司;凋亡检测试剂盒、RIPA裂解液(强)、PMSF购于江苏碧云天公司;PARP、XIAP抗体购于美国Cell Signaling Technology公司;Tubulin抗体购于德国Novus公司;lipofectamine 3000脂质体、山羊抗兔二抗购于美国Thermo公司;PVDF膜购于美国Millipore公司;ECL发光液购于重庆葆光生物公司。
1.2 细胞培养与药物处理Hep3B细胞用含10% 胎牛血清的MEM培养基培养,HuH7细胞用含10%胎牛血清的DMEM高糖培养基培养,2种细胞均置于5% CO2、37 ℃的条件下静置培养。每2~3天更换1次培养液或进行传代。当重新铺板后的细胞进入到对数生长期时,进行相应的药物处理。药物作用24 h或48 h后,收集细胞进行下一步实验。
1.3 细胞转染在2个EP管中加入适量等体积无血清培养基,然后向其中一管加入1份体积的质粒/siRNA,向另一管加入2份体积的lipofectamine 3000,各自混匀后静置5 min。混合上述2管液体并在室温下静置20 min,随后将混合液加入待转染细胞中。待细胞培养12 h后,移除含转染试剂的培养基并进行后续处理。pEBB-XIAP及对照空载质粒购于美国Addgene公司;XIAP及对照的siRNA由北京擎科生物公司合成。si-XIAP序列为:正义链5′-AAGUGGUAGUCCUGUUUCAGCUU-3′;反义链5′-AAGCUGAAACAGGACUACCACUU-3′。
1.4 CCK-8检测细胞存活将3 000个/孔细胞接种在96孔板中培养24 h,随后对细胞进行药物处理。药物处理48 h后,弃去培养基,向每孔加入100 μL含10% CCK-8的相应培养基,然后置于培养箱中4 h。最后测定各孔的光密度值[D(450)],并计算各组细胞的存活率。
1.5 流式细胞术检测细胞凋亡HCC细胞铺于6孔板中,药物处理24 h,收集细胞并漂洗,用含Annexin V和PI的缓冲液重悬细胞并避光15 min后,采用流式细胞仪进行检测。Annexin V单阳为早期凋亡细胞,Annexin V和PI双阳为晚期凋亡细胞。以各组的早期凋亡细胞和晚期凋亡细胞的总和作为总的细胞凋亡率。
1.6 Western blot检测蛋白表达用含有PMSF的细胞裂解液提取经药物处理24 h后的各组细胞中的总蛋白,调整蛋白质浓度后变性,经10%丙烯酰胺凝胶进行电泳分离。蛋白在浓缩胶中以80 V的电压进行电泳,当蛋白进入分离胶后以120 V的条件电泳1 h。随后用半干转印仪以恒流1.5 A的条件转膜30 min,将蛋白转印到PVDF膜上,并用5%蛋白封闭液常温封闭1 h。TBST洗膜后,用1 ∶1 000的相应抗体工作液4 ℃下孵育过夜。第2天用TBST洗膜3次后,用1 ∶10 000稀释的山羊抗兔二抗工作液在室温条件下孵育1 h。孵育结束后,再用TBST洗膜3次,最后用ECL发光显影液在化学发光仪中对膜进行曝光显影。
1.7 统计学分析采用GraphPad Prism 7软件进行分析,结果用x±s表示。两组间比较采用独立样本t检验;采用dunnett对检验多样本间的两两比较进行多重比较。以P < 0.05为差异有统计学意义。
2 结果 2.1 左旋棉酚联合表柔比星能显著抑制HCC细胞的存活如图 1所示,表柔比星以0.25 μmol/L浓度单独处理Hep3B细胞(图 1A)、HuH7细胞(图 1B)48 h,细胞生长受到明显抑制。左旋棉酚单独处理Hep3B细胞(图 1C)、HuH7细胞(图 1D)48 h,在10 μmol/L浓度时,细胞生长明显受到抑制;而在5 μmol/L浓度时,细胞生长虽然受到抑制,但与溶剂对照组相比,该差异无统计学意义。因此,后续实验选择5 μmol/L浓度探讨左旋棉酚对表柔比星抗HCC的增强作用。左旋棉酚(5 μmol/L)和表柔比星(0.25 μmol/L)联合处理HCC细胞48 h会更加显著抑制细胞的存活(图 1E、F),与表柔比星组相比,该差异具有统计学意义(P < 0.05)。以上结果提示,左旋棉酚可增强表柔比星杀伤HCC细胞的能力。
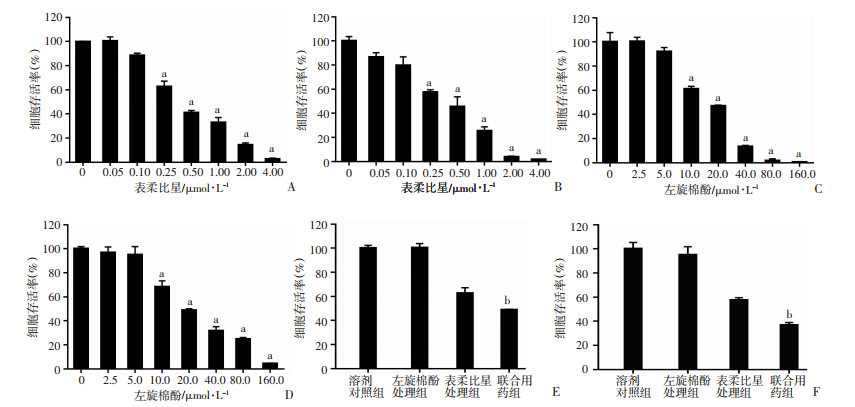
|
| A:表柔比星单药处理Hep3B细胞系48 h后存活情况;B:表柔比星单药处理HuH7细胞系48 h后存活情况;C:左旋棉酚单药处理Hep3B细胞系48 h后存活情况;D:左旋棉酚单药处理HuH7细胞系48 h后存活情况;E:联合用药处理Hep3B细胞系48 h后存活情况;F:联合用药处理HuH7细胞系48 h后存活情况 a:P < 0.05,与溶剂对照组(0 μmol/L)比较;b:P < 0.05,与表柔比星处理组比较 图 1 CCK-8检测各处理对HCC细胞存活的影响 |
2.2 左旋棉酚联合表柔比星能显著诱导HCC细胞的凋亡
流式细胞仪分析结果显示(图 2A):HCC细胞经药物处理24 h后,与溶剂对照组和单独用药组相比,联合处理组的细胞凋亡率明显升高(P < 0.05)。而经Western blot验证发现,左旋棉酚联合表柔比星处理HCC细胞24 h,能显著诱导凋亡相关分子聚(腺苷二磷酸-核糖)聚合酶[poly (ADP-ribose) polymerase, PARP]的剪切(图 2B~D),表明该两药联合可显著促进HCC细胞的凋亡。

|
|
1:溶剂对照组;2:左旋棉酚处理组;3:表柔比星处理组;4:联合用药组 a:P < 0.05,与联合用药组比较 A:流式细胞术检测各组细胞凋亡情况;B:Western blot检测PARP蛋白剪切情况 Cle-PARP:剪切型PARP;Tubulin:微管蛋白(内参);C:Hep3B细胞系中剪切型PARP半定量分析;D:HuH7细胞系中剪切型PARP半定量分析 图 2 不同处理方式对HCC细胞凋亡的影响 |
2.3 左旋棉酚可抑制表柔比星诱导的X连锁凋亡抑制蛋白
进一步探究左旋棉酚增强表柔比星诱导HCC细胞凋亡及抑制细胞生长的可能机制,分析各组药物对HCC细胞内抗凋亡蛋白的影响。结果发现:表柔比星会诱导HCC细胞内抗凋亡蛋白X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)的表达上调;而联合使用左旋棉酚后,表柔比星对XIAP的诱导则会受到抑制(图 3)。
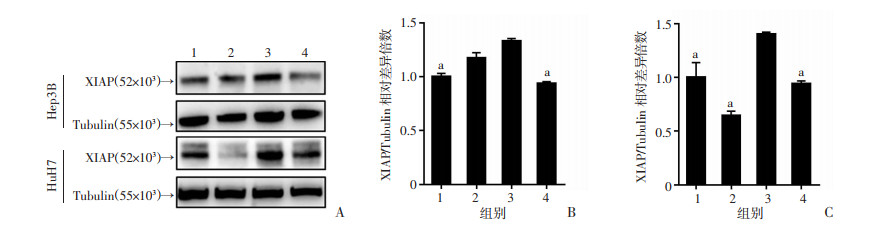
|
|
1:溶剂对照组;2:左旋棉酚处理组;3:表柔比星处理组;4:联合用药组 a:P < 0.05,与表柔比星处理组比较 A:XIAP蛋白水平检测;B:Hep3B细胞系XIAP半定量分析;C:HuH7细胞系XIAP半定量分析 图 3 Western blot检测各组别HCC细胞中XIAP蛋白水平的影响 |
2.4 沉默X连锁凋亡抑制蛋白可促进表柔比星诱导HCC细胞凋亡及抑制细胞增殖
为了探究XIAP对表柔比星抗HCC的影响,利用siRNA干扰技术沉默XIAP后发现:沉默XIAP可显著增强表柔比星对HCC细胞的杀伤作用(图 4A、B),同时能显著促进HCC细胞中PARP的剪切(图 4C~E)。
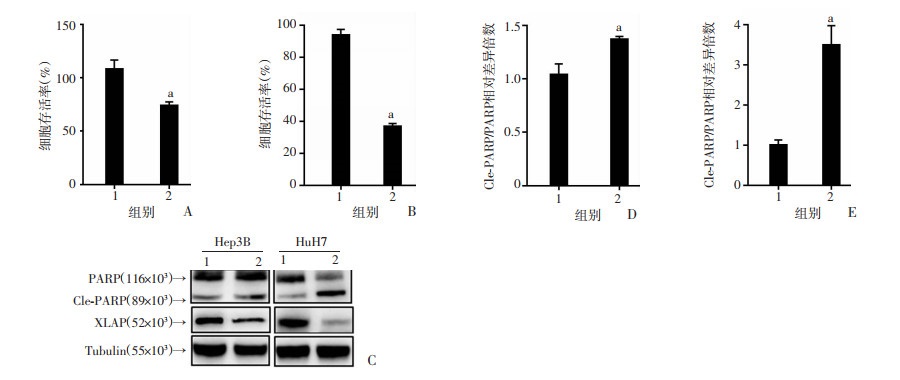
|
|
1 : 对照siRNA+表柔比星组; 2:沉默XIAP+表柔比星处理组 a: P < 0.05,与对照siRNA+表柔比星组比较 A: Hep3B细胞系存活情况; B: HuH7细胞系存活情况; C: PARP蛋白剪切情况Cle-PARP: 剪切型PARP; Tubulin: 微管蛋白(内参); D: Hep3B细胞系中剪切型PARP半定量分析; E: HuH7细胞系中剪切型PARP半定量分析 图 4 沉默XIAP对表柔比星杀伤HCC细胞及诱导细胞凋亡的影响 |
2.5 过表达X连锁凋亡抑制蛋白削弱左旋棉酚对表柔比星杀伤HCC细胞能力的增强作用
分别在HCC细胞中转染XIAP质粒或对照质粒,然后经左旋棉酚和表柔比星联合处理细胞,过表达XIAP显著削弱了左旋棉酚增强表柔比星对HCC细胞杀伤的作用(图 5A、B),同时HCC细胞中PARP的剪切也受到了抑制(图 5C、E)。以上结果提示,XIAP是左旋棉酚增强表柔比星抗HCC的关键分子。
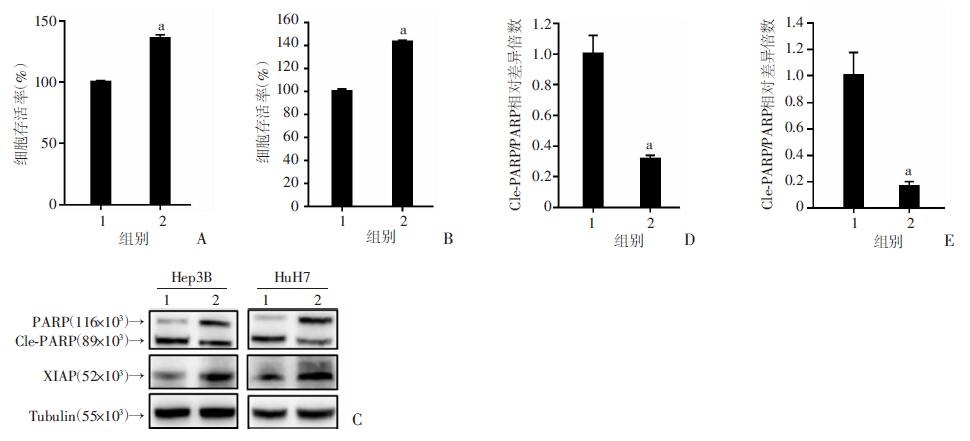
|
|
1 : 对照质粒+联合用药组; 2:过表达XIAP+联合用药组 a: P < 0.05, 与对照质粒+联合用药组比较 A: Hep3B细胞系存活情况; B: HuH7细胞系存活情况; pEBB-XIAP: XIAP的过表达质粒; C: PARP蛋白剪切情况Cle-PARP: 剪切型PARP; Tubulin: 微管蛋白(内参); D: Hep3B细胞系中剪切型PARP半定量分析; E: HuH7细胞系中剪切型PARP半定量分析 图 5 过表达XIAP对左旋棉酚增强表柔比星杀伤HCC细胞及诱导细胞凋亡的影响 |
2.6 左旋棉酚可抑制表柔比星诱导的真核起始因子4E的磷酸化
表柔比星处理HCC细胞可促进eIF4E的磷酸化,而左旋棉酚可显著减弱表柔比星诱导的eIF4E的磷酸化(图 6A~C)。提示左旋棉酚抑制表柔比星诱导的XIAP上调表达是通过抑制其IRES依赖的翻译起始而实现的。
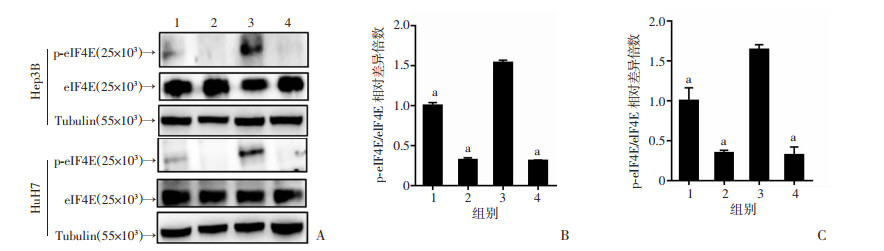
|
|
1:溶剂对照组;2:左旋棉酚处理组;3:表柔比星处理组;4:联合用药组 a:P < 0.05,与表柔比星处理组比较 A:p-eIF4E水平检测 p-eIF4E:磷酸化的真核起始因子4E;Tubulin:微管蛋白(内参);B:Hep3B细胞系p-eIF4E半定量分析C:HuH7细胞系p-eIF4E半定量分析 图 6 Western blot检测各处理对HCC细胞系中eIF4E磷酸化水平的影响 |
3 讨论
在全球范围内,肝细胞癌导致了大量的癌症相关死亡,尽管早期的HCC可以进行手术切除,但80%的HCC患者术后仍会出现肝内复发[12]。此外,大多数HCC患者诊断时已是晚期,失去了手术切除的机会。近年来研究表明,表柔比星联合TACE化疗是一种有效且安全的治疗手段,尤其对不能切除HCC的患者来说,可以提高生存率[13]。然而,在长期的表柔比星单药治疗过程中,肿瘤细胞对表柔比星会产生耐药性,从而影响治疗的成功率和临床结局[4]。有研究表明,在杀伤多种肿瘤时,表柔比星会诱导肿瘤细胞显著上调抗凋亡蛋白survivin的水平,从而导致肿瘤细胞对表柔比星的敏感性降低[14]。而本研究证实,表柔比星还可诱导HCC细胞中抗凋亡分子XIAP的上调表达,从而引起HCC细胞对表柔比星杀伤作用的抵抗;而沉默XIAP的表达可促进表柔比星对HCC细胞的杀伤作用。这说明XIAP可能在HCC细胞抵抗表柔比星杀伤的过程中起重要作用。
左旋棉酚是一种从棉籽中提取的黄色多酚羟基双萘醛类化合物,虽然最初被用作男性避孕药及治疗女性子宫功能性出血、子宫内膜异位症的药物。但近年研究表明,左旋棉酚对HCC在内的多种癌症细胞系具有抗癌作用,是一种有效的天然抗癌剂,现在正处于2期/3期临床试验阶段。普遍认为,左旋棉酚可作为BH3的类似物,抑制BH3肽与Bcl-2和Bcl-XL蛋白的结合,影响Bcl蛋白的抗凋亡作用,从而诱导凋亡和细胞的生长抑制[8]。然而,除单独使用能发挥一定抗癌作用外,左旋棉酚还可增敏多种化疗药物的抗癌效应。例如,在胶质瘤中,左旋棉酚可抑制hedgehog/Notch通路而增敏三氧化二砷[9];在晚期非小细胞肺癌中,左旋棉酚可抑制脱嘌呤/脱嘧啶核酸内切酶1 (APE1),从而增敏紫杉醇和顺铂的抗肿瘤作用[10];在非小细胞肺癌中,左旋棉酚可抑制YES相关蛋白/含PDZ结合基序的转录共激活因子(YAP/TAZ),从而增敏表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKIs)[11]。更重要的是,左旋棉酚可以在结肠癌细胞中抑制包括XIAP在内的多种抗凋亡蛋白的表达[15],这暗示其可能具有增敏表柔比星杀伤HCC细胞的能力。本研究证实,左旋棉酚在低浓度情况下(5 μmol/L)能够抑制表柔比星诱导的XIAP上调表达,增强表柔比星抗HCC细胞的能力。通过过表达XIAP进一步证实,XIAP可阻碍左旋棉酚对表柔比星杀伤HCC细胞的增强作用,这充分说明XIAP表达水平的下调正是左旋棉酚增强表柔比星联合杀伤HCC细胞的关键。那么表柔比星是通过何种方式诱导XIAP的上调表达呢?
有研究证实,XIAP mRNA具有独特的5’-UTR和二级结构,能够以IRES依赖的方式进行蛋白质翻译[16]。而这种IRES依赖的翻译机制又与eIF4E的磷酸化密不可分[17]。本研究发现,左旋棉酚可显著抑制表柔比星诱导的eIF4E磷酸化,这对XIAP的IRES依赖的翻译至关重要,因此推测左旋棉酚是通过抑制表柔比星诱导的p-eIF4E,阻碍了XIAP以IRES依赖的方式进行翻译,从而抑制XIAP的表达上调。
综上所述,左旋棉酚联合表柔比星可以显著促进HCC细胞Hep3B和HuH7的凋亡并抑制细胞的存活,而该途径主要是通过抑制eIF4E的磷酸化和XIAP的上调表达而实现。在表柔比星处理过程中,HCC细胞的eIF4E被磷酸化,随后促进XIAP以IRES依赖的方式持续翻译。而加入左旋棉酚后,eIF4E的磷酸化受到抑制,阻碍了XIAP的持续翻译,从而影响到XIAP抗凋亡作用的发挥,最终促进表柔比星诱导细胞凋亡。本研究为左旋棉酚与表柔比星联用抗HCC以及表柔比星更好地应用于HCC治疗等临床问题提供了理论基础与实验依据。
| [1] |
JEMAL A, WARD E M, JOHNSON C J, et al. Annual report to the nation on the status of cancer, 1975-2014, featuring survival[J]. J Natl Cancer Inst, 2017, 109(9): djx030. |
| [2] |
BAI Z B, QIN Y L, ZHU G Y, et al. Efficacy and safety of epirubicin applied in transcatheter arterial chemoembolization for hepatocellular carcinoma: a meta-analysis[J]. J Cancer Res Ther, 2018, 14(1): 133-138. |
| [3] |
FORNER A, GILABERT M, BRUIX J, et al. Treatment of intermediate-stage hepatocellular carcinoma[J]. Nat Rev Clin Oncol, 2014, 11(9): 525-535. |
| [4] |
HAN K H, PARK J Y. Chemotherapy for advanced hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2008, 23(5): 682-684. |
| [5] |
LU Y Z, LI J, DONG C E, et al. Recent advances in gossypol derivatives and analogs: a chemistry and biology view[J]. Future Med Chem, 2017, 9(11): 1243-1275. |
| [6] |
WANG B, CHEN L F, NI Z H, et al. Hsp90 inhibitor 17-AAG sensitizes Bcl-2 inhibitor (-)-gossypol by suppressing ERK-mediated protective autophagy and Mcl-1 accumulation in hepatocellular carcinoma cells[J]. Exp Cell Res, 2014, 328(2): 379-387. |
| [7] |
WU Y, WEI Y N, YUE W Y, et al. Influence of gossypol acetic acid on the growth of human adenoid cystic carcinoma ACC-M cells and the expression of DNA methyltransferase 1[J]. Genet Mol Res, 2015, 14(4): 13456-13466. |
| [8] |
ZHAO G X, XU L H, PAN H, et al. The BH3-mimetic gossypol and noncytotoxic doses of valproic acid induce apoptosis by suppressing cyclin-A2/Akt/FOXO3a signaling[J]. Oncotarget, 2015, 6(36): 38952-38966. |
| [9] |
LINDER B, WEHLE A, HEHLGANS S, et al. Arsenic trioxide and (-)-gossypol synergistically target glioma stem-like cells via inhibition of hedgehog and Notch signaling[J]. Cancers, 2019, 11(3): 350. |
| [10] |
WANG Y X, LI X M, ZHANG L, et al. A randomized, double-blind, placebo-controlled study of B-cell lymphoma 2 homology 3 mimetic gossypol combined with docetaxel and cisplatin for advanced non-small cell lung cancer with high expression of apurinic/apyrimidinic endonuclease 1[J]. Invest New Drugs, 2020, 38(6): 1862-1871. |
| [11] |
XU J, ZHU G Y, CAO D, et al. Gossypol overcomes EGFR-TKIs resistance in non-small cell lung cancer cells by targeting YAP/TAZ and EGFR L858R/T790M[J]. Biomed Pharmacother, 2019, 115: 108860. |
| [12] |
BRUIX J, GORES G J, MAZZAFERRO V. Hepatocellular carcinoma: clinical frontiers and perspectives[J]. Gut, 2014, 63(5): 844-855. |
| [13] |
LIU Z H, SUN J X, FENG J K, et al. Prognostic comparison between liver resection and transcatheter arterial chemoembolization for hepatocellular carcinoma patients with bile duct tumor thrombus: a propensity-score matching analysis[J]. Front Oncol, 2022, 12: 835559. |
| [14] |
HAMY A S, BIECHE I, LEHMANN-CHE J, et al. BIRC5 (survivin): a pejorative prognostic marker in stage Ⅱ/Ⅲ breast cancer with no response to neoadjuvant chemotherapy[J]. Breast Cancer Res Treat, 2016, 159(3): 499-511. |
| [15] |
SUNG B, RAVINDRAN J, PRASAD S, et al. Gossypol induces death receptor-5 through activation of ROS-ERK-CHOP pathway and sensitizes colon cancer cells to TRAIL[J]. J Biol Chem, 2016, 291(32): 16923. |
| [16] |
THAKOR N, SMITH M D, ROBERTS L, et al. Cellular mRNA recruits the ribosome via eIF3-PABP bridge to initiate internal translation[J]. RNA Biol, 2017, 14(5): 553-567. |
| [17] |
LI X Z, LI B, NI Z H, et al. Metformin synergizes with BCL-XL/BCL-2 inhibitor ABT-263 to induce apoptosis specifically in p53-defective cancer cells[J]. Mol Cancer Ther, 2017, 16(9): 1806-1818. |




