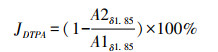2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系复合伤研究所,创伤、烧伤与复合伤国家重点实验室;
3. 400038 重庆,陆军军医大学(第三军医大学)第一附属医院:关节科
2. State Key Laboratory of Trauma, Burns and Combined Injury, Institute of Combined Injury, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Center for Joint Surgery, First Affiliated Hospital, Army Medical University (Third Military Medical University), Chongqing, 400038
人类历史上有一些严重的核事故如切尔诺贝利核电站事故[1]、福岛核电站因海啸发生核废弃物泄漏等[2],大量高水平的各种裂变产物被排放到环境中造成核污染[1-3]。核素可经消化道途径进入血液[4],引起严重疾病和死亡[3, 5-6]。二乙烯三胺五乙酸(diethylenetriamine pentaacetic acid,DTPA)为美国食品药品监督管理局(Food and Drug Administration,FDA)推荐使用的广谱螯合剂,其副作用较多,且尚无消化道剂型[7]。乙二醇壳聚糖(glycol chitosan,GC)是壳聚糖(chitosan,CS)改性后的衍生物之一,其水溶性良好,并具有CS的生物相容性、可降解性及低毒性等特点[8-10],且对辐射损伤有一定的防护作用[11-14]。
鉴于此,本研究拟将DTPA、GC通过有机合成、化学交联等方法,合成乙二醇壳聚糖-二乙烯三胺五乙酸(glycol chitosan-diethylenetriamine pentaacetic acid,GC-DTPA),并制备口服溶液,以期提高其螯合促排能力、增加其使用途径、减少其副作用及延伸其治疗时机,从而拟为消化道核沾染的早期促排提供快速、高效、无毒的广谱螯合促排剂。
1 材料与方法 1.1 实验动物6~8周龄健康SPF级SD大鼠80只,雌雄不拘,体质量180~220 g,由陆军军医大学实验动物中心提供。饲养环境:室温20~25 ℃,相对湿度40%~70%,大鼠自由活动,自由饮水,喂以普通鼠食。
1.2 试剂及仪器GC(G7753,Sigma);DTPA(信裕生物);99% N-(3-二甲氨基丙基)-N’-乙基碳二亚胺盐酸盐(N-(3-dimethylaminopropyl)-n’-ethyl carbon diimide hydroch-loride,EDC)与98%N-羟基琥珀酰亚胺(N-hydroxysuccinimide,NHS)购于北京百灵威科技有限公司;透析袋(截留分子量为8 000~14 000,BBI)。FT-IR 800型红外光谱仪(KBr压片); BrukerAV-400型核磁共振仪;大鼠ICE-6细胞(赛百慷);二甲基亚砜(索莱宝);1640培养基;0.25%胰蛋白酶(含EDTA);胎牛血清(GIBCO,美国);CCK-8试剂盒(碧云天)。
1.3 GC-DTPA的制备称取GC 1 g(2.86 mmol -NH2)于250 mL烧瓶中,加入50 mL去离子水,充分溶解;称取DTPA 1.12 g(2.86 mmol)、EDC 650 mg、NHS 380 mg于烧瓶中,30℃反应24 h[15-16]。将溶液转移至透析袋中去离子水透析3 d,冷冻干燥得226 mg淡黄色固体。产物用傅立叶变换红外光谱(Fourier transform infrared,FT-IR),核磁共振氢谱(proton nuclear magnetic resonance, 1H NMR)进行表征。
1.4 GC-DTPA的表征 1.4.1 FT-IR测试取适量样品与KBr粉末以质量比1 ∶200混合,研细压片后测试; 扫描范围4 000 cm-1~ 400 cm-1,取GC、GC-DTPA进行测试。
1.4.2 1H NMR分析运用超导核磁共振仪扫描核磁氢谱。将GC、GC-DTPA溶于重水(D2O)溶液中,扫描条件:频率为400 MHz,范围0~14 ppm。
1.5 GC-DTPA的细胞相容性研究取对数生长期大鼠ICE-6细胞,以5×103/孔均匀接种于96孔板,放入37 ℃、体积分数5% 的CO2培养箱中孵育,待细胞贴壁生长,吸弃培养液,使用GC-DTPA溶液(浓度分别为0.01、0.05、0.1、0.5 mg/mL)处理细胞。同时设置对照组,每组设置6个复孔,置于培养箱孵育48 h后弃去培养基,每孔加入100 μL CCK-8工作液(CCK-8 ∶1640=1 ∶10),置于培养箱孵育1 h后,用酶标仪测定450 nm处吸光度值[D(450)]。细胞存活率=[D(450)试验孔-D(450)空白孔]/[D(450)对照孔-D(450)空白孔]×100%。
1.6 动物实验测试GC-DTPA的全身毒性反应实验于陆军军医大学复合伤研究所国家重点实验室完成,全程按陆军军医大学动物伦理委员会批准的动物保护指南实施。80只大鼠随机分为4组。实验给药方式均采用灌胃针经口灌胃给药,实验前12 h大鼠禁食。参考文献[17-21],设置实验组GC-DTPA剂量:60、90、120 mg/kg共3组,均溶于1 mL生理盐水中;对照组给予同等剂量生理盐水,饲养笼中继续饲养并观察。分别于2、7、14 d称量并记录大鼠体质量,观察大鼠是否出现体质量改变和死亡情况等。14 d各组随机选取5只大鼠剪尾取静脉血,行常规血液学检测:白细胞计数(WBC)、红细胞计数(RBC)、血红蛋白含量(HGB)、血小板计数(PLT)。血液生化检查:钾离子(K+)、钙离子(Ca2+)、无机磷(P)、尿素氮(BUN)、肌酐(CREA)、丙氨酸转移酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、谷氨酰转移酶(GGT)。取血后处死大鼠,取心、肝、脾、肺、肾、卵巢及回盲部相同位置1 cm组织,用冰PBS冲洗干净,4%多聚甲醛固定,石蜡包埋切片,HE染色后显微镜下观察。其余大鼠继续饲养观察6个月。
1.7 统计学分析应用SPSS 25.0统计软件进行数据处理。正态分布计量资料以x±s表示,多组间比较采用单因素方差分析,两两比较采用Tukey-t检验。重复测量数据采用重复测量方差分析,当交互作用有统计学意义时进一步采用简单效应分析。以P < 0.05表示差异有统计学意义。
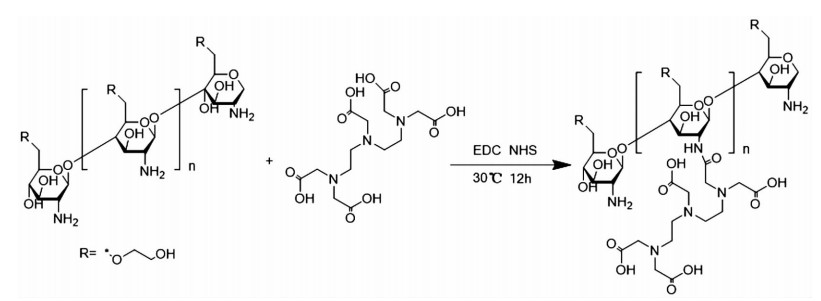
2 结果 2.1 GC-DTPA的合成GC-DTPA的合成路线见图 1。在NHS和EDC的催化作用下,GC与DTPA通过N-酰化反应制备。制备的产物为淡黄色固体,易溶于水溶液中,可完全溶解,呈淡黄色澄清液体。
|
| 图 1 GC-DTPA的合成路线图 |
2.2 GC-DTPA的表征
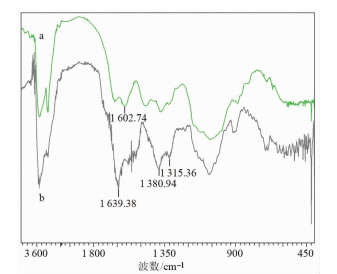
GC、GC-DTPA的FT-IR如图 2所示。图 2a处1602.74 cm-1位置为GC上的-NH2基团,图 2b GC-DTPA上伯胺峰消失;图 2b 1639.38 cm-1为GC-DTPA上的-COOH基团,图 2b 1400 cm-1~1200 cm-1 GC-DTPA上出现仲酰胺键特征峰增强。说明DTPA已经接枝在了GC上。
|
| 绿色(a):GC;灰色(b):GC-DTPA 图 2 GC、GC-DTPA的FT-IR |
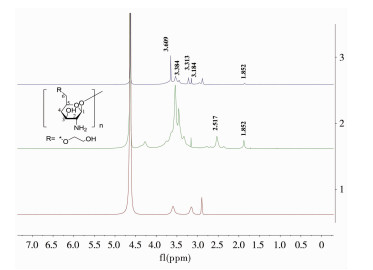
GC-DTPA、GC及DTPA的1H NMR见图 3。3-GC-DTPA δ 3.184~3.609 ppm为GC上的质子峰;δ 3.384 ppm为DTPA侧链叔胺与羧基之间亚甲基上的质子峰;δ 3.313 ppm为DTPA侧链N-CH2-CH2-N单元亚甲基上的质子峰;GC-DTPA上GC的氨基峰(δ=2.517)消失,表明GC的氨基完全与DTPA的羧基发生酰胺化反应,证明DTPA成功接枝到了GC上。文献[22]报道壳聚糖的酯化反应大都发生于氨基和C6的羟基上,以接枝前后GC单元C6的羟基(δ=1.852)的质子比峰面积(A1为GC上C6的羟基峰积分面积,A2为GC-DTPA中C6的羟基峰积分面积)计算反应比例,结果显示GC上C6羟基的反应率为96.3%,计算公式为:
|
| 3-GC-DTPA(蓝色);2-GC(绿色);1-DTPA(红色) 图 3 GC、GC-DTPA的1H NMR |
综上可知,DTPA接枝GC的接枝率为196.3%。
2.3 GC-DTPA细胞相容性研究与对照组相比,随着GC-DTPA浓度的增加对ICE-6细胞的增殖无明显影响(P>0.05),且其浓度达到0.5 mg/mL时,细胞存活率均> 90%(图 4)。
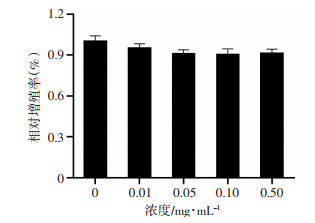
|
| 图 4 不同浓度GC-DTPA对ICE-6细胞活性的影响(n=6,x±s) |
2.4 GC-DTPA的全身毒性反应 2.4.1 体质量变化
各组大鼠体质量在给药后第2天均稍有下降,后逐步恢复并稳步增长,且各组体质量于0、2、7、14 d的变化趋势无统计学差异(P>0.05,图 5)。2 d体质量较前稍有减轻,可能与灌胃操作对大鼠食欲的影响有关。
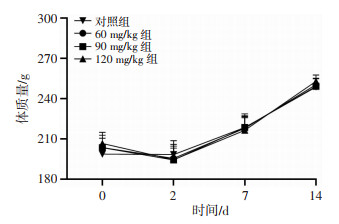
|
| 图 5 各组大鼠各时间点体质量变化(n=20,x±s) |
2.4.2 常规血液学检查
各组大鼠给药14 d血常规检查结果中WBC、RBC、HGB、PLT等指标均无统计学差异(P>0.05,表 1)。
| 组别 | WBC/×109·L-1 | RBC/×1012·L-1 | HGB/g·L-1 | PLT/×109·L-1 |
| 对照组 | 8.14±2.30 | 7.83±1.35 | 171.44±25.32 | 1 018.38±85.45 |
| GC-DTPA给药组 | ||||
| 60 mg/kg组 | 5.82±0.40 | 9.22±2.45 | 183.00±44.09 | 1 019.20±51.13 |
| 90 mg/kg组 | 5.87±0.75 | 8.11±1.08 | 163.20±20.08 | 959.20±88.79 |
| 120 mg/kg组 | 7.51±2.90 | 9.11±1.16 | 181.20±21.28 | 975.00±65.43 |
2.4.3 血液生化检查
各组大鼠给药14 d血液生化检查结果显示(表 2),对照组BUN水平低于60 (P < 0.05)、120 mg/kg组(P < 0.001);实验组CREA水平均高于对照组(P < 0.001),ALP水平均低于对照组(P < 0.01);ALT、AST、GGT、K+、Ca2+、P水平与对照组无统计学差异(P>0.05)。
| 组别 | K+/mmol·L-1 | Ca2+/mmol·L-1 | P/mmol·L-1 | BUN/mmol·L-1 | CREA/μmol·L-1 | ALT/U·L-1 | AST/U·L-1 | ALP/U·L-1 | GGT/U·L-1 |
| 对照组 | 5.06±0.73 | 2.62±0.05 | 2.61±0.70 | 6.54±0.86 | 24.20±3.49 | 41.97±7.89 | 149.30±24.66 | 175.00±34.46 | 0.76±0.27 |
| GC-DTPA给药组 | |||||||||
| 60 mg/kg组 | 5.23±0.33 | 2.73±0.06 | 2.33±0.20 | 7.85±0.88a | 37.40±2.61c | 32.90±4.12 | 144.26±19.04 | 93.00±47.68b | 0.88±0.41 |
| 90 mg/kg组 | 5.24±0.36 | 2.74±0.08 | 2.07±0.21 | 6.78±0.93 | 35.60±2.97c | 39.20±6.76 | 132.26±26.99 | 102.20±30.88b | 0.54±0.37 |
| 120 mg/kg组 | 4.92±0.12 | 2.69±0.16 | 2.12±0.32 | 8.51±0.68c | 38.20±3.42c | 37.12±3.42 | 128.42±16.47 | 94.80±10.80b | 0.52±0.46 |
| a: P < 0.05,b:P < 0.01,c:P < 0.001,与对照组比较 | |||||||||
2.4.4 大鼠各脏器组织病理学变化
给药14 d各组大鼠脏器组织病理学结果显示(图 6):心脏内膜、外膜及心肌结构完整,心肌细胞未见肿胀及变性,间质未见炎症细胞浸润。肝小叶排列整齐,无肝细胞水肿及其他改变,汇管区结构正常,无纤维化及炎细胞浸润。脾脏结构完整,白髓、红髓未见异常。肾单位数量、形态、分布正常,未见明显损伤性改变。肺泡上皮完整,未见出血、水肿以及炎细胞浸润。小肠绒毛排列整齐,未见黏膜损伤及炎细胞浸润。卵巢组织结构清晰,各级卵泡清晰可见,间质血管较丰富,未见炎性细胞浸润。各组剩余大鼠继续饲养,连续观察6个月,未出现大鼠死亡情况。

|
| 图 6 各组大鼠给药14 d各器官组织病理学观察结果 |
3 讨论
核爆炸或核泄漏具有杀伤力大且致伤因素复杂特点,一旦发生核战争或核泄露事件,会给人类带来毁灭性打击,因此研究核暴露后的损伤和防护具有重要的军事和社会意义[4, 6, 23-24]。目前,壳聚糖及其改性后的衍生物在生物医药领域得到广泛应用。乙二醇改性后的壳聚糖具有壳聚糖的生物活性、生物相容性及辐射防护作用[13-14, 25],且具无生物毒性、无免疫原性等特点[11-12, 26],还改善了其不溶于水、碱及一般有机溶剂的特性。本研究采用有机合成及化学交联的方法,成功将DTPA接枝在乙二醇改性后的壳聚糖上,合成产物GC-DTPA为亲水化合物,不能通过细胞膜的磷脂双分子层,其结构中含有大量的-COOH与-OH,-COOH与-OH分别均可与重金属螯合[27-28],且已有研究证实-COOH、-OH在体外均有较强的结合核素的能力[21, 29-30]。大量-OH能在消化道让粪便保持大量的水分,产生容积性和湿润性导泻[31-32]。故其预期能使摄入消化道的放射性核素快速经胃肠道途径排出体外,有效减少放射性核素经肠道吸收入血,为后续治疗赢得时间。
本研究结果显示,新合成的GC-DTPA与大鼠ICE-6细胞共培养,细胞在1~2 d快速生长,细胞相对增殖率均在90%以上,表明其具有良好的细胞相容性。不同剂量GC-DTPA对大鼠体质量及常规血液学检查结果无明显影响,连续观察6个月,各组大鼠生存情况良好。实验组尿素氮及肌酐结果稍高于对照组,但均处于正常值参考范围内[33-35],无临床意义。实验组与对照组大鼠各脏器均未见损伤性病理改变。故上述细胞及动物实验结果验证了新合成的GC-DTPA聚合物在常规使用剂量范围安全性良好。
综上研究结果表明,化学合成、交联方法可合成GC-DTPA,并未见其明显细胞毒性,且在口服给药至120 mg/kg时未见明显全身毒性反应,值得进一步研究其消化道核沾染的螯合促排效果。
| [1] |
RANTAVAARA A. Ingestion doses in Finland due to (90)Sr, (134)Cs, and (137)Cs from nuclear weapons testing and the Chernobyl accident[J]. Appl Radiat Isot, 2008, 66(11): 1768-1774. |
| [2] |
BRUMFIEL G, FUYUNO I. Fukushima's legacy of fear[J]. Nature, 2012, 483: 138-40. |
| [3] |
MINENKO V F, ULANOVSKY A V, DROZDOVITCH V V, et al. Individual thyroid dose estimates for a case-control study of Chernobyl-related thyroid cancer among children of Belarus: part Ⅱ. Contributions from long-lived radionuclides and external radiation[J]. Health Phys, 2006, 90(4): 312-327. |
| [4] |
APOSTOAEI A I. Absorption of strontium from the gastrointestinal tract into plasma in healthy human adults[J]. Health Phys, 2002, 83(1): 56-65. |
| [5] |
BJORNERSTEDT R, HAGGROTH S. Determination of strontium-90 distribution in human bone[J]. Nature, 1960, 185: 366-367. |
| [6] |
RAABE O G, PARKS N J. Skeletal uptake and lifetime retention of 90Sr and 226Ra in beagles[J]. Radiat Res, 1993, 133(2): 204-218. |
| [7] |
ARTS J, BADE S, BADRINAS M, et al. Should DTPA, an Aminocarboxylic acid (ethylenediamine-based) chelating agent, be considered a developmental toxicant?[J]. Regul Toxicol Pharmacol, 2018, 97: 197-208. |
| [8] |
荆晓光, 刘舒云, 郭维民, 等. 可注射性乙二醇壳聚糖/双醛功能化聚乙二醇水凝胶的细胞相容性[J]. 中国组织工程研究, 2019, 23(2): 196-203. JING X G, LIU S Y, GUO W M, et al. Cytocompatibility of injectable glycol chitosan/dibenzaldehyde-terminated poly-ethyleneglycol hydrogel[J]. Chin J Tissue Eng Res, 2019, 23(2): 196-203. |
| [9] |
王爱勤, 李洪启, 俞贤达. 不同介质中乙二醇壳聚糖的合成及性能研究[J]. 天然产物研究与开发, 1997, 9(2): 28-31. WANG A Q, LI H Q, YU X D. Studies on synthesis and preperties of glycolchitosan in the different solvents[J]. Nat Prod Res Dev, 1997, 9(2): 28-31. |
| [10] |
余敬谋, 李永杰, 王成润, 等. 乙二醇壳聚糖-胆固醇接枝物载多柔比星自聚集纳米粒的制备及其大鼠体内药动学研究[J]. 中国药学杂志, 2010, 45(4): 277-282. YU J M, LI Y J, WANG C R, et al. Preparation of doxorubicin loaded self-aggregated nanoparticles based on cholesterol-modified glycol chitosan conjugate and its pharmacokinetics in rats[J]. Chin Pharm J, 2010, 45(4): 277-282. |
| [11] |
WANG W J, XUE C H, MAO X Z. Chitosan: Structural modification, biological activity and application[J]. Int J Biol Macromol, 2020, 164: 4532-4546. |
| [12] |
YOON S P, HAN M S, KIM J W, et al. Protective effects of chitosan oligosaccharide on paraquat-induced nephrotoxicity in rats[J]. Food Chem Toxicol, 2011, 49(8): 1828-1833. |
| [13] |
GULIK E S, KOSTESHA N I A. Radioprotective efficacy of chitosan, dissolved in aqueous extract of Abies Sibirica[J]. Radiats Biol Radioecol, 2004, 44(5): 563-565. |
| [14] |
ZHAI X C, YANG X, ZOU P, et al. Protective effect of chitosan oligosaccharides against cyclophosphamide-induced immunosuppression and irradiation injury in mice[J]. J Food Sci, 2018, 83(2): 535-542. |
| [15] |
BHATT R, SREEDHAR B, PADMAJA P. Adsorption of chromium from aqueous solutions using crosslinked chitosan-diethylenetriaminepentaacetic acid[J]. Int J Biol Macromol, 2015, 74: 458-466. |
| [16] |
REPO E, MALINEN L, KOIVULA R, et al. Capture of co(Ⅱ) from its aqueous EDTA-chelate by DTPA-modified silica gel and chitosan[J]. J Hazard Mater, 2011, 187(1/2/3): 122-132. |
| [17] |
KOSTIAL K, KARGACIN B, LANDEKA M. Oral Zn-DTPA treatment reduces cadmium absorption and retention in rats[J]. Toxicol Lett, 1987, 39(1): 71-75. |
| [18] |
MICCOLI L, MÉNÉTRIER F, LAROCHE P, et al. Chelation treatment by early inhalation of liquid aerosol DTPA for removing Plutonium after rat lung contamination[J]. Radiat Res, 2019, 192(6): 630-639. |
| [19] |
SUEDA K, SADGROVE M P, HUCKLE J E, et al. Orally administered DTPA penta-ethyl ester for the decorporation of inhaled (241)Am[J]. J Pharm Sci, 2014, 103(5): 1563-1571. |
| [20] |
WILSON J P, COBB R R, DUNGAN N W, et al. Decorporation of systemically distributed americium by a novel orally administered diethylenetriaminepentaacetic acid (DTPA) formulation in beagle dogs[J]. Health Phys, 2015, 108(3): 308-318. |
| [21] |
胡丹飞. 新型促排剂WSC-DTPA纳米粒对内污染铀促排和防护作用的研究[D]. 苏州: 苏州大学, 2013. HU D F. Decorporation and radiation protection effects of WSC-DTPA nanoparticles on internal uranium exposure[D]. Suzhou: Soochow University, 2013. |
| [22] |
芦娟娟. O-羧甲基壳聚糖枝接偶氮色素的制备及抗还原能力的研究[D]. 天津: 天津大学, 2016. LU J J. Research on O-carboxymethyl chitosan grafted azo pigment: preparation and anti-reductive ability[D]. Tianjin: Tianjin University, 2016. |
| [23] |
GULAKOV A V. Accumulation and distribution of (137)Cs and (90)Sr in the body of the wild boar (Sus scrofa) found on the territory with radioactive contamination[J]. J Environ Radioact, 2014, 127: 171-175. |
| [24] |
付维林, 陈翔宇, 李蓉, 等. 支气管喷入高剂量贫铀染毒犬模型早期损伤特点研究[J]. 第三军医大学学报, 2021, 43(1): 52-58. FU W L, CHEN X Y, LI R, et al. Features of early injuries in canine model of high dose depleted uranium exposure through bronchial spraying[J]. J Third Mil Med Univ, 2021, 43(1): 52-58. |
| [25] |
郭剑平, 杨仲田, 张华屏. 低聚壳聚糖的辐射防护作用小鼠试验研究[J]. 辐射防护通讯, 2010, 30(2): 23-25. GUO J P, YANG Z T, ZHANG H P. Study on radiation protection effect of oligo-chitosan for mice[J]. Radiat Prot Bull, 2010, 30(2): 23-25. |
| [26] |
GITERU S G, CRIDGE B, OEY I, et al. In-vitro degradation and toxicological assessment of pulsed electric fields crosslinked zein-chitosan-poly(vinyl alcohol) biopolymeric films[J]. Food Chem Toxicol, 2020, 135: 111048. |
| [27] |
LUU T T, DINH V P, NGUYEN Q H, et al. Pb(Ⅱ) adsorption mechanism and capability from aqueous solution using red mud modified by chitosan[J]. Chemosphere, 2022, 287: 132279. |
| [28] |
ZHANG Y Z, ZHAO M W, CHENG Q, et al. Research progress of adsorption and removal of heavy metals by chitosan and its derivatives: a review[J]. Chemosphere, 2021, 279: 130927. |
| [29] |
高旭, 李鹏, 王学刚, 等. EDTA螯合-电絮凝处理低浓度含铀废水[J]. 环境工程, 2018, 36(7): 27-32. GAO X, LI P, WANG X G, et al. Treatment of low concentration uranium-containing wastewater by edta chelating-electrocoagulation[J]. Environ Eng, 2018, 36(7): 27-32. |
| [30] |
张刘珍. 新型内污染纳米型促排药物的研制[D]. 苏州: 苏州大学, 2009. ZHANG L Z. A new nano-chelating agent to 89Sr[D]. Suzhou: Soochow University, 2009. |
| [31] |
陆正清. 糖醇类营养型合成甜味剂的开发与应用[J]. 食品工业科技, 2004, 25(10): 115-7. LU Z Q. Development and application of sugar alcohol nutritional synthetic sweeteners[J]. Sci Technol Food Ind, 2004, 25(10): 115-117. |
| [32] |
张英杰. 甘露醇在临床应用中的新进展[J]. 临床荟萃, 1996, 11(15): 695. ZHANG Y J. New progress in clinical application of mannitol[J]. Clin Focus, 1996, 11(15): 695. |
| [33] |
邓雯, 陈莉莉, 刘晶, 等. SPF级SD大鼠血液学及血清生化指标正常值探讨[J]. 毒理学杂志, 2010, 24(2): 174-175. DENG W, CHEN L L, LIU J, et al. Study on normal values of hematology and serum biochemical indexes in SPF SD rats[J]. J Toxicol, 2010, 24(2): 174-175. |
| [34] |
张薇, 唐彬, 付新录, 等. 不同月龄SPF级SD大鼠临床生理生化背景数据分析[J]. 热带医学杂志, 2018, 18(1): 5-10. ZHANG W, TANG B, FU X L, et al. Analysis of the background data of hemocytology and biochemistry in the blood of SPF Sprague Dawley rats at different ages[J]. J Trop Med, 2018, 18(1): 5-10. |
| [35] |
赵毓梅, 郑定仙, 黄业宇, 等. SD大鼠血常规、血液生化指标、脏体比正常参考值范围研究[J]. 中国卫生检验杂志, 2002, 12(2): 165-7. ZHAO Y M, ZHENG DI X, HUANG Y Y. Study on normal reference range of blood routine, blood biochemical indexes and organ-body ratio in etal.SD rats[J]. Chin J Heal Lab Technol, 2002, 12(2): 165-7. |