2. 100026 北京,朝阳区妇幼保健院儿科;
3. 266033 山东 青岛,青岛市海慈医疗集团泌尿外科
2. Department of Pediatrics, Chaoyang District Maternal and Child Health Hospital, Beijing, 100026;
3. Department of Urology, Qingdao Haici Medical Group, Qingdao, Shandong Province, 266033, China
叶酸在细胞生长、分化、修复和宿主防御等方面扮演重要角色,其缺乏可导致许多先天性疾病的发生率明显增加。具体的作用机制是叶酸作为一碳代谢转移酶系的辅酶,起传递一碳单位的作用,其缺乏能够影响基因组甲基化重编程过程和组蛋白甲基化修饰,甚至改变它们的相互作用,影响相关区域染色质的表观修饰[1]。我们前期研究[2-6]发现胚胎发育过程中,叶酸缺乏可导致基因组甲基化紊乱和组蛋白甲基化修饰的异常。可见叶酸缺乏介导的一碳代谢紊乱可能通过改变DNA甲基化和组蛋白甲基化,影响染色质的表观修饰状态,最终导致发育异常和先天性疾病的(如神经管畸形,先心病等)发生。因此探索叶酸缺乏在胚胎发育中的作用及其机制,对于正确合理补充叶酸防治出生缺陷的发生有重要意义。
早期胚胎发育被认为是建立表观遗传修饰的一个关键窗口,不仅经历两次重要的基因组DNA甲基化重编程过程,还伴随着组蛋白的甲基化修饰,如组蛋白H3K4和H3K27的二价甲基化修饰[7-8]。Brachyury基因是胚胎发育早期特定阶段的一个T-box转录因子,它在体内特异表达于原肠胚形成期,参与脊索和中胚层轴向发育;体外分化培养特异性地表达在拟胚体(embryoid bodies,EBs)的三胚层阶段[9-10]。Brachyury基因在胚胎发育过程中起非常重要的作用,小鼠中Brachyury基因纯合突变(T-/-)导致胚胎在妊娠中期死亡,表现为中胚层结构来源的组织形态发生严重破坏,包括脊索、尿囊和原条;而杂合突变(T+/-)的小鼠后期轴向发育畸形,表现为短尾或无尾畸形,内脏和神经管之间融合,偶有骶椎的畸形[11]。Brachyury基因还参与多种疾病的发生,包括脊索瘤、血管瘤,中枢神经系统和肾脏相关疾病等[12-13]。因此Brachyury基因是胚胎发育早期的关键基因,且在进化过程中高度保守,该基因通过调控中胚层发育和脊索分化,诱导或参与多个发育进程,继而影响多个组织器官的形成。
因此,本研究进一步探索叶酸缺乏对于发育关键基因Brachyury的表观调控机制。由于ESCs分化为EBs的过程与体内胚胎的早期发育过程相似,因此我们选择叶酸缺乏的EBs分化细胞模型展开研究,通过检测Brachyury基因的甲基化和相关组蛋白修饰,进一步探讨其潜在的作用机制,为阐明叶酸对早期胚胎发育的作用提供新的角度。
1 材料与方法 1.1 实验材料 1.1.1 细胞培养用试剂明胶(货号:G1393)、DMEM(货号:D2429)和叶酸(货号:F7876)购自Sigma公司;β-巯基乙醇(货号:21985023)、非必需氨基酸(货号:11140)、L-谷氨酸(货号:35050)、胎牛血清(货号:16000)购自Thermo fisher公司;LIF(白血病抑制因子, Leukemia Inhibitory Factor,货号:LIF1010)购自Millipore公司。
1.1.2 实验用主要试剂Bisulfate处理DNA修饰试剂盒(P-1016)购自Epigentek公司;一抗H3K4me3(货号:ab8580)和H3K27me3(货号:ab6002)购自Abcam公司;ChIP试剂盒(货号:53008)购自Active Motif公司;cDNA合成试剂盒(货号:K1622)购自Thermo公司。
1.1.3 实验细胞小鼠胚胎干细胞(embryonic stem cell,ESCs)129/Sv品系D3购自上海生科院细胞库。
1.2 细胞培养与模型建立 1.2.1 细胞培养先将小鼠ESCs接种在涂有0.2%明胶的培养皿上,培养在不同叶酸浓度的DMEM培养基中(缺乏组0 mg/L,正常组4 mg/L),培养基中添加0.1 mmol/L β-巯基乙醇、非必需氨基酸、L-谷氨酸、15%胎牛血清和1 000 U/mL LIF。细胞培养在含5%的CO2的湿化环境中保持37 ℃,每天全量换液1次,培养4 d。细胞用0.25%胰酶进行消化,收集细胞用于后续实验。
1.2.2 细胞模型建立与分组ESC根据不同叶酸处理条件分为两组:4 mg/L为正常组,0 mg/L为叶酸缺乏组。去掉LIF,进一步将ESCs分化为EBs(处理条件见图 1)后分为3组。①正常组,4 mg/L叶酸培养的ESCs分化为EBs;②叶酸缺乏组,0 mg/L叶酸培养的ESCs分化为EBs;③叶酸补充组,0 mg/L叶酸培养的ESCs分化为EBs时改为正常叶酸培养基进行培养。
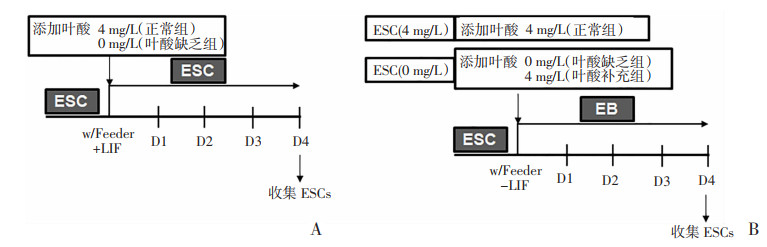
|
| A:ESC叶酸缺乏细胞模型;B:ESC分化为EB叶酸缺乏细胞模型 图 1 叶酸缺乏细胞模型制作步骤流程图 |
1.3 甲基化分析
将收集的细胞用Qiagen试剂盒提取出DNA,通过Nanodrop测定DNA浓度,D(260)∶D(280)=1.8保证DNA的纯度。将提取出的基因组DNA进行PCR扩增(引物见表 1),得到研究基因的产物。用Methylamp DNA修饰试剂盒进行Bisulfate处理完成CT转换。使用Sequenom-MassARRAY平台(CapitalBio)对Brachyury进行定量甲基化分析。具体序列参考文献[14],甲基化比率由Epityper软件版本1.0生成。
| 基因 | 引物序列 |
| Brachyury_1 | 正义:AATTTTTTTTGAAAAGGTTGAGGA 反义:AATAAAAAATTACTCTAAAACTATTCTCCA |
| Brachyury_2 | 正义:GGGTAGAAAAGGTGAAATTTTTTTT 反义:TTTTCCAAAAACCAACCTCTAAAAT |
| Brachyury_3 | 正义:GTTTTTTTTAGAAGTAGGGGTAGGT 反义:AAAATCTCTTTAAACAATAACATTCCTC |
| Brachyury_4 | 正义:TTAGTTAGTTTGTGTTGTGGGTTTG 反义:CTCCTCCTCTTTAAAAAACAATTCC |
1.4 ChIP-qPCR
将细胞在室温下以1%终浓度的37%甲醛交联10 min,染色质碎片经核酸酶处理,超声处理。分别用组蛋白H3K4me3和H3K27me3的抗体和对照抗体IgG进行孵育,免疫沉淀DNA经反向交联和DNA纯化后,进行RT-PCR反应(引物见表 2),获得各自的Ct值,并计算ChIP的富集效率。
| 基因 | 引物序列 |
| Brachyury | 正义:CCCACTGAGTCACAGGCTTT 反义:ACCACCAGCTCCAGAGGTAT |
| GAPDH | 正义:CCTCCTCCAATTCAACCCTTAAGA 反义:GAAAAGGAGATTGCTACGCCATAG |
1.5 实时定量PCR
将收集的细胞用trizol法提取RNA,通过nanodrop测定RNA浓度和纯度。将RNA逆转成cDNA,通过RT-PCR检测感兴趣基因的浓度(引物见表 3)。内参基因为GAPDH,用2-ΔCt方法计算目标基因的表达水平,其中ΔCt=Ct(目标基因)-Ct(GAPDH)。
| 基因 | 引物序列 |
| Brachyury | 正义:CACCTGTGTCACCCCCATCTAT 反义:CCTGCCACTTTGAGCCTAGAA |
| Gata6 | 正义:GCCAACTGTCACACCACAAC 反义:TGTTACCGGAGCAAGCTTTT |
| Fgf5 | 正义:GCGACGTTTTCTTCGTCTTC 反义:ACAATCCCCTGAGACACAGC |
| Gsc | 正义:CTCGGAGGAGTCAGAAAACG 反义:TCGACTGTCTGTGCAAGTCC |
| Oct4 | 正义:TCTTTCCACCAGGCCCCCGGCTC 反义:TGCGGGCGGACATGGGGAGATCC |
| Nanog | 正义:CAGGTGTTTGAGGGTAGCTC 反义:CGGTTCATCATGGTACAGTC |
| Sox2 | 正义:TAGAGCTAGACTCCGGGCGATGA 反义:TTGCCTTAAACAAGACCACGAAA |
| DNMT1 | 正义:ACCCAAGGAAGAGTCGGAAG 反义:TCCTCCTTTGATTTCCGCCT |
| DNMT3a | 正义:AGCACCCACTCTTCATTGGA 反义:ACACTCGACACAAAAGCACC |
| DNMT3b | 正义:TGCAGTAACACAAGCTGCTG 反义:CAATCTTTCCTGCGTCGGAG |
| GAPDH | 正义:TGTGTCCGTCGTGGATCTGA 反义:CCTGCTTCACCACCTTCTTGA |
1.6 统计学分析
使用SPSS 19.0软件(McGraw-Hill Inc,New York,NY)对数据进行分析。数据以x±s表示,单样本t检验评价叶酸缺乏组和正常组之间的差异。用单因素方差分析检验评价多个处理组之间的差异。
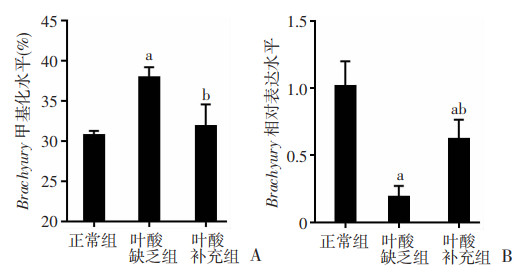
2 结果 2.1 叶酸缺乏的ESCs分化为EBs的过程中Brachyury表达下调的甲基化调控机制 2.1.1 叶酸缺乏通过高甲基化调控导致Brachyury表达下调叶酸缺乏的EBs中,Brachyury甲基化显著上调,由正常组(30.75±0.50)%升高至缺乏组(37.93±1.24)%;补充叶酸基本降至正常[(31.88±2.67)%,图 2A]。同时,叶酸缺乏的EBs中,Brachyury在转录水平显著下调,缺乏组Brachyury相对表达量为正常组的(0.19±0.08)倍;补充叶酸后Brachyury相对表达量上升至正常组的(0.62±0.14)倍(图 2B)。
|
|
a:P < 0.05,与正常组比较; b:P < 0.05,与叶酸缺乏组比较 A:massarray检测EBs中Brachyury的甲基化水平(n=6);B:RT-PCR检测EBs中Brachyury的表达水平(n=3) 图 2 叶酸缺乏的ESCs分化为EBs后Brachyury基因高甲基化致表达下调(x±s) |
2.1.2 Brachyury可能通过DNMT3b影响其甲基化修饰
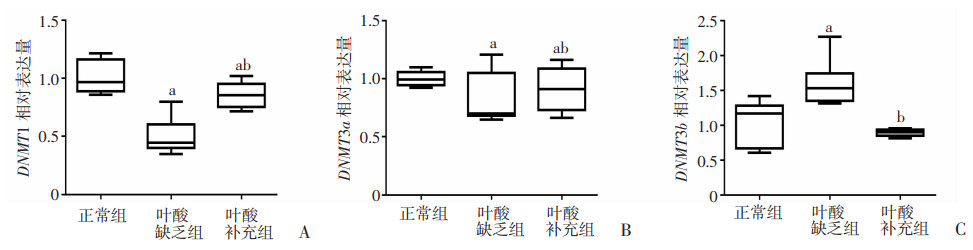
研究检测了3种DNA甲基化酶(DNMTs)的表达,结果显示叶酸缺乏的EBs中DNMT1表达显著下调,缺乏组中DNMT1相对表达量为正常组的(0.51±0.14)倍,补充叶酸后升高至正常组的(0.85±0.10)倍;DNMT3b的相对表达量叶酸缺乏组为正常组的(1.59±0.31)倍,补充叶酸后表达量下调至(0.89±0.05)倍;DNMT3a表达结果不随叶酸培养条件的改变而改变(图 3)。结果提示,Brachyury甲基化的改变可能与DNMTs密切相关,尤其是DNMT3b。
|
|
a:P < 0.05,与正常组比较; b:P < 0.05,与叶酸缺乏组比较 A:DNMT1;B:DNMT3a;C:DNMT3b 图 3 RT-PCR检测叶酸缺乏的EBs中DNMTs的表达(n=3,x±s) |
2.1.3 叶酸缺乏的EBs中Brachyury调控区组蛋白H3K27me3修饰升高
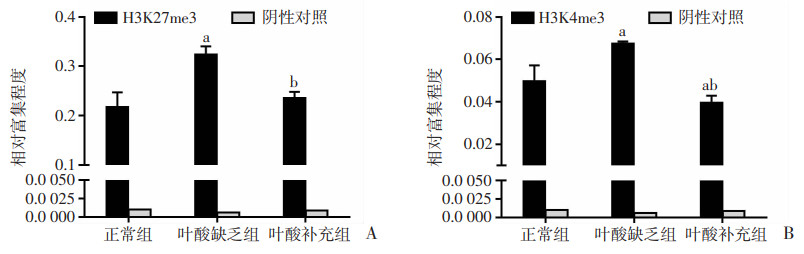
叶酸缺乏的ESCs分化为EBs后,ChIP-qPCR检测结果显示Brachyury基因的组蛋白修饰表现为H3K27甲基化水平升高;正常组、叶酸缺乏组的相对富集程度为(0.22±0.03)、(0.32±0.02),补充叶酸后为(0.24±0.01)。可能抑制该基因表达,与之前结果相一致。
结果中虽然H3K4甲基化水平也呈相同的升高表现,但整体结合偏低;正常组、叶酸缺乏组的相对富集程度为(0.050±0.008)、(0.067±0.001),补充叶酸后为(0.040±0.003)。相比而言,组蛋白修饰调控以H3K27甲基化修饰为主。该结果提示叶酸缺乏条件下,组蛋白H3K27甲基化修饰可能参与调控Brachyury基因的表达(图 4)。
|
|
a:P < 0.05,与正常组比较; b:P < 0.05,与叶酸缺乏组比较 A:蛋白H3K27me3;B:蛋白H3K4me3 图 4 ChIP-qPCR检测叶酸缺乏的EBs中Brachyury调控区组蛋白修饰改变(n=3,x±s) |
2.2 叶酸缺乏的ESCs分化为EBs的过程中细胞分化进程受阻
研究检测了ESCs中多潜能性markers:Oct4、Nanog和Sox2的表达。结果显示:叶酸缺乏导致ESCs中Nanog和Sox2的表达显著降低,Oct4表达没有显著改变。缺乏组Nanog和Sox2相对表达量分别为正常组的(0.43±0.20)、(0.58±0.03)倍(图 5A~C),提示叶酸缺乏可能导致ESCs多潜能性发生改变。在ESCs向EBs分化过程中,Nanog和Sox2在叶酸缺乏组中表达显著上调,其相对表达量分别为正常组的(3.18±0.95)和(4.23±1.59)倍;叶酸补充组Nanog和Sox2的相对表达量分别为正常组的(1.58±0.49)和(1.27±0.48)倍,显著下调。叶酸缺乏组的Oct4相对表达量为正常组的(1.30±0.23)倍,补充叶酸后为(1.36±0.16)倍(图 5D~F)。以上结果提示叶酸缺乏可能延缓EBs的分化进程。
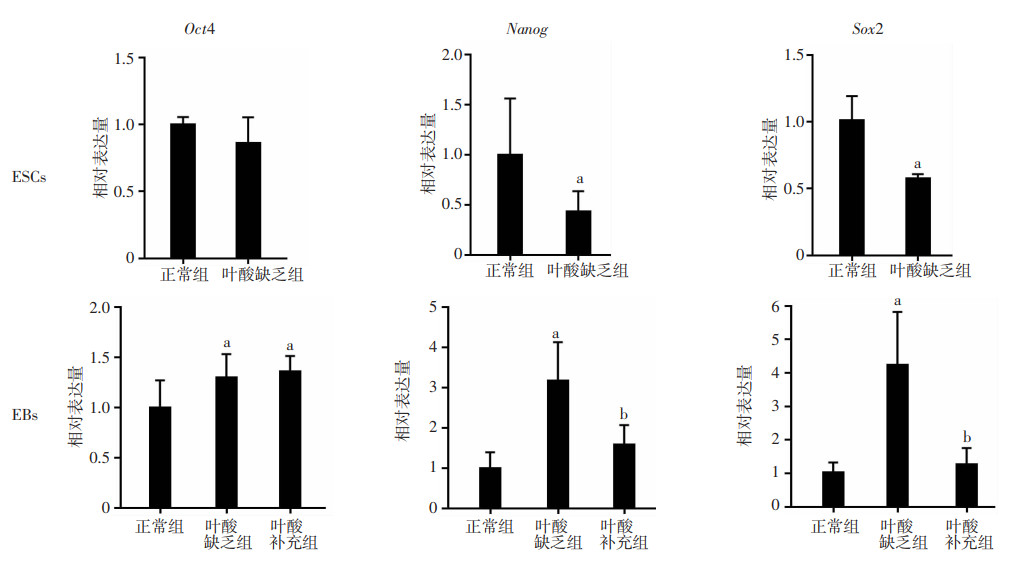
|
| a:P < 0.05,与正常组比较; b:P < 0.05,与叶酸缺乏组比较 图 5 叶酸缺乏的ESCs分化为EBs的过程中多潜能性干细胞markers表达改变(n=3,x±s) |
2.3 叶酸缺乏的ESCs分化为EBs后其三胚层结构显著改变
形态学检测结果显示:EBs细胞形态显著变化,表现为EBs球形结构变小,形态不规则;叶酸补充后EBs小球体积接近正常,呈规则的球体结构(图 6A)。
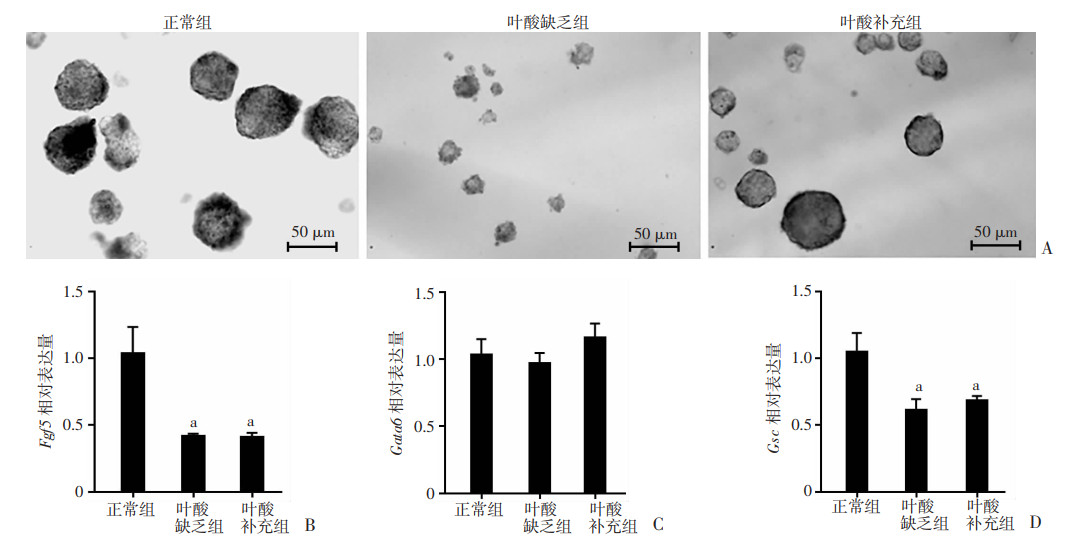
|
|
a:P < 0.05,与正常组比较 A:显微镜下不同叶酸处理的EBs形态结构改变;B、C、D分别为不同叶酸处理的EBs中外胚层(Fgf5)、内胚层(Gata6)、中胚层(Gsc)markers的表达 图 6 叶酸缺乏的ESCs分化为EBs后其形态及三胚层结构的改变(n=3,x±s) |
研究选择了三胚层的markers(内胚层:Gata6,中胚层:Gsc,外胚层:Fgf5),通过RT-PCR检测其在不同叶酸处理组的EBs中表达情况。结果显示:Fgf5和Gsc表达趋势一致,均表现为叶酸缺乏的ESCs分化为EBs后表达下调,其相对表达量在叶酸缺乏组中分别为正常组的(0.42±0.04)、(0.61±0.20)倍;但叶酸补充后没有显著改变,Fgf5和Gsc的相对表达量在叶酸补充组分别为正常组的(0.41±0.08)、(0.68±0.08)倍,而Gata6仅在叶酸缺乏的EBs中表达降低(图 6B~D)。提示叶酸缺乏可能影响了EBs的三胚层结构,对中胚层和外胚层影响更大。
3 讨论本研究在叶酸缺乏的ESCs分化为EBs的细胞模型中发现发育关键基因Brachyury的表达显著下调,而补充叶酸能够有效逆转这一现象。通过检测DNA甲基化酶DNMTs的表达,发现从头甲基化酶DNMT3b的表达上调,同时发现Brachyury基因调控区的组蛋白H3K27me3升高,提示叶酸缺乏可能通过DNA甲基化和组蛋白H3K27me3协同作用,最终抑制了Brachyury基因的表达。进一步通过检测ESCs多潜能性markers和EBs三胚层特异性markers的表达,发现叶酸缺乏的ESCs分化为EBs过程中多个多潜能性基因表达升高,中外胚层表达降低,提示叶酸可能影响ESCs向EBs的正常分化进程。本研究从新的角度阐释胚胎发育早期的营养缺乏增加疾病风险的理论,为了解叶酸影响胚胎发育尤其是早期胚胎发育的机制提供科学依据。
3.1 叶酸缺乏致Brachyury基因表达下调及其调控机制发生在基因调控序列的甲基化可以在不影响DNA序列的同时改变基因的表达,因此正确的甲基化模式对于基因的精确表达至关重要。特别是在胚胎发育的早期,需要大量的基因在特定的时间和空间开启和关闭,以确保其沿着正确的轨迹发育。发育早期的关键基因Brachyury,其表达质或量的改变会引起胚胎发育异常,而这种精确的基因表达调控过程多是在转录及转录后等不同水平进行的。研究发现胚胎发育过程中Brachyury基因存在甲基化重编程特征,如斑马鱼中发现Ntl(Brachyury的直系同源基因)在6~10体节开始去甲基化,受精后16~48小时变化最明显[15];蟾蜍中也发现Xbra(Brachyury的直系同源基因)在原肠胚期的一过性甲基化改变[16]。本研究发现叶酸缺乏的ESCs分化为EBs后,Brachyury启动子区甲基化水平显著上调,表达则被抑制,补充叶酸能够有效逆转这一现象,这与我们之前的研究相一致,这也在另一种ESCs的细胞模型中进一步得到了证实[14]。
那么叶酸缺乏如何影响Brachyury的甲基化改变?有研究在细胞模型中发现DNA甲基化酶Dnmt3a和3b双突变的EBs中,Brachyury基因甲基化水平明显降低[17],提示DNA甲基化酶可能参与这个过程。我们发现叶酸缺乏的EBs中,DNA甲基化酶DNMT3b表达上调,补充叶酸后表达恢复,提示DNMT3b参与Brachyury基因的甲基化修饰。除此之外,研究还发现Brachyury基因受组蛋白甲基化调控。发育过程中组蛋白甲基化呈现二价修饰特征:在胚胎早期分化先激活,成为常染色质,表现为H3K4三甲基化;后期被抑制,成为异染色质,表现为H3K27三甲基化[18-19]。Brachyury基因还是组蛋白H3K4去甲基化酶LSD1的靶基因[20]。我们的研究发现正常EBs中存在组蛋白H3K4me3和H3K27me3的二价修饰,但以H3K27me3为主。叶酸缺乏导致Brachyury基因的组蛋白H3K27me3修饰显著升高,从而参与调控Brachyury基因的表达,导致其表达下调。
有研究显示H3K27me3与DNA甲基化存在协同作用。DNMTs能够与H3K27me3的关键复合物PRC2相互作用,而且癌细胞或细胞系中一旦存在H3K27me3标记的基因会成为DNA异常甲基化的目标[21-22]。在失活的X-染色体上同时存在DNA甲基化和H3K27me3,从而导致转录失活[23]。反之,在ESCs中去除DNMTs后,H3K27me3也会减少[24]。因此叶酸缺乏通过调控Brachyury基因DNA甲基化和组蛋白H3K27me3修饰,共同作用于Brachyury的表达,导致其表达被显著抑制。
3.2 叶酸缺乏影响ESCs向EBs的分化进程胚胎发育包括一系列循序渐进的严格细胞状态,这些细胞里包括很多阶段特异的基因集合,这些基因最终以严格的时空顺序表达[25-26],因此,异常的发育关键基因的表达会直接影响某一阶段胚胎的发育。EBs作为体外关键的早期分化细胞模型,拥有典型的内中外三胚层结构,类似于体内的原肠胚期,三胚盘的出现在后期逐渐分化成不同的组织器官。Brachyury作为EBs阶段特异的关键基因,其表达遵循严格的时空顺序,当胚胎继续发育或者细胞从EBs继续分化,它的表达显著降低甚至消失。而由于叶酸缺乏导致的Brachyury基因表达抑制对EBs有何影响?我们从多潜能性和三胚层结构上进行了探讨,结果发现叶酸缺乏的EBs中,多潜能基因表达升高,尤其是Nanog和Sox2,提示叶酸缺乏可能让部分正常已分化的EBs细胞处于未分化状态,对EBs的形成造成滞后的影响;而三胚层结构也发生了异常,尤其是中外两个胚层均出现分化滞后状态(图 6)。研究已经表明Brachyury基因是胚胎发育早期的关键基因,可能作为一个调控网络中的核心因子,促进下游基因的正确表达,以维持正常的发育过程。已有研究表明Brachyury基因参与调控中胚层发育和脊索分化,诱导或参与多个发育进程,对后续多个组织器官的形成起关键作用[25-28]。因此,叶酸缺乏的EBs中未分化状态和中外胚层结构的这些改变可能与Brachyury基因的异常关系密切。
本研究从叶酸缺乏通过改变Brachyury基因调控区域的DNA甲基化水平和组蛋白H3K27甲基化修饰,或者它们协同作用,共同调控Brachyury基因的表达,通过影响早期胚胎发育,引起多系统发育异常。本研究从发育的早期阶段阐释叶酸缺乏对出生缺陷的复杂作用提供新的思路,为叶酸缺乏影响多系统发育的调控机制和作用靶点提供进一步的实验依据,同时为临床进行围孕期疾病防治开展精确的分子诊断提供初步依据。
| [1] |
BEKDASH R A. Earlylife nutrition and mental health: the role of DNA methylation[J]. Nutrients, 2021, 13(9): 3111. |
| [2] |
CHANG S Y, JING J, SHANGGUAN S F, et al. The effect of folic acid deficiency on Mest/Peg1 in neural tube defects[J]. Int J Neurosci, 2021, 131(5): 468-477. |
| [3] |
LI B Y, CHANG S Y, LIU C, et al. Low maternal dietary folate alters retrotranspose by methylation regulation in intra-uterine growth retardation (IUGR) fetuses in a mouse model[J]. Med Sci Monit, 2019, 25: 3354-3365. |
| [4] |
WANG L, CHANG S, GUAN J, et al. Tissue-specific methy-lation of long interspersed nucleotide element-1 of Homo sapiens (L1Hs) during human embryogenesis and roles in neural tube defects[J]. Curr Mol Med, 2015, 15(5): 497-507. |
| [5] |
ZHANG Q, XUE P, LI H L, et al. Histone modification mapping in human brain reveals aberrant expression of histone H3 lysine 79 dimethylation in neural tube defects[J]. Neurobiol Dis, 2013, 54: 404-413. |
| [6] |
CHANG S Y, WANG L, GUAN Y Q, et al. Long interspersed nucleotide element-1 hypomethylation in folate-deficient mouse embryonic stem cells[J]. J Cell Biochem, 2013, 114(7): 1549-1558. |
| [7] |
XU Q H, XIE W. Epigenome in early mammalian development: inheritance, reprogramming and establishment[J]. Trends Cell Biol, 2018, 28(3): 237-253. |
| [8] |
LADSTÄTTER S, TACHIBANA K. Genomic insights into chromatin reprogramming to totipotency in embryos[J]. J Cell Biol, 2019, 218(1): 70-82. |
| [9] |
KISPERTA, KOSCHORZ B, HERRMANN B G. The T protein encoded by Brachyury is a tissue-specific transcription factor[J]. Embo J, 1995, 14(19): 4763-4772. |
| [10] |
BRUCE A E E, WINKLBAUER R. Brachyury in the gastrula of basal vertebrates[J]. Mech Dev, 2020, 163: 103625. |
| [11] |
POSTMA A V, ALDERS M, SYLVA M, et al. Mutations in the T (brachyury) gene cause a novel syndrome consisting of sacral agenesis, abnormal ossification of the vertebral bodies and a persistent notochordal canal[J]. J Med Genet, 2014, 51(2): 90-97. |
| [12] |
BARRESI V, IENI A, BRANCA G, et al. Brachyury: a diagnostic marker for the differential diagnosis of chordoma and hemangioblastoma versus neoplastic histological mimickers[J]. Dis Markers, 2014, 2014: 514753. |
| [13] |
SHARIFNIA T, WAWER M J, CHEN T, et al. Small-molecule targeting of brachyury transcription factor addiction in chordoma[J]. Nat Med, 2019, 25(2): 292-300. |
| [14] |
CHANG S Y, LU X L, WANG S, et al. The effect of folic acid deficiency on FGF pathway via Brachyury regulation in neural tube defects[J]. FASEB J, 2019, 33(4): 4688-4702. |
| [15] |
YAMAKOSHI K, SHIMODA N. De novo DNA methylation at the CpG island of the zebrafishno tail gene[J]. genesis, 2003, 37(4): 195-202. |
| [16] |
STANCHEVA I, EL-MAARRI O, WALTER J, et al. DNA methylation at promoter regions regulates the timing of gene activation in Xenopus laevis embryos[J]. Dev Biol, 2002, 243(1): 155-165. |
| [17] |
JACKSON M, KRASSOWSKA A, GILBERT N, et al. Severe global DNA hypomethylation blocks differentiation and induces histone hyperacetylation in embryonic stem cells[J]. Mol Cell Biol, 2004, 24(20): 8862-8871. |
| [18] |
KUMAR D, CINGHU S, OLDFIELD A J, et al. Decoding the function of bivalent chromatin in development and cancer[J]. Genome Res, 2021, 31(12): 2170-2184. |
| [19] |
LIU X Y, WANG C F, LIU W Q, et al. Distinct features of H3K4me3 and H3K27me3 chromatin domains in pre-implantation embryos[J]. Nature, 2016, 537(7621): 558-562. |
| [20] |
FOSTER C T, DOVEY O M, LEZINA L, et al. Lysine-specific demethylase 1 regulates the embryonic transcriptome and CoREST stability[J]. Mol Cell Biol, 2010, 30(20): 4851-4863. |
| [21] |
SCHLESINGER Y, STRAUSSMAN R, KESHET I, et al. Polycomb-mediated methylation on Lys27 of histone H3 pre-marks genes for de novo methylation in cancer[J]. Nat Genet, 2007, 39(2): 232-236. |
| [22] |
CHARLTON J, DOWNING T L, SMITH Z D, et al. Global delay in nascent strand DNA methylation[J]. Nat Struct Mol Biol, 2018, 25(4): 327-332. |
| [23] |
GALUPA R, HEARD E. X-chromosome inactivation: new insights intoCis and trans regulation[J]. Curr Opin Genet Dev, 2015, 31: 57-66. |
| [24] |
BRINKMAN A B, GU H C, BARTELS S J J, et al. Sequential ChIP-bisulfite sequencing enables direct genome-scale investigation of chromatin and DNA methylation cross-talk[J]. Genome Res, 2012, 22(6): 1128-1138. |
| [25] |
QIU A Q, ZHANG H, KENNEDY B K, et al. Spatio-temporal correlates of gene expression and cortical morphology across lifespan and aging[J]. NeuroImage, 2021, 224: 117426. |
| [26] |
TONELOTTO V, TRAPANI V, BRETAUD S, et al. Spatio-temporal expression and distribution of collagen VI during zebrafish development[J]. Sci Rep, 2019, 9(1): 19851. |
| [27] |
LOLAS M, VALENZUELA P D T, TJIAN R, et al. Charting Brachyury-mediated developmental pathways during early mouse embryogenesis[J]. Proc Natl Acad Sci USA, 2014, 111(12): 4478-4483. |
| [28] |
GENTSCH G E, OWENS N D L, MARTIN S R, et al. In vivo T-box transcription factor profiling reveals joint regulation of embryonic neuromesodermal bipotency[J]. Cell Rep, 2013, 4(6): 1185-1196. |




