免疫球蛋白A(Immunoglobulin A, IgA)肾病是全世界最常见的原发性肾小球肾病,每年影响全球20万~ 35万人[1-2],也是我国慢性肾功能衰竭常见的病因之一[3]。IgA肾病患者首发症状常常表现为镜下血尿或蛋白尿。肾活检是诊断IgA肾病的金标准[4]。尽管目前IgA肾病病理分级依赖于牛津分型,但有研究报道血管病变在IgA肾活检的检出率较高,特别是小动脉透明样变,并与预后密切相关[5]。不仅如此,IgA肾病患者通常合并高血压,持续高血压会导致肾脏血管出现病变,其主要表现为小动脉透明样变[6]。同时,高血压也被证实为IgA肾病进展的独立危险因素[6-7]。然而,在临床实践中,部分IgA肾病合并高血压患者并未出现血管病变[8]。因此,明确小动脉透明样变在高血压IgA肾病的作用对临床评估有重要指导作用。本研究旨在探究小动脉透明样变与IgA肾病合并高血压患者的临床病理资料的相关性,以评估小动脉透明样变严重程度的临床适用性。
1 资料与方法 1.1 研究对象选择2012-2018年在陆军军医大学第二附属医院肾内科住院并行肾组织病理活检确诊为IgA肾病且合并高血压的患者。纳入标准:①肾组织病理活检标本光镜下的肾小球数量≥ 8个[9];②有完整的临床及病理资料。排除标准:①狼疮肾炎、乙肝病毒相关性肾炎及过敏性紫癜性肾炎等继发性IgA肾病患者;②合并糖尿病、自身免疫性疾病及肿瘤等其他系统性疾病。
高血压的诊断标准为:非同日3次测得体循环动脉血压升高,收缩压≥ 140 mmHg和(或)舒张压≥90 mmHg[10]。
共纳入患者246例,按病理活检中小动脉透明样变的程度共分为3组,无小动脉透明样变组73例(男性35例,女性38例),轻度小动脉透明样变组136例(病变程度:1%~25%;男性74例,女性62例),中度小动脉透明样变组37例(病变程度:26%~50%;男性18例,女性19例),收集患者入院行肾活检当次的临床及病理资料。本研究符合赫尔辛基宣言,经陆军军医大学第二附属医院伦理委员会批准(2018-研第006-01),所有患者签署知情同意书。
1.2 研究方法 1.2.1 一般临床资料① 基本资料:包括年龄、性别、身高、体质量,并根据公式计算体质量指数(BMI)=体质量/身高2(kg/m2)。②实验室检查指标:包括C反应蛋白(CRP)、肿瘤坏死因子α(TNF-α)、血清补体3(Complement 3, C3)、血清补体4(Complement 4, C4)、血红蛋白、白蛋白、胆固醇、尿素、肌酐、尿酸、24 h尿蛋白定量(24 hours urinary protein quantity, 24 h-UP),并根据CKD-EPI[11]公式估算肾小球滤过率(eGFR)。
1.2.2 病理资料获取纳入患者的肾活检病理报告,肾活检病理报告主要包含光镜检测结果,根据光镜检测结果进行Lee分级及牛津分型[12],本研究纳入的病理指标包括活检的肾小球总数、肾小球球性硬化个数、Lee分级、牛津分级中的系膜细胞增生(M)、毛细血管内皮细胞增生(E)、节段性肾小球硬化(S)、肾小管萎缩或间质纤维化(T)、新月体形成(C),根据肾小球球性硬化个数/活检的肾小球总数计算球性硬化率。无小动脉透明样变及小动脉透明样变的病理图片见图 1。
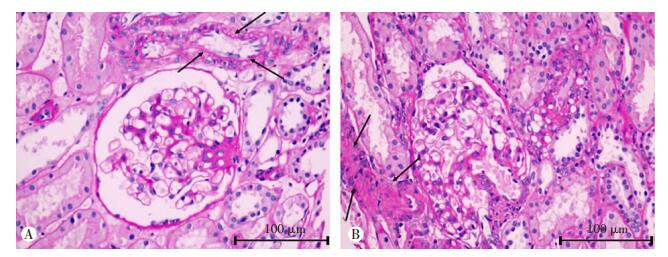
|
| A:无小动脉透明样变;B:有小动脉透明样变;黑色箭头示间质血管;小动脉透明样变:可见均质、红染物质沉积在间质血管管腔 图 1 患者肾脏组织的病理观察(PAS染色) |
1.3 统计学方法
采用SPSS 25.0及GraphPad prism 8软件进行统计学分析,计量资料符合正态分布的采用x±s表示,多组间比较采用单因素方差分析,采用LSD事后检验进行组间两两比较;不符合正态分布的采用M(P25,P75)表示,多组间比较采用Kruskal-Wallis H检验;计数资料以率(%)表示,采用χ2检验,当理论频数小于5时,采用Fisher精确概率法;相关性分析中,与牛津分型的相关性分析采用Cramer V系数,用V表示,其余采用Spearman相关性分析,采用rs表示。P<0.05表示差异有统计学意义。
2 结果 2.1 各组患者临床指标的变化在临床资料方面(图 1、表 1),TNF-α(P=0.007)、尿素(P=0.001)、尿酸(P=0.016)、肌酐(P<0.001)和eGFR(P<0.001)在3组间差异有统计学意义。与无小动脉透明样变组的患者相比,轻度小动脉透明样变组的患者尿素(P=0.006)、尿酸(P=0.005)和肌酐(P<0.001)显著升高,eGFR显著下降(P<0.001),中度小动脉透明样变组年龄(P=0.016)显著增加,TNF-α (P=0.006) 显著升高,尿素(P=0.002)和肌酐水平(P<0.001)进一步升高,而eGFR进一步下降(P<0.001);与轻度小动脉透明样变组相比,中度小动脉透明样变组肾功能损伤更为严重,表现为eGFR显著下降(P=0.027)。3组间其余临床指标无统计学差异。
| 指标 | 无小动脉透明样变组 | 轻度小动脉透明样变组 | 中度小动脉透明样变组 | P1 | P2 | P3 | P4 |
| 例数/n | 73(29.67) | 136(55.28) | 37(15.04) | ||||
| 年龄/岁 | 38.37±11.04 | 40.51±11.35 | 44.03±13.31 | 0.054 | 0.204 | 0.016 | 0.102 |
| BMI/kg·m-2 | 24.40±3.75 | 23.97±3.06 | 24.09±3.82 | 0.688 | 0.388 | 0.658 | 0.846 |
| CRP/mg·L-1 | 2.50(1.85, 3.35) | 2.75(2.10, 4.38) | 2.90(2.00, 4.35) | 0.087 | NA | NA | NA |
| TNF-α/pg·mL-1 | 8.00(6.95, 9.90) | 8.70(7.60, 10.90) | 9.70(8.00, 12.05) | 0.007 | 0.127 | 0.006 | 0.230 |
| C3/g·L-1 | 0.85±0.19 | 0.89±0.19 | 0.89±0.21 | 0.484 | 0.271 | 0.344 | 0.866 |
| C4/mg·dL-1 | 19.40(18.00, 21.60) | 19.70(16.43, 23.28) | 19.40(17.65, 23.30) | 0.604 | 0.421 | 0.374 | 0.695 |
| 血红蛋白/g·L-1 | 132.79±17.45 | 130.16±21.06 | 124.70±22.60 | 0.144 | 0.372 | 0.049 | 0.148 |
| 白蛋白/g·L-1 | 41.22±7.31 | 40.75±5.96 | 38.84±6.69 | 0.179 | 0.618 | 0.070 | 0.114 |
| 胆固醇/mmol·L-1 | 4.65(4.10, 5.70) | 4.70(4.17, 5.34) | 4.98(4.30, 5.84) | 0.425 | NA | NA | NA |
| 尿素/mmol·L-1 | 5.54(4.53, 7.13) | 6.58(5.06, 8.59) | 6.86(5.92, 8.38) | 0.001 | 0.006 | 0.002 | 0.603 |
| 肌酐/μmol·L-1 | 87.30(66.35, 125.30) | 114.80(87.53, 156.10) | 135.00(101.45, 165.30) | <0.001 | <0.001 | <0.001 | 0.135 |
| 尿酸/μmol·L-1 | 382.90±89.90 | 425.94±111.46 | 423.85±108.79 | 0.016 | 0.005 | 0.055 | 0.915 |
| eGFR/mL·(min·1.73 m2)-1 | 80.42(60.00, 110.29) | 64.55(43.68, 86.61) | 49.61(37.97, 59.70) | <0.001 | <0.001 | <0.001 | 0.027 |
| 24 h-UP/g·24 h-1 | 0.65(0.33, 1.46) | 0.99(0.31, 1.95) | 1.30(0.36, 2.86) | 0.128 | NA | NA | NA |
| NA: 未获取;P1:3组间比较;P2:轻度小动脉透明样变组与无小动脉透明样变组比较;P3:中度小透明样变组与无小动脉透明样变组比较;P4:中度小动脉透明样变组与轻度小动脉透明样变组比较 | |||||||
2.2 各组患者病理指标的变化
在病理特征方面(图 2、表 2),与无小动脉透明样变组相比,轻度小动脉透明样变组节段性肾小球硬化S1(P=0.003)、间质纤维化或肾小管萎缩T1/T2(P<0.001)比例明显增加,中度小动脉透明样变组球性硬化率(P=0.011)、肾小管萎缩或间质纤维化T1/T2(P<0.001)比例明显增加。与轻度小动脉透明样变组相比,中度小动脉透明样变组球性硬化率(P=0.018)显著增加。3组间随着小动脉透明样变的程度加重,Lee分级高分级的比例显著增加(P<0.001),与无小动脉透明样变组相比,轻度小动脉透明样变组与中度小动脉透明样变组的高分级比例均显著增加(P<0.001)。组间其余病理指标无统计学差异。
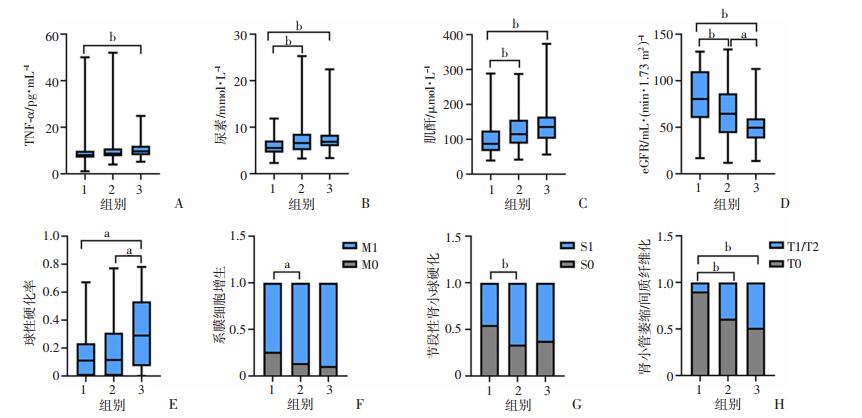
|
| A:TNF-α;B:尿素;C:肌酐;D:eGFR;E:球性硬化率;F:系膜细胞增生;G:节段性肾小球硬化;H:肾小管萎缩/间质纤维化;1:无小动脉透明样变组; 2:轻度小动脉透明样变组; 3:中度小动脉透明样变组;a: P<0.05; b: P<0.01 图 2 3组患者临床病理指标比较 |
| 指标 | 无小动脉透明样变 | 轻度小动脉透明样变 | 中度小动脉透明样变 | P1 | P2 | P3 | P4 | |
| 球性硬化率 | 0.11(0.00, 0.23) | 0.11(0.00, 0.31) | 0.29(0.07, 0.54) | 0.009 | 1.000 | 0.011 | 0.018 | |
| 牛津分级 | ||||||||
| M | M0 | 19(26.03) | 19(13.97) | 4(10.81) | 0.048 | 0.031 | 0.064 | 0.787 |
| M1 | 54(73.97) | 117(86.03) | 33(89.19) | |||||
| E | E0 | 72(98.63) | 130(95.59) | 35(94.59) | 0.363 | 0.465 | 0.621 | 0.680 |
| E1 | 1(1.37) | 6(4.41) | 2(5.41) | |||||
| S | S0 | 40(54.79) | 46(33.82) | 14(37.84) | 0.012 | 0.003 | 0.093 | 0.649 |
| S1 | 33(45.21) | 90(66.18) | 23(62.16) | |||||
| T | T0 | 66(90.41) | 83(61.03) | 19(51.35) | <0.001 | <0.001 | <0.001 | 0.289 |
| T1/T2 | 7(9.59)/0(0.00) | 50(36.76)/3(2.21) | 16(43.24)/2(5.41) | |||||
| C | C0 | 67(91.78) | 116(85.29) | 32(86.49) | 0.397 | 0.176 | 0.382 | 0.855 |
| C1/C2 | 6(8.22)/0(0.00) | 19(13.97)/1(0.74) | 5(13.51)/0(0.00) | |||||
| Lee分级 | <0.001 | <0.001 | 0.001 | 0.071 | ||||
| Ⅰ | 8(10.96) | 1(0.74) | 1(2.70) | |||||
| Ⅱ | 25(34.25) | 14(10.29) | 1(2.70) | |||||
| Ⅲ | 36(49.32) | 79(58.09) | 18(48.65) | |||||
| Ⅳ | 4(5.48) | 42(30.88) | 16(43.24) | |||||
| Ⅴ | 0(0.00) | 0(0.00) | 1(2.70) | |||||
| P1:3组间比较;P2:轻度小动脉透明样变组与无小动脉透明样变组比较;P3:中度小透明样变组与无小动脉透明样变组比较;P4:中度小动脉透明样变组与轻度小动脉透明样变组比较 | ||||||||
2.3 小动脉透明样变与各临床病理指标相关性分析
相关性分析显示(表 3),在IgA肾病合并高血压患者中,小动脉透明样与eGFR的负相关关系最强(rs=-0.367,P<0.001),与Lee分级、肌酐、间质纤维化或肾小管萎缩(T)的正相关关系最强(rs=0.433、rs=0.319、V=0.317,P<0.001),与TNF-α、尿素也有一定的正相关关系(rs=0.200、rs=0.239,P=0.002、P<0.001)。
| 指标 | rs/V | P |
| 年龄 | 0.144 | 0.024 |
| BMI | -0.026 | 0.682 |
| CRP | 0.132 | 0.038 |
| TNF-α | 0.200 | 0.002 |
| C3 | 0.069 | 0.282 |
| C4 | 0.064 | 0.319 |
| 血红蛋白 | -0.111 | 0.082 |
| 白蛋白 | -0.133 | 0.037 |
| 胆固醇 | 0.036 | 0.575 |
| 尿素 | 0.239 | <0.001 |
| 肌酐 | 0.319 | <0.001 |
| 尿酸 | 0.190 | 0.003 |
| eGFR | -0.367 | <0.001 |
| 24 h-UP | 0.130 | 0.042 |
| 肾小球硬化率 | 0.158 | 0.013 |
| M | 0.157 | 0.048 |
| E | 0.081 | 0.444 |
| S | 0.189 | 0.012 |
| T | 0.317 | <0.001 |
| C | 0.087 | 0.397 |
| Lee分级 | 0.433 | <0.001 |
3 讨论
IgA肾病患者的预后千差万别,部分患者迅速进展至终末期肾脏病,部分患者进展缓慢。关于IgA肾病的预后影响因素,近年来受到越来越多的关注和研究[12-13]。MIYABE等[14]使用多因素回归分析发现高血压是IgA肾病预后不良的独立危险因素, BERTHOUX等[15]也发现在肾活检时没有高血压的患者,进展至透析或者死亡的风险显著降低。AMANO等[16]指出肾脏是高血压损害的重要靶器官,原发性高血压导致的肾脏损害主要体现为良性肾小动脉硬化的肾脏血管病变,而在病理方面主要表现为入球小动脉透明样变。ZHANG等[6]指出有小动脉透明样变的IgA肾病患者与无小动脉透明样变的患者相比,血压显著升高,eGFR显著下降,提示小动脉透明样变可能引起血压增高,同时小动脉透明样变是引起肾功能预后不良的危险因素。CAI等[9]指出小血管病变在IgA肾病中常见,在其纳入的944例患者中,约20.4%患者病理活检中发现小动脉透明样变,在没有血管损伤的患者中,高血压的发生率显著低于有小血管病变的患者,分析发现小血管病变与血压升高密切相关,但小血管病变的IgA肾病患者中约有20%未合并高血压,这些发现提示高血压并不是小血管病变的唯一原因。基于此,本研究探究当IgA肾病患者合并高血压时,小动脉透明样变与临床及病理指标的相关性。结果提示,在IgA肾病合并高血压的患者中,小动脉透明样变与患者的临床及病理指标显著相关。
肌酐可以自由地通过肾小球滤过,且不被肾脏重吸收以及代谢,故用来估算肾小球滤过率[17]。本研究发现,随着小动脉透明样变的程度加重,eGFR显著降低,同时相关性分析提示小动脉透明样变与临床指标中的肌酐正相关关系最强,与肾小球滤过率负相关关系最强,说明随着小动脉透明样变程度加重,可能加重肾功能损伤,患者预后不良风险增加。有研究指出蛋白尿增多是引起肾小球疾病预后不良的危险因素[18]。本研究中,随着小动脉透明样变严重程度增加,各组间24 h-UP无统计学差异,可能提示在IgA肾病合并高血压的患者中,小动脉透明样变严重程度对肾小球滤过膜屏障损伤程度无显著差别。本研究还发现,小动脉透明样变程度加重,血管损伤加重,TNF-α水平升高,与RODRIGUEZ-ITURBE等[19]研究一致。除此之外,中度小动脉透明样变的患者,年龄显著大于无小动脉透明样变患者。这与WU等[7]报道的肾活检时,肾内血管病变越重,年龄越大一致。有研究[20]指出,血尿酸升高会引起肾脏疾病或者加重已经存在的肾脏疾病,其机制可能是损伤肾小球小动脉,导致肾自我调节功能受损,而在我们的分组中,轻度小动脉透明样变的患者尿酸显著高于无小动脉透明样变者,与此前研究一致。同时由相关性分析可知以上因素均与小动脉透明样变存在较弱的相关关系。
TRIMARCHI等[12]详细总结了多个研究中关于牛津分级中各个指标与肾脏预后的关系,其中系膜细胞增生(M)、节段性肾小球硬化(S)、肾小管萎缩或间质纤维化(T)、新月体形成(C)均与肾脏预后相关。系膜细胞增生(M)、节段性肾小球硬化(S)、新月体形成(C)受其他因素影响,而肾小管萎缩或间质纤维化(T)是肾脏预后的独立危险因素,已在多个研究中被证实[13, 21-24]。本研究中,轻度小动脉透明样变与无小动脉透明样变组相比,系膜细胞增生M1、节段性肾小球硬化S1及肾小管萎缩或间质纤维化T1/T2的比例增加,当小动脉病变程度进一步加重时,肾小管萎缩或间质纤维化T1/T2的比例进一步增加,相关性分析提示小动脉透明样变与牛津分型中的肾小管萎缩或间质纤维化(T)正相关关系最强。提示当小动脉透明样变加重,肾小管萎缩/间质纤维化程度越重,可能的原因是当小动脉透明样变逐渐加重,小动脉管壁增厚、僵硬,弹性降低,管腔狭窄甚至闭塞,进而导致局部缺血,加重肾小管萎缩和间质纤维化。而肾小管萎缩或间质纤维化(T)是IgA肾病预后不良的独立危险因素,因此小动脉透明样变越重的患者,肾脏预后不良风险越大,在临床工作中应对这部分患者予以更多关注。另外,本研究的中度小动脉透明样变患者的球性硬化率显著高于轻度及无小动脉透明样变患者,提示小动脉透明样变越重,无功能的肾小球比例越高。KATAFUCHI等[25]研究发现新月体形成(C)可作为IgA肾病预后不良的预测因子,但当在eGFR>30 mL/(min·1.73m2)的患者中,新月体形成(C)不是肾脏预后不良的独立危险因素[12],本研究中新月体形成(C)在各组间无统计学差异,与KATAFUCHI等的研究结果一致。
Lee分级是1982年制定的IgA肾病病理分级方法[26],此种方法将多种指标集中在一个分级中,SOARES等[27]指出Lee分级越高,肾功能越差。同时,有研究运用多因素回归分析指出高级别Lee分级的患者肾功能恶化进展风险是Lee I级患者的数倍[28]。本研究指出,在IgA肾病合并高血压患者中,随着小动脉透明样变严重程度增加,Lee分级高级别的比例显著增加,且小动脉透明样变与Lee分级有强相关性。这提示,小动脉透明样变程度越重而肾脏病变越重,患者肾功能恶化进展风险越大。由于影响IgA肾病小动脉透明样变及高血压的病理生理因素众多,本研究尚存在一些不足:本研究为横断面研究,样本量有限,导致分组不够完善,所得结论可能存在片面性。后续将扩大样本量,完善分组,做进一步研究。
综上所述,在IgA肾病合并高血压的患者中,有小动脉透明样变的患者的肌酐更高,肾小球滤过率更低,肾小管萎缩及间质纤维化程度更重,同时Lee分级提示病理病变更重,这些指标的差异往往也预示着患者的预后更差。因此,在临床工作中,我们需要对IgA合并高血压并伴小动脉透明样变的患者予以更多的关注、更积极的治疗以及更加密切的随访。
| [1] |
RODRIGUES J C, HAAS M, REICH H N. IgA nephropathy[J]. Clin J Am Soc Nephrol, 2017, 12(4): 677-686. |
| [2] |
GLASSOCK R J. Mortality risk in IgA nephropathy[J]. J Am Soc Nephrol, 2019, 30(5): 720-722. |
| [3] |
XIE Y S, CHEN X M. Epidemiology, major outcomes, risk factors, prevention and management of chronic kidney disease in China[J]. Am J Nephrol, 2008, 28(1): 1-7. |
| [4] |
PERŠE M, VEČERIĆ-HALER Ž. The role of IgA in the pathogenesis of IgA nephropathy[J]. Int J Mol Sci, 2019, 20(24): 6199. |
| [5] |
DUGUID J B, ANDERSON G S. The pathogenesis of hyaline arteriolosclerosis[J]. J Pathol Bacteriol, 1952, 64(3): 519-522. |
| [6] |
ZHANG Y, SUN L L, ZHOU S H, et al. Intrarenal arterial lesions are associated with higher blood pressure, reduced renal function and poorer renal outcomes in patients with IgA nephropathy[J]. Kidney Blood Press Res, 2018, 43(2): 639-650. |
| [7] |
WU J, CHEN X M, XIE Y S, et al. Characteristics and risk factors of intrarenal arterial lesions in patients with IgA nephropathy[J]. Nephrol Dial Transplant, 2005, 20(4): 719-727. |
| [8] |
王淑平, 刘树军, 李起奉, 等. 高血压所致肾损害患者临床及病理分析[J]. 中国实验诊断学, 2021, 25(11): 1683-1685. WANG S P, LIU S J, LI Q F, et al. Clinical and pathological analysis of patients with renal damage caused by hypertension[J]. Chin J Lab Diagn, 2021, 25(11): 1683-1685. |
| [9] |
CAI Q Q, SHI S F, WANG S X, et al. Microangiopathic lesions in IgA nephropathy: a cohort study[J]. Am J Kidney Dis, 2019, 74(5): 629-639. |
| [10] |
CHOBANIAN A V, BAKRIS G L, BLACK H R, et al. The seventh report of the joint national committee on prevention, detection, evaluation, and treatment of high blood pressure: The JNC 7 report[J]. JAMA, 2003, 289(19): 2560-2572. |
| [11] |
INKER L A, SCHMID C H, TIGHIOUART H, et al. Estimating glomerular filtration rate from serum creatinine and cystatin C[J]. N Engl J Med, 2012, 367(1): 20-29. |
| [12] |
TRIMARCHI H, BARRATT J, CATTRAN D C, et al. Oxford classification of IgA nephropathy 2016: an update from the IgA nephropathy classification working group[J]. Kidney Int, 2017, 91(5): 1014-1021. |
| [13] |
SHI S F, WANG S X, JIANG L, et al. Pathologic predictors of renal outcome and therapeutic efficacy in IgA nephropathy: validation of the Oxford classification[J]. Clin J Am Soc Nephrol, 2011, 6(9): 2175-2184. |
| [14] |
MIYABE Y, KARASAWA K, AKIYAMA K, et al. Grading system utilising the total score of Oxford classification for predicting renal prognosis in IgA nephropathy[J]. Sci Rep, 2021, 11(1): 3584. |
| [15] |
BERTHOUX F, MOHEY H, LAURENT B, et al. Predicting the risk for dialysis or death in IgA nephropathy[J]. J Am Soc Nephrol, 2011, 22(4): 752-761. |
| [16] |
AMANO H, KOIKE K, HARUHARA K, et al. Time-averaged proteinuria during follow-up and renal prognosis in patients with biopsy-proven benign nephrosclerosis[J]. Clin Exp Nephrol, 2020, 24(8): 688-695. |
| [17] |
LEVEY A S, PERRONE R D, MADIAS N E. Serum creatinine and renal function[J]. Annu Rev Med, 1988, 39: 465-490. |
| [18] |
KAMANO C, SHIMIZU A, JOH K, et al. A cross-sectional study in patients with IgA nephropathy of correlations between clinical data and pathological findings at the time of renal biopsy: a Japanese prospective cohort study[J]. Clin Exp Nephrol, 2021, 25(5): 509-521. |
| [19] |
RODRIGUEZ-ITURBE B, PONS H, JOHNSON R J. Role of the immune system in hypertension[J]. Physiol Rev, 2017, 97(3): 1127-1164. |
| [20] |
MYLLYMÄKI J, HONKANEN T, SYRJÄNEN J, et al. Uric acid correlates with the severity of histopathological parameters in IgA nephropathy[J]. Nephrol Dial Transplant, 2005, 20(1): 89-95. |
| [21] |
KANG S H, CHOI S R, PARK H S, et al. The Oxford classification as a predictor of prognosis in patients with IgA nephropathy[J]. Nephrol Dial Transplant, 2012, 27(1): 252-258. |
| [22] |
LV J C, SHI S F, XU D M, et al. Evaluation of the Oxford Classification of IgA nephropathy: a systematic review and meta-analysis[J]. Am J Kidney Dis, 2013, 62(5): 891-899. |
| [23] |
LE W B, ZENG C H, LIU Z S, et al. Validation of the Oxford classification of IgA nephropathy for pediatric patients from China[J]. BMC Nephrol, 2012, 13: 158. |
| [24] |
PARK K S, HAN S H, KIE J H, et al. Comparison of the Haas and the Oxford classifications for prediction of renal outcome in patients with IgA nephropathy[J]. Hum Pathol, 2014, 45(2): 236-243. |
| [25] |
KATAFUCHI R, NINOMIYA T, NAGATA M, et al. Validation study of Oxford classification of IgA nephropathy: the significance of extracapillary proliferation[J]. Clin J Am Soc Nephrol, 2011, 6(12): 2806-2813. |
| [26] |
LEE S M, RAO V M, FRANKLIN W A, et al. IgA nephropathy: morphologic predictors of progressive renal disease[J]. Hum Pathol, 1982, 13(4): 314-322. |
| [27] |
SOARES M F S, ROBERTS I S D. Histologic classification of IgA nephropathy: past, present, and future[J]. Semin Nephrol, 2018, 38(5): 477-484. |
| [28] |
赵春梅, 袁宏伟. IgA肾病组织病理学特点与临床预后关系研究[J]. 中华实用诊断与治疗杂志, 2015, 29(6): 589-590, 592. ZHAO C M, YUAN H W. Correlation of histopathologic characteristics of IgA nephropathy and clinical prognosis[J]. J Chin Pract Diagn Ther, 2015, 29(6): 589-590, 592. |




