2. 400038 重庆,陆军军医大学(第三军医大学):第一附属医院神经内科
2. Department of Neurology, First Affiliated Hospital; Army Medical University (Third Military Medical University), Chongqing, 400038, China
肌萎缩侧索硬化症(amyotrophic lateral sclerosis,ALS)是一组病因未知的异质性致命性神经退行性疾病,其特征是初级运动皮质、脑干和脊髓的上运动神经元和下运动神经元退行性病变[1]。目前研究发现,ALS病变部位不局限于运动区域,还涉及运动外区域,可引起不同程度的认知行为或自主神经紊乱症状[2]。目前ALS疾病主要依据临床表征以及运动神经元电生理特性进行诊断[3],由于ALS疾病表型显示出高度的特异性,加上缺乏可靠的运动神经元生物标志物,导致ALS诊断延迟(不完全表型约12个月甚至更长)[4],从而限制了对ALS患者进行潜在神经保护的早期治疗方案。因此,寻找合适的非侵入式的生物标记物来表征ALS疾病表型具有十分重要的临床价值。
脑磁共振成像(magnetic resonance imaging,MRI)已被证明在监测ALS患者中枢神经系统变性方面具有较好的应用价值[5]。本课题组在前期应用结构MRI研究发现,ALS患者右侧BA4a区灰质体积与修订版ALS功能评分量表(revised ALS functional rating scale,ALSFRS-R)评分呈正相关[6]。基于静息态功能磁共振成像(functional magnetic resonance imaging,fMRI)的功能连接显示其与神经系统疾病关联的潜在应用前景[7],最近一项研究也发现ALS患者动态功能连接改变与运动功能障碍严重程度相关[8]。但目前该领域仍主要集中于运动通路功能网络,针对ALS患者大脑功能连接的整体特点及全脑功能网络拓扑特性研究较少。
本研究通过构建大脑大尺度功能网络,基于图论理论、横断面研究ALS患者与健康对照组功能网络差异,并对ALS患者的功能拓扑网络异常参数值与认知及运动功能的评分进行相关分析,探讨ALS患者静息态fMRI功能脑网络连接性损伤模式,以期为ALS早期诊断寻找客观影像学标记。
1 资料与方法 1.1 研究对象招募2015年5月至2018年3月在陆军军医大学第一附属医院神经内科确诊的25例ALS患者,其诊断符合世界神经病学联盟的修订版EI Escorial诊断标准[9]。ALS患者组男性13例,女性12例,年龄29~68(47.2±9.2)岁,病程为3~71个月。同时招募年龄、性别匹配的26例健康志愿者作为健康对照(healthy control, HC)组,其中男性19例,女性7例,年龄27~62(46.0±8.8)岁,以上被试均为右利手。纳入标准:符合修订版EI Escorial诊断标准[9]的ALS患者;患者在MRI扫描期间能够仰卧。排除标准:有药物或酒精依赖病史;高血压、脑血管病及其他神经系统病变相关疾病;磁共振检查禁忌证。本研究通过陆军军医大学第一附属医院伦理委员会审批(KY202231),受试者均签署知情同意书。
1.2 临床量表检查评估所有ALS患者由1名神经内科医生进行3项临床量表检查:ALSFRS-R评价,评分总分从0(不能完成任务)到40分(正常);简易精神状态检查(mini-mental state examination,MMSE)量表评价,MMSE量表总分30分,分数在27~30分为正常,分数 < 27为认知功能障碍;蒙特利尔评估量表(Montreal cognitive assessment,MoCA)评价,MoCA量表总分30分,分数在26~30分为正常,分数 < 26为认知功能障碍。
1.3 影像数据采集使用德国西门子3.0T磁共振扫描仪器扫描大脑静息态fMRI数据。fMRI全脑快速成像EPI序列的扫描参数为:Tr=2 000 ms,TE=30 ms,翻转角度为90°,检查视野(field of view,FOV)为192 mm×192 mm,36个横断层,层厚为3 mm,体素大小:3 mm×3 mm× 3 mm,共240个时间点。在患者进入扫描室前,提前告知受试者平卧于扫描仪内,闭上双眼,不要睡觉,尽量不思考任何事情,保持不动。
1.4 静息态fMRI数据预处理使用MRIcron软件中的dcm2niigui软件将所有DICOM数据转换为NIFTI格式,数据预处理采用基于MATLAB 2014a平台的DPARSF软件进行处理(http://rfmri.org/DPARSF)。首先进行时间层校正,共采集240个时间点,删除每位被试数据的前10个时间点的数据,以得到剩余230个稳定时间点的大脑信号;接着进行头动校正,把每位被试的每帧图像与参考图像(设为平均图像)进行刚性配准,要求所有数据头动不超过±2 mm或者转动在±2°范围内,若有超出范围的则剔除该数据;然后进行空间标准化,把功能fMRI数据配准到高分辨率T1空间,再将T1图像配准至MNI空间的EPI模板,利用配准参数文件将个体fMRI数据映射到MNI空间中,重采样至3 mm×3 mm×3 mm的分辨率体素;最后进行空间平滑:对所有fMRI图像采用FWHM=8 mm平滑核进行高斯平滑;进行0.01~0.08 Hz带通滤波,目的是对低频基线漂移以及高频生理信号的去除。最终获得所有被试预处理后的MNI空间的时间序列数据。
1.5 功能网络构建及图论分析功能连接网络构建:按照自动解剖标记(automated anatomical labeling,AAL)图谱[10],将大脑皮层划分为90个感兴趣的解剖区域(region of interest,ROI),这些解剖区域作为每位患者的大脑功能连接网络的节点。提取每个ROI中所有体素的时间序列并取平均值,以获得每块ROI的平均时间序列。针对每对ROI的平均时间序列进行Pearson相关分析,每个受试者产生90×90时间序列相关系数矩阵。使用Fisher’s Z变换将相关矩阵转换为Z值,以改善相关系数的正态性。则此Z值即为每一条网络的边[11]。
图论分析:使用GRETNA toolbox(http://www.nitrc.org/projects/gretna/)探讨整体和局部的功能网络特征,功能网络稀疏度选取范围为10%~30%。对于全局指标计算全局效率(global efficiency,Eglob)、局部效率(local efficiency,Eloc)、特征路径长度(characteristic path length,Lp)、集聚系数(clustering coefficient,Cp)、标准化特征路径长度(λ)和小世界组织参数(σ)。局部节点参数则计算节点效率(nodal efficiency,Ne)、节点度值(degree centrality,Dc)[12]。
1.6 统计学分析采用SPSS 22.0软件进行统计学分析,对于人口统计学和神经心理学测试,采用双样本t检验比较ALS组和HC组年龄差异,采用χ2检验比较两组间性别变量差异。通过GRETNA软件,首先进行基于网络的统计分析(network-based statistics,NBS)[13],对两组被试的全脑功能连接进行组间差异分析;接着统计组间网络参数(全局参数和节点参数)之间差异,采用基于非参数置换检验(10 000次)方法,计算组间网络参数的统计显著性,P < 0.05认为差异有统计学意义。将ALS患者组的功能拓扑网络异常参数值(网络连接发生改变的FC值、全局参数值、组间有差异脑区的节点参数值)分别与ALS患者的ALSFRS-R、MMSE、MoCA评分进行Pearson相关分析,以双侧P < 0.05为差异有统计学意义。
2 结果 2.1 ALS组和对照组人口统计学和神经心理学资料比较ALS患者组和HC组人口统计特征见表 1。两组间在性别、年龄上差异无统计学意义(P>0.05)。
| 组别 | n | 男/女(例) | 年龄/岁 | 病程/月 | ALSFRS-R量表/分 | MoCA量表/分 | MMSE量表/分 |
| ALS组 | 25 | 13/12 | 47.2±9.2 | 23.6±15.7 | 33.9±6.8 | 25.1±2.7 | 28.5±1.8 |
| 对照组 | 26 | 19/7 | 46.0±8.8 | ||||
| P值 | 0.12 | 0.62 |
2.2 ALS组和对照组全脑功能连接比较
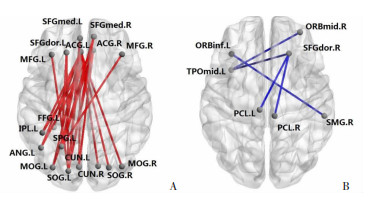
基于NBS方法,对ALS组和对照组的大脑功能连接进行组间差异分析,将两组间功能网络的脑区连接异常改变的结果进行显示,通过MATLAB中BrainNet view软件绘制图画。结果发现,ALS患者组在大脑前、后脑区之间功能连接出现广泛增强改变,前扣带回、额上回、额中回等脑区与楔叶、枕上回、枕中回、梭状回等脑区之间功能连接显著增强(图 1A)。ALS组的右侧背外侧前额叶与双侧中央旁小叶、左侧颞极颞中回之间功能连接性降低,左侧眶内额下回-缘上回环路的功能连接亦显著降低(图 1B)。
|
| A:ALS组全脑的功能连接增强脑区 红色线条示功能连接增强; MFG:额中回;SFGmed:内侧额上回;ACG:前扣带回;SOG:枕上回;SPG:顶上回;CUN:楔叶;MOG:枕中回;FFG:梭状回;IPL:顶下缘角回;ANG:角回;B:ALS组全脑的功能连接降低脑区蓝色线条示功能连接降低; SMG:缘上回;PCUN:楔前叶;PCL:中央旁小叶;MTG:颞中回;SFGdor:背外侧额上回;ORBmid:眶部额中回;ORBinf:眶部额下回 图 1 ALS组大脑功能连接异常改变脑区 |
2.3 ALS组和对照组全局参数属性比较
采用15%稀疏度下的网络计算结果见表 2,由网络的小世界属性的定义发现,两组均存在小世界参数δ>1,表明两个被试组的功能网络均具有小世界组织特征。ALS患者标准化特征路径长度λ较对照组显著缩短(P < 0.05),其他参数组间未发现有统计学差异。
| 组别 | n | 全局效率 | 局部效率 | 特征路径长度 | 集聚系数 | 标准化特征路径长度 | 小世界属性 | 标准化集聚系数 |
| ALS组 | 25 | 0.41±0.05 | 0.68±0.06 | 2.50±0.34 | 0.55±0.04 | 1.17±0.06 | 1.40±0.39 | 1.63±0.42 |
| 对照组 | 26 | 0.39±0.07 | 0.66±0.09 | 2.67±0.62 | 0.54±0.05 | 1.21±0.10 | 1.37±0.55 | 1.63±0.59 |
| t值 | 1.20 | 1.16 | -1.50 | 1.18 | -2.14 | 0.48 | 0.25 | |
| P值 | 0.24 | 0.25 | 0.14 | 0.24 | 0.04 | 0.63 | 0.81 |
2.4 ALS组和对照组局部节点参数属性比较
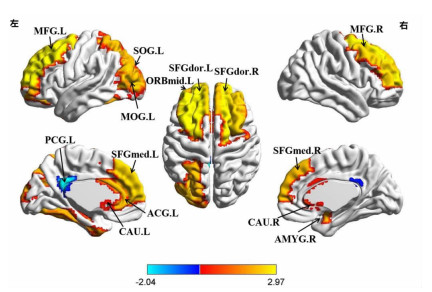
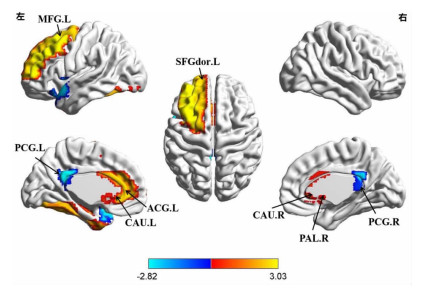
根据图论理论计算ALS组和对照组的节点效率和节点度参数值,通过非参数置换检验方法计算两组间网络局部节点参数的差异,将两组间局部节点参数值有差异的脑区结果进行显示。结果发现ALS患者节点效率Ne主要集中在双侧额叶、左枕叶等脑区显著增加,左后扣带回节点效率降低(图 2);左侧额叶及尾状核的节点度Dc显著增加,但双侧后扣带回、右侧苍白球的Dc显著降低(图 3)。
|
| 颜色条示t值大小:红色代表ALS组节点效率增强的脑区;蓝色代表ALS组节点效率降低的脑区; SFGdor:背外侧额上回;MFG:额中回;ORBmid:眶部额中回;SFGmed:内侧额上回;ACG:前扣带回;PCG:后扣带回;AMYG:杏仁核;SOG:枕上回;MOG:枕中回;CAU:尾状核 图 2 ALS组功能网络的节点效率异常改变脑区 |
|
| 颜色条表示t值大小:红色代表ALS组节点度增强的脑区;蓝色代表ALS组节点度降低的脑区;SFGdor:背外侧额上回;MFG:额中回;ACG:前扣带回;PCG:后扣带回;CAU:尾状核;PAL:豆状苍白球 图 3 ALS组功能网络的节点度异常改变脑区 |
2.5 相关分析结果
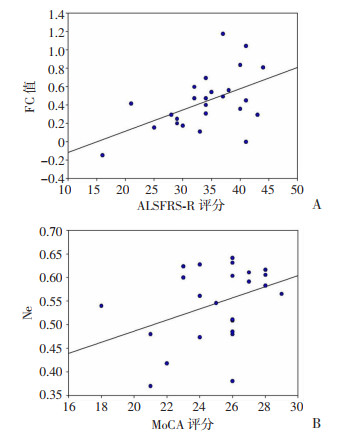
将大脑功能连接异常的FC值与临床量表进行相关分析发现,左侧眶内额下回和缘上回功能连接FC值与ALSFRE-R评分呈正相关关系(r=0.512,P=0.008,图 4A),即左侧眶内额下回和缘上回功能连接FC值越低,ALSFRE-R评分也越低。将有差异的网络参数值与临床量表进行相关分析发现,左侧枕中回节点效率与MoCA评分存在正相关趋势关系(r=0.393,P=0.05,图 4B),其他功能连接及网络参数值与临床量表评分之间未发现有显著相关关系。
|
| A:左侧眶内额下回和缘上回FC值与ALSFRE-R评分;B:左枕中回节点效率Ne与MoCA评分 图 4 全脑功能网络异常参数与临床量表相关分析 |
3 讨论
本研究采集静息态fMRI影像数据并利用图论理论分析和脑功能连接探索ALS患者大脑功能网络拓扑属性,发现ALS患者存在功能网络连接性异常改变,大脑前、后脑区之间连接显著增强。ALS组和对照组的大脑结构均具有小世界特性,ALS患者大脑的最短路径长度λ降低,应用大脑功能网络分析对了解ALS疾病相关运动控制和认知损害的神经机制具有重要意义。
3.1 ALS患者功能网络连接变化特点多项静息态fMRI研究证实,ALS患者在大脑调节特定行为和认知功能的网络内存在功能连接增加的改变,额颞叶神经网络功能连接增强且与执行功能障碍有关[14-15]。本研究发现ALS患者额叶与顶叶、颞叶及枕叶之间连接显著增强,认为大脑前、后脑区之间功能连接增加可能有助于克服额叶和顶叶结构损伤引起的功能障碍。已有研究发现这些区域是结构连接中断的一部分,结构连接降低可在5.5个月的时间里从初级运动区扩展到额叶和顶叶区域[16]。ALS患者胼胝体损伤可导致抑制性GABA能中间神经元的丢失[17],经胼胝体抑制作用减弱从而导致前、后脑区间功能连接增强。最近一项多中心研究也证实,ALS中存在广泛的运动/运动外脑结构及功能网络变性[18],表明图论分析和连接组学可能是检测ALS运动神经元变性、运动/运动外脑区功能改变和网络重组的有力工具。
本研究还发现,ALS患者运动网络右侧背外侧前额叶与双侧中央旁小叶、左侧颞极颞中回之间功能连接性显著降低,左侧眶内额上回-缘上回功能连接也显著降低。ZHOU等[19]报道了12例ALS患者与健康对照者的运动网络连通性,发现初级运动皮质和运动前皮质存在连接性降低。背外侧前额叶作为额叶重要脑功能区,其在工作记忆、注意力调控、认知控制、连接认知和动作中起到重要作用。中央旁小叶位于中央前、后回折入内侧面的部分,与对侧小腿和足的运动、感觉有关。ALS患者背外侧前额叶与运动相关皮层中央旁小叶间功能连接值降低,表明其认知控制、运动感觉功能受到损害。本研究相关分析发现,ALS患者左侧眶内额上回-缘上回功能连接值与ALSFRS-R评分呈显著正相关,即眶额叶与缘上回功能连接值越低,疾病的严重程度越重。此前也有研究发现在肢体先发病的ALS患者中,左侧眶额叶与ALSFRS-R相关[20]。眶额叶在情绪控制等高级脑功能和复杂行为执行中有重要作用,参与记忆或行为决策功能;缘上回与语言表达和处理等功能相关,主要涉及语言感知和加工[21]。眶内额下回和缘上回功能连接降低提示情绪控制功能与语言表达处理功能之间的转换出现异常。本研究发现大脑功能连接降低改变和相关性结果可能对预测ALS疾病诊断有用,左侧眶内额上回-缘上回功能连接值可作为一种影像学标记物,对于疾病的诊断及预后评估具有一定的参考意义。
3.2 ALS患者功能网络拓扑参数变化特点大脑大尺度连接的网络研究能揭示促进神经信息分离和整合的特性,本研究发现ALS患者和HC组大脑均具有小世界组织特性,与之前对ALS患者的图论研究结果基本一致[22],表明人脑支持在涉及认知、感觉和运动处理的分离的大脑区域之间整合信息,以赋予抵抗病理损伤的能力,并以最小的成本最大限度地提高不同大脑区域之间的信息处理效率。尽管在ALS患者和HC组中具有小世界组织,但两组被试在功能连接网络的拓扑特性上存在一些差异,本研究发现ALS患者大脑的标准化特征路径长度降低。标准化特征路径长度可反映大脑中信息传输的能力,大脑网络中远距离脑区之间的最短路径可确保信息的有效整合和快速传输[12]。本研究显示,ALS患者功能连接网络的全局特性改变可能通过完整区域的代偿功能连接在相对较短的时间内达到正常水平,表明ALS患者的信息整合和神经元长距离传输信息的能力在短期内可能有所提高。
本研究在分析ALS患者功能网络的拓扑特性时发现在13个节点的节点效率显著增加,主要位于视觉-认知网络的大脑区域,包括左侧枕中回、左侧枕上回、双侧额中回、双侧背外侧额上回、左侧眶额皮质及边缘系统等,与本研究ALS患者功能网络连接增加的脑区基本一致。这些脑区的节点效率增强、脑区功能连接增加,可能是因为在结构损伤的情况下,需要这些脑区更高效地对其结构损伤带来的功能异常进行补偿[23],但当ALS病理负担增加到一定程度时,这种补偿可能会耗尽,从而表现出明显的临床症状。相关分析还发现在左枕中回节点效率与MoCA评分存在正相关趋势,即ALS患者认知功能评分越高,左侧枕中回节点效率增加越多,视觉皮层节点效率增加对ALS患者运动功能障碍起到一定的代偿作用。本研究还发现左侧后扣带回节点效率降低、双侧后扣带回节点度降低,表明后扣带回节点与其他所有脑节点之间信息传递效率降低。研究显示大脑中央前回与后扣带回之间存在显著连通性[24],后扣带回在运动相关网络重组具有重要作用,本研究结果提示后扣带回可能是ALS患者运动功能障碍的一个关键区域。
3.3 小结与研究局限本研究提供了一个新的视角来了解功能网络破坏对ALS的早期运动及认知损害的神经病理学影响。本研究还存在一定的局限性。首先,本研究是样本量相对较小的横断面研究,未来需要更大样本量的纵向研究来检测功能网络特性的动态变化。其次,本研究只关注ALS患者功能网络特性与其神经生理学测试的关系,下一步还需探索功能网络和结构连接之间的重叠以获得更令人信服和可靠的结果。
| [1] |
AL-CHALABI A, HARDIMAN O, KIERNAN M C, et al. Amyotrophic lateral sclerosis: moving towards a new classification system[J]. Lancet Neurol, 2016, 15(11): 1182-1194. |
| [2] |
MAZÓN M, COSTA J F V, TEN-ESTEVE A, et al. Imaging biomarkers for the diagnosis and prognosis of neurodegenerative diseases. the example of amyotrophic lateral sclerosis[J]. Front Neurosci, 2018, 12: 784. |
| [3] |
DE CARVALHO M, DENGLER R, EISEN A, et al. Electrodiagnostic criteria for diagnosis of ALS[J]. Clin Neurophysiol, 2008, 119(3): 497-503. |
| [4] |
VÁZQUEZ-COSTA J F, MAZÓN M, CARRERES-POLO J, et al. Brain signal intensity changes as biomarkers in amyotrophic lateral sclerosis[J]. Acta Neurol Scand, 2018, 137(2): 262-271. |
| [5] |
BASAIA S, FILIPPI M, SPINELLI E G, et al. White matter microstructure breakdown in the motor neuron disease spectrum: recent advances using diffusion magnetic resonance imaging[J]. Front Neurol, 2019, 10: 193. |
| [6] |
王倩楠, 张静娜, 张晔, 等. 基于体素形态学和表面形态计量学MRI观察肌萎缩侧索硬化患者大脑结构改变[J]. 中国医学影像技术, 2018, 34(12): 1772-1776. WANG Q N, ZHANG J N, ZHANG Y, et al. Voxel-based morphological analysis and surface-based morphometry MRI observation on brain structural changes in patients with amyotrophic lateral sclerosis[J]. Chin J Med Imaging Technol, 2018, 34(12): 1772-1776. |
| [7] |
HOHENFELD C, WERNER C J, REETZ K. Resting-state connectivity in neurodegenerative disorders: is there potential for an imaging biomarker?[J]. Neuroimage Clin, 2018, 18: 849-870. |
| [8] |
CHEN H J, ZOU Z Y, ZHANG X H, et al. Dynamic changes in functional network connectivity involving amyotrophic lateral sclerosis and its correlation with disease severity[J]. J Magn Reson Imaging, 2021, 54(1): 239-248. |
| [9] |
PERRY J, PRATT, GETZOFF. Amyotrophic lateral sclerosis: update and new developments[J]. Degener Neurol Neuromuscul Dis, 2012, 1. |
| [10] |
TZOURIO-MAZOYER N, LANDEAU B, PAPATHANASSIOU D, et al. Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain[J]. Neuro Image, 2002, 15(1): 273-289. |
| [11] |
WATTS D J, STROGATZ S H. Collective dynamics of 'small-world' networks[J]. Nature, 1998, 393(6684): 440-442. |
| [12] |
BULLMORE E, SPORNS O. Complex brain networks: graph theoretical analysis of structural and functional systems[J]. Nat Rev Neurosci, 2009, 10(3): 186-198. |
| [13] |
ZALESKY A, FORNITO A, BULLMORE E T. Network-based statistic: identifying differences in brain networks[J]. Neuro Image, 2010, 53(4): 1197-1207. |
| [14] |
TROJSI F, ESPOSITO F, DE STEFANO M, et al. Functional overlap and divergence between ALS and bvFTD[J]. Neurobiol Aging, 2015, 36(1): 413-423. |
| [15] |
MCKENNA M C, CORCIA P, COURATIER P, et al. Fronto-temporal pathology in motor neuron disease phenotypes: insights from neuroimaging[J]. Front Neurol, 2021, 12: 723450. |
| [16] |
VERSTRAETE E, VELDINK J H, VAN DEN BERG L H, et al. Structural brain network imaging shows expanding disconnection of the motor system in amyotrophic lateral sclerosis[J]. Hum Brain Mapp, 2014, 35(4): 1351-1361. |
| [17] |
LOEWE K, MACHTS J, KAUFMANN J, et al. Widespread temporo-occipital lobe dysfunction in amyotrophic lateral sclerosis[J]. Sci Rep, 2017, 7: 40252. |
| [18] |
BASAIA S, AGOSTA F, CIVIDINI C, et al. Structural and functional brain connectome in motor neuron diseases: a multicenter MRI study[J]. Neurology, 2020, 95(18): e2552-e2564. |
| [19] |
ZHOU F Q, GONG H H, LI F J, et al. Altered motor network functional connectivity in amyotrophic lateral sclerosis: a resting-state functional magnetic resonance imaging study[J]. Neuroreport, 2013, 24(12): 657-662. |
| [20] |
RAMANATHAN R S, RANA S. Demographics and clinical characteristics of primary lateral sclerosis: case series and a review of literature[J]. Neurodegener Dis Manag, 2018, 8(1): 17-23. |
| [21] |
IZQUIERDO A. Functional heterogeneity within rat orbitofrontal cortex in reward learning and decision making[J]. J Neurosci, 2017, 37(44): 10529-10540. |
| [22] |
HEIMRATH J, GORGES M, KASSUBEK J, et al. Additional resources and the default mode network: evidence of increased connectivity and decreased white matter integrity in amyotrophic lateral sclerosis[J]. Amyotroph Lateral Scler Frontotemporal Degener, 2014, 15(7/8): 537-545. |
| [23] |
DUKIC S, MCMACKIN R, BUXO T, et al. Patterned functional network disruption in amyotrophic lateral sclerosis[J]. Hum Brain Mapp, 2019, 40(16): 4827-4842. |
| [24] |
ROSE S, PANNEK K, BELL C, et al. Direct evidence of intra-and interhemispheric corticomotor network degeneration in amyotrophic lateral sclerosis: an automated MRI structural connectivity study[J]. Neuro Image, 2012, 59(3): 2661-2669. |




