高血糖是动脉粥样硬化发生发展的重要因素。有研究证实,中国有近76.9%的冠心病(coronary heart disease,CHD)患者合并有血糖升高[1]。临床上冠脉造影发现,CHD合并糖尿病(diabetes mellitus,DM)患者的冠脉病变常呈弥漫性,狭窄程度更严重,且常累及多支血管。CHD与DM之间的内在关系越来越受到研究者的关注,许多学者认为多种免疫细胞参与的慢性炎症反应是这两种疾病进展的共同土壤[2]。辅助性T细胞(T helper cells,Th)、单核-巨噬细胞、自然杀伤细胞等免疫细胞可能参与动脉粥样硬化(atherosclerosis,AS)过程中的内皮细胞损伤、泡沫细胞形成等,加剧系统或局部的炎症反应[3]。本研究通过分析不同血糖状态下CHD患者外周血中1型辅助性T细胞/2型辅助性T细胞(type 1 T helper cells/type 2 T helper cells,Th1/Th2)的变化及其对人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)的损伤作用,进一步探讨Th1/Th2在高糖状态下对AS形成的作用。
1 材料与方法 1.1 研究对象选择2019年1月至2021年4月于本院心血管内科住院期间行冠脉造影的患者, 共选取确诊冠心病患者73名。纳入标准:冠心病患者定义为冠脉造影结果显示≥1支血管有动脉粥样硬化斑块形成,管腔狭窄程度≥50%。排除标准:3个月内诊断急性冠脉综合征,心功能不全纽约心脏病学会(New York Association, NYHA)分级≥Ⅲ级,严重的心脏瓣膜病,各种类型的心肌病,先天性心脏病,肿瘤,严重肝肾功能不全及自身免疫系统疾病。根据患者的血糖检测结果分为3组:糖尿病组(DM组)25例(男性14例,女性11例),年龄50~72(62±7)岁;糖耐量异常组(IGR组)10例(男性7例,女性3例),年龄48~84(68±14)岁;血糖正常组(Normal组)38例(男性24例,女性14例),年龄42~83(62±10)岁。①血糖正常(Normal)定义为研究对象空腹血糖 < 6.0 mmol/L且餐后2 h血糖 < 7.8 mmol/L,②糖尿病(DM)定义为既往明确糖尿病病史或入院行OGTT试验示空腹血糖≥7.0 mmol/L或餐后2 h血糖≥11.1 mmol/L,③糖耐量异常(IGR)定义为入院行OGTT试验示6.0 mmol/L≤空腹血糖 < 7.0 mmol/L或7.8 mmol/L≤餐后2 h血糖 < 11.1 mmol/L。同时收集同期健康体检者20例(对照组),男性11例,女性9例,年龄52~71(61±5)岁,心电图及超声心动图未见异常,无冠心病致病危险因素(吸烟、饮酒、高脂血症、血糖异常、高血压、早发的心血管疾病家族史,超重BMI≥25.0 kg/m2,心理评估量表显示无焦虑、抑郁状态)。研究方案通过医院医学伦理委员会审查[(2022)科研伦理审第(10)号],所有研究对象已签署知情同意书。
1.2 方法 1.2.1 研究对象生化指标检测研究对象的血样均于患者入院签署知情同意后的次日清晨空腹抽取。患者外周血血清总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、甘油三酯(TG)、空腹血糖(GLU)和糖化血红蛋白(HbAlc)由本院生化试验室检测。
1.2.2 ELISA检测血浆干扰素-γ(interferon-γ, IFN-γ)、白细胞介素(interleukin, IL)-4、IL-2和IL-10水平抽取患者外周静脉血入肝素管,3 000 r/min离心5 min后收集上层血浆,于检测前储存于-80 ℃冰箱中。用ELISA试剂盒(华美,武汉)检测血浆IFN-γ、IL-4、IL-2和IL-10水平。
1.2.3 密度梯度离心法分离人外周血单个核细胞(peripheral blood mononuclear cell, PBMC)肝素抗凝患者外周血10 mL,加入同等体积的1640培养液,叠加于同体积淋巴细胞分离液(Solarbio,北京)上,4 ℃、2 000 r/min离心20 min,滴管吸取中层云雾状细胞层,加入5倍体积的洗涤液洗涤2次,4 ℃、1 500 r/min离心10 min,弃上清。
1.2.4 PBMC胞内细胞染色及流式细胞仪分析PBMC培养液中加入佛波酯(1 μg/mL)、离子霉素(50 μg/mL)和Brefeldin A(500 μg/mL)(Sigma-Aldrich,美国),孵箱中孵育后,加入兔血清封闭细胞表面FcR,冰浴后加入鼠抗人CD3-PerCP抗体(BD Pharmingen,美国),冰浴后加入fix/perm液破膜, 后加入鼠抗人IFN-γ-FITC、IL-4-PE的抗体或小鼠IgG1 FITC/IgG1 PE的同型抗体(BD Pharmingen,美国),室温避光孵育后流式细胞仪检测。
1.2.5 HUVEC培养缓冲液冲洗脐静脉2次,向脐静脉中注射37℃预热过的胶原酶(Sigma-Aldrich,美国),消化20 min后收集细胞悬液,用含有10%胎牛血清的M199培养液重悬,添加终浓度为300 μg/mL牛垂体提取物(Sigma-Aldrich,美国)和10 μg/mL血管内皮生长因子(Sigma-Aldrich,美国),接种于6孔板中,培养至第3代备用。
1.2.6 免疫磁珠清除PBMC中CD4+T细胞分离PBMC,离心后弃上清,加入清洗后的磁珠(Dynal Biotech,挪威),4℃冰浴箱中轻柔旋转摇匀30 min,将Eppendorf管置于磁架2 min后,吸取上清液,洗涤液离心洗涤2次,流式细胞仪检测CD4的表达。
1.2.7 细胞毒性试验毒性试验效应细胞分8种:分别为对照组、Normal组、IGR组和DM组的PBMC和四者清除CD4+T细胞的PBMC。收集HUVEC用洗涤液洗涤,接种于96孔板。效应孔及对照孔分别加入效应细胞悬液或10%胎牛血清的RPMI1640培养液,其中效靶比为50∶1,设3个复孔。37 ℃孵箱中孵育6 h后,弃悬浮细胞液,重新加入含10%胎牛血清的RPMI1640培养液。调零孔、对照孔及效应孔分别加入20 μL MTT试剂(5 mg/mL), 放入37 ℃恒温培养箱继续培养4 h后弃培养液,加入DMSO(150 μL/孔), 室温振荡10 min后于490 nm波长的酶标仪检测各孔吸光度值[D(490)]。试验结果以HUVEC存活率表示。细胞存活率=[D(490)效应组-D(490)调零孔]/[D(490)对照组-D(490)调零孔]×100%。
1.3 统计学分析应用SPSS 23.0统计软件。正态分布数据以x±s表示,非正态分布数据以中位数(最小值,最大值)表示。连续变量组间差异应用方差分析,频数变量的组间差异应用Nemenyi检验分析,P < 0.05表示差异有统计学意义。
2 结果 2.1 研究对象基本情况4组研究对象年龄、性别构成、吸烟饮酒史、TC、LDL及TG水平差异均无统计学意义。DM组和IGR组较Normal组和对照组空腹血糖、糖化血红蛋白均明显升高(P < 0.05,表 1)。
| 指标 | 对照组(n=20) | 冠心病组 | ||
| Normal组(n=38) | IGR组(n=10) | DM组(n=25) | ||
| 年龄/岁 | 61±5 | 62±10 | 68±14 | 62±7 |
| 女性/例 | 9 | 14 | 3 | 11 |
| 吸烟史/例 | - | 21 | 2 | 7 |
| 饮酒史/例 | - | 13 | 2 | 8 |
| 高血压病/例 | - | 20 | 6 | 11 |
| 空腹血糖/mmol·L-1 | 4.96±0.53 | 5.28±0.37 | 5.67±0.59 | 8.54±2.74a |
| 糖化血红蛋白(%) | - | - | 6.1(5.8,6.3) | 7.0(6.0,9.9)a |
| 高密度胆固醇/mmol·L-1 | 1.19±0.15 | 1.11±0.28 | 1.08±0.25 | 0.96±0.21 |
| 低密度胆固醇/mmol·L-1 | 2.54±0.58 | 2.63±0.94 | 2.73±0.91 | 2.43±0.80 |
| 甘油三酯/mmol·L-1 | - | 2.73±7.75 | 2.21±2.50 | 2.38±2.88 |
| a: P < 0.05,与IGR组比较 | ||||
2.2 各组外周血中Th1及Th2细胞相关细胞因子水平
Th1细胞相关细胞因子IFN-γ:DM组、IGR组和Normal组较对照组均明显升高,差异具有统计学意义(P < 0.05);DM组较IGR组和Normal组有进一步升高,差异具有统计学意义(P < 0.05);Th1细胞相关细胞因子IL-2:DM组、IGR组和Normal组较对照组有增高趋势,但差异无统计学意义。Th2细胞相关细胞因子IL-10:DM组、IGR组和Normal组较对照组均明显降低(P < 0.05),冠心病的3个亚组中,IL-10浓度差异亦有统计学意义(P < 0.05),见表 2;IL-4低于试剂盒的最低检测水平,均未测出。
| 组别 | n | IFN-γ | IL-2 | IL-10 |
| 对照组 | 20 | 39.18±4.34 | 46.35±5.81 | 35.69±4.25 |
| 冠心病组 | ||||
| Normal组 | 38 | 47.69±5.08a | 50.18±7.71 | 30.03±4.28a |
| IGR组 | 10 | 47.60±3.91a | 48.59±6.53 | 23.83±4.23a |
| DM组 | 25 | 58.29±8.24ab | 48.23±5.50 | 20.74±3.61ab |
| a: P < 0.05,与对照组比较;b:P < 0.05,与IGR组比较 | ||||
2.3 各组外周血PBMC中Th1和Th2细胞百分比比较
DM组Th1(IFN-γ/CD3+)细胞百分比较IGR组、Normal组和对照组显著升高,差异有统计学意义(P < 0.05);IGR组、Normal组较对照组差异无统计学意义。4组间Th2细胞变化差异无统计学意义,见图 1、表 3。
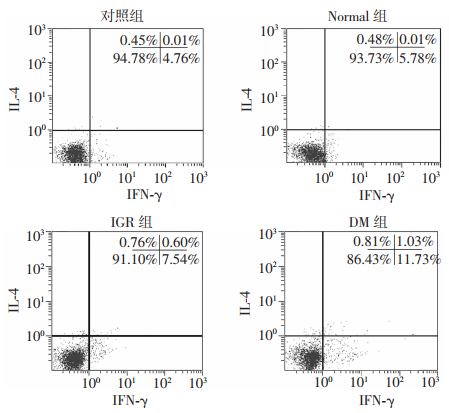
|
| 图 1 各组外周血PBMC中Th1(IFN-γ/CD3+T)和Th2(IL-4/CD3+T)细胞百分比的比较 |
| 组别 | n | Th1(IFN-γ/CD3+) | Th2(IL-4/CD3+) |
| 对照组 | 20 | 6.26±1.18a | 0.68±0.13 |
| 冠心病组 | |||
| Normal组 | 38 | 6.13±1.19a | 0.65±0.09 |
| IGR组 | 10 | 6.38±0.89a | 0.62±0.12 |
| DM组 | 25 | 10.13±2.34 | 0.64±0.13 |
| a:P < 0.05,与DM组比较 | |||
2.4 各组不同效应细胞对HUVEC的毒性试验
经过免疫磁珠筛选后,(CD4-)-PBMC中的CD4+T细胞百分比 < 5%。DM组PBMC作用后,HUVEC的存活率较其他3组明显降低(P < 0.05);另外3组HUVEC的存活率差异无统计学意义;清除CD4+T细胞后,DM组HUVEC的存活率较清除CD+T细胞前明显提升(P < 0.05);清除CD4+T细胞后,4组HUVEC的存活率差异无统计学意义(表 4)。
| 组别 | PBMC | (CD4-)-PBMC | |
| 对照组 | 77.64±4.01a | 81.21±1.95 | |
| 冠心病组 | |||
| Normal组 | 77.78±2.78a | 79.92±3.46 | |
| IGR组 | 78.19±4.02a | 79.35±2.08 | |
| DM组 | 67.69±1.96 | 78.93±2.66 | |
| a:P < 0.05,与DM组比较 | |||
3 讨论
血糖升高是动脉粥样硬化疾病发生发展的重要危险因素,糖尿病大血管病变,如动脉粥样硬化所致的冠心病、脑血管及周围血管疾病,发病率较同年龄非糖尿病患者发病率高2~4.5倍,是糖尿病患者高死亡率和高致残率的主要原因之一[1, 4]。但目前为止,动脉粥样硬化疾病的发展与糖尿病的关系未完全阐明。近年的研究提示,慢性、亚临床性炎症有可能是糖尿病和动脉粥样硬化共同的病理基础,体液及细胞免疫在其中起重要作用[2, 5]。辅助性T细胞(T helper cell,Th)作为炎症反应的重要参与者,已有研究证实分泌IFN-γ的1型辅助性T细胞(Th1)在1型糖尿病(T1DM)患者的发病过程中起重要作用[6]。然而,Th细胞是一个异质性的细胞群体,即包括可能促进炎症反应的Th1细胞亚群,也包括对多种炎症反应起调节作用的Th2细胞亚群[7]。为进一步推测高糖状态下Th细胞在动脉粥样硬化进程中的作用,本试验分析了在不同血糖状态冠心病患者外周血Th细胞百分比及相关细胞因子的变化,结果发现,Th1细胞百分比和相关细胞因子IFN-γ水平的升高与血糖升高关系密切,且Th细胞可能参与了多种细胞对血管内皮的损伤,并起促进作用。
Th细胞根据其参与的免疫反应类型可以分为Th0、Th1、Th2及Th17细胞等多个亚群[8]。在动脉粥样硬化的发展过程中,Th1细胞是重要的参与者,其主要分泌IFN-γ和IL-2。它在动脉粥样硬化斑块的发展及斑块的活化中起重要作用,IFN-γ还可以活化单个核细胞导致炎症反应持续发生[9]。Th2细胞和Th17细胞也存在于动脉粥样硬化斑块中,但百分比较Th1细胞要低得多。Th2细胞可以分泌IL-4、IL-5和IL-10,可以通过激活STAT-6导致GATA-3表达抑制Th1细胞分化和IFN-γ分泌,对动脉粥样硬化的进展起保护作用[10]。正常情况下,Th1细胞和Th2细胞亚群存在着相互调节,它们的细胞功能趋于动态平衡。Th1细胞数目扩增及IFN-γ分泌增多可以导致动脉粥样硬化斑块的进展和活化。本试验前期的研究证实,ACS的发病与Th1/Th2细胞功能失衡关系密切[11]。但在糖尿病患者动脉粥样硬化的进程中,Th1/Th2细胞功能和百分比的变化在不同的研究观察中却有着不同的结果[12-14]。本试验结果发现,合并糖尿病的冠心病患者(DM组)外周血中Th1细胞百分比及相关细胞因子IFN-γ相对于其他组患者明显升高;而IGR组和Normal组的冠心病患者相对于对照组仅有Th1细胞相关细胞因子IFN-γ升高,而Th1细胞百分比并无明显变化。说明Th1细胞扩增不明显,但其功能随血糖升高有逐渐扩增活化的趋势,其分泌的细胞因子进一步加剧了炎症反应。而另一种Th1细胞相关细胞因子IL-2在高糖状态下的冠心病患者外周血中虽有增加趋势,但其差异并无统计学意义,也提示Th1细胞的炎症反应在糖尿病合并冠心病的动脉粥样硬化进程中是一种低水平的长期慢性炎症状态,与急性冠脉综合征中动脉粥样硬化斑块在短时间内活化破裂导致血栓形成具有一定区别。同样,Th2细胞百分比在各组间均无显著差异,但Th2细胞相关细胞因子IL-10在冠心病患者中较对照组显著降低,并且外周血中IL-10的水平随着血糖水平的升高逐渐降低,差异均有统计学意义,说明高糖状态对Th2细胞的功能仍有一定影响,使Th2细胞对炎症的抑制作用减弱。这些研究结果均说明,高糖状态下冠心病患者外周血中存在Th1/Th2细胞功能失衡,Th1/Th2相关细胞因子的失衡可能加剧系统及局部炎症反应。高糖状态下冠心病患者体内长期慢性的炎症反应状态促使了动脉粥样硬化斑块的进展。
研究证明,血管内皮损伤是动脉粥样硬化斑块形成的始动因素[15-16]。本研究通过细胞毒性试验发现,合并冠心病患者外周血PBMC对HUVEC的损害随着PBMC来源患者的血糖水平升高而逐渐增强,提示血糖升高可以提升PBMC对HUVEC的损伤作用,且PBMC对HUVEC的损伤作用的提升随着PBMC中CD4+T细胞的清除而消失,与对照组PBMC无显著性差异,说明Th细胞在PBMC对HUVEC的损伤过程中起至关重要的作用。人体外周血中PBMC包括多种异质性的细胞亚群,有分泌多种细胞因子CD4+的Th细胞,有细胞杀伤作用的CD8+的细胞毒性T细胞(T cytotoxic cells,Tc),还有多种调节免疫反应的调节性T细胞(regulatory T cells,Treg)等,它们相互协调制衡,形成一个复杂的免疫网络,在机体的多种病理生理过程中发挥作用。Th细胞是PBMC中CD4+T细胞亚群中的重要组成部分,Th1细胞亚群的功能亢进对系统炎症反应的持续存在具有推动作用,亦可能促进Tc细胞对血管内皮细胞的损伤,并抑制Treg对炎症反应的调节,从而推动高糖状态下动脉粥样硬化的进展。高糖状态下冠心病患者外周血总Th1/Th2细胞的分化失衡,Th1细胞的扩增和功能亢进导致的慢性炎症反应可能加速了高糖状态下冠心病患者内皮细胞的损伤,导致动脉粥样硬化斑块的进展。
综上所述,本研究为高糖状态下动脉粥样硬化发生机制的研究提供了一种新的思路:高糖状态下动脉粥样硬化斑块的进展与Th1/Th2细胞功能失衡、Th1细胞功能亢进密切相关,系统免疫状态和炎性内环境的改变可能对斑块的进展起重要作用。
| [1] |
MA R C W. Epidemiology of diabetes and diabetic complications in China[J]. Diabetologia, 2018, 61(6): 1249-1260. |
| [2] |
POZNYAK A, GRECHKO A V, POGGIO P, et al. The diabetes mellitus-atherosclerosis connection: the role of lipid and glucose metabolism and chronic inflammation[J]. Int J Mol Sci, 2020, 21(5): E1835. |
| [3] |
GILICZE O, SIMON D, FARKAS N, et al. Characterization of lymphocyte subpopulations and cardiovascular markers in pericardial fluid of cardiac surgery patients[J]. Clin Hemorheol Microcirc, 2019, 73(4): 579-590. |
| [4] |
VⅡGIMAA M, SACHINIDIS A, TOUMPOURLEKA M, et al. Macrovascular complications of type 2 diabetes mellitus[J]. Curr Vasc Pharmacol, 2020, 18(2): 110-116. |
| [5] |
YUAN T, YANG T, CHEN H, et al. New insights into oxidative stress and inflammation during diabetes mellitus-accelerated atherosclerosis[J]. Redox Biol, 2019, 20: 247-260. |
| [6] |
SHAO F, ZHENG P L, YU D, et al. Follicular helper T cells in type 1 diabetes[J]. FASEB J, 2020, 34(1): 30-40. |
| [7] |
SAIGUSA R, WINKELS H, LEY K. T cell subsets and functions in atherosclerosis[J]. Nat Rev Cardiol, 2020, 17(7): 387-401. |
| [8] |
GISTERÅ A, HANSSON G K. The immunology of atherosclerosis[J]. Nat Rev Nephrol, 2017, 13(6): 368-380. |
| [9] |
ALI A J, MAKINGS J, LEY K. Regulatory T cell stability and plasticity in atherosclerosis[J]. Cells, 2020, 9(12): 2665. |
| [10] |
ALBANY C J, TREVELIN S C, GIGANTI G, et al. Getting to the heart of the matter: the role of regulatory T-cells (tregs) in cardiovascular disease (CVD) and atherosclerosis[J]. Front Immunol, 2019, 10: 2795. |
| [11] |
HAN S F, LIU P, ZHANG W, et al. The opposite-direction modulation of CD4+CD25+ Tregs and T helper 1 cells in acute coronary syndromes[J]. Clin Immunol, 2007, 124(1): 90-97. |
| [12] |
OLSON N C, DOYLE M F, DE BOER I H, et al. Associations of circulating lymphocyte subpopulations with type 2 diabetes: cross-sectional results from the multi-ethnic study of atherosclerosis (MESA)[J]. PLoS One, 2015, 10(10): e0139962. |
| [13] |
ZHAO S L, MO Z H, HE H H, et al. Imbalance of T-helper 1/T-helper 2 cytokines and impaired glucose tolerance among patient with acute coronary syndrome[J]. J Cancer Res Ther, 2018, 14(Supplement): S480-S485. |
| [14] |
ŠIKLOVÁ M, KRAUZOVÁ E, SVOBODOVÁ B, et al. Circulating monocyte and lymphocyte populations in healthy first-degree relatives of type 2 diabetic patients at fasting and during short-term hyperinsulinemia[J]. Mediators Inflamm, 2019, 2019: 1491083. |
| [15] |
GIMBRONE M A Jr, GARCÍA-CARDEÑA G. Endothelial cell dysfunction and the pathobiology of atherosclerosis[J]. Circ Res, 2016, 118(4): 620-636. |
| [16] |
CHRYSOHOOU C, KOLLIA N, TOUSOULIS D. The link between depression and atherosclerosis through the pathways of inflammation and endothelium dysfunction[J]. Maturitas, 2018, 109: 1-5. |




