2. 400016 重庆,重庆医科大学:附属第一医院放射治疗室
2. Radiation Treatment Room, the First Affiliated Hospital of Chongqing Medical University, Chongqing, 400016, China
当归是中医临床“补血、活血”要药,当归多糖(Angelica sinensis polysaccharide, ASP)是其主要药物活性成分[1]。ASP对机体的造血系统和免疫系统功能有明确促进作用,对抗肿瘤和抗辐射损伤也有显著良好功效[2-5]。本课题组既往研究发现[6],ASP既能抑制白血病细胞增殖,诱导其向红系、粒系方向分化,又能加速受辐射损伤小鼠的造血功能重建,并促进小鼠免疫功能恢复。迄今,ASP对骨髓移植重建小鼠造血功能的机制尚不清楚。因此,本研究通过构建小鼠骨髓移植模型,探讨ASP促进骨髓细胞移植后造血重建的生物学机制,旨在为阐释当归“补血、活血”的现代生物学机制提供理论依据,也为当归的临床应用提供实验室资料。
1 材料与方法 1.1 实验动物选取10只8~10周龄雄性C57BL/6J小鼠为供体小鼠。另选取30只同周龄雌性C57BL/6J小鼠为受体小鼠。体质量20~25 g,由重庆市医学实验动物中心提供, 动物合格证号:SCXK(渝) 2007-0001。饲养条件控制在20~25 ℃,自然照明,自由饮水和摄食。
1.2 材料与试剂当归多糖购自陕西慈缘生物技术有限公司(批号为CY130421,甘肃岷县当归提取,纯度≥95%);EDU细胞增殖检测试剂盒(中国锐博生物公司);基因组DNA提取试剂盒(艾科瑞生物公司);DMEM培养基与F12培养基(美国GIBCO公司);GM-CSF、IL-3与SCF的ELISA检测试剂盒(上海研辉生物);全自动血液细胞分析仪(迈瑞兽用分析仪,型号:BC-2800vet)。
1.3 小鼠骨髓移植模型构建与分组给药颈椎脱臼处死供体雄鼠,取股骨,制备骨髓单个核细胞悬液,计数备用。受体雌鼠放置在有机玻璃照射盒(长16 cm,宽16 cm,高4.3 cm)内,给予小鼠X射线全身一次性致死剂量照射(照射距离: 55 cm;剂量率:300 cGy/min;总剂量8.0 Gy),建立受体小鼠造血衰竭骨髓移植模型。采用简单随机化法将受体小鼠分为3组,每组10只。对照组(Ctrl组):辐射小鼠后6 h内,由尾静脉输入无菌PBS (0.2 mL/只);骨髓移植组(BMT组):辐射后4~6 h内由尾静脉移植入供体鼠骨髓单个核细胞悬液0.2 mL(5×106个/只),同时给予小鼠腹腔注射PBS(0.2 mL/只×9 d);骨髓移植+当归多糖组(TASP组):供体鼠骨髓单个核细胞移植数量同骨髓移植组,移植后给予受体鼠腹腔注射ASP (100 mg/kg×9 d)[7-8]。
1.4 骨髓细胞移植后受体小鼠体质量变化骨髓细胞移植后每天测量BMT组与TASP组小鼠体质量,连续观察9 d,评价受体小鼠体质量变化规律。
1.5 受体小鼠骨髓细胞与脾集落细胞Y染色体决定基因的检测分别取受体小鼠骨髓细胞和脾集落细胞。脾集落细胞的提取:颈椎脱臼处死受体小鼠,取出脾脏后,摘取肉眼可见脾脏表面的脾集落,置入DMEM培养液中,用注射器针芯研磨脾集落,通过不锈钢网(100目)过滤研磨液,提取脾集落细胞。PCR分析供体小鼠骨髓细胞和脾集落细胞中的Y染色体性别决定基因(Sry基因)。具体按以下步骤进行,①抽提DNA: 制备小鼠骨髓细胞和脾集落细胞悬液,参照基因组DNA提取试剂盒产品说明书提取细胞基因组DNA;②PCR扩增: Sry引物序列上游5′-TGTGGTCCCGTGGTGAGAG-3′,下游5′-CTCCAGTCTTGCCTGTATGTG-3′。50 μL的PCR反应体系: 上下游引物(10 μmol/L)各1 μL, DNA 1 μL, Taq酶25 μL,RNase free water 22 μL。预变性94 ℃ 30 s;变性98 ℃ 10 s,退火55 ℃ 30 s,延伸72 ℃ 1 min,共30个循环;最终延伸72 ℃ 2 min;③扩增物的检测: 取PCR扩增产物3 μL, 经2%琼脂糖凝胶电泳后, 在凝胶电泳图像分析系统中进行Sry基因片段分析(312 bp), 并记录拍照。
1.6 血常规的检测在移植供体骨髓细胞后第9天,采受体小鼠眼眶血, 全自动血细胞分析仪检测血常规(WBC、RBC、HGB、PLT数量)。
1.7 受体鼠股骨有核细胞计数与细胞周期检测移植供体骨髓细胞后第9天,处死受体鼠,取股骨制备骨髓细胞悬液,计算单只股骨骨髓有核细胞(bone marrow nucleated cells, BMNCs)总数。收集两组受体小鼠的BMNCs各1×105个,PBS洗涤2次,70%冷乙醇,4 ℃固定过夜。测定前遗弃固定液,加入碘化丙啶和RNA酶工作液,4 ℃染色处理30 min,300目滤网过滤后上流式细胞仪,经计算机数据处理分析得出细胞周期的各时相比例。
1.8 受体鼠骨髓基质细胞增殖能力检测与成纤维细胞集落(CFU-F)计数提取受体小鼠骨髓单个核细胞,DMEM完全培养液培养骨髓基质细胞,观察细胞贴壁生长情况,取对数生长期的细胞,在培养体系中加入EDU(100 μL,50 μmol/L)作用24 h,按照EDU试剂盒说明书操作,每孔随机选择3个视野,在荧光显微镜下观察阳性信号,并计算EDU染色阳性细胞百分率(阳性细胞总数/总细胞数×100%)。
在37 ℃,含5% CO2条件下在6孔板中培养CFU-F,每隔4 d更换1次细胞培养基,共培养10 d,弃掉培养液,PBS洗涤后加入甲醇溶液固定细胞10 min,每孔加入结晶紫染液,用蒸馏水洗涤各孔,37 ℃烘干进行CFU-F计数和拍照。
1.9 血清和骨髓基质细胞培养上清液中造血生长因子测定取受体小鼠眼眶血,制备血清备用。按1.8方法培养骨髓基质细胞,收集培养10 d的上清液,双抗体夹心ELISA检测试剂盒检测血清与细胞上清液中造血生长因子含量。①建立标准曲线;②每孔各加入待测样品10 μL,样本稀释液40 μL;③加HRP标记的抗体100 μL,将反应板置37 ℃ 60 min;④洗涤反应板4~6次, 在滤纸上印干;⑤每孔加入底物工作液各50 μL,置37 ℃暗处反应15 min;⑥在450 nm处测光密度值;⑦根据标准曲线计算IL-3、GM-CSF、SCF的含量。
1.10 统计学分析数据采用GraphPad Prism 8.0.2处理, 结果以x±s表示, 组间比较采用独立样本t检验, 以P < 0.05表示差异有统计学意义。
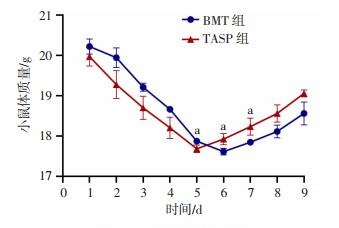
2 结果 2.1 ASP对受体小鼠体质量变化的影响对照组小鼠7 d内全部死亡。辐射后,BMT组与TASP组受体小鼠体质量均下降,在骨髓移植5~6 d后体质量逐步回升。TASP组小鼠体质量恢复明显较快(P < 0.05),见图 1。且小鼠的精神状态、进食和活动明显好于BMT组小鼠。
|
| a:P < 0.05,与BMT组比较 图 1 ASP对移植骨髓细胞后受体小鼠体质量变化的影响 |
2.2 受体小鼠骨髓细胞与脾集落细胞检测到Y染色体决定基因
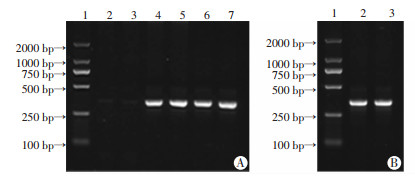
移植雄性供体骨髓细胞后,在受体小鼠骨髓细胞与脾集落细胞检出Y染色体Sry基因片段,其片段长度为312 bp,提示供体小鼠骨髓细胞已经成功移植入雌性受体小鼠骨髓和脾脏(图 2)。
|
| A:受体小鼠骨髓细胞Sry基因的检测 1:DNA标准;2~3:雌性小鼠骨髓细胞PCR产物;4~5:雄性小鼠骨髓细胞PCR产物; 6:移植后BMT组受体雌性小鼠骨髓细胞PCR产物; 7: 移植后TASP组受体雌性小鼠骨髓细胞PCR产物;B:受体小鼠脾集落中Y染色体的检测 1:DNA标准;2:BMT组受体鼠脾集落Sry基因检测; 3: TASP组受体鼠脾集落Sry基因检测 图 2 受体小鼠骨髓细胞与脾集落细胞的Y染色体决定基因 |
2.3 ASP对受体小鼠血常规指标的影响
TASP组小鼠的RBC、WBC、HGB数量均明显高于BMT组小鼠(P < 0.05),见表 1。提示ASP能促进供体骨髓细胞对受体小鼠的造血功能重建。
| 组别 | RBC/1012·L-1 | WBC/109·L-1 | HGB/g·L-1 | PLT/109·L-1 |
| BMT组 | 8.71±0.08 | 0.70±1.17 | 126.70±1.53 | 246.30±97.73 |
| TASP组 | 9.03±0.14a | 1.77±0.51a | 136.00±1.73b | 435.10±72.02 |
| a: P < 0.05, b: P < 0.01,与BMT组比较 | ||||
2.4 ASP对受体小鼠股骨有核细胞数和骨髓细胞周期分布的影响
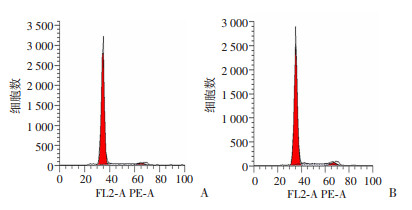
结果表明,BMT组单只股骨有核细胞数为(7.63±0.76)×106,而TASP组小鼠单只股骨有核细胞数为(8.87±0.91)×106。TASP组小鼠骨髓细胞G0/G1期细胞比例下降,而S期和G2/M期细胞比例明显增高(P < 0.05),见表 2。
| 组别 | G0/G1期 | S期 | G2/M期 |
| BMT组 | 90.07±6.55 | 7.53±2.32 | 2.40±0.67 |
| TASP组 | 85.21±7.68a | 11.22±3.34a | 3.57±1.02a |
| a:P < 0.05,与BMT组比较 | |||
|
| A:BMT组的细胞数;B:TASP组的细胞数 图 3 ASP对受体小鼠骨髓细胞周期分布的影响 |
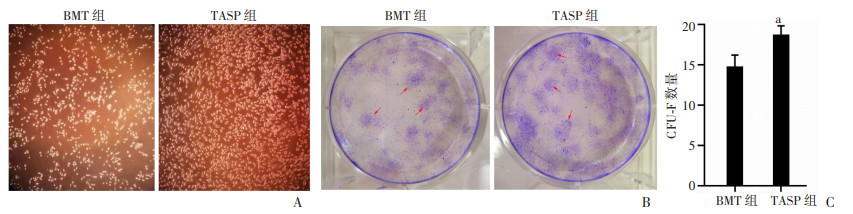
2.5 ASP对受体小鼠骨髓基质细胞增殖能力和CFU-F形成数量的影响
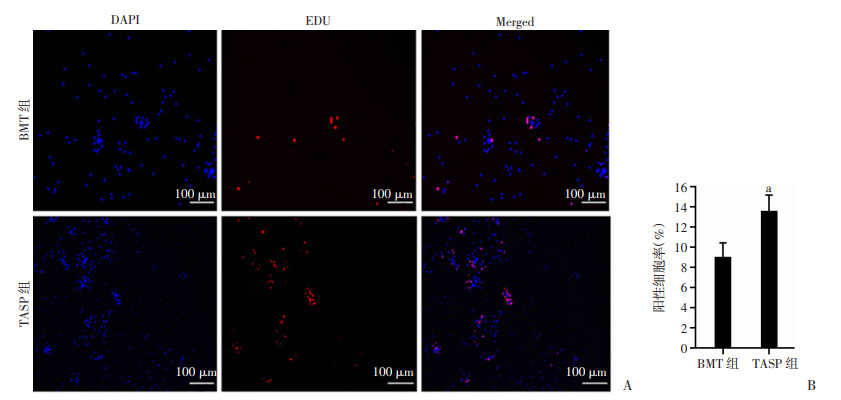
EDU细胞增殖检测实验表明,TASP组小鼠骨髓基质细胞的增殖能力明显高于BMT组小鼠(P < 0.05), 见图 4。TASP组受体小鼠的骨髓基质细胞贴壁率更高,且小鼠CFU-F形成数量明显高于BMT组小鼠(P < 0.05), 见图 5。提示ASP可以促进受体小鼠骨髓造血基质细胞的增殖。
|
| A:骨髓基质细胞EDU实验(荧光倒置显微镜);B:EDU染色阳性细胞百分率 a: P < 0.05, 与BMT组比较 图 4 ASP对受体小鼠骨髓基质细胞EDU增殖能力的影响 |
|
| A:骨髓基质细胞贴壁生长情况(×100);B:CFU-F结晶紫染色实验 ↑:示CFU-F;C: CFU-F形成数量 a: P < 0.05, 与BMT组比较 图 5 ASP对受体小鼠骨髓基质细胞贴壁与成纤维细胞集落生成单位(CFU-F)数量的影响 |
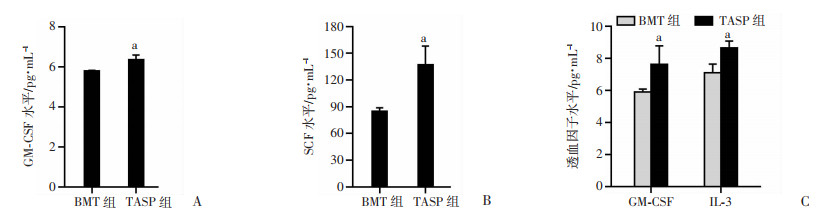
2.6 ASP对受体小鼠造血生长因子生成的影响
结果表明,TASP组小鼠血清和骨髓基质细胞上清液中GM-CSF、IL-3、SCF水平明显高于BMT组(P < 0.05), 见图 6。
|
| A: 受体小鼠骨髓基质细胞上清液中GM-CSF的水平;B:受体小鼠骨髓基质细胞上清液中SCF的水平;C:受体小鼠血清中造血因子水平;a: P < 0.05, 与BMT组比较 图 6 ASP对受体小鼠血清与骨髓基质细胞培养上清液中造血生长因子生成的影响 |
3 讨论
既往研究证明[9],当归多糖是当归中重要的抗衰老成分,能促进造血干细胞增殖和分化,延缓造血干细胞衰老,并能促进移植骨髓细胞重建受体小鼠的造血功能,但其机制尚不清楚。本研究构建辐射所致小鼠骨髓衰竭模型,通过移植供体骨髓单个有核细胞,研究ASP促进受体小鼠造血功能机制。
移植供体造血干细胞或全骨髓是治疗血液系统恶性肿瘤、造血与免疫功能衰竭和肿瘤辅助治疗等的有效手段。本研究将雄性小鼠骨髓造血细胞移植给受致死剂量辐射的雌性受体小鼠,探讨供体造血细胞对致死剂量辐射受体小鼠的造血重建功能。结果表明,8.0 Gy的X射线一次性辐射为C57BL/6J小鼠的致死剂量,如果不移植供体骨髓细胞,小鼠在几天内全部死亡,与相关研究结果一致[10-11]。移植骨髓细胞后,在受体小鼠骨髓细胞与脾集落细胞中检测出供体Y染色体Sry基因片段。本实验证实雄性供体小鼠骨髓成功移植入雌性受体小鼠骨髓和脾脏,为研究来自供体骨髓造血细胞在受体小鼠体内的造血重建工作奠定了理论与技术基础。由于PCR的敏感性及未设立目标序列的量级对照曲线,对植入细胞定量还有待进一步研究。
有研究报道[7],给受致死剂量辐射的小鼠移植同种骨髓细胞,第9天左右可在受体小鼠脾表面观察到肉眼可见的结节,即脾集落生成单位(CFU-S),受体小鼠造血功能得以重建。造血功能重建成功的重要标志是外周血指标的快速恢复。本课题组检测了骨髓移植后第9天受体小鼠外周血指标,结果表明,TASP组小鼠外周血的RBC、WBC、HGB数量恢复速度显著快于BMT组,且小鼠精神状态、活动能力与体质量增加也明显好于BMT组小鼠,提示ASP能促进供体骨髓细胞对受体小鼠的造血重建进程。
骨髓是机体的终身造血器官,骨髓造血功能是评价造血重建的关键指标[12]。骨髓细胞总数和细胞周期分布是反映骨髓细胞增殖活性的具体参数[13]。本研究表明,BMT组和TASP组小鼠的骨髓有核细胞数量均逐渐回升,但是骨髓移植后注射ASP可使小鼠BMNC数量回升速度明显加快,且股骨有核细胞的G0/G1期细胞比例下降,而S期和G2/M期细胞比例明显增高。这提示ASP可促进移植骨髓细胞增殖,加快受体小鼠的造血重建步伐。
造血诱导微环境(hematopoietic inductive microenvironment, HIM)对造血干细胞增殖分化起着重要调控作用[14-15]。HIM的核心成分是造血基质细胞,它为造血细胞增殖与分化提供生物支架,还可通过分泌造血生长因子调控血细胞的发生[16-17]。研究报道,造血微环境对造血重建功能起着重要的作用[18],ASP可通过直接或间接改善造血微环境来调控血细胞发生[19]。本研究结果表明,ASP可提高骨髓基质细胞贴壁和增殖能力,且可提高CFU-F集落生成数量,提示ASP可能通过改善受体HIM环境,从而促进供体骨髓细胞加快对受体小鼠造血重建作用。
造血生长因子对造血细胞增殖分化起着重要的调控作用[20],参与调控造血细胞发生的正向因子主要包括GM-CSF、SCF、EPO、IL-3等[21-22]。为了进一步阐释ASP促进造血重建功能的机制,本研究检测了受体小鼠血清与骨髓基质细胞培养上清液的造血因子的水平。结果表明,ASP能显著提高血清中GM-CSF和IL-3水平,也能提高骨髓基质细胞上清液中GM-CSF和SCF水平。提示ASP促进造血重建机制可能与通过刺激骨髓基质细胞分泌GM-CSF、IL-3和SCF有密切的关系。但ASP对造血生长细胞因子受体及其与受体结合后启动的信号传导还需要进一步研究。
综上所述,本研究探讨了当归多糖对骨髓细胞移植后受体小鼠造血功能重建的机制。结果提示,ASP提高受体小鼠造血重建功能的初步机制与改善造血微环境和促进造血相关因子的产生有关,其具体机制还有待进一步的研究。但本实验没有设计与临床常用药进行比较,因此ASP在骨髓细胞移植中的机制还有待进一步研究。
| [1] |
MU X Y, ZHANG Y Y, LI J, et al. Angelica sinensis polysaccharide prevents hematopoietic stem cells senescence in D-galactose-induced aging mouse model[J]. Stem Cells Int, 2017, 2017: 3508907. |
| [2] |
刘永琦, 颜春鲁, 安方玉, 等. 当归多糖对镉染毒大鼠肝损伤及免疫损伤的影响[J]. 解放军药学学报, 2018, 34(2): 101-104. LIU Y Q, YAN C L, AN F Y, et al. Effects of Angelica sinensis polysaccharide on liver damage and immunocyte injury caused by cadmium in rats[J]. Pharm J Chin PLA, 2018, 34(2): 101-104. |
| [3] |
丁学兰, 赵信科, 邱勇玉, 等. 当归多糖对环磷酰胺致骨髓抑制小鼠外周血细胞、免疫功能的影响[J]. 卫生职业教育, 2016, 34(16): 153-155. DING X L, ZHAO X K, QU Y Y, et al. Effects of Angelica polysaccharide on peripheral blood cells and immune function of in bone marrow suppression mice induced by cyclophosphamide[J]. Heal Vocat Educ, 2016, 34(16): 153-155. |
| [4] |
卢志伟, 许小敏, 王磊, 等. 当归及当归多糖对辐射所致大鼠肝肾损伤的防护作用[J]. 解放军医学杂志, 2017, 42(9): 815-819. LU Z W, XU X M, WANG L, et al. Protective effects of Angelica sinensis and Angelica sinensis polysaccharides against liver and kidney injury induced by irradiation in rats[J]. Med J Chin PLA, 2017, 42(9): 815-819. |
| [5] |
翟凡叶, 汤磊磊, 王立宇, 等. 当归及其活性成分对肿瘤微环境免疫功能的影响及其抗肿瘤作用机制研究概况[J]. 山西中医药大学学报, 2020, 21(1): 77-78. ZHAI F Y, TANG L L, WANG L Y, et al. Research progress on effect of Angelica and its active components on tumor microenvironment immune function and its antitumor mechanism[J]. J Shanxi Coll Tradit Chin Med, 2020, 21(1): 77-78. |
| [6] |
邓方芳, 耿珊, 姜蓉, 等. 当归多糖对人白血病干细胞体外增殖与体内移植模型的影响[J]. 解剖学报, 2021, 52(1): 41-48. DENG F F, GENG S, JIANG R, et al. Effects of Angelica Sinensis polysaccharide on proliferation in vitro and transplantation of human leukemia stem cells in vivo[J]. Acta Anat Sin, 2021, 52(1): 41-48. |
| [7] |
RODRIGUEZ Y BAENA A, MANSO B A, FORSBERG E C. CFU-S assay: a historical single-cell assay that offers modern insight into clonal hematopoiesis[J]. Exp Hematol, 2021, 104: 1-8. |
| [8] |
张梦思, 邹婷, 叶渊文, 等. 当归多糖对衰老模型大鼠脾脏结构与功能的影响[J]. 解剖学报, 2015, 46(2): 257-264. ZHANG M S, ZOU T, YE Y W, et al. Effects of Angelica sinensis polysaccharide on the spleen structure and function of aging rats[J]. Acta Anat Sin, 2015, 46(2): 257-264. |
| [9] |
张岩岩, 李静, 贾道勇, 等. 当归多糖对衰老模型大鼠骨髓造血功能的影响及其机制[J]. 解剖学报, 2014, 45(6): 785-792. ZHANG Y Y, LI J, JIA D Y, et al. Effect of Angelica polysaccharide on hematopiesis in aging rats and its biological mechanism[J]. Acta Anat Sin, 2014, 45(6): 785-792. |
| [10] |
孙苏平, 蔡建明, 项莺松, 等. 小鼠骨髓移植后移植细胞数和时间因素对回巢及存活率的影响[J]. 中华血液学杂志, 2003, 24(5): 274-275. SUN S P, CAI J M, XIANG Y S, et al. Effects of number of transplanted cells and time on homing and survival rate after bone marrow transplantation in mice[J]. Chin J Hematol, 2003, 24(5): 274-275. |
| [11] |
窦昊颖, 杜亚格, 韩远豪, 等. 当归补血汤协同肌源性干细胞移植重建小鼠造血功能的实验研究[J]. 中国实验血液学杂志, 2020(4): 1177-1182. DOU H Y, DU Y G, HAN Y H, et al. Mechanism of hematopoietic reconstruction in mice treated with Danggui buxue decoction combined with muscle-derived stem cell transplantation[J]. J Exp Hematol, 2020(4): 1177-1182. |
| [12] |
LIU M X, TAN H N, ZHANG X K, et al. Hematopoietic effects and mechanisms of Fufang e'jiao Jiang on radiotherapy and chemotherapy-induced myelosuppressed mice[J]. J Ethnopharmacol, 2014, 152(3): 575-584. |
| [13] |
ZHAO A B, YU B, WU X L, et al. Protective effects on myelosuppression mice treated by three different classic Chinese medicine formulae[J]. Pharmacogn Mag, 2011, 7(26): 133-140. |
| [14] |
PINHO S, FRENETTE P S. Haematopoietic stem cell activity and interactions with the niche[J]. Nat Rev Mol Cell Biol, 2019, 20(5): 303-320. |
| [15] |
SZADE K, GULATI G S, CHAN C K F, et al. Where hematopoietic stem cells live: the bone marrow niche[J]. Anti-oxid Redox Signal, 2018, 29(2): 191-204. |
| [16] |
WALKLEY C R, SHEA J M, SIMS N A, et al. Rb regulates interactions between hematopoietic stem cells and their bone marrow microenvironment[J]. Cell, 2007, 129(6): 1081-1095. |
| [17] |
SHARMA M, ROSS C, SRIVASTAVA S. Ally to adversary: mesenchymal stem cells and their transformation in leukaemia[J]. Cancer Cell Int, 2019, 19: 139. |
| [18] |
周倍伊. 骨髓造血微环境对造血干细胞的影响及中医药对造血调控的认识[J]. 广西中医药大学学报, 2019, 22(1): 67-71. ZHOU B Y. Influence of bone marrow hematopoietic micro-environment on hematopoietic stem cells and understanding of hematopoietic regulation by traditional Chinese medicine[J]. J Guangxi Univ Chin Med, 2019, 22(1): 67-71. |
| [19] |
王改琴, 贾书花, 吴宏. 当归多糖对小鼠骨髓基质细胞增殖、细胞周期及细胞凋亡的影响[J]. 四川解剖学杂志, 2009, 17(1): 6-8. WANG G Q, JIA S H, WU H. Effects of Angelica polysaccharides on the proliferation, cell cycle and apoptosis of mice bone marrow stromal cell[J]. Sichuan J Anat, 2009, 17(1): 6-8. |
| [20] |
CHOUSTERMAN B G, ARNAUD M. Is there a role for hematopoietic growth factors during sepsis?[J]. Front Immunol, 2018, 9: 1015. |
| [21] |
MEHTA H M, MALANDRA M, COREY S J. G-CSF and GM-CSF in neutropenia[J]. J Immunol, 2015, 195(4): 1341-1349. |
| [22] |
COMAZZETTO S, MURPHY MM, BERTO S, et al. Restricted hematopoietic progenitors and erythropoiesis require SCF from leptin receptor+ niche cells in the bone marrow[J]. Cell Stem Cell, 2019, 24(3): 477-486. |




