高血压在我国的发病率一直居高不下,其患病人数高达2.45亿[1]。盐敏感性高血压是由于相对高盐摄入导致的血压升高,占我国北方人群原发性高血压的58%[2],而盐敏感性高血压长期控制不佳则会导致心肌肥厚和纤维化[3]。心肌肥厚和纤维化是多种心血管疾病的重要病理基础,是心力衰竭、恶性心律失常以及心源性猝死的独立危险因素[4]。然而,迄今为止仍缺少针对性的防治药物,因此开展心肌肥厚和纤维化的防治药物研究具有重要意义。
G蛋白在心肌肥厚和纤维化的发生发展中扮演了重要的角色。牵张刺激以及神经内分泌因素都可以通过激活受体下游的G蛋白诱导心肌肥厚和纤维化的形成[5]。研究表明,过表达Gαq分子可以促进心肌肥厚和纤维化的形成,而敲除Gαq分子则可改善心肌肥厚和纤维化[6],这提示针对Gαq分子设计药物具有广阔的应用前景。G蛋白抑制肽(G alpha q-protein carboxyl terminus imitation polypeptide, GCIP)是我室针对Gαq分子自主研发的多肽药物,本室既往研究发现腹腔注射GCIP对去甲肾上腺素诱导的小鼠心肌肥厚模型[7]、自发性高血压大鼠模型[8]以及阿霉素诱导的大鼠心力衰竭模型等均具有良好的改善作用[9];但GCIP对于盐敏感性高血压导致心肌肥厚和纤维化的作用以及对小鼠生存率的影响尚待观察。因此,本研究拟通过建立DOCA-高盐诱导的盐敏感性高血压模型,皮下注射GCIP并观察其对小鼠存活率、心肌肥厚和纤维化的影响,初步探讨其机制,进而为深化盐敏感性高血压导致心肌肥厚和纤维化的机制,以及GCIP的研发提供新的实验依据。
1 材料与方法 1.1 主要试剂GCIP(采用固相方法合成,北京中科亚光科技公司,批号:C271401,纯度:96%);醋酸脱氧皮质酮(江苏佳尔科药业集团股份有限公司,批号C34-196602, 纯度≥98%);磷酸化p38兔单克隆抗体、p38兔单克隆抗体、磷酸化ERK1/2兔单克隆抗体、ERK1/2兔单克隆抗体以及α-SMA兔单克隆抗体购自美国CST公司;β-actin小鼠单克隆抗体购自南京金斯瑞生物科技公司;辣根过氧化物酶标记山羊抗兔IgG和山羊抗小鼠IgG购自上海碧云天生物技术有限公司。
1.2 实验动物健康清洁级雄性小鼠64只,6~8周龄,体质量20~24 g,购自湖南省斯莱克景达实验动物有限公司,动物实验合格证号:SCXK(湘)2019-0004。
1.3 动物分组及模型建立雄性C57BL/6小鼠64只腹腔注射戊巴比妥(40 mg/kg)麻醉,背部正中切开后,分离并且结扎左侧肾动脉、肾静脉和输尿管,行左侧肾脏切除术,并逐层关闭腹腔,术后恢复7 d。实验中切除左肾存活的小鼠61只,通过完全随机分组法分为空白对照组(n=10):饮纯净水;DOCA-高盐处理组(n=14)、GCIP 0.1 mg/kg(n=12)、0.3 mg/kg(n=12)、1.0 mg/kg(n=13)组:每隔1 d皮下注射DOCA(100 mg/kg),并给予1% NaCl饮水;GCIP 0.1、0.3、1.0 mg/kg组每日2次皮下注射相应剂量的GCIP。给药期间,每日检测小鼠存活率,4 d测量1次血压。第28天,异氟烷麻醉后,行小鼠心脏超声;第29天,以1%戊巴比妥钠麻醉后,处死小鼠,开胸取出心脏。
1.4 小鼠血压检测采用小鼠无创血压仪(BP2010A)测量小鼠安静清醒状态下尾动脉收缩压(SMP)。测量前,将小鼠置于安静通风地带,使其适应环境。接下来,将小鼠尾巴预热5~10 min,使尾动脉充分扩张。最后设置参数,测量血压。每只重复测量3次,每次间隔60 s,取平均值。
1.5 小鼠左心功能检测给药第28天,使用适量脱毛膏脱去小鼠胸毛,异氟烷麻醉小鼠后并将其固定在小动物超声检测台,在胸腔上涂抹适量超声耦合剂,将探头置于小鼠左胸前,采用小动物超声成像系统(Vevo 2100)检测各组小鼠的心脏功能:左心室射血分数(LVEF),左心室短轴缩短率(LVFS)。每只小鼠重复3次测量后,计算平均值。
1.6 小鼠心脏肥厚指数计算小鼠结束心脏超声学检测后,打开胸腔,取出心脏,用预冷的生理盐水冲洗心腔3次,用干净的滤纸吸干,称全心质量。小心分离右心室,称剩余左心室及室间隔质量,最后计算心脏指数及左心室指数。心脏指数=全心质量/体质量;左心室指数=左心质量/体质量。
1.7 显微镜观察小鼠左心心肌组织病理学变化小鼠心肌组织以4%多聚甲醛固定、石蜡包埋后,经HE染色、麦胚凝集素(wheat germ agglutinin,WGA)以及天狼星红(Sirius red)染色后以中性树胶封片,电子显微镜下观察心肌组织、细胞形态及左心室胶原纤维沉积并拍图。每张切片随机选取5个视野,用Image J软件测量心肌细胞面积及左心室心肌胶原容积分数,并取平均值。
1.8 Western blot检测取新鲜的心肌组织,加入RIPA裂解液、蛋白酶抑制剂、磷酸蛋白酶抑制剂混合物,使用匀浆器冰上研磨后,静置30 min,然后4 ℃、12 000×g离心15 min,取上清液。采用BCA法进行蛋白定量至50 μg,加入4×Loading buffer后在100 ℃下热变性5 min,用10%聚丙烯酰胺凝胶分离,80 V电泳40 min后,120 V电泳直到Loading Buffer跑至胶底;200 mA转膜120 min;5%脱脂奶粉室温下封闭PVDF膜2 h,1×TBST缓冲液置于摇床振荡清洗8 min,4次,加入相应比例稀释的一抗(1∶1 000),4 ℃下孵育过夜,清洗3次后,室温下孵育二抗(1∶1 000)2 h。化学发光高灵敏凝胶成像仪拍照显色,分析条带灰度值。蛋白相对表达水平=目的条带灰度值/内参条带灰度值×100%。
1.9 统计学分析采用SPSS 24.0录入数据,5组间小鼠生存情况采用Kaplan-Meier曲线表示,并进行对数秩检验(两两比较采用Bonferroni调整检验水准法);实验数据以x±s表示,多组间比较采用单因素方差分析,两两组间比较采用LSD法,P < 0.05为差异有统计学意义。
2 结果 2.1 GCIP显著提高盐敏感性高血压小鼠的生存率为了研究GCIP对盐敏感性高血压小鼠生存时间的影响,给药期间每日监测小鼠存活率。单侧肾切除后,各组小鼠活动,饮水均正常。造模期间空白对照组小鼠无死亡,DOCA-高盐组、GCIP-0.1 mg/kg组、GCIP-0.3 mg/kg组、GCIP-1.0 mg/kg组小鼠分别死亡6、4、1、1只,累计生存率分别为57%、66%、91%、92%。与空白对照组比,DOCA-高盐处理组的生存率显著降低,降低至57%(P < 0.05);与DOCA-高盐处理组相比,0.3、1.0 mg/kg GCIP组小鼠生存率显著提高,提升至91%、92%(P < 0.05)。结果表明GCIP能够有效提高盐敏感性高血压小鼠的存活率。见图 1。
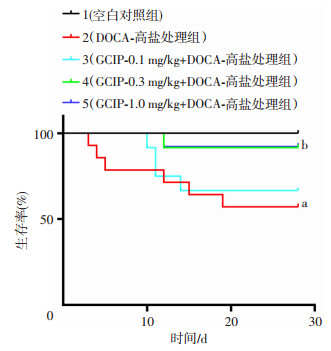
|
| a:P < 0.05, 与空白对照组比较; b:P < 0.05,与DOCA-高盐处理组比较 图 1 GCIP显著提高盐敏感性高血压小鼠的生存率(n=12) |
2.2 GCIP明显改善盐敏感性高血压小鼠的心肌肥厚
DOCA-高盐处理28 d后,通过分离称量小鼠心脏计算心肌肥厚指数,并对小鼠心脏组织进行病理染色评估盐敏感性高血压小鼠的心肌肥厚。DOCA-高盐处理28 d后,相比于空白对照组,DOCA-高盐处理组小鼠的心脏指数和左心室指数明显升高(P < 0.05)。而经过1.0 mg/kg GCIP的治疗后,小鼠的心脏指数和左心室指数显著降低(P < 0.05)。见图 2A、B。为了进一步评估小鼠心肌,对小鼠心脏组织进行HE和WGA染色观察。与空白对照组相比,DOCA-高盐处理组心肌细胞排列紊乱,组织中可见炎性细胞浸润,单位视野内细胞核的数量减少,心肌细胞面积显著增大(P < 0.05)。与DOCA-高盐处理组相比,0.1、0.3、1.0 mg/kg GCIP组的心肌细胞面积较DOCA-高盐处理组明显减小(P < 0.05)。见图 2C~E。以上结果均表明GCIP能够有效改善盐敏感性高血压小鼠的心肌肥厚。
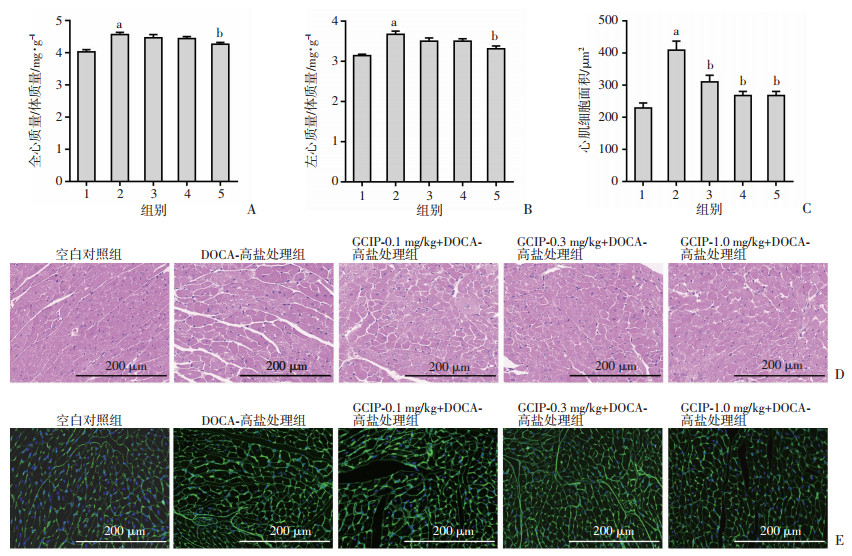
|
| A:小鼠心脏质量/体质量;B:小鼠左心质量/体质量;C:Image J统计小鼠心肌组织中心肌细胞的平均面积 1:空白对照组;2:DOCA-高盐处理组;3~5分别为0.1、0.3、1.0 mg/kg GCIP+DOCA-高盐处理组;a:P < 0.05, 与空白对照组比较; b:P < 0.05,与DOCA-高盐处理组比较;D:HE染色观察心脏组织中心肌细胞面积;E:WGA染色观察心脏组织中心肌细胞面积 图 2 GCIP明显改善盐敏感性高血压小鼠的心肌肥厚(n=6) |
2.3 GCIP明显改善盐敏感性高血压小鼠的心肌纤维化
为了评估小鼠心肌纤维化,通过天狼星红染色观察小鼠左心室胶原纤维沉积情况,通过Western blot检测小鼠心脏组织中α-平滑肌肌动蛋白(α-SMA)的表达。与空白对照组相比,DOCA-高盐处理组左心室细胞间质胶原沉积明显增加(P < 0.05);与DOCA-高盐处理组相比,0.1、0.3、1.0 mg/kg GCIP组左心室细胞间质胶原沉积明显减少(P < 0.05)。见图 3A、B。由心脏成纤维细胞分化而来的肌成纤维细胞是导致心肌纤维化形成的主要细胞类型,而α-SMA则是肌成纤维细胞分化的重要标志物,因此,本研究对心脏组织α-SMA的表达进行观察。与空白对照组相比,经过DOCA-高盐处理的小鼠,心脏组织中α-SMA表达显著升高(P < 0.05),而经过0.1、0.3、1.0 mg/kg GCIP处理后,小鼠心脏组织α-SMA的蛋白表达显著降低(P < 0.05)。见图 3C、D。以上结果说明,GCIP能够明显改善盐敏感性高血压小鼠的心肌纤维化。
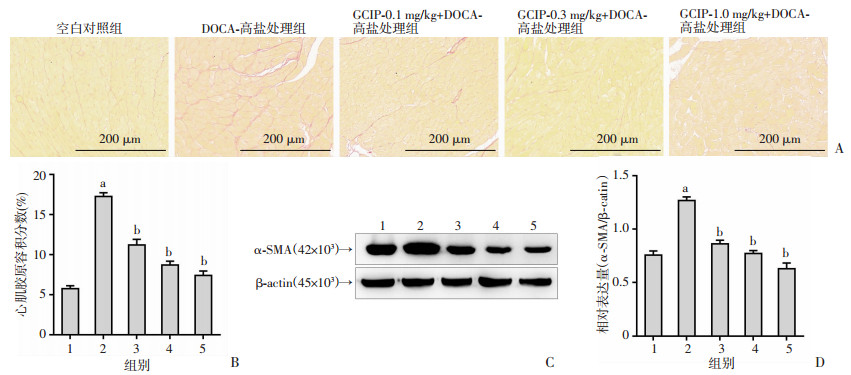
|
| A:天狼星红染色观察心肌胶原沉积;B:左心胶原沉积的统计分析;C:Western blot检测小鼠心脏组织中α-SMA的表达 1:空白对照组;2:DOCA-高盐处理组;3~5分别为0.1、0.3、1.0 mg/kg GCIP+DOCA-高盐处理组;a:P < 0.05,与空白对照组比较;b:P < 0.05,与DOCA-高盐处理组比较;D:α-SMA表达水平统计分析 图 3 GCIP改善盐敏感性高血压小鼠的心肌纤维化(n=5) |
2.4 GCIP明显改善盐敏感性高血压小鼠的左心收缩功能
为了进一步评估GCIP对盐敏感性高血压小鼠心肌肥厚和纤维化的改善作用,采用小动物超声成像系统检测小鼠心功能。与空白对照组相比,DOCA-高盐处理组小鼠左心收缩功能明显降低(P < 0.05),表现为射血分数和左心室短轴缩短率的降低。与DOCA-高盐处理组相比,0.3、1.0 mg/kg GCIP组的左心收缩功能明显改善,表现为射血分数均明显提升(P < 0.05)以及左心室短轴缩短率明显升高(P < 0.05)。见图 4。结果表明GCIP能够明显改善盐敏感性高血压小鼠的左心收缩功能。
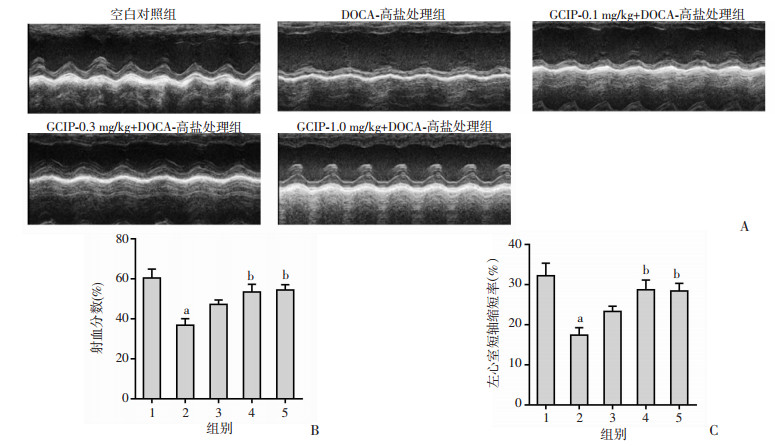
|
| A: 小鼠代表性的超声图像;B:小鼠左心射血分数;C:小鼠左心室短轴缩短率 1:空白对照组;2:DOCA-高盐处理组;3~5分别为0.1、0.3、1.0 mg/kg GCIP+DOCA-高盐处理组;a:P < 0.05,与空白对照组比较; b:P < 0.05,与DOCA-高盐处理组比较 图 4 GCIP改善盐敏感性高血压小鼠的心功能(n=5) |
2.5 GCIP降低盐敏感性高血压小鼠的血压
为了研究GCIP对盐敏感性高血压的改善作用,采用无创尾套法监测小鼠血压。如表 1所示,与空白对照组相比,经过DOCA-高盐处理的小鼠收缩压在第8天开始显著升高(P < 0.05),并在20 d达到最高点。空白对照组,DOCA-高盐处理组,0.1、0.3、1.0 mg/kg GCIP组28 d内的平均血压分别为90.60、121.58、105.85、105.09、106.31 mmHg。与空白对照组相比,经过DOCA-高盐处理的小鼠28 d内的平均血压显著提升(P < 0.05),提高约25.61%,然而经过0.1、0.3、1.0 mg/kg GCIP处理后,小鼠28 d内的平均血压显著降低(P < 0.05),其中0.1、0.3、1.0 mg/kg GCIP分别降低约12.42%、13.16%、12.14%。结果表明,GCIP具有一定的降压作用。
| 组别 | 第1天 | 第4天 | 第8天 | 第12天 |
| 空白对照组 | 83.14±15.82 | 78.86±7.23 | 85.14±20.98 | 89.86±8.35 |
| DOCA-高盐处理组 | 77.05±9.22 | 93.83±9.93 | 121.61±19.74a | 125.09±14.61a |
| GCIP-0.1 mg/kg+DOCA-高盐处理组 | 78.81±6.87 | 98.71±18.06 | 96.14±14.01b | 106.72±7.27b |
| GCIP-0.3 mg/kg+DOCA-高盐处理组 | 77.86±9.97 | 93.84±10.12 | 109.91±11.96b | 97.43±11.93b |
| GCIP-1.0 mg/kg+DOCA-高盐处理组 | 82.58±12.39 | 89.86±14.24 | 101.32±11.73b | 108.23±2.85b |
| 组别 | 第16天 | 第20天 | 第24天 | 第28天 |
| 空白对照组 | 97.71±8.36 | 93.57±10.53 | 97.57±4.99 | 100.12±8.80 |
| DOCA-高盐处理组 | 135.72±8.02a | 143.92±11.13a | 135.92±7.05a | 138.23±1.50a |
| GCIP-0.1 mg/kg+DOCA-高盐处理组 | 111.32±16.59b | 128.21±14.34b | 115.74±12.52b | 111.81±16.12b |
| GCIP-0.3 mg/kg+DOCA-高盐处理组 | 111.65±9.24b | 122.34±18.92b | 118.61±9.99b | 110.13±5.67b |
| GCIP-1.0 mg/kg+DOCA-高盐处理组 | 113.32±9.76b | 124.43±15.64b | 120.14±3.65b | 110.61±12.62b |
| a:P < 0.05,与空白对照组比较;b:P < 0.05,与DOCA-高盐处理组比较 | ||||
2.6 GCIP抑制盐敏感性高血压小鼠心脏组织中p38/ERK1/2的磷酸化
为了研究GCIP改善心肌肥厚和纤维化的潜在机制,通过Western blot检测p38和ERK1/2的蛋白表达。由图 5可见,与空白对照组相比,DOCA-高盐处理组p-p38以及p-ERK1/2蛋白相对表达量显著升高(P < 0.05);与DOCA-高盐处理组相比,不同剂量的GCIP组p-p38和p-ERK1/2蛋白相对表达量显著降低(P < 0.05)。结果表明GCIP改善盐敏感性高血压小鼠的心肌肥厚和纤维化的作用机制与抑制p38和ERK1/2的磷酸化有关。
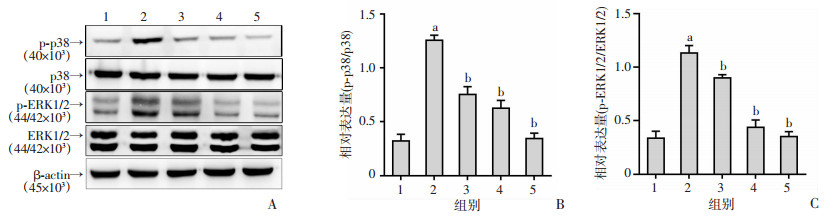
|
| A:Western blot检测小鼠心脏组织中p38和ERK1/2的表达;B:p38磷酸化蛋白表达量统计分析;C:ERK1/2磷酸化蛋白表达量统计分析 1:空白对照组;2:DOCA-高盐组;3~5分别为0.1、0.3、1.0 mg/kg GCIP+DOCA-高盐处理组;a:P < 0.05, 与空白对照组比较;b:P < 0.05,与DOCA-高盐处理组比较 图 5 GCIP抑制盐敏感性高血压小鼠心脏组织中p38/ERK1/2的磷酸化(n=5) |
3 讨论
盐敏感性高血压是由于相对高盐摄入引发的血压升高,据统计在我国的高血压患者中,有超过半数的盐敏感者。心脏是盐敏感性高血压的重要靶器官,长期未受控制的高血压会导致心肌肥厚和纤维化,最终发展为心力衰竭等疾病。DOCA-高盐动物模型是通过单侧肾切除手术,以及皮下注射DOCA并喂养高盐水构建的动物模型,被广泛用于盐敏感性高血压的研究[10]。GCIP是我室自主研发的多肽药物,尽管既往研究发现腹腔注射GCIP对多种动物模型的心肌肥厚和纤维化具有良好的防治作用,但是GCIP对于盐敏感性高血压引发的心肌肥厚和纤维化的作用及对生存率的影响尚待研究。因此本研究通过建立DOCA-高盐诱导的盐敏感性高血压小鼠模型,研究皮下注射GCIP对心肌肥厚及纤维化改善作用并探讨了其初步机制。
本研究表明,DOCA-高盐处理28 d,小鼠的血压升高并且心脏出现明显的肥厚和纤维化,而经过GCIP干预后,小鼠的血压降低、心肌肥厚和纤维化程度明显减轻,这说明GCIP对盐敏感性高血压小鼠的血压、心肌肥厚和纤维化具有良好的防治作用。心脏结构损伤如心肌肥厚和纤维化会进一步引发心脏功能降低,本研究发现DOCA-高盐组小鼠心脏功能下降,然而GCIP干预则可使小鼠的左心收缩功能明显提高,说明GCIP对盐敏感性高血压小鼠降低的心功能具有改善作用。生存率是评价药物有效性的重要指标,本研究发现DOCA-高盐组小鼠的生存率明显降低(降低至57%,P < 0.05),与之前的研究相吻合[11],而经过GCIP干预后,小鼠生存率显著提升(提升至92%,P < 0.05),这说明GCIP能够显著提高盐敏感性高血压小鼠的生存率。长期未受控制的高血压是心肌肥厚和纤维化的重要诱因,本研究发现DOCA-高盐处理组小鼠28 d的平均血压明显升高,而经过GCIP干预后,小鼠28 d的平均血压明显降低,说明GCIP具有一定的降压作用。收缩血管是机体维持血压的重要调控方式,而血管的收缩活动取决于平滑肌的收缩和舒张。G蛋白广泛分布于血管平滑肌细胞,并在血管平滑肌收缩的信号传导过程中发挥重要作用,本室既往研究发现GCIP能够抑制自发性高血压大鼠的主动脉重构,且可以抑制血管紧张素Ⅱ诱导的血管平滑肌细胞肥大[12],提示GCIP的降压作用可能与抑制血管重构有关。既往有研究表明,去甲肾上腺素、血管紧张素-Ⅱ、内皮素等能够与相应受体结合,进而激活MAPK信号通路引发心肌肥厚;而p38和ERK1/2则是MAPK信号通路的主要分子元件[13-14]。为此本研究对其进行了观察,发现DOCA-高盐组小鼠心脏组织中p38和ERK1/2蛋白含量不变,而磷酸化蛋白含量明显提高,提示该信号通路激活,而GCIP干预则可明显抑制p38和ERK1/2的磷酸化,提示GCIP的改善作用与抑制p38和ERK1/2信号通路有关。
患者的依从性是影响药物疗效的重要因素。本室既往研究表明GCIP腹腔注射对多种动物模型的心肌肥厚和纤维化具有良好的防治作用,然而这种给药方式在临床上存在一定的局限性,如疼痛、难以自主给药等,因此探寻方便快捷的给药途径具有重要意义。皮下注射是临床常见的给药途径,操作简便,患者接受度较高。本研究发现GCIP皮下注射能够明显改善小鼠心肌肥厚和纤维化和心脏功能,并能提高小鼠存活率,说明皮下给药是GCIP的方便有效的给药途径。
综上所述,本研究发现皮下注射GCIP能够明显提高盐敏感性高血压小鼠的生存率、降低血压、改善心脏功能及心肌肥厚和纤维化,其机制与抑制p38/ERK1/2信号通路有关。
| [1] |
MILLS K T, STEFANESCU A, HE J. The global epidemiology of hypertension[J]. Nat Rev Nephrol, 2020, 16(4): 223-237. |
| [2] |
李玉明, 杨宁. 盐敏感性高血压特点及防治[J]. 中国实用内科杂志, 2015, 35(4): 299-302. LI Y M, YANG N. The characteristics and prevention of salt-sensitive hypertension[J]. Chin J Pract Intern Med, 2015, 35(4): 299-302. |
| [3] |
DRAZNER M H. The progression of hypertensive heart disease[J]. Circulation, 2011, 123(3): 327-334. |
| [4] |
SHENASA M, SHENASA H. Hypertension, left ventricular hypertrophy, and sudden cardiac death[J]. Int J Cardiol, 2017, 237(6): 60-63. |
| [5] |
WANG J L, GARERI C, ROCKMAN H A. G-protein-coupled receptors in heart disease[J]. Circ Res, 2018, 123(6): 716-735. |
| [6] |
SÁNCHEZ-FERNÁNDEZ G, CABEZUDO S, GARCÍA-HOZ C, et al. Gαq signalling: the new and the old[J]. Cell Signal, 2014, 26(5): 833-848. |
| [7] |
卢小岚, 杨华, 邓翔, 等. G蛋白抑制肽GCIP-27对小鼠心肌肥大的影响[J]. 中国药房, 2010, 21(9): 793-795. LU X L, YANG H, DENG X, et al. Effects of G protein inhibitory peptide GCIP-27 on myocardial hypertrophy in mice[J]. China Pharmacy, 2010, 21(9): 793-795. |
| [8] |
WANG X Q, ZHANG H G, CHENG Y Q, et al. Inhibition of left ventricular remodelling in spontaneously hypertensive rats by G alpha q-protein carboxyl terminus imitation polypeptide GCIP-27 is not entirely dependent on blood pressure[J]. Clin Exp Pharmacol Physiol, 2008, 35(10): 1215-1221. |
| [9] |
LU X L, TONG Y F, LIU Y, et al. Galphaq protein carboxyl terminus imitation polypeptide GCIP-27 improves cardiac function in chronic heart failure rats[J]. PLoS One, 2015, 10(3): e0121007. |
| [10] |
BASTING T, LAZARTIGUES E. DOCA-salt hypertension: an update[J]. Curr Hypertens Rep, 2017, 19(4): 32. |
| [11] |
LING Y H, KRISHNAN S M, CHAN C T, et al. Anakinra reduces blood pressure and renal fibrosis in one kidney/DOCA/salt-induced hypertension[J]. Pharmacol Res, 2017, 116: 77-86. |
| [12] |
ZHANG H G, CHENG Y Q, LIU Y, et al. Gαq-protein carboxyl Terminus imitation polypeptide GCIP-27 attenuates proliferation of vascular smooth muscle cells and vascular remodeling in spontaneously hypertensive rats[J]. Biol Pharm Bull, 2011, 34(10): 1527-1532. |
| [13] |
GALLO S, VITACOLONNA A, BONZANO A, et al. ERK: a key player in the pathophysiology of cardiac hypertrophy[J]. Int J Mol Sci, 2019, 20(9): E2164. |
| [14] |
ROMERO-BECERRA R, SANTAMANS A M, FOLGUEIRA C, et al. p38 MAPK pathway in the heart: new insights in health and disease[J]. Int J Mol Sci, 2020, 21(19): E7412. |




