2. 528000 广东 佛山,中山大学附属佛山医院: 病理科
2. Department of Pathology, the Affiliated Foshan Hospital of Sun Yat-sen University, Foshan, Guangdong Province, 528000, China
80%的子宫内膜癌(endometrial cancer,EC)确诊时属于早期,其5年生存率可达到95%以上,但其中约20%最终会出现复发转移[1]。淋巴脉管间隙浸润(lymphovascular space invasion,LVSI)是指光学显微镜下在肿瘤外围的正常淋巴管或血管间隙中清楚地看到至少一簇癌细胞。LVSI(+)被公认是EC复发并影响总生存期的独立高危因素, 尤其在淋巴结阴性的早期患者中,是临床医师决策是否给予术后辅助放化疗的重要参考[1-3]。然而,目前LVSI的检测仍存在较多争议,主要包括以下几个方面:其一,无公认的标准指南可供参照,主观性强,假阳性及假阴性率高,从而导致危险因素的误判分层;其二,LVSI的范围和严重程度(局灶/广泛)的预后价值可能不同,但目前无成熟的定量/半定量评价体系;其三,苏木精-伊红染色法(HE)下无法分辨血管侵犯(blood vessel invasion,BVI)还是淋巴管侵犯(lymphatic vessel invasion,LVI),而两者的预后意义可能也不相同。长期以来,多数研究将LVSI看作单个变量来研究其对EC的预后价值,而并未“分型”(区分LVI或BVI)和“定量”(评价程度为广泛或局灶)。近几年有研究分别从“分型”或“定量”角度分析发现,BVI较LVI患者预后更差[4],程度广泛的LVSI较局灶LVSI更影响患者生存[5]。但是,这些研究能“分型”者不能“定量”,已“定量”者未行“分类”。本研究旨在通过纳入早期EC患者人群,运用联合免疫组化(immunohistochemistry,IHC)与半定量评价方法来进一步明确其LVSI类型和程度,并分析其与预后的关系,探讨该联合评价体系的应用价值,为临床决策提供参考依据。本研究依据观察性流行病学研究报告论文国际报告规范清单(STROBE)进行报道。
1 资料与方法 1.1 样本量计算查阅文献,Ⅰ期EC的LVSI阳性率约为15%,LVSI(+)与(-)的5年无复发生存率(5-year relapse-free survival,5y-RFS)分别为66.1%与91.4%[6]。设检验水准α=0.05,检验效能(1-β)=0.8,按1 ∶3比例入组,用PASS软件估算样本量。计算样本量约需96例,其中LVSI(+)至少24例,加上10%失访率,总样本量需106例。
1.2 临床资料回顾性收集2010-2017年在中山大学附属佛山医院妇科住院接受手术切除且有完整病历及随访资料的早期子宫内膜癌病例203例,患者均为女性,中位年龄54(27~75)岁。纳入标准:①年龄≥18岁;②接受子宫内膜癌根治性手术(全子宫+双附件+盆腔淋巴结切除±主动脉旁淋巴结切除术);③术后分期:2009FIGO分期Ⅰ~Ⅱ期;④术后病理组织学类型:子宫内膜样腺癌。排除标准:①合并第二原发肿瘤;②合并妊娠;③合并心、肺、肝、肾等脏器功能不全且未有效控制者;④围术期(生存期在3个月以内)死亡;⑤病历资料不完整,患者依从性差,不配合随访。本研究通过医院伦理委员会批准(伦审研[2020]第68-1号),所有患者由其本人签署知情同意书。具体病例临床病理特征见表 1。
| 临床病理特征 | 例数 |
| 年龄/岁 | |
| <60 | 157 |
| ≥60 | 46 |
| 分期(FIGO 2009) | |
| ⅠA | 110 |
| ⅠB | 55 |
| Ⅱ | 38 |
| 组织学分级 | |
| 1 | 34 |
| 2 | 122 |
| 3 | 47 |
| 肌层侵犯 | |
| <1/2 | 137 |
| ≥1/2 | 66 |
| 术后治疗 | |
| 盆腔外照射+阴道后装放疗 | 20 |
| 阴道后装放疗 | 26 |
| 化疗 | 39 |
| 无 | 131 |
| 复发 | |
| 局部复发(5年内) | 27 |
| (5年以上) | 2 |
| 远处转移(5年内) | 29 |
| (5年以上) | 3 |
1.3 LVSI的IHC分型及半定量分层方法
调阅符合入组标准患者的病理玻片与蜡块,复核其HE染色下的LVSI情况,选取最具代表性的区域对应蜡块切取白片进行IHC检测。每个蜡块切取4~10张白片,最多检测5张白片作半定量。LVSI的IHC标记过程使用D2-40和Ⅷ因子分别特异性标记淋巴管和血管。使用DAKO Omnis全自动免疫组化染色机进行石蜡切片的脱蜡、抗原修复和免疫染色过程。具体程序如下:碱性修复液(Tirs-EDTA9.0,DAKO, Denmark) 97 ℃ 30 min,分别加入一抗小鼠抗人D2-40 (DAKO, Denmark)和兔抗人第Ⅷ因子(DAKO, Denmark)32 ℃孵育20 min,3%过氧化氢(DAKO, Denmark)阻断3 min,酶标羊抗兔和鼠免疫球蛋白聚合物二抗试剂(DAKO, Denmark) 32 ℃孵育20 min,二氨基联苯胺显色5 min,苏木精复染,盐酸酒精分化,流水冲洗,梯度酒精脱水,烤干后中性树胶封片。显微镜下观察染色效果,染色可疑者即行重新标记染色。以PBS缓冲液取代一抗作阴性对照,以已知阳性反应片作阳性对照。
盲法判读:由不清楚患者临床信息和HE染色LVSI情况的2位病理科医师对IHC结果进行判读。在肿瘤外围的正常淋巴管或血管内皮间隙中清楚地看到至少一簇癌细胞,判定为LVSI(+)。根据内皮细胞的IHC着色情况,D2-40(+)Ⅷ(-)判为LVI(+),D2-40(-)Ⅷ(+)判为BVI(+),D2-40(+)Ⅷ(+)判为LVI+BVI,D2-40(-)Ⅷ(-)判为LVSI(-)。如两位医师意见不一致,则会经过商议达成共识。
半定量分层:经过IHC区分LVSI类型后,分别对LVI(+)或BVI(+)的患者采用3层分级体系进行半定量分层,分别统计局灶LVI、广泛LVI、局灶BVI、广泛BVI、LVI+BVI、LVSI(-)的例数。计算平均每张玻片的LVSI数量=全部玻片看到的LVSI总数/玻片数量。具体分层标准如下:①无:即LVSI(-);②局灶:平均每片玻片中肿瘤组织周围≤1处LVSI;③广泛:平均每片玻片中肿瘤组织周围可见>1处的LVSI。
1.4 随访方法对入组患者进行随访,随访形式以患者定期返院复诊及电话方式进行。术后2年内每3个月复诊一次,其后3年内每半年复诊一次,满5年后每年一次,每2个月电话随访1次。返院复查内容包括问诊、体格检查、血常规、肿瘤标记物、影像学等。记录所有患者的无复发生存时间(relapse-free survival,RFS,从手术到首次随访发现复发或随访截止日之间的时间),计算5y-RFS(术后5年内未复发的患者人数/总患者人数×100%)。随访时间截至2021年11月。随访率100%。203例患者中位随访时间55.3(2~139)个月。
1.5 统计学方法采用SPSS 22.0软件进行统计分析。计数资料比较采用χ2检验,多组率两两比较采用Holm-Bonferroni校正法。采用Kaplan-Meier法描绘生存曲线,Log-rank检验比较组间差异,Cox比例风险模型分析各临床病理因素与RFS的关系。采用双侧检验,以P<0.05为差异有统计学意义,可信区间采用95%的可信度(95%CI)。
2 结果 2.1 早期子宫内膜癌中各LVSI类型与程度的分布各LVSI类型与程度判定见图 1。78.8%(56/71)HE染色下判定为LVSI(-)的病例用IHC法被确认为LVSI(+),而有37.5%(9/24)HE法认定的LVSI在IHC染色下未显色。HE染色下,LVSI阳性率为11.8%(24/203),LVSI(+)组与(-)组5y-RFS无统计学差异;使用IHC染色法后,LVSI阳性率提高到35.0%(71/203),LVSI(+)组与(-)组5y-RFS差异有统计学意义。引入分类半定量法后,LVSI(+)被细分为5个亚组,局灶LVI组30例(14.7%),广泛LVI组16例(7.8%),局灶BVI组9例(4.4%),广泛BVI组4例(2.0%)和LVI+BVI组12例(5.9%)。其5y-RFS与LVSI(-)组相比差异均有统计学意义(P<0.01),但各亚组两两比较差异无统计学意义。见表 2。
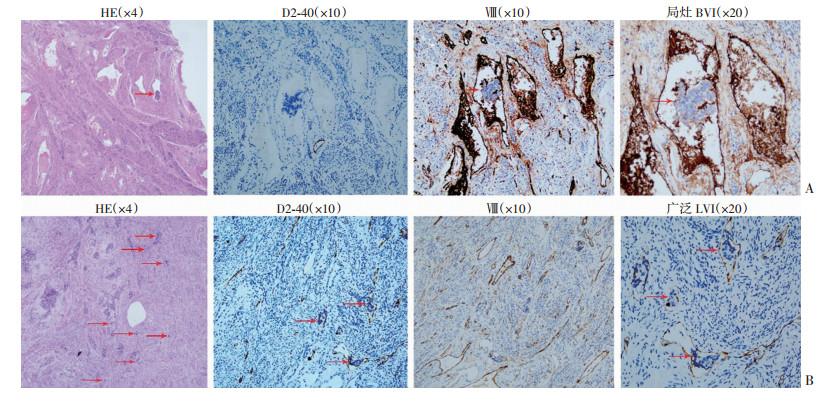
|
| A:局灶BVI ↑:示淋巴管侵犯病灶;B:广泛LVI ↑:示血管侵犯病灶 图 1 免疫组化分型联合半定量分层法判定LVSI类型与程度 |
| 判定方法 | n | 5年内复发 | 5y-RFS(%) | χ 2值 | P值 |
| HE法 | |||||
| LVSI(+) | 24 | 8 | 66.7 | 0.450 | 0.502 |
| LVSI(-) | 179 | 48 | 73.2 | ||
| IHC法 | |||||
| LVSI(+) | 71 | 38 | 46.5 | 36.765 | <0.01 |
| LVSI(-) | 132 | 18 | 86.3 | ||
| 分类半定量法 | |||||
| 局灶LVI | 30 | 13 | 56.7 | 41.164 | <0.01 |
| 广泛LVI | 16 | 8 | 50.0 | ||
| 局灶BVI | 9 | 6 | 33.3 | ||
| 广泛BVI | 4 | 3 | 25.0 | ||
| LVI+BVI | 12 | 8 | 33.3 | ||
| LVSI(-) | 132 | 18 | 86.3 |
2.2 LVSI类型和程度与早期子宫内膜癌预后的关系
按分类半定量法分组后各亚组的RFS曲线见图 2。LVSI(+)的病例中,广泛BVI组中位无复发生存时间(median relapse-free survival,mRFS)最短(26.1个月),局灶LVI组最长(mRFS=74.3个月),均与LVSI (-)组(mRFS未达到)有统计学差异(P<0.01)。单因素分析显示,年龄、肌层浸润深度、LVSI状况、术后放疗与早期EC的RFS有关(P<0.05),分期、组织学分级、术后化疗则与之无关。Cox多因素回归显示,年龄、分期、LVSI状况、术后放疗、术后化疗是影响早期EC预后的独立预后因素(P<0.05),而肌层浸润深度、组织学分级并不是早期EC预后的独立危险因素。见表 3。进一步比较各LVSI亚组,广泛LVI者(HR: 5.832, 95%CI: 2.463~13.808)较局灶LVI者(HR: 3.380, 95%CI: 1.708~6.688)复发风险高,局灶BVI者(HR: 12.536, 95%CI: 4.692~33.493)、广泛BVI者(HR: 11.538, 95%CI: 2.869~46.399)、LVI+BVI者(HR: 10.065, 95%CI: 4.215~24.032)的复发风险相差不大,均高于广泛LVI者。
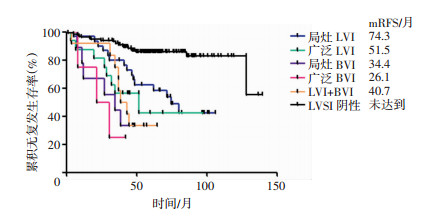
|
| 图 2 分类半定量法分组后各亚组RFS曲线 |
| 临床病理因素 | 单因素 | 多因素 | |||||
| HR | 95%CI | P值 | HR | 95%CI | P值 | ||
| 年龄/岁 | |||||||
| <60 | 1 | 1 | |||||
| ≥60 | 1.877 | 1.099~3.206 | 0.021 | 2.636 | 1.409~4.933 | 0.002 | |
| 分期 | |||||||
| ⅠA~ⅠB | 1 | 1 | |||||
| Ⅱ | 1.502 | 0.825~2.732 | 0.183 | 1.867 | 1.002~3.480 | 0.049 | |
| 肌层浸润 | |||||||
| <1/2 | 1 | 1 | |||||
| ≥1/2 | 1.673 | 1.003~2.788 | 0.049 | 1.292 | 0.732~2.281 | 0.376 | |
| 组织学分级 | |||||||
| 1~2 | 1 | 1 | |||||
| 3 | 1.358 | 0.766~2.408 | 0.295 | 1.335 | 0.734~2.431 | 0.344 | |
| LVSI情况 | |||||||
| LVSI阴性 | 1 | 1 | |||||
| 局灶LVI | 3.530 | 1.806~6.900 | <0.01 | 3.380 | 1.708~6.688 | <0.01 | |
| 广泛LVI | 5.243 | 2.294~11.982 | <0.01 | 5.832 | 2.463~13.808 | <0.01 | |
| 局灶BVI | 9.137 | 3.602~23.177 | <0.01 | 12.536 | 4.692~33.493 | <0.01 | |
| 广泛BVI | 14.270 | 4.124~49.372 | <0.01 | 11.538 | 2.869~46.399 | 0.001 | |
| LVI+BVI | 6.592 | 2.868~15.147 | <0.01 | 10.065 | 4.215~24.032 | <0.01 | |
| 术后治疗 | |||||||
| 无 | 1 | 1 | |||||
| 放疗 | 0.306 | 0.131~0.711 | 0.006 | 0.270 | 0.112~0.652 | 0.004 | |
| 化疗 | 0.854 | 0.444~1.642 | 0.637 | 0.465 | 0.227~0.952 | 0.036 | |
3 讨论
LVSI(+)被认为是恶性肿瘤发生淋巴或血行转移播散的开始,对EC淋巴结转移和远处转移复发都具有重要的预后价值。然而,长期以来大部分文献都将LVSI看作单个预后因素来分析。近年逐渐有对LVSI做进一步分型或定量的研究,发现不同类型和程度的LVSI预后价值并不一致,这很可能影响早期EC术后患者的临床分层决策。从表 4可见,大多数研究都未兼顾LVSI“分型”与“定量”的同步评估,而且将早期与晚期EC病例同时入组一并统计,基线特征差异较大,结论多不一致。本研究入组病例全部为Ⅰ~Ⅱ期EC患者,旨在将IHC联合半定量评价方法二者结合以探讨其在早期EC预后的应用价值。
| 研究(发表年份) | 样本量 | 研究设计 | 患者分期 | 检测方法 | LVI(%) | BVI(%) | 半定量 | 主要终点 | 主要结论 |
| ALEXANDER-SEFRE等(2009)[7] | 77 | 回顾性队列 | Ⅰ | IHC | 22(29) | 23(30) | 否 | RFS, OS | 首次报道使用IHC法区分EC的LVSI类型的预后意义(未比较LVI与BVI的预后差异) |
| MANNELQVIST等(2009)[4] | 286 | 回顾性队列 | Ⅰ~Ⅳ | IHC | 84(31) | 50(18) | 否 | RFS, OS | LVI与BVI都是独立危险因子,BVI(+)者预后更差 |
| VANDENPUT等(2010)[8] | 62 | 回顾性队列 | Ⅰ~Ⅲ | IHC | 32(52) | 41(66) | 否 | RFS, OS | BVI是OS独立危险因子 |
| VISSER等(2017)[9] | 183 | 病例-对照 | Ⅰ~Ⅲ | IHC | 59(32) | 12(7) | 否 | 不同结局病例的LVI和BVI比例 | BVI是复发的独立危险因子 |
| SATO等(2018)[10] | 376 | 回顾性队列 | Ⅰ~Ⅲ | IHC | 82(22) | 87(23) | 否 | RFS | BVI是复发的独立危险因子 |
| WAKAYAMA等(2018)[11] | 189 | 回顾性队列 | Ⅰ~Ⅳ | IHC | 55(31) | 36(19) | 否 | RFS, OS | LVI是OS独立危险因子 |
| HACHISUGA等(1999)[12] | 303 | 回顾性队列 | Ⅰ~Ⅳ | HE | 未报告 | 未报告 | 是 | OS | OS:广泛LVSI者最短,局灶LVSI与LVSI(-)者相近 |
| BOSSE等(2015) [5] | 926 | 前瞻性队列 | Ⅰ | HE | 未报告 | 未报告 | 是 | RFS, OS | 远处转移风险:广泛LVSI者最高,局灶LVSI者次之,LVSI(-)者最低OS:广泛LVSI者最短,局灶LVSI与LVSI(-)者相近 |
| MATSUO等(2015)[13] | 711 | 回顾性队列 | Ⅰ~Ⅲ | HE | 未报告 | 未报告 | 是 | RFS | 远处转移风险:广泛LVSI者最高,局灶LVSI与LVSI(-)者相近 |
| RFS: 无复发生存时间;OS: 总生存时间 | |||||||||
传统LVSI的认定是在HE染色下由病理科医师依据个人经验进行形态学判定,并无公认的标准指南可供参照执行,主观性强,个体差异大,制片过程中形成的肿瘤碎屑,伴微囊性、伸长及碎片状(microcystic,elongated,fragmented,MELF)模式的浸润也常常难以与LVSI鉴别,假阳性及假阴性率较高。IHC染色法使用能特异性标记淋巴管与血管的D2-40和Ⅷ因子抗体,不仅能准确地判定LVSI,提高敏感性和特异性,还能区分LVI与BVI,为进一步研究两者的预后价值提供基础。本研究发现,HE法判定的LVSI阳性率偏低,从5y-RFS差异上看也无法体现其预后价值;IHC染色法则使LVSI检出率明显提高,据其划分的两组也观察到5y-RFS差异有统计学意义,提示该方法可作为LVSI的优选判定方法。
在本研究中,引入分类半定量法后,LVSI(+)被细分为5个亚组:局灶LVI、广泛LVI、局灶BVI、广泛BVI、LVI+BVI。其中局灶LVI最常见(14.7%),广泛BVI发生率最低(2.0%)。各亚组的5y-RFS与LVSI(-)组相比差异均有统计学意义,但各亚组两两比较无统计学差异。由于本研究纳入病例均为早期(Ⅰ~Ⅱ期)患者,较局部晚期患者发生脉管侵犯概率更低,故部分亚组病例数偏少,两两比较时难以获得统计学差异。VISSER等[9]报道,经过IHC标记,LVSI的检出率从HE下的24.6%提高到36.1%,其中大部分(29.5%) 仅有LVI(+),3.8%为BVI(+),2.7%是LVI+BVI,本研究结果与文献报道基本一致。
在单因素分析中,我们发现,年龄、肌层浸润深度、LVSI状况、术后放疗均与RFS相关,经Cox回归多因素分析校正后,年龄、分期、LVSI状况、术后放疗、术后化疗是影响早期EC预后的独立预后因素,而肌层浸润深度、组织学分级并不是早期EC预后的独立危险因素。本研究观察到,大多数早期EC复发病例的复发时间都在5年内,几个LVSI亚组的5年复发率虽然相近,但RFS却显示出差异。Cox回归模型多因素分析显示,虽然LVI(+)与BVI(+)都属于LVSI(+),复发风险都高于LVSI(-)者,但半定量分组后预后意义差别较大。广泛LVI者的mRFS短于局灶LVI者(51.5 vs 74.3个月),复发风险更高;而局灶BVI者与广泛BVI者的mRFS和HR相近,复发风险都明显高于广泛LVI者;而LVI+BVI组的复发风险则更接近于单纯BVI(+)组。
既往研究发现,虽然LVI比BVI更常见[4],但在很多区域淋巴结阴性的早期恶性肿瘤病例中都可以检测出循环肿瘤细胞,这个现象提示血行转移并非全都由LVI侵入淋巴系统继而进入血液循环发展而来,而是在肿瘤发生早期已经具备的能力[14]。发生淋巴管扩散与血行转移的分子机制差异较大,倾向于先发生LVI还是BVI,是由肿瘤细胞本身的侵袭能力及基因表达决定的,部分恶性程度高的肿瘤细胞很可能在侵犯淋巴管之前就已经直接入血[15]。在EC[16]、乳腺癌[17]中都观察到多个基因的上调/下调与LVSI相关。LVI与BVI之间,也许不是因果关系,而是并列关系。
理论上,LVI与BVI可能导致截然不同的临床结局:LVI更多的与区域淋巴结转移和局部复发相关,BVI则可能是全身转移的根源[4, 18]。乳腺癌[19]、结肠癌[20]等恶性肿瘤中都观察到LVI与BVI的预后价值不一样。VISSER等[9]、SATO等[10]均发现,在EC患者中,LVI(+)与淋巴结转移的关联性更显著,却并非预后的独立危险因子;而BVI(+)出现血行转移风险更高,RFS更短,尤其是在淋巴结阴性患者中。KIMYON等[21]报道,BVI(而非LVI)是EC宫颈间质浸润的重要途径。最近一项多中心回顾性研究[3]提示,对于LVSI阳性Ⅰ期EC,术后辅助治疗(放疗±化疗)可改善其无进展生存。但是,辅助治疗的方式与疗效是否受LVSI类型的影响则暂未见相关文献报道。
本研究的半定量评价体系选用了经文献证实预后区分度最明确的三级半定量法(无/局灶/广泛)[5]。一项基于926例样本的前瞻性队列研究(PORTEC 1和2)[5]发现,同为Ⅰ期EC患者,广泛LVSI者远处转移风险最高(HR: 4.5, 95%CI: 2.4~8.5),局灶LVSI者次之(HR: 2.4, 95%CI: 1.3~4.9),无LVSI者最低。HACHISUGA等[12]研究表明,广泛LVSI者OS最短,而局灶LVSI与无LVSI者OS并无显著差别。本研究也发现,从LVI亚组看,复发风险从高至低依次为LVI+BVI者>广泛LVI者>局灶LVI者>无LVSI者,与以上研究相印证。本研究还发现,BVI对预后的影响更大,局灶BVI与广泛BVI预后相当,一旦出现BVI,即使仅是局灶BVI,其预后也较广泛LVI差。MANNELQVIST等[4]报道,LVI(+)者复发风险(HR: 4.5, 95%CI: 2.0~10.5),介乎于LVSI(-)(HR=1)与BVI(+)(HR: 8.7, 95%CI: 3.9~19.5)之间,一旦出现BVI,即使同时合并存在LVI也不增加额外的风险,BVI是更主要的预后因子。这与本研究结果基本一致。
综合上述结果,我们推断,两种LVSI类型的预后价值可能不一样:LVI的预后价值受淋巴管侵犯程度影响较大,广泛LVI者复发转移风险更高;BVI较LVI的远期预后价值更高,对RFS影响更显著,且与BVI程度无关。从临床角度分析,一方面,全面手术分期的实施,使潜在淋巴结转移灶得到切除,目前以放疗为主的术后治疗方案也有助于降低局部复发的风险,从而可能一定程度削弱了LVI的预后影响;另一方面,血行转移是EC的主要复发模式[10],对于淋巴结阴性的早期患者,辅助化疗并非必选,而常规病理报告HE法检出LVSI的敏感性和特异性较差,无法早期识别出BVI(+),可能使这些BVI(+)患者错过接受全身化疗降低复发的机会。基于本研究结果,对于BVI(+)和广泛LVI的患者,可能需要实施更积极的术后辅助治疗方案。本研究也是目前所知首次关于早期EC的LVSI分类半定量的预后价值的报道。
综上所述,应用IHC联合半定量来评价LVSI的方法有助于更精确地评估细分早期EC患者的预后风险,广泛LVI较局灶LVI者复发风险高,BVI(+)者较LVI(+)者预后更差,且与BVI程度无关;年龄、分期、LVSI状况、术后放疗、术后化疗是影响早期EC预后的独立预后因素。本研究为回顾性研究,受入组样本量、病历资料完整度、患者随访依从性等限制,可能存在偏倚,尚需更大规模的前瞻性多中心临床研究及更长的随访时间来进一步证实IHC联合半定量评价LVSI的方法在早期EC中的应用价值。
| [1] |
BEAVIS A L, YEN T T, STONE R L, et al. Adjuvant therapy for early stage, endometrial cancer with lymphovascular space invasion: is there a role for chemotherapy?[J]. Gynecol Oncol, 2020, 156(3): 568-574. |
| [2] |
CONCIN N, MATIAS-GUIU X, VERGOTE I, et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma[J]. Int J Gynecol Cancer, 2021, 31(1): 12-39. |
| [3] |
SON J, CHAMBERS L M, CARR C, et al. Adjuvant treatment improves overall survival in women with high-intermediate risk early-stage endometrial cancer with lymphovascular space invasion[J]. Int J Gynecol Cancer, 2020, 30(11): 1738-1747. |
| [4] |
MANNELQVIST M, STEFANSSON I, SALVESEN H B, et al. Importance of tumour cell invasion in blood and lymphatic vasculature among patients with endometrial carcinoma[J]. Histopathology, 2009, 54(2): 174-183. |
| [5] |
BOSSE T, PETERS E E, CREUTZBERG C L, et al. Substantial lymph-vascular space invasion (LVSI) is a significant risk factor for recurrence in endometrial cancer: a pooled analysis of PORTEC 1 and 2 trials[J]. Eur J Cancer, 2015, 51(13): 1742-1750. |
| [6] |
LOIZZI V, CORMIO G, LORUSSO M, et al. The impact of lymph vascular space invasion on recurrence and survival in patients with early stage endometrial cancer[J]. Eur J Cancer Care (Engl), 2014, 23(3): 380-384. |
| [7] |
ALEXANDER-SEFRE F, NIBBS R, RAFFERTY T, et al. Clinical value of immunohistochemically detected lymphatic and vascular invasions in clinically staged endometrioid endometrial cancer[J]. Int J Gynecol Cancer, 2009, 19(6): 1074-1079. |
| [8] |
VANDENPUT I, VANHOVE T, CALSTER B V, et al. The use of lymph vessel markers to predict endometrial cancer outcome[J]. Int J Gynecol Cancer, 2010, 20(3): 363-367. |
| [9] |
VISSER N C M, WERNER H M J, KRAKSTAD C, et al. Type of vascular invasion in association with progress of endometrial cancer[J]. APMIS, 2017, 125(12): 1084-1091. |
| [10] |
SATO M, TAGUCHI A, FUKUI Y, et al. Blood vessel invasion is a strong predictor of postoperative recurrence in endometrial cancer[J]. Int J Gynecol Cancer, 2018, 28(5): 875-881. |
| [11] |
WAKAYAMA A, KUDAKA W, MATSUMOTO H, et al. Lymphatic vessel involvement is predictive for lymph node metastasis and an important prognostic factor in endometrial cancer[J]. Int J Clin Oncol, 2018, 23(3): 532-538. |
| [12] |
HACHISUGA T, KAKU T, FUKUDA K, et al. The grading of lymphovascular space invasion in endometrial carcinoma[J]. Cancer, 1999, 86(10): 2090-2097. |
| [13] |
MATSUO K, GARCIA-SAYRE J, MEDEIROS F, et al. Impact of depth and extent of lymphovascular space invasion on lymph node metastasis and recurrence patterns in endometrial cancer[J]. J Surg Oncol, 2015, 112(6): 669-676. |
| [14] |
ALONSO-ALCONADA L, MUINELO-ROMAY L, MADISSOO K, et al. Molecular profiling of circulating tumor cells links plasticity to the metastatic process in endometrial cancer[J]. Mol Cancer, 2014, 13: 223. |
| [15] |
PADUCH R. The role of lymphangiogenesis and angiogenesis in tumor metastasis[J]. Cell Oncol (Dordr), 2016, 39(5): 397-410. |
| [16] |
WATANABE T, HONMA R, KOJIMA M, et al. Prediction of lymphovascular space invasion in endometrial cancer using the 55-gene signature selected by DNA microarray analysis[J]. PLoS One, 2019, 14(9): e0223178. |
| [17] |
KUROZUMI S, JOSEPH C, SONBUL S, et al. A key genomic subtype associated with lymphovascular invasion in invasive breast cancer[J]. Br J Cancer, 2019, 120(12): 1129-1136. |
| [18] |
GUJAM F J, GOING J J, EDWARDS J, et al. The role of lymphatic and blood vessel invasion in predicting survival and methods of detection in patients with primary operable breast cancer[J]. Crit Rev Oncol Hematol, 2014, 89(2): 231-241. |
| [19] |
KLINGEN T A, CHEN Y, STEFANSSON I M, et al. Tumour cell invasion into blood vessels is significantly related to breast cancer subtypes and decreased survival[J]. J Clin Pathol, 2017, 70(4): 313-319. |
| [20] |
FUJII T, SUTOH T, MORITA H, et al. Vascular invasion, but not lymphatic invasion, of the primary tumor is a strong prognostic factor in patients with colorectal cancer[J]. Anticancer Res, 2014, 34(6): 3147-3151. |
| [21] |
KIMYON COMERT G, BASARAN D, ERGIN AKKOZ H, et al. Blood vessel invasion in endometrial cancer is one of the mechanisms of spread to the cervix[J]. Pathol Oncol Res, 2019, 25(4): 1431-1436. |




