体外循环相关性肺损伤是心脏直视手术常见而严重的并发症,继发于肺缺血再灌注基础上的肺泡上皮细胞损伤是其最典型的病理生理改变之一[1-3]。氧糖剥夺/恢复(oxygen-glucose deprivation/recovery, OGD/R)模型常用来在细胞水平上研究缺血再灌注损伤效应。在离体细胞培养实验中,OGD/R可引起细胞发生焦亡和凋亡两种结局类似但过程完全独立的死亡过程[4-5]。细胞焦亡由Caspase 1、4、5介导,表现为细胞膜通透性升高和细胞胀裂,伴随炎性细胞因子IL-1β、IL-18显著升高和炎性细胞浸润[6-8],是一种“燃烧式”的细胞死亡,它常是细胞或机体为应对伤害性刺激或清除入侵病原,保障机体渡过生存危机而采取的自救性反应,但不适当的或过度的细胞焦亡却可能导致炎症反应放大和组织损伤。而细胞凋亡则主要由Caspase 3介导,表现为细胞向内塌陷、皱缩,常见于细胞新陈代谢或生长发育中组织重塑等条件下,也可见于伤害性刺激较轻的条件下,不伴随炎性细胞因子变化和炎性细胞浸润[9-10],相对于细胞焦亡来看,是一种“安静的”细胞死亡方式,对机体整体的影响较小。A549细胞来源于人肺癌上皮细胞,具有永生化和无限增殖的能力,常用作研究肺泡上皮细胞功能及有关病理生理机制的模式细胞。我们前期研究证实,OGD/R可引发A549细胞发生焦亡[11],但同一OGD/R条件下,是否同时触发A549细胞凋亡,以及焦亡与凋亡的平衡是否可被调节,以促使A549细胞以炎症反应较轻的凋亡方式死亡,尚不清楚。本研究拟对此进行初步探索。
1 材料与方法 1.1 材料和主要试剂人A549肺泡上皮细胞细胞株, 由本单位中心实验室保存。高糖DMEM培养基购自Gibco公司;无糖DMEM培养基购自迈晨科技有限公司;胎牛血清购自杭州四季青生物工程材料有限公司;Annexin V-FITC/PI流式凋亡检测试剂盒、人源细胞因子IL-1β、IL-18 ELISA试剂盒购自欣博盛生物科技有限公司;PCR逆转录试剂盒、购自MedChemExpress有限公司;引物购自上海生工;VX-765、Z-DEVD-FMK购自美国APExBIO公司;全蛋白提取试剂盒、BCA蛋白浓度测量试剂盒购自江苏凯基生物技术股份有限公司;兔多克隆抗体购自成都正能生物技术有限责任公司。
1.2 细胞培养及分组冷冻保存的A549细胞用37 ℃水浴解冻,采用完全培养基(含10%胎牛血清的高糖DMEM)培养传代,每2天更换1次培养液,至生长密度达70%~80%时分为以下几组:对照组(control),氧糖剥夺/恢复组(OGD/R),氧糖剥夺/恢复复合焦亡抑制剂组(OGD/R+VX-765),氧糖剥夺/恢复复合凋亡抑制剂组(OGD/R+Z-DEVD-FMK,以下简称OGD/R+FMK)。OGD/R条件根据以前的研究确定[11],具体方法为:OGD/R组细胞更换无糖无血清培养基,在37 ℃和1% O2条件下处理6h,然后更换完全培养基在37 ℃、21% O2条件下继续培养6h,该过程模拟临床条件下的缺血-再灌注过程。VX-765终浓度为50 μg/mL,Z-DEVD-FMK终浓度为60 μg/mL,均于OGD/R前加入相应分组细胞中。对照组仅在平行时间点给予更换完全培养基的操作,不实施OGD/R处理。OGD/R后分别检测各组细胞凋亡及焦亡相关指标,根据检测结果分析,本研究追加检测了各组细胞非经典凋亡及焦亡通路中关键分子BID和GSDME的mRNA和蛋白表达。
1.3 流式细胞术检测A549细胞凋亡水平采用Annexin V-FITC/PI双染法以流式细胞仪进行检测,主要步骤如下:以完全培养基重悬细胞,调整浓度为每毫升5×105个细胞,接种于6孔板,每孔4 mL,培养过夜。待细胞贴壁后,按照前述分组处理细胞,然后弃去培养基,用PBS清洗后,再用0.25%胰蛋白酶消化直至细胞完全脱落,收集细胞,以1 000×g离心5 min,弃去上清液,收集细胞,用PBS轻轻重悬细胞并计数。取5~10万个重悬的细胞,于4 ℃下以1 000×g离心5 min,弃去上清液,重复3次后,将细胞重悬于binding buffer 200 μL中,依次加入Annexin V-FITC和PI试剂各10 μL,轻轻混匀,于4 ℃下避光孵育30 min;再加入binding buffer 300 μL,用流式细胞仪检测细胞总凋亡率。
1.4 ELISA法测定A549细胞上清液中IL-1β、IL-18的水平各组细胞培养结束后,收集上清液,4 ℃、1 000×g离心20 min,吸取上清液,放入-80 ℃冰箱备用,待全部样本收集齐全后采用ELISA法测定上清液中IL-1β和IL-18的浓度,操作步骤按照试剂盒说明书进行,酶标仪中读取450 nm波长处的光密度值D(450),制作标准曲线,并按照标准曲线计算样本中的IL-1β、IL-18浓度。
1.5 RT-qPCR检测A549细胞焦亡与凋亡相关分子mRNA的表达细胞培养结束后,采用TRIzol法提取总RNA:每培养孔加入TRIzol裂解液1 mL,充分吹打混匀细胞,转移至EP管,置冰上继续裂解10 min。加入氯仿200 μL,涡旋30 s充分混匀,4 ℃、14 400 r/min,离心10 min后留取上层水相。加入等体积异丙醇,涡旋30 s充分混匀,4 ℃、14 400 r/min,离心10 min,收集白色RNA沉淀。按照逆转录试剂盒说明书步骤合成cDNA,条件为25 ℃ 2 min,42 ℃ 45min,85 ℃ 2 min。采用实时荧光定量PCR法测定mRNA表达水平,反应条件为:95 ℃ 15 min;95 ℃ 10 s、60 ℃ 32 s,共40个循环,各引物序列见表 1,采用周期阈值法(2-△△Ct)分析目的基因表达,以β-actin为内参照。
| Name | Primer sequence | Product/bp |
| Caspase 1 | 上游: 5′-GAAGAAACACTCTGAGCAAGTC-3′ 下游: 5′-GATGATGATCACCTTCGGTTTG-3′ |
112 |
| NLRP3 | 上游: 5′-AGGGATGAGAGTGTTGTGTGAAACG-3′ 下游: 5′-GCTTCTGGTTGCTGCTGAGGAC-3′ |
131 |
| ASC | 上游: 5′-CTCAAGAAGTTCAAGCTGAAGC-3′ 下游: 5′-TAGGTCTCCAGGTAGAAGCTG-3′ |
134 |
| GSDMD | 上游: 5′-GAGCTTCCACTTCTACGATGCCATG-3′ 下游: 5′-CCTGCGATCTTTGCCTGTCCTG-3′ |
84 |
| Caspase 3 | 上游: 5′-CCAAAGATCATACATGGAAGCG-3′ 下游: 5′-CTGAATGTTTCCCTGAGGTTTG-3′ |
185 |
| BCL2 | 上游:5′-GACTTCGCCGAGATGTCCAG-3′ 下游: 5′-GAACTCAAAGAAGGCCACAATC-3′ |
129 |
| BAX | 上游: 5′-CGAACTGGACAGTAACATGGAG-3′ 下游: 5′-CAGTTTGCTGGCAAAGTAGAAA-3′ |
157 |
| BID | 上游: 5′-CTGTGAACCAGGAGTGAGTC-3′ 下游: 5′-GTAGGTTTGTGATGCACTCATC-3′ |
101 |
| GSDME | 上游: 5′-TTTGCATTCATAGACATGCCAG-3′ 下游: 5′-GTTCATCATCAAATAGGACCGC-3′ |
181 |
| GAPDH | 上游: 5′-CAGGAGGCATTGCTGATGAT-3′ 下游: 5′-GAAGGCTGGGGCTCATTT-3′ |
138 |
1.6 Western blot检测A549细胞焦亡与凋亡相关蛋白的表达
各组培养细胞处理结束后,采用PBS清洗,胰酶消化,离心收集细胞沉淀,加入细胞裂解液和蛋白酶抑制剂,提取总蛋白,BCA法定量蛋白浓度。总蛋白样品煮沸变性,取20 μg上样行十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳,分离总蛋白样品。电泳条件为60 V、30 min,120 V、60 min,电泳结束后250 mA条件下转膜2 h。PVDF膜用5%脱脂奶粉液封闭90 min,TBST洗膜4次,每次5 min。加入特异性一抗,4 ℃下摇床过夜孵育,再经TBST清洗3次,每次5 min。最后加入辣根过氧化物酶标记的二抗,室温孵育2 h,TBST清洗3次,每次10 min。以GAPDH为内参,ECL曝光显影,采用Bio-Rad quantity One软件分析。
1.7 统计学分析采用SPSS 25.0统计软件进行分析,GraphPad Prism 8.0软件绘图。本实验中均为计量资料,以x±s表示。两组间均数比较采用独立样本t检验,多组间均数比较先采用单因素方差分析,然后采用Bonferroni法进行两两比较, 检验水准α=0.05。
2 结果 2.1 A549细胞总凋亡率的变化对照组与OGD/R组细胞总凋亡率分别为(3.67±0.64)vs(12.57±1.97),OGD/R组细胞总凋亡率升高,差异有统计学意义(P < 0.05)。经焦亡和凋亡抑制剂处理后,OGD/R+VX-765组、OGD/R+FMK组总凋亡率分别为(5.97±1.28)和(5.17±0.78),均较OGD/R组下降,差异有统计学意义,见图 1。
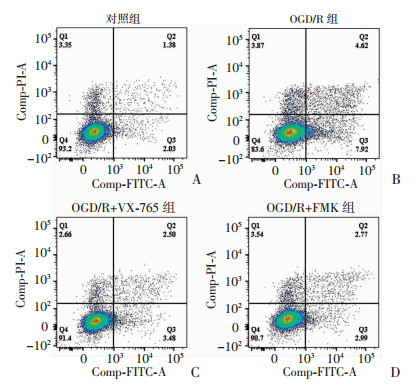
|
| 图 1 流式细胞术检测结果 |
2.2 A549细胞培养上清中,焦亡标志物IL-1β和IL-18的变化
ELISA检测结果显示,OGD/R组上清液中IL-1β和IL-18的浓度与对照组比较,OGD/R组升高,差异具有统计学意义(P < 0.05);使用焦亡抑制剂VX-765后,与OGD/R组比较出现降低,差异具有统计学意义(P < 0.05);使用凋亡抑制剂Z-DEVD-FMK后,与OGD/R组比较也出现降低,差异具有统计学意义(P < 0.05,图 2)。
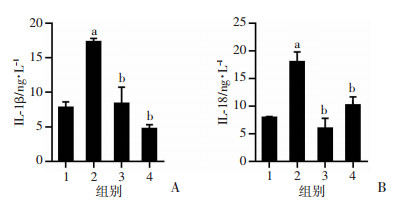
|
| A:IL-1β;B:IL-18 1:对照组;2:OGD/R组;3:OGD/R+VX-765组;4:OGD/R+FMK组; a:P < 0.05,与对照组比较; b:P < 0.05,与OGD/R组比较 图 2 A549细胞上清液IL-1β、IL-18表达量变化 |
2.3 A549细胞凋亡关键分子Caspase 3、BAX和BCL2的mRNA和蛋白表达的变化
RT-qPCR结果显示,OGD/R组细胞凋亡相关分子Caspase 3、BAX和BCL2的mRNA相对表达量与对照组相比Caspase 3和BAX表达升高,BCL2表达降低,BCL2/BAX比值降低,差异具有统计学意义(P < 0.05);使用凋亡抑制剂Z-DEVD-FMK后,Caspase 3、BAX和BCL2的mRNA相对表达量与OGD/R组比较,Caspase 3表达量降低,差异具有统计学意义(P < 0.05);使用焦亡抑制剂VX-765后,Caspase 3、BAX和BCL2的mRNA相对表达量与OGD/R组比较,差异无统计学意义(P>0.05,图 3)。

|
| A:RT-qPCR检测结果;B:Western blot检测结果;C:半定量分析 1:对照组;2:OGD/R组;3:OGD/R+VX-765组;4:OGD/R+FMK组;a:P < 0.05,与对照组比较;b:P < 0.05,与OGD/R组比较 图 3 A549细胞凋亡关键分子的mRNA和蛋白表达情况 |
Western blot检测结果显示,OGD/R组凋亡关键分子Caspase 3、cleaved-Caspase 3、BAX和BCL2的蛋白相对表达量与对照组相比Caspase 3、cleaved-Caspase 3、BAX表达升高,BCL2表达降低,BCL/BAX比值降低,差异具有统计学意义(P < 0.05);使用了凋亡抑制剂Z-DEVD-FMK后上述关键分子的蛋白相对表达量,与OGD/R组相比Caspase 3、Cleaved-Caspase 3表达下调,差异具有统计学意义(P < 0.05);使用了焦亡抑制剂VX-765后,Caspase 3、BAX和BCL2的蛋白相对表达量与OGD/R组相比差异无统计学意义(P>0.05),cleaved-caspase 3较OGD/R组相对表达量有所降低,差异具有统计学意义(P < 0.05,图 3)。
2.4 A549细胞焦亡关键分子NLRP3、ASC、Caspase 1和GSDMD的mRNA和蛋白表达的变化RT-qPCR检测结果显示,OGD/R组细胞焦亡相关分子NLRP3、ASC、Caspase 1、GSDMD的mRNA相对表达量与对照组相比升高,差异具有统计学意义(P < 0.05);使用了焦亡抑制剂VX-765后上述分子的mRNA相对表达量与OGD/R组相比出现下调,差异具有统计学意义(P < 0.05);使用了凋亡抑制剂Z-DEVD-FMK后上述分子的mRNA相对表达量与OGD/R组相比差异无统计学意义(P>0.05,图 4)。
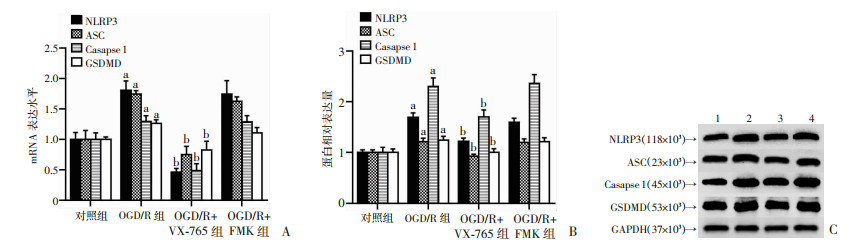
|
| A:RT-qPCR检测结果;B:Western blot检测结果;C:半定量分析 1:对照组;2:OGD/R组;3:OGD/R+VX-765组;4:OGD/R+FMK组;a:P < 0.05,与对照组比较;b:P < 0.05,与OGD/R组比较 图 4 A549细胞焦亡关键分子mRNA与蛋白相对表达 |
Western blot检测结果显示,OGD/R组焦亡关键分子NLRP3、ASC、Caspase 1、GSDMD的蛋白相对表达量与对照组相比升高,差异具有统计学意义(P < 0.05);使用了焦亡抑制剂VX-765后上述关键分子的蛋白相对表达量与OGD/R组相比出现下调,差异具有统计学意义(P < 0.05);使用了凋亡抑制剂Z-DEVD-FMK后上述关键分子相对表达量与OGD/R组相比无统计学意义(P>0.05,图 4)。
2.5 非经典细胞凋亡及焦亡通路中关键分子BID和GSDME的mRNA和蛋白表达RT-qPCR检测结果显示,OGD/R组BID、GSDME的mRNA相对表达量与对照组相比升高,差异具有统计学意义(P < 0.05);使用了焦亡抑制剂VX-765后BID、GSDME的mRNA相对表达量与OGD/R组比较,BID相对表达量降低,差异具有统计学意义(P < 0.05);使用了凋亡抑制剂Z-DEVD-FMK后BID、GSDME的mRNA相对表达量与OGD/R组比较,GSDME表达下调,差异具有统计学意义(P < 0.05,图 5)。
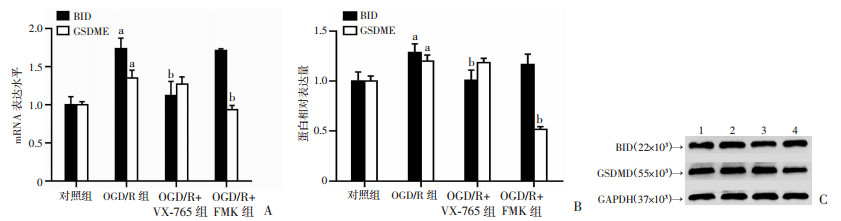
|
| A:RT-qPCR检测结果;B:Western blot检测结果;C:半定量分析 1:对照组;2:OGD/R组;3:OGD/R+VX-765组;4:OGD/R+FMK组;a:P < 0.05,与对照组比较;b:P < 0.05,与OGD/R组比较 图 5 A549细胞BID与GSDME的mRNA和蛋白相对表达 |
Western blot检测结果显示,OGD/R组BID、GSDME的蛋白相对表达量与对照组相比升高,差异具有统计学意义(P < 0.05);使用了焦亡抑制剂VX-765后BID、GSDME的蛋白相对表达量与OGD/R组比较,BID相对表达量降低,差异具有统计学意义(P < 0.05);使用了凋亡抑制剂Z-DEVD-FMK后BID、GSDME的蛋白相对表达量与OGD/R组比较,GSDME下调,差异具有统计学意义(P < 0.05,图 5)。
3 讨论本研究再次证实当前OGD/R条件可引发A549肺泡上皮细胞发生焦亡,且当前OGD/R条件还可同时触发A549细胞凋亡;凋亡和焦亡抑制剂对两种细胞死亡方式存在交叉抑制效应,且并非通过Caspase 3和Caspase 1途径;补充实验结果显示OGD/R激活了Caspase 1/BID和Caspase 3/GSDME途径,提示OGD/R引发的细胞焦亡与凋亡存在共享信号通路。
凋亡与焦亡是严重伤害性刺激下细胞两种截然不同的程序性细胞死亡方式。前者表现为染色质固缩、片段化以及细胞整体内陷,不伴有炎性细胞浸润和炎症因子释放[9-10],后者则表现为细胞“胀裂”,胞膜通透性升高,胞内物质漏出及炎性因子的释放,伴随强烈炎症反应[6-8]。本研究发现,OGD/R同时引发A549细胞发生凋亡与焦亡,则二者之间是否存在调控可能性,是否可以通过抑制其中一种,而导致死亡已不可避免的细胞更多地向另一种方式转变,尤其是抑制焦亡而促使细胞结局向凋亡转变,从而减轻炎症反应,是一个值得关注的问题。
本研究发现,给予焦亡抑制剂VX-765处理后,焦亡关键分子NLRP3、ASC、Caspase 1和GSDMD的mRNA与蛋白表达均出现降低,培养上清中焦亡标志蛋白IL-1β和IL-18的浓度也出现降低,表明OGD/R引起的细胞焦亡受到抑制。与此同时,流式细胞检测发现细胞凋亡率也出现下降,提示焦亡抑制剂VX-765使细胞凋亡也受到了抑制,但凋亡关键分子Caspase 3、BAX和BCL2的mRNA和蛋白表达并未受到影响,这提示OGD/R引起的细胞凋亡可能涉及Caspase 3之外的非经典途径。有研究证实,焦亡关键分子Caspase 1活化后可通过切割BID蛋白参与细胞凋亡的发生,在BID基因敲除细胞中,激活Caspase 1可使细胞凋亡受到显著抑制[12-14]。因此,本研究检测了BID的mRNA和蛋白表达变化,结果显示OGD/R后,A549细胞BID的mRNA和蛋白表达升高,且焦亡抑制剂VX-765(抑制Caspase 1)对此有抑制作用,这提示Caspase 1/BID机制参与了OGD/R引发的细胞凋亡。
本研究还发现,在给予凋亡抑制剂Z-DEVD-FMK处理后,促凋亡关键分子Caspase 3、BAX被抑制,抑凋亡关键分子BCL2的mRNA和蛋白表达上调,细胞凋亡率下降。与此同时,细胞焦亡也受到一定程度的抑制,但细胞焦亡关键分子Caspase 1、ASC、NLRP3、GSDMD的mRNA与蛋白表达并未受到显著影响,这提示OGD/R引起的细胞焦亡中可能涉及另外的机制。细胞焦亡机制包括Caspase 1依赖的经典途径与Caspase4、5依赖的非经典途径[6],这些焦亡关键分子活化后,水解细胞膜GSDMD蛋白导致膜孔形成和渗漏,并同时促使IL-1β、IL-18前体成熟并释放,标志细胞焦亡的发生[15-16]。但近期有研究证实细胞焦亡还存在通过Caspase 3水解胞膜GSDME蛋白而导致膜孔形成的新机制[17]。为此我们检测了A549细胞在OGD/R条件下GSDME的表达情况,结果显示,OGD/R后A549细胞GSDME的mRNA和蛋白表达出现升高,且可被Casepase 3抑制剂所抑制,这提示OGD/R引起的细胞焦亡中,包含Casepase 3/GSDME机制的参与。
本研究的目的在于通过OGD/R细胞模型来模拟体外循环中肺泡上皮细胞的缺血再灌注,以进一步理解体外循环相关性肺损伤的发生机制,并探讨抑焦亡促凋亡以减轻炎症反应获得肺保护效应的可能性。肺泡上皮细胞是呼吸膜的关键组成部分,也是肺缺血再灌注损伤的关键靶点[18],并可继发引起肺泡表面活性物质代谢障碍、基底膜毁损和炎性细胞浸润,若能以炎症反应较轻的凋亡形式死亡,无疑有助于减轻缺血再灌注所致的肺损伤。本研究发现,OGD/R条件下A549细胞的Caspase 1表达增加既可通过ASC、NLRP3、GSDMD途径引起细胞焦亡,也可通过BID途径引起细胞凋亡,还发现Caspase 3表达增加既可引起细胞凋亡,也可通过GSDME途径引起细胞焦亡,提示OGD/R引起的细胞焦亡与凋亡存在共享信号通路。因此,凋亡与焦亡抑制剂对两种细胞死亡方式存在交叉抑制现象,但本研究既未证实通过抑制细胞焦亡而促使细胞向凋亡方向发展,也未证实抑制细胞凋亡而促使焦亡发生。这提示上述抑焦亡促凋亡以减轻炎症反应获得肺保护效应的可行性存疑,但是并未排除焦亡和凋亡抑制剂在防治体外循环相关性肺损伤中的可能性,尤其可以对二者联合应用进行进一步探索。
本研究尚存在一些不足,首先是当前OGD/R条件与临床体外循环下肺泡上皮细胞实际缺血再灌注条件并不完全吻合[19],其次是细胞焦亡与凋亡仅通过检测分子标记来代表,进一步的实验中应该采取电镜并结合基因调控等更准确的实验手段。此外,A549细胞虽广泛用作肺泡上皮模式细胞,但其生物学性状和功能与肺泡上皮细胞可能仍存在差异,进一步研究中应考虑采用原代培养的肺泡上皮细胞。但是,本研究结果为更好理解体外循环相关性肺损伤等缺血再灌注类肺损伤的发生机制提供了一些新的线索,值得进一步关注。
综上,氧糖剥夺/恢复可同时导致A549细胞发生焦亡与凋亡,且细胞焦亡与凋亡存在共享信号通路;焦亡与凋亡抑制剂均可同时抑制OGD/R引起的A549细胞焦亡与凋亡。
| [1] |
DENG Y X, HOU L, XU Q Y, et al. Cardiopulmonary bypass induces acute lung injury via the high-mobility group box 1/toll-like receptor 4 pathway[J]. Dis Markers, 2020, 2020: 8854700. |
| [2] |
KARACALILAR M, ONAN I S, ONAN B, et al. Effects of pulmonary perfusion during cardiopulmonary bypass on lung functions after cardiac operation[J]. J Card Surg, 2020, 35(10): 2469-2476. |
| [3] |
YUAN S M. Postperfusion lung syndrome: physiopathology and therapeutic options[J]. Rev Bras Cir Cardiovasc, 2014, 29(3): 414-425. |
| [4] |
HU Z Z, YUAN Y, ZHANG X L, et al. Human umbilical cord mesenchymal stem cell-derived exosomes attenuate oxygen-glucose deprivation/reperfusion-induced microglial pyroptosis by promoting FOXO3a-dependent mitophagy[J]. Oxid Med Cell Longev, 2021, 2021: 6219715. |
| [5] |
XIE P, REN Z K, LV J, et al. Berberine ameliorates oxygen-glucose deprivation/reperfusion-induced apoptosis by inhibiting endoplasmic Reticulum stress and autophagy in PC12 cells[J]. Curr Med Sci, 2020, 40(6): 1047-1056. |
| [6] |
SHI J J, GAO W Q, SHAO F. Pyroptosis: gasdermin-mediated programmed necrotic cell death[J]. Trends Biochem Sci, 2017, 42(4): 245-254. |
| [7] |
WANG Q, WU J F, ZENG Y C, et al. Pyroptosis: a pro-inflammatory type of cell death in cardiovascular disease[J]. Clin Chim Acta, 2020, 510: 62-72. |
| [8] |
MCKENZIE B A, DIXIT V M, POWER C. Fiery cell death: pyroptosis in the central nervous system[J]. Trends Neurosci, 2020, 43(1): 55-73. |
| [9] |
XU X B, LAI Y Y, HUA Z C. Apoptosis and apoptotic body: disease message and therapeutic target potentials[J]. Biosci Rep, 2019, 39(1): BSR20180992. |
| [10] |
KACZANOWSKI S. Apoptosis: its origin, history, maintenance and the medical implications for cancer and aging[J]. Phys Biol, 2016, 13(3): 031001. |
| [11] |
王小燕, 肖宗懿, 易寒, 等. 氧糖剥夺/恢复对A549肺泡上皮细胞焦亡的影响[J]. 中国细胞生物学学报, 2020, 42(11): 1969-1974. WANG X Y, XIAO Z Y, YI H, et al. Effects of oxygen-glucose deprivation/recovery on pyroptosis of A549 alveolar epithelial cells[J]. Chin J Cell Biol, 2020, 42(11): 1969-1974. |
| [12] |
MAN S M, KARKI R, KANNEGANTI T D. Molecular mechanisms and functions of pyroptosis, inflammatory caspases and inflammasomes in infectious diseases[J]. Immunol Rev, 2017, 277(1): 61-75. |
| [13] |
MAHIB M R, HOSOJIMA S, KUSHIYAMA H, et al. Caspase-7 mediates caspase-1-induced apoptosis independently of bid[J]. Microbiol Immunol, 2020, 64(2): 143-152. |
| [14] |
RIGO A, FERRARINI I, LORENZETTO E, et al. BID and the α-bisabolol-triggered cell death program: converging on mitochondria and lysosomes[J]. Cell Death Dis, 2019, 10(12): 889. |
| [15] |
ORNING P, LIEN E, FITZGERALD K A. Gasdermins and their role in immunity and inflammation[J]. J Exp Med, 2019, 216(11): 2453-2465. |
| [16] |
RUAN J W, WANG S J, WANG J B. Mechanism and regulation of pyroptosis-mediated in cancer cell death[J]. Chem Biol Interact, 2020, 323: 109052. |
| [17] |
WANG Y P, GAO W Q, SHI X Y, et al. Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a gasdermin[J]. Nature, 2017, 547(7661): 99-103. |
| [18] |
ALI A, CYPEL M. Commentary: To Die or not to Die-rescuing lung cells from ischemia-reperfusion injury[J]. J Thorac Cardiovasc Surg, 2022, 163(2): e123-e124. |
| [19] |
LAGIER D, FISCHER F, FORNIER W, et al. Effect of open-lung vs conventional perioperative ventilation strategies on postoperative pulmonary complications after on-pump cardiac surgery: the PROVECS randomized clinical trial[J]. Intens Care Med, 2019, 45(10): 1401-1412. |




