创伤、感染、肿瘤、骨溶解以及各种先天性疾病是造成髋臼骨缺损的主要原因[1],而相应的髋臼骨缺损重建是人工全髋关节置换术时面临的难题。合适的材料选择和假体制备是手术成功的关键。钽金属具有良好的生物相容性和优异的力学性能,是一种理想的骨替代修复材料。通过调节多孔结构的设计参数可以制备弹性模量介于松质骨和皮质骨之间的植入假体,避免应力遮挡。高摩擦系数,可提高植入体的初期稳定性,而通过仿骨小梁结构设计可诱导新生骨组织长入[2]。目前临床上多采用Zimmer公司气相沉积工艺制造的多孔钽金属骨缺损假体,虽然已在临床应用二十多年,但存在相应假体的形状难以与骨缺损形状匹配、术中使用骨锉修型时产生更多的骨量丢失以及感染风险等一系列问题[1]。3D打印能很好地成型复杂的几何形状,且在真空环境下采用电子束作为能量源制备多孔假体具有成形效率高、避免气体氧化和杂质污染等优势[3]。本团队在“十三五”国家重点研发计划增材制造专项的资助下,开发了自主知识产权的电子束选区融化(SEBM)增材制造装备(Y150型),并利用该装备成功制备了多孔钽金属髋臼骨缺损假体。本院关节外科在2018年6-12月采用该多孔钽金属假体修复了4例Paprosky ⅡB型髋臼骨缺损的患者,并进行术后随访,观察短期临床效果,现报告如下。
1 资料与方法 1.1 纳入与排除标准纳入标准:①年龄≥18岁,性别不限;②有终末期髋关节疾病需要施行人工髋关节置换术且伴有Paprosky ⅡB型髋臼骨缺损的患者;③患者及家属签署知情同意书,同意参加临床试验。
排除标准:①伴有活动性感染、严重凝血功能障碍不适宜手术者;②心肺功能较差不能耐受手术者;③钽金属过敏者;④患恶性肿瘤等疾病可能影响术后随访;⑤神经肌肉功能不全,会导致术后髋关节不稳定或步态异常者。
1.2 一般资料采用纳排标准筛选2018年6-12月收治的4例Paprosky ⅡB型髋臼骨缺损的患者。入组的4例患者分别表示为A、B、C、D。相关信息如年龄、性别、骨缺损分型、症状、病程等见表 1。临床试验方案通过陆军军医大学第一附属医院伦理委员会审核批准(批准号KY201908),所有临床试验方案符合伦理学规范。
| 患者 | 年龄/岁 | 性别 | 骨缺损分型 | 症状 | 病程/年 |
| A | 40 | 女 | Paprosky ⅡB型 | 疼痛和功能障碍 | 33 |
| B | 46 | 女 | Paprosky ⅡB型 | 疼痛 | 10 |
| C | 53 | 女 | Paprosky ⅡB型 | 疼痛和功能障碍 | 2 |
| D | 41 | 男 | Paprosky ⅡB型 | 疼痛和功能障碍 | 20 |
1.3 髋臼骨缺损假体设计与制造技术 1.3.1 影像检查及三维重建
入组患者接受X线(德国西门子数字化Axiom Aristos VX Plus设备)在站立位拍摄,X线正位片见图 1。
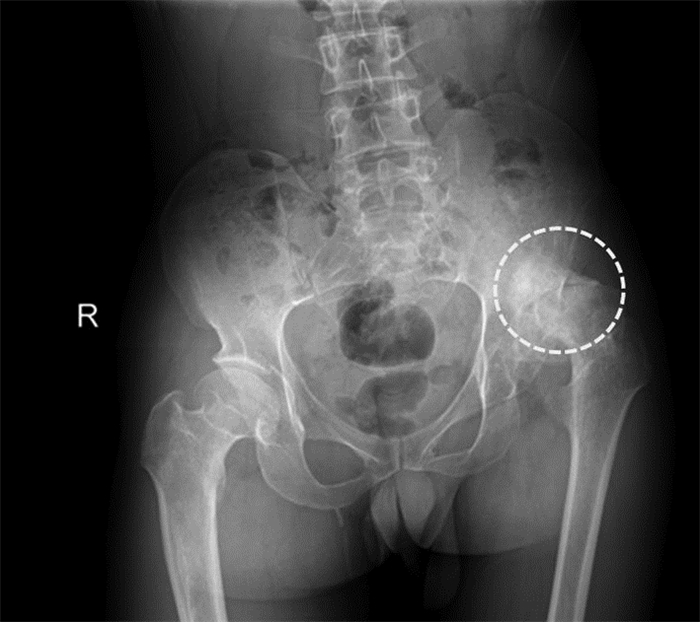
|
| 图 1 髋臼骨缺损患者术前X线正位片 |
使用(德国西门子的SOMATOM Definition)CT扫描设备在患者平躺状态下扫描全骨盆至股骨远端20.0 cm,扫描参数为球管电压120 kV、电流200 mA、层间距1.0 mm、层厚1.0 mm。所有的影像学数据通过INFINITT软件转成DICOM格式,使用U盘存储备用。将患者薄层扫描数据以CT影像DICOM格式导入Mimics Innovation Suite 19.0软件,通过阈值划分、动态分割生成左右侧骨盆、骶骨和左右侧股骨的三维图像,其髋臼骨缺损情况如图 2,同时将其以STL格式导出备用。
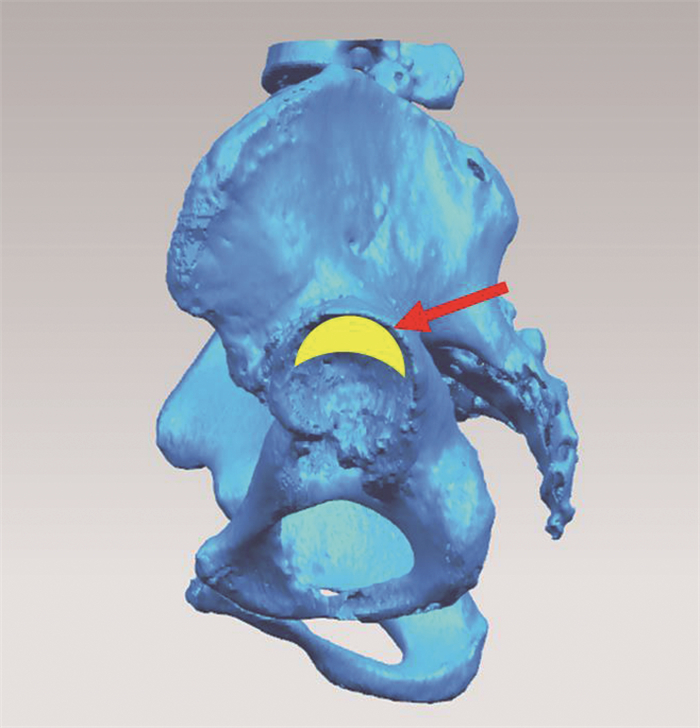
|
| 箭头示需重建的骨缺损区域 图 2 髋臼骨缺损矢状位视图 |
1.3.2 髋臼骨缺损假体的设计
将骨盆及左右侧股骨STL数据导入UG NX 11.0中,模拟人处于站立位转台,将骨盆正置,在真臼位置模拟髋臼杯放置位置,髋臼后外侧显露出骨缺损。根据骨缺损的区域设计出与骨盆完全匹配的月牙状骨缺损假体,见图 3。在骨缺损假体上设计3个用于固定的螺钉孔,孔径为5.0 mm。人体松质骨弹性模量0.1~1.5 GPa,皮质骨弹性模量12~18 GPa,为避免应力遮挡,应将髋臼骨缺损假体设计为多孔结构(孔径0.35 mm、丝径0.70 mm、孔隙率75%),将弹性模量降至3 GPa左右,界于皮质骨和松质骨弹性模量之间[4]。多孔结构有助于骨细胞的黏附和生长[5]。螺钉孔外扩1.5 mm实体结构,以保证植入螺钉时骨缺损假体不会碎裂。
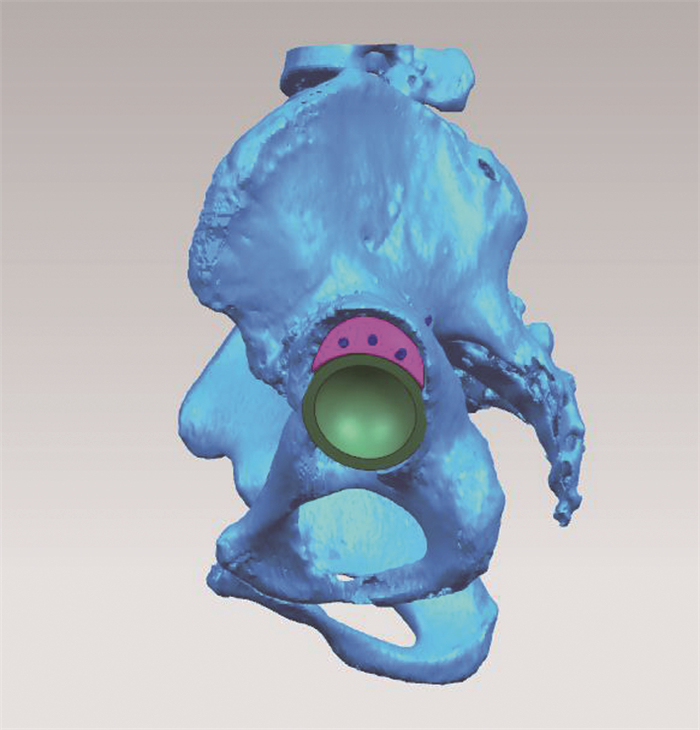
|
| 图 3 设计的髋臼骨缺损假体 |
1.3.3 髋臼骨缺损多孔钽金属假体制备
目前国内外学者制备多孔钽金属假体的主要方法有:气相沉积法[6]、有机泡沫浸渍法[7]、粉末烧结法[8]和激光快速成形[9]等,本团队采用电子束选区融化增材制造设备(Sailong-Y150)成形多孔钽骨缺损假体,设备参数见表 2。通过逐层打印、层层堆积的方式,将多孔钽打印成形。成形后的多孔钽在真空环境中缓慢冷却,待零件冷却至室温后出炉,将成形底板上的粉块转移至粉末回收系统中,用夹杂着钽粉的高压气体吹多孔钽骨缺损假体,以去除多孔钽零件表面及内部未熔化的金属钽粉末,使用专用工具去除支撑结构后,置入超声波清洗机中清洗取出,见图 4。
| 项目 | 设备参数 |
| 外形尺寸 | 2000 mm×1200 mm×2150 mm |
| 成形仓尺寸 | 200 mm×200 mm×300 mm |
| 最大成形尺寸 | 150 mm×150 mm×200 mm |
| 铺粉厚度 | 35~200 μm |
| 电子束束斑直径 | ≤0.2 mm |
| 成形零件尺寸精度 | ±0.3 mm |
| 设备极限真空 | ≤9.5×10-4 Pa |

|
| 图 4 3D打印多孔钽髋臼骨缺损假体 |
1.4 手术方法
术前行常规双髋正、侧位的X线片及CT检查,并进行常规胸片、血常规、生化、心电图、凝血功能、心肺功能等检查,评估患者的重要脏器功能。术中采用腰硬联合阻滞麻醉,患者取侧卧位,常规消毒铺单,作患部后外侧切口长约15 cm,依次切开皮肤、皮下组织,分离肌肉后显露大粗隆,露出真臼。对照术前计划,使用克氏针定位真臼磨挫点,透视定位确认真臼位置,使用小号锉小心磨锉髋臼至适当髋臼杯型号,脉冲冲洗器反复冲洗髋臼骨床,保持前倾15°,外翻45°置入适当髋臼杯,臼杯稳定,植入两颗松质骨螺钉。将3D打印钽金属骨缺损假体置于髋臼顶部(图 5),多孔钽金属假体与髋臼之间植入松质骨,3D打印钽金属骨缺损假体的螺钉孔钻入克氏针2枚,调整位置可后,拧入松质骨螺钉3颗。修整股骨髓腔入口,钻入3 mm克氏针1枚,透视定位可见导针位于髓腔内部,沿克氏针方向开髓腔,逐级扩大髓腔钻直径至适当股骨柄型号,透视可见试模位置良好,随后植入股骨柄假体。观察髋关节置换假体及骨缺损假体,位置可。脉冲冲洗器反复冲洗伤口,清点纱布器械无误后放置负压引流管1根,于关节腔内部置入稳可信2 g,紧密缝合关闭阔筋膜及臀肌筋膜,逐层缝合皮下、皮肤。无菌敷料及弹力绷带加压包扎。术后给予药物镇痛和抗感染治疗,打开引流管阀门后无明显血性液体渗出后,随拔掉引流管。叮嘱患者加强功能锻炼,及早下地行走预防深静脉血栓。
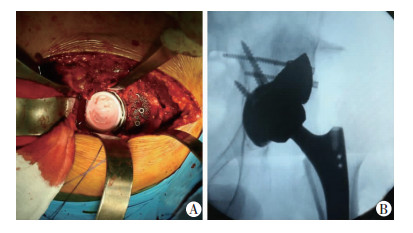
|
| A:术中假体植入;B: 术中C臂片 图 5 植入3D打印多孔钽髋臼骨缺损假体 |
1.5 随访及评价指标 1.5.1 髋关节功能评价
Harris髋关节评分,满分100分,90分以上为优良,80~89分为较好,70~79分为可,小于70分为差。
1.5.2 生活质量改善评价术前术后记录患者髋关节疼痛视觉模拟量表(visual analog scale, VAS)评分,分值区间为0~10分,分值越低代表疼痛程度越轻。SF-36生活质量评分,由8个维度组成(生理机能、生理职能、躯体疼痛、一般健康状况、活力、社会功能、情感职能、精神健康)共计36个条目组成,评分采用累加法,分值越高,代表生活质量越高。
1.5.3 影像学评估术后及随访时行站立位髋关节正侧位X线检查,观察3D打印钽金属骨缺损假体和髋关节置换假体之间是否出现透亮线、移位、无菌性松动、骨溶解以及与骨界面骨长入的情况。
2 结果 2.1 髋关节功能改善情况患者均获有效随访,随访(22.5±3.5)个月。4例患者术前Harris评分为(64.5±12.1),末次随访时Harris评分为(86.2±0.3)。与术前相比,关节活动功能明显改善。
2.2 生活质量改善情况末次随访时进行VAS评分和SF-36评分,4例患者术前VAS评分为(7.5±0.7),末次随访时VAS评分为(2.5±0.7)。4例患者术前SF-36评分为(39.3±6.3),术后末次随访时SF-36评分为(81.6±3.8),与术前相比,生活质量有明显改善。
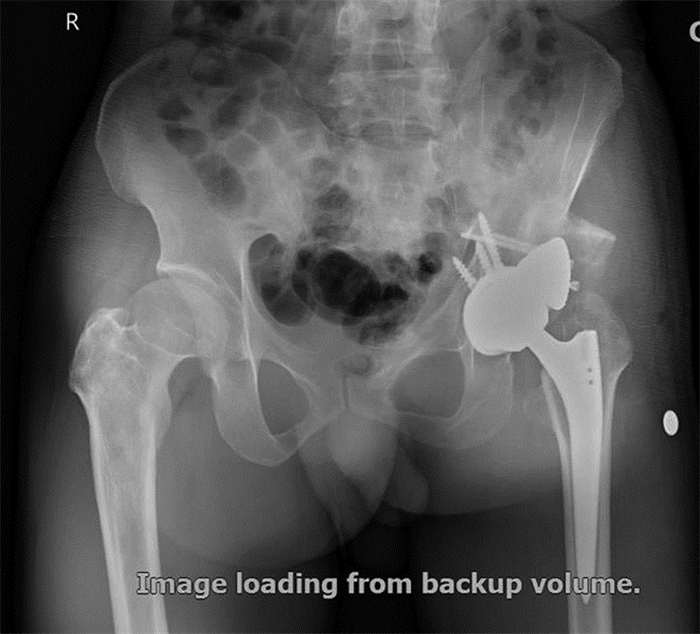
2.3 影像学评估术后及随访时未发现手术部位肿胀、感染及术后并发症。末次随访时行X线正侧位检查,未发现3D打印钽金属骨缺损假体和髋关节置换假体周边出现透亮线、松动、骨溶解等不良情况,末次随访X线正位片如图 6。
|
| 图 6 3D打印多孔钽金属假体重建髋臼骨缺损患者末次随访X线正位片 |
3 讨论 3.1 3D打印髋臼骨缺损金属假体是未来发展趋势
髋臼骨缺损的重建是进行人工全髋关节置换术时常遇到的难题[10],常见于全髋关节翻修术。重建髋臼骨缺损的常用方法有颗粒骨打压植骨、结构性植骨及金属垫块填充等[11],但上述方法都不能精准匹配髋臼骨缺损形状,术中需使用骨锉刀对宿主骨进行修型,从而增加了手术时间、手术难度和风险。由于3D打印能够1 ∶1成型髋臼骨缺损形状,很好地解决了骨缺损外形匹配的难题。髋臼骨缺损假体的内部空间结构采用仿骨小梁结构的十二面体填充,设计其孔径大小为400~600 μm,孔隙率为75%~85%,最终弹性模量介于皮质骨(12~18 GPa)和松质骨(0.1~1.5 GPa)之间,在既保证力学强度的同时又可以避免应力遮挡,同时增加与宿主骨表面接触面积,提升了初始稳定性[12]。因3D打印髋臼骨缺损假体是在术前一体化成形,省去了在术中对骨缺损形态进行修形和组配金属垫块的时间,从而减少了麻醉时间、手术时间、术中出血量以及术后并发症发生的可能。基于3D打印具有自由成形的特点,理论上可应用于任何类型的髋臼骨缺损假体成形。21世纪是个性化医疗时代,3D打印作为实现个性化医疗的重要手段,已成为医学界和工程界共同关注和研究的热点,3D打印制备髋臼骨缺损假体势在必行。
3.2 钽金属具有优异的理化性质和生物相容性如何选择骨缺损修复材料是临床治疗首要考虑因素。以往研究发现骨水泥填充骨缺损的病例,中远期随访失败率较高[13]。自体骨移植存在供区骨量有限,且术后骨缺损供区易出现感染、疼痛、血肿和疤痕等并发症[14]。异体骨移植存在诱发宿主免疫反应的问题,可导致移植骨的过度吸收或骨不连、骨折和深部感染等,影响治疗效果[15]。3D打印技术制备多孔钛植入体重建骨缺损,近几年逐渐被应用到医疗领域。唐成等[16]采用3D打印个性化多孔钛金属支架重建12例患者的髋臼骨缺损,术后1年复查,髋关节影像显示:关节假体位置良好、关节力线恢复满意,髋臼骨缺损区与金属支架之间紧密接触、无松动。但钛合金植入体长期处于人体电解质中会释放出毒性元素钒,可能引起骨软化和神经紊乱等症状[17]。因此需要选用生物相容性更佳的金属材料用于骨缺损修复。
钽金属由于其稳定的理化性质、优良的生物力学性质[18]以及良好生物整合能力被广泛应用于组织缺损的重建[19-20]。在临床研究中,CASSAR-GHEITI等[21]在全髋关节翻修术中,使用多孔钽重建髋臼上外侧缺损,获得了很好的生存率,并取得良好的中期随访效果。同时钽植入体具有更低的感染率,SCHILDHAUER等[22]评估了细菌对钽棒的黏附性,结果发现金黄色葡萄球菌对钽棒的黏附性明显低于钛合金。MIETTINEN等[23]回顾性分析多孔钽髋臼假体在髋关节翻修术后13.4年的有效率,结果表明累计有效率为98.9%。相对于松质骨和皮质骨,多孔钽的摩擦系数分别为0.8和0.74,比其他金属植入材料的摩擦系数高40%~80%,十分有利于术后的早期稳定。因此,选用钽金属作为重建骨缺损材料更佳,既符合临床需求,又保证髋臼骨缺损假体生存率及临床疗效。
3.3 医工交互实现个性化髋臼骨缺损假体的设计与制备3D打印髋臼骨缺损假体作为交叉学科的产物,设计与制备髋臼骨缺损假体涉及大量的医工交互环节,如何保证设计与制备的髋臼骨缺损假体满足临床的需求是工程师和医师面临的共同难题。
由于工程师与医师的知识背景不同,在进行3D打印髋臼骨缺损假体的设计与制备时,需要工程思维和医学思维进行不断的交互,达到认知的统一性。因此需将具有丰富临床经验的医师和工程师整合到一个平台,共同搭建“产、学、研、医”一体化的“医工交叉、协同创新”平台,推进3D打印多孔钽髋臼骨缺损技术临床转化应用。
3.4 电子束选区融化增材制造装备制备钽金属假体更具优势目前能够实现钽金属假体3D打印的有激光和电子束增材制造装备。电子束增材制造装备的能量密度和成形效率均高于激光,激光成形时需充入保护气体,使得打印时钽金属假体易被保护气体污染,且成形后应力相对于电子束成形较高,后期需进行热处理,增加了工序及时间成本。虽然电子束增材装备光斑直径大于激光束,使得其成形精度低于激光,但0.3 mm的成形精度已满足手术的要求,见表 3。因此,本团队提出使用电子束增材制造装备制备多孔钽植入假体,并成功研发出粉床电子束增材制造装备,于2018年4月19日成功实施首例多孔钽假体植入合并左侧人工全膝关节翻修术,为后续3D打印骨缺损假体的制备及临床试用奠定了基础。
| 参数类型 | 激光增材制造装备 | 电子束增材装备 |
| 热源 | 激光 | 电子束 |
| 能量密度 | 104 W/mm2 | 109 W/mm2 |
| 成形精度 | ±0.05 mm | ±0.3 mm |
| 成形效率 | 5~20 cm3/h | >50 cm3/h |
| 成形气氛 | 保护气体 | 真空 |
| 成形应力 | 高 | 低 |
| 后处理 | 线切割、热处理 | 无 |
综上,本研究采用粉床电子束增材制造装备成功制备了多孔钽金属髋臼骨缺损假体,并用于4例全髋关节置换Paprosky ⅡB型骨缺损修复,短期具有良好的临床疗效,显著减轻患者疼痛,改善髋关节功能并提升了生活质量。
利益冲突声明 所有作者声明在项目实施和文章撰写过程中,不存在利益冲突
| [1] |
毛克亚, 刘建恒, 崔翔. 骨组织工程材料在大段骨缺损修复中的应用进展[J]. 武警医学, 2020, 31(4): 277-280, 283. MAO K Y, LIU J H, CUI X. Application of bone tissue engineering materials in the repair of large bone defects[J]. Med J Chin PAPF, 2020, 31(4): 277-280, 283. |
| [2] |
赵德伟, 李军雷. 多孔Ta的制备及其作为骨植入材料的应用进展[J]. 金属学报, 2017, 53(10): 1303-1310. ZHAO D W, LI J L. Fabrication of the porous tantalum and its current status used as orthopedics implants materials[J]. Acta Metallurgica Sinica, 2017, 53(10): 1303-1310. |
| [3] |
李宏新, 周斌, 林峰. 电子束与激光复合选区熔化系统的开发[J]. 电加工与模具, 2018(S1): 59-63. LI H X, ZHOU B, LIN F. The development of electron beam and laser hybrid selective melting equipment[J]. Electr Mach Tool, 2018(S1): 59-63. |
| [4] |
杨坤, 汤慧萍, 王建, 等. 标准化和增材制造个性化多孔钽植入体的研究进展[J]. 热加工工艺, 2017, 46(22): 5-8, 12. YANG K, TANG H P, WANG J, et al. Research development of standardized and addtively manufactured custom-made porous tantalum implant[J]. Hot Working Technol, 2017, 46(22): 5-8, 12. |
| [5] |
BODHAK S, BOSE S, BANDYOPADHYAY A. Role of surface charge and wettability on early stage mineralization and bone cell-materials interactions of polarized hydroxyapatite[J]. Acta Biomater, 2009, 5(6): 2178-2188. |
| [6] |
LI X, WANG L, YU X M, et al. Tantalum coating on porous Ti6Al4V scaffold using chemical vapor deposition and preliminary biological evaluation[J]. Mater Sci Eng C Mater Biol Appl, 2013, 33(5): 2987-2994. |
| [7] |
刘培生, 崔光, 陈一鸣, 等. 有机泡沫浸浆烧结法制备宏观网状多孔钽: CN101660076A[P]. 2010-03-03. LIU P S, CUI G, CHEN Y M, et al. Macro mesh structural porous tantalum prepared by dipping and sintering organic foams: CN101660076A[P]. 2010-03-03. |
| [8] |
阮建明, 叶雷, 谢健全, 等. 医用金属植入材料多孔钽及其制备方法: CN102205144A[P]. 2011-10-05. RUAN J M, YE L, XIE J Q, et al. Porous tantalum serving as medical metal implanted material and preparation method thereof: CN102205144A[P]. 2011-10-05. |
| [9] |
李洋. 激光增材制造(3D打印)制备生物医用多孔金属工艺及组织性能研究[D]. 苏州: 苏州大学, 2015. LI Y. Study on the process and properties of porous metal prepared by laser additive manufacturing(3D printing)[D]. Suzhou: Soochow University, 2015. |
| [10] |
翁习生. 人工髋关节翻修术中髋臼骨缺损的重建方法[J]. 中华骨与关节外科杂志, 2022, 15(1): 10-18. WENG X S. Surgical techniques for acetabular defect reconstruction in revision total hip arthroplasty[J]. Chin J Bone Joint Surg, 2022, 15(1): 10-18. |
| [11] |
孙京涛, 蔡松涛, 王少华, 等. 3D打印金属垫块修复髋臼骨缺损在全髋关节置换术中的应用[J]. 中医正骨, 2020, 32(7): 41-42, 46. SUN J T, CAI S T, WANG S H, et al. Application of 3D-printed metal block to repair acetabular bone defects in total hip arthroplasty[J]. J Tradit Chin Orthop Traumatol, 2020, 32(7): 41-42, 46. |
| [12] |
赵敏超, 黄燕, 袁伟健, 等. 3D打印金属内植物在骨科的应用特点[J]. 中国组织工程研究, 2018, 22(31): 5027-5033. ZHAO M C, HUANG Y, YUAN W J, et al. Application of three-dimensional printing metal implants in orthopedics[J]. Chin J Tissue Eng Res, 2018, 22(31): 5027-5033. |
| [13] |
PAGNANO W, HANSSEN A D, LEWALLEN D G, et al. The effect of superior placement of the acetabular component on the rate of loosening after total hip arthroplasty[J]. J Bone Joint Surg Am, 1996, 78(7): 1004-1014. |
| [14] |
王兴, 刘洪臣. 自体骨移植修复种植位点骨缺损的研究进展[J]. 口腔颌面修复学杂志, 2016, 17(1): 49-52. WANG X, LIU H C. Research progress of autologous bone transplantation in repair of bone defects at implant sites[J]. Chin J Prosthodont, 2016, 17(1): 49-52. |
| [15] |
钟招明, 韩智敏, 修虎, 等. 同种异体骨移植的免疫反应及处理方法[J]. 江西医学院学报, 2003, 43(6): 146-149. ZHONG Z M, HAN Z M, XIU H, et al. Immune response and treatment of allogeneic bone transplantation[J]. Acta Acad Med Jiangxi, 2003, 43(6): 146-149. |
| [16] |
唐成, 李旭祥, 凌辰, 等. 3D打印个性化多孔钛金属支架重建髋臼骨缺损的中期疗效评估[J]. 南京医科大学学报(自然科学版), 2019, 39(12): 1774-1778. TANG C, LI X X, LING C, et al. The medium-term outcomes of 3D printed customized porous titanium acetabular prosthesis replacement for acetabular bone defection[J]. J Nanjing Med Univ(Nat Sci), 2019, 39(12): 1774-1778. |
| [17] |
张玉梅. 钛及钛合金在口腔科应用的研究方向[J]. 生物医学工程学杂志, 2000, 7(2): 206-208, 217. ZHANG Y M. The researches on titanium and titanium alloy in dental use[J]. J Biomed Eng, 2000, 7(2): 206-208, 217. |
| [18] |
LIU Y, BAO C, WISMEIJER D, et al. The physicochemical/biological properties of porous tantalum and the potential surface modification techniques to improve its clinical application in dental implantology[J]. Mater Sci Eng C, 2015, 49: 323-329. |
| [19] |
SAMBAZIOTIS C, LOVY A J, KOLLER K E, et al. Histologic retrieval analysis of a porous tantalum metal implant in an infected primary total knee arthroplasty[J]. J Arthroplasty, 2012, 27(7): 1413. |
| [20] |
BALLA V K, BODHAK S, BOSE S, et al. Porous tantalum structures for bone implants: fabrication, mechanical and in vitro biological properties[J]. Acta Biomater, 2010, 6(8): 3349-3359. |
| [21] |
CASSAR-GHEITI A J, MEI X Y, AFENU E A, et al. Midterm outcomes after reconstruction of superolateral acetabular defects using flying buttress porous tantalum augments during revision total hip arthroplasty[J]. J Arthroplasty, 2021, 36(8): 2936-2941. |
| [22] |
SCHILDHAUER T A, ROBIE B, MUHR G, et al. Bacterial adherence to tantalum versus commonly used orthopedic metallic implant materials[J]. J Orthop Trauma, 2006, 20(7): 476-484. |
| [23] |
MIETTINEN H J, MIETTINEN S S, KETTUNEN J S, et al. Revision hip arthroplasty using a porous tantalum acetabular component[J]. HIP Int, 2021, 31(6): 782-788. |




