2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系:毒理学研究所;
3. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系:军队环境卫生学教研室
2. Institute of Toxicology, College of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China;
3. Department of Environmental Health, College of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
乳腺癌是全球女性发病率最高的癌症,也是全球女性癌症相关死亡的主要原因[1]。据统计[2],2021年美国有284 00例新增乳腺癌病例,占新发癌症病例总数的30%;大约有44 30名患者死亡,占所有癌症相关死亡人数的15%。尽管研究者已努力地研究乳腺癌的肿瘤生物学,探索了越来越多的乳腺癌生物标志物和潜在治疗靶点,但是对乳腺癌恶性进展和转移的分子机制仍然知之甚少[3-4]。因此,仍然需要进一步探索新的生物标志物和乳腺癌发生发展的潜在机制。
跨膜蛋白196(transmembrane protein 196,TMEM196)位于人类染色体7p21.1,编码一个跨膜蛋白,包含172个氨基酸和4个跨膜区域。TMEM196属于跨膜蛋白家族成员,后者在基本生理过程中起关键作用,包括细胞的分化、迁移、黏附、聚集、溶解和信号转导调节[5-7]。既往研究发现,TMEM196在肺癌中的表达水平降低,而甲基化水平升高,并且其高甲基化和肺癌患者较差的存活率有关[8]。然而,截至目前,尚没有关于TMEM196在乳腺癌中的作用研究,因此,本研究旨在通过实验方法初步探讨其在乳腺癌中的生物学作用。
1 材料与方法 1.1 主要试剂DMEM及RPMI 1640培养基购自HyClone公司,胎牛血清和Opti-MEM培养基购自Gibco公司,ViaFectTM转染试剂和CellTiter 96© Aqueous细胞增殖检测试剂购自Promega公司,PrimeScriptTM反转录试剂盒和2×Taq Master Mix购自TaKaRa公司,G418、RIPA裂解液、BCA试剂盒和SDS-PAGE凝胶购自Solarbio公司,兔来源GAPDH抗体、β-catenin抗体和MMP7抗体购自Cell Signaling Technology公司,兔来源TMEM196抗体购自Santa Cruz公司。
1.2 细胞培养人乳腺癌细胞系(MDA-MB-231、MCF-7和BT474)购自中国科学院细胞库,用含10%胎牛血清的DMEM培养基和RPMI 1640培养基常规置于37℃、5%CO2培养箱中培养。
1.3 免疫组织化学染色采用的组织芯片购自上海芯超生物科技有限公司(序列号:HBre-Duc170Sur-01),共包含160个乳腺癌样本和70个癌旁样本,160例住院病例均为女性患者,年龄(53.61±13.13)岁,入院诊断均为“浸润性乳腺癌”,这些病例在2001年1月至2004年8月接受手术切除,随访2~150个月,在研究前已获得所有患者的书面知情同意书,本研究获得上海芯超生物科技有限公司伦理委员会的批准(SHYJS-CP-1804021)。免疫组化结果由2名病理学家(设盲)独立阅读和解释,根据显色细胞比例,评分标准:阴性为0分;阳性率 < 25%为1分;阳性率25%~ < 50%为2分;阳性率50%~ < 75%为3分;阳性率75%~100%为4分。根据细胞的染色程度,无染色为0分,浅黄色为1分,棕黄色为2分,棕色为3分。将两项指标(染色强度和阳性染色细胞数)相乘,得到免疫组化评分;评分>6则认为TMEM196高表达。
1.4 RNA提取和实时定量-聚合酶链反应(quantitative real time-polymerase chain reaction,RT-qPCR)根据TRIzol试剂说明书从细胞中分离并提取总RNA,使用PrimeScriptTM反转录试剂盒从2 μg总RNA中合成cDNA,通过带有SYBR荧光标记的2×Taq Master Mix进行RT-qPCR反应体系的配置,使用2-ΔΔCt方法计算不同样品之间mRNA的相对表达水平,GAPDH为内参照,每组设置3个复孔。GAPDH正向引物5′-AATGGGCAGCCGTTAGGAAA-3′,反向引物5′-GCCCAATACGACCAAATCAGAG-3′;TMEM196正向引物5′-ATGACCGAGGAAGGATGTGC-3′,反向引物5′-GCCACAAAGAAGAAACGGGG-3′。
1.5 细胞转染将乳腺癌细胞以合适的数量接种至培养皿中,待细胞长至70%~80%,使用ViaFectTM转染试剂盒转染带有绿色荧光标记的TMEM196过表达或干扰质粒,转染体系如下:转染试剂4.5 μL:质粒1.5 μg:Opti-MEM100 μL,48 h后用荧光显微镜观察转染情况,按照合适的浓度加入G418或杀稻瘟菌素筛选稳定转染的细胞14 d,挑选稳定克隆,扩大培养,构建稳定差异表达TMEM196的乳腺癌细胞模型。
1.6 细胞增殖实验将乳腺癌细胞以5 000/孔接种到96孔板中,培养24 h后,用过表达或干扰TMEM196表达质粒转染细胞,使用CellTiter 96© Aqueous细胞增殖检测试剂分别在0、24、48和72 h测量490 nm处的光密度值[D(490)],实验分组:在过表达细胞模型中,Vector组为对照组,TMEM196组为处理组;在干扰细胞模型中,Control组为对照组,Sh-3和Sh-4为处理组。实验至少重复3次。
1.7 细胞划痕实验将稳定转染的细胞以30×104/孔接种于6孔板中,培养至单层汇合状态,融合度>90%,在6孔板背面做“井”字标记,用移液枪头垂直均匀划开单层细胞,分别在0、24和48 h对细胞拍照,选取视野内3个固定位置拍照记录,实验分组同前。
1.8 Transwell实验分别使用涂有或没有基质胶混合物的Transwell小室来评估细胞侵袭和迁移情况。将稳定转染细胞以3×104/孔接种于无血清培养基的上室,下室使用含10% FBS的培养基作为趋化剂。孵育24 h后,将位于室底部的细胞用4%多聚甲醛固定15 min,0.1%的结晶紫染色15 min,显微镜下拍照,每孔随机选择3个区域对侵袭或迁移的细胞进行计数,实验分组同前。
1.9 Western blot检测常规方法于冰上裂解并提取细胞总蛋白,BCA法测定蛋白浓度,蛋白质定量40 μg/孔,在12%的SDS-PAGE中电泳1.5 h,随后将蛋白转移到PVDF膜上,在室温下用5%脱脂牛奶封闭1 h后,分别加入GAPDH抗体(1∶1 000)、TMEM196抗体(1∶1 000)、β-catenin(1∶1 000)抗体和MMP7(1∶1 000)抗体并在4 ℃下孵育过夜,次日将膜与二抗在室温下继续孵育1 h后,用TBST洗膜3次,然后显影曝光。
1.10 生物信息学分析TMEM196的mRNA表达通过癌症基因组图谱(The Cancer Genome Atlas,TCGA,https://www.cancer.gov/)数据库进行分析,预后分析通过Kaplan-Meier数据库(http://kmplot.com/)进行。
1.11 统计学分析采用SPSS 21.0 (SPSS Inc.,Chicago,IL,USA) 统计软件进行分析,计量资料以x±s表示,配对样本采用Student t检验,独立样本采用Mann-Whitney U检验;两组间生存率的比较采用对数秩检验(Log-rank test)。采用双侧检验,P < 0.05表示差异具有统计学意义。
2 结果 2.1 TMEM196在乳腺癌中的表达通过TCGA数据库分析发现,TMEM196在乳腺癌组织中表达降低(P < 0.05,图 1A);RT-qPCR检测TMEM196在乳腺癌细胞系中的表达,结果发现TMEM196在MDA-MB-231和MCF-7细胞中表达下调(P < 0.05,图 1B),而在BT474细胞中的表达和正常乳腺细胞没有明显差异。
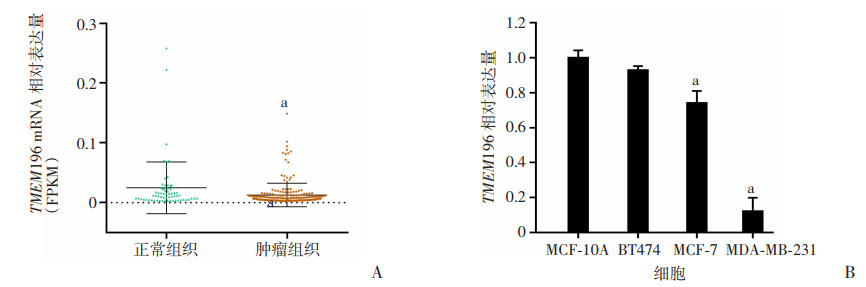
|
| A: TCGA数据库分析TMEM196在正常组织和乳腺癌组织中的mRNA水平差异 a:P < 0.05,与正常组织比较;B:RT-qPCR验证TMEM196在正常乳腺和乳腺癌细胞之间的表达差异 a:P < 0.05,与MCF-10A比较 图 1 TMEM196在乳腺癌中的表达情况分析(n=3,x±s) |
2.2 TMEM196在乳腺癌中的预后作用
通过Kaplan-Meier数据库分析TMEM196在乳腺癌中的预后作用。结果显示,高表达的TMEM196和较好的总体生存率(overall survival,OS)有关(HR=0.720,95%CI: 0.523~0.992,P=0.045,图 2A);TMEM196和乳腺癌患者的无复发生存率(relapse-free survival,RFS)也有较好的相关性(HR=0.643,95%CI: 0.541~0.764,P < 0.001,图 2B)。利用Kaplan-Meier数据库进一步分析发现,在4种乳腺癌亚型中,高表达TMEM196均和RFS呈显著正相关(HR=0.483、0.618、0.662、0.701,95%CI: 0.321~0.728、0.475~0.805、0.459~0.955、0.508~0.966,P < 0.05,图 2C~F)。
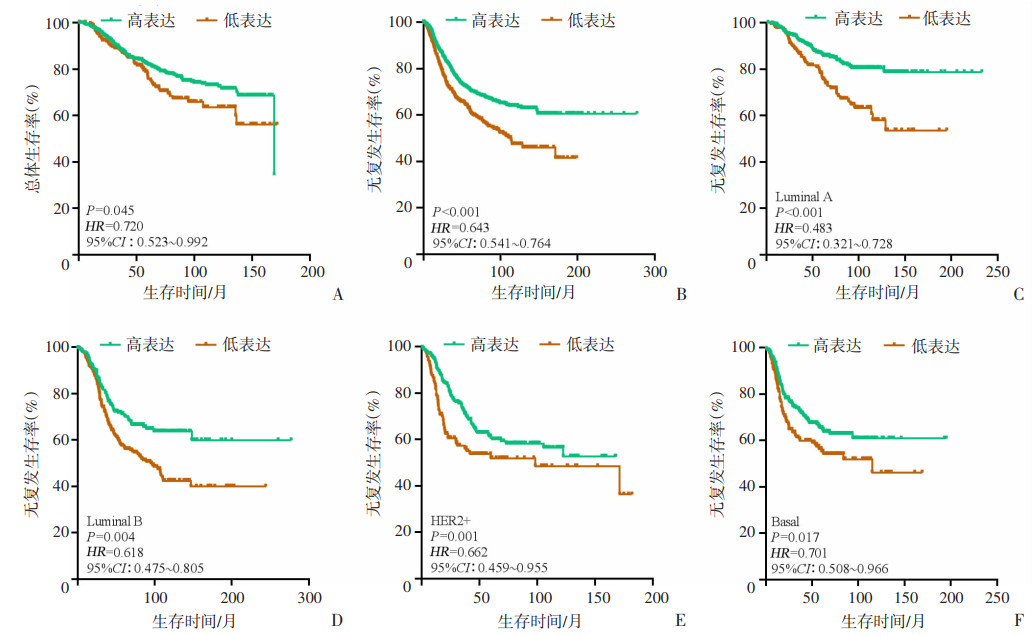
|
| A:总体生存率;B:无复发生存率;C~F分别为TMEM196在乳腺癌Luminal A、Luminal B、HER2+和Basal 4个亚型中不同表达的患者无复发生存率 图 2 Kaplan-Meier数据库分析TMEM196在乳腺癌中的预后情况 |
2.3 组织芯片验证TMEM196蛋白在乳腺癌中的表达及预后作用
免疫组化分析结果显示,TMEM196在细胞质中表达,棕黄色为阳性。TMEM196在正常乳腺组织中呈现相对高表达,而在配对的癌组织中相对低表达。3例癌组织的病理类型均为浸润性导管癌(图 3A),分子亚型分别为HER2过表达型乳腺癌(HER2+)、三阴型乳腺癌(triple negative breast cancer,TNBC)和Luminal型乳腺癌。统计染色情况后发现,TMEM196在乳腺癌组织中的蛋白水平降低(P=0.002,图 3B),进一步分析高/低表达样本的比例发现,正常组织高表达样本比例为62.9%(44/70),而癌组织中仅为43.1%(69/160)。根据中国临床肿瘤学会(Chinese society of clinical oncology,CSCO)乳腺癌诊疗指南2021版,将160例乳腺癌样本按照雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)的表达情况进行分类:Luminal型(ER/PR>1%且HER2阴性);HER2+型(荧光原位杂交显示HER2阳性);TNBC(ER、PR、HER2均为阴性),最终得到81例Luminal型乳腺癌,47例HER2+型乳腺癌,32例TNBC。分析3组的TMEM196蛋白表达情况发现,TMEM196在Luminal型最高、HER2+次之、TNBC组最低(P=0.028,图 3C)。结合临床信息进行生存分析,TMEM196低表达患者的OS明显低于TMEM196高表达患者(HR=0.524,95%CI: 0.293~0.936,P=0.040,图 3D)。在不同分子亚型中进行生存分析发现,高表达的TMEM196在不同亚型中显示较高的OS,在HER2+组中差异具有统计学意义(HR=0.232,95%CI: 0.067~0.801,P=0.043,图 3E~G)。

|
|
a:P < 0.05,与正常组比较;b:P < 0.05,与Luminal组比较 A:TMEM196在乳腺正常组织和乳腺癌组织中的染色情况对比;B:TMEM196蛋白在乳腺正常组织和乳腺癌组织中的表达情况;C:TMEM196蛋白在乳腺癌Luminal型、HER2+型和TNBC中的表达比较;D:TMEM196蛋白在160例患者中不同表达的OS;E-G:TMEM196蛋白在乳腺癌Luminal型、HER2+型和TNBC中不同表达的OS 图 3 通过组织芯片分析TMEM196蛋白在乳腺癌患者中的表达和预后 |
2.4 过表达TMEM196对乳腺癌细胞功能的影响
为探讨TMEM196在肿瘤发生中的潜在作用,将TMEM196过表达质粒转染到低表达TMEM196的MDA-MB-231和MCF-7细胞系中,建立了稳定差异表达TMEM196的细胞模型;通过RT-qPCR证实外源性TMEM196的表达(P < 0.05,图 4A)。与Vector组相比,TMEM196的异位表达抑制了MDA-MB-231和MCF-7细胞的生长(P < 0.05,图 4B、C)。划痕实验结果显示:TMEM196的过表达抑制了MDA-MB-231(P < 0.05,图 4D、H)和MCF-7(P < 0.05,图 4E、I)细胞的伤口愈合。Transwell实验进一步检测过表达TMEM196之后MDA-MB-231和MCF-7细胞的运动能力变化,与Vector组相比,TMEM196的过表达显著抑制了MDA-MB-231(P < 0.05,图 4F、J)和MCF-7细胞(P < 0.05,图 4G、K)的迁移与侵袭。

|
|
a:P < 0.05,与Vector组比较 A:RT-qPCR检测MDA-MB-231和MCF-7细胞中TMEM196过表达;B、C:MTS法检测TMEM196过表达对MDA-MB-231和MCF-7细胞增殖的影响;D、E、H、I:划痕实验检测TMEM196过表达对MDA-MB-231和MCF-7细胞运动能力的影响;F、G、J、K:Transwell实验检测TMEM196过表达对MDA-MB-231和MCF-7细胞迁移及侵袭能力的影响 图 4 TMEM196过表达抑制乳腺癌细胞的增殖、侵袭和迁移(n=3,x±s) |
2.5 干扰TMEM196对乳腺癌细胞功能的影响
使用miRNA载体在TMEM196较高表达的BT474细胞系中敲除TMEM196的表达。成功转染后,RT-qPCR检测显示TMEM196表达降低(P < 0.05,图 5A)。增殖实验显示:与Control组相比,干扰TMEM196后显著促进了BT474细胞的增殖(P < 0.05,图 5B)。划痕实验表明,与Control组相比,干扰TMEM196能够促进BT474细胞的伤口愈合能力(P < 0.05,图 5C)。同样的,干扰TMEM196之后能够促进BT474细胞的迁移与侵袭(P < 0.05,图 5D)。

|
|
a:P < 0.05,与Control组比较 A:通过RT-qPCR在BT474细胞中检测TMEM196的干扰效果;B:MTS法检测干扰TMEM196后对BT474细胞增殖的影响;C:划痕实验检测干扰TMEM196后对BT474细胞运动能力的影响;D:Transwell实验检测干扰TMEM196对BT474细胞迁移及侵袭能力的影响 图 5 干扰TMEM196能够促进乳腺癌细胞的增殖、迁移和侵袭(n=3,x±s) |
2.6 TMEM196对β-catenin/MMP7信号通路的影响
细胞功能实验结果显示TMEM196能够抑制乳腺癌细胞的迁移与侵袭,进一步检测β-catenin及其下游靶基因MMP7的表达变化。结果显示:与Vector组相比,TMEM196过表达细胞中的β-catenin以及下游的MMP7明显下调(P < 0.05,图 6A);与此相反,β-catenin以及下游的MMP7在干扰TMEM196细胞中表达上调(P < 0.05,图 6B)。

|
| A:在MDA-MB-231细胞中过表达TMEM196后β-catenin及MMP7的变化 a:P < 0.05,与Vector组比较;B:在BT474细胞中干扰TMEM196后β-catenin及MMP7的变化 a:P < 0.05,与Control组比较 图 6 TMEM196对β-catenin/MMP7信号通路的影响(n=3,x±s) |
2.7 在干扰细胞模型中使用β-catenin抑制剂后细胞的功能变化
在干扰TMEM196表达的BT474细胞中加入β-catenin抑制剂(ICG001,Beyotime),后者可以拮抗Wnt/β-catenin/TCF介导的转录,并特异性结合到启动子结合蛋白。Transwell实验检测细胞的迁移和侵袭能力的变化,结果显示:干扰TMEM196后细胞迁移和侵袭的数量增加;而加入β-catenin抑制剂可在一定程度上阻止这种效果(P < 0.05,图 7A)。检测3组中MMP7蛋白的变化显示:与Control组比较,Sh-4组的MMP7蛋白明显升高,加入β-catenin抑制剂后其表达再次下降(P < 0.05,图 7B),表明TMEM196可以通过Wnt通路调控下游基因的变化,TMEM196抑制β-catenin的表达,导致其下游基因MMP7的表达减少。
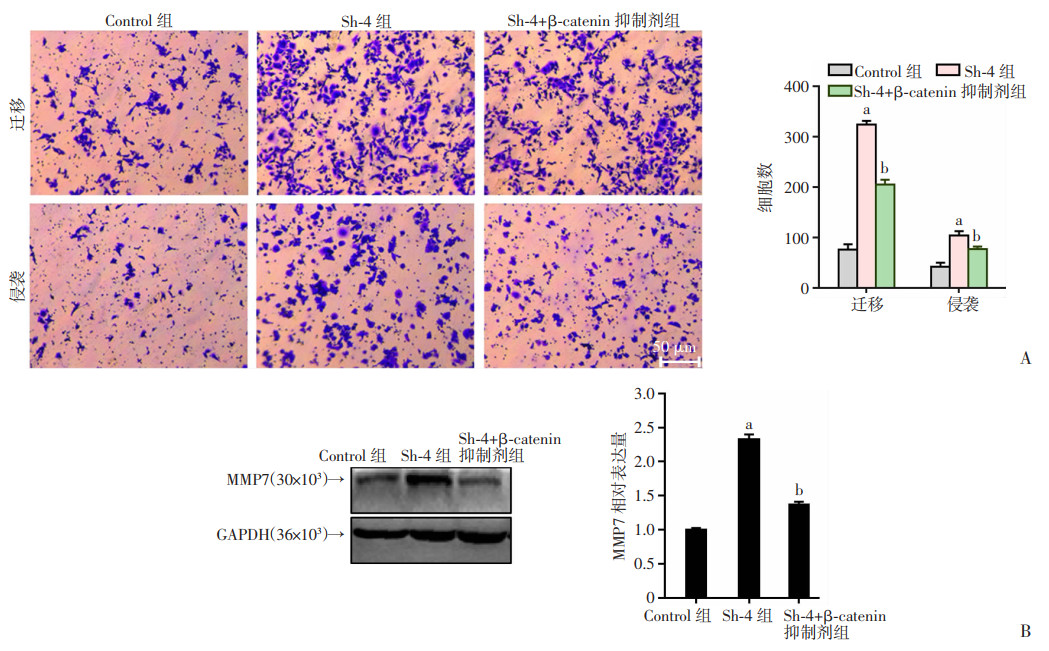
|
|
a:P < 0.05,与Control组比较;b:P < 0.05,与Sh-4组比较 A:Transwell实验检测细胞迁移及侵袭能力的变化;B:Western blot检测各组MMP7蛋白的表达 图 7 TMEM196通过抑制β-catenin的表达调控乳腺癌细胞的迁移与侵袭(n=3,x±s) |
3 讨论
既往研究发现,TMEM196在肺癌组织中甲基化水平明显升高,其高甲基化和更差的预后显著相关,提示TMEM196可以视为肺癌预后的潜在标志物[8-9]。但是,截至目前,尚没有关于TMEM196在其他肿瘤中发挥作用的相关报道,包括乳腺癌。本研究在乳腺癌中通过实验方法探索TMEM196的表达和预后,以及其对Wnt/β-catenin/MMP7信号通路的影响,对于探索乳腺癌新的预后标志物具有重要的参考价值。我们利用人群队列发现TMEM196在乳腺癌中表达降低,低表达的TMEM196和乳腺癌患者更差的预后有关;同时,利用实验方法初步发现TMEM196可以通过抑制β-catenin的表达而调控β-catenin/MMP7信号通路,从而对乳腺癌细胞的迁移及侵袭能力产生影响。我们的研究结果提示TMEM196是乳腺癌潜在的预后标志物,值得进一步深入研究与探索。
3.1 TMEM196在乳腺癌中的研究价值基因在肿瘤细胞中的亚细胞定位对于研究其功能执行的方式具有重要的意义。通过查找人类蛋白质图谱(human protein atlas,HPA)数据库,我们发现TMEM196定位于核质和高尔基体,通过查阅文献得知,核质是细胞核内的重要组成部分,其内包含了多种转运受体蛋白以及酶等对肿瘤的分化、凋亡、信号转导等具有重要作用的物质[10]。此外,一项关于乳腺癌的研究发现,ZNF750表达的抑制显著增加了高尔基体面向划痕的细胞数量,从而促进细胞划痕愈合,说明高尔基体是细胞迁移过程中的关键参与者,并且朝向迁移方向[11],这些证据为下一步深入研究TMEM196在乳腺癌中的作用提供了可参考的信息。
TMEM196属于跨膜蛋白家族的一员,到目前为止,仅仅只发现TMEM196在肺癌中受甲基化调控从而对预后产生了影响,然而其在人类其他癌症中的作用还是一片空白。不可否认的是,随着人类癌症研究的不断深入,越来越多的研究证实跨膜蛋白家族成员在肿瘤局部进展及远处转移过程中发挥至关重要的作用[12],包括上皮-间充质转化(epithelial-mesenchymal transition,EMT)、调节细胞间黏附分子(intercellular adhesion molecule,ICAM) 和血管细胞黏附分子(vascular cell adhesion molecule,VCAM) 与血小板/中性粒细胞和内皮细胞的相互作用、钙激活氯离子通道(calcium-activated chloride channels,CaCCs)以及调节Ⅰ型干扰素(interferon,IFN)信号传导和先天免疫等。除此之外,一些跨膜蛋白被当做潜在的预后标志物,包括TMEM45A、TMEM48、TMEM98等[13-17]。上述研究结果表明跨膜蛋白家族在癌症的转移过程中扮演重要的角色。由于肿瘤的转移是非常复杂的机制,需要多种蛋白质共同参与,目前大部分跨膜蛋白在其中发挥作用的机制尚不明确,亟须深入研究。同时也说明,TMEM196在乳腺癌中的作用是值得研究和发掘的。
3.2 TMEM196在乳腺癌中的表达和预后本研究发现,TMEM196在乳腺癌中表达降低且与较差的预后结局(OS、RFS)有关,同时在包含70个正常样本和160个乳腺癌样本的组织微阵列验证了这一结果。TMEM196的表达在TNBC细胞和组织中最低,同时,利用组织芯片在TNBC患者中进行生存分析提示TMEM196高表达和较好的预后有关;Kaplan-Meier数据库的分析结果显示,在Basal乳腺癌亚型中,高表达TMEM196高表达和较好的预后有关。从病理角度来说,TNBC是乳腺癌的一个亚组,定义为ER-、PR-和HER2-,而Basal型乳腺癌定义为表达细胞角蛋白和其他非管腔(基底)基因的基底样乳腺癌,与TNBC的重叠程度达到90%[18]。因此,上述的结果具有一致性,说明TMEM196是乳腺癌潜在的预后标志物。近年来,新的组织微阵列技术可用于各种不同的阵列设计[19]。例如,包含癌症前驱病变和进展期病变样本的阵列,包含来自同一组织的正常、癌旁和恶性样本的组织型比较阵列,或者包含同一肿瘤实体的不同亚型或阶段的癌症阵列。例如,一项关于乳腺癌的研究开发了一种新的半自动循环肿瘤细胞(circulating tumor cell,CTC)计数系统,叫做流体细胞微阵列芯片系统(fluidic cell microarray chip system,FCMC),可以独立于肿瘤特异性标志物或物理特性而捕获CTC,比既往的CTC检测系统具有更高的灵敏度和准确性[19]。总之,组织微阵列是目前以及未来转化癌症研究的有力工具,有许多值得研究的内容有待发掘。
3.3 TMEM196对乳腺癌细胞功能及下游信号通路的影响本研究通过细胞实验发现,TMEM196可以抑制乳腺癌细胞的迁移及侵袭,并且可以抑制β-catenin及其下游的MMP7的表达;而敲低TMEM196之后,β-catenin和MMP7的表达也随之升高;加入β-catenin抑制剂之后,MMP7的表达又进一步降低,说明TMEM196可以通过Wnt/β-catenin/MMP7通路从而调控乳腺癌细胞的运动能力。众所周知,Wnt/β-catenin信号通路的激活在包括乳腺癌在内的各种癌症的发生、发展和转移中起着关键作用[20-22]。除此之外,基质金属蛋白酶7(MMP7)作为一种小的分泌性蛋白水解酶。它的表达与多种癌症的侵袭、迁移相关[23],一些研究表明MMP7在乳腺癌细胞和组织中均过表达[24],是β-catenin最重要的下游靶基因之一。在后续的研究中,可以在干扰TMEM196表达的基础上进一步敲低MMP7,观察乳腺癌细胞的功能变化,这个结果能够更加有利的论证本研究的结论。在本研究中,我们发现MMP7是TMEM196下游的重要靶基因,以上结果表明TMEM196可能通过减弱β-catenin/MMP7信号通路来抑制乳腺癌细胞的迁移与侵袭。
3.4 研究局限及结论本研究尚有一些不足之处:①本研究通过实验方法初步探索了TMEM196在乳腺癌中的作用及其可能作用的下游信号通路,但是TMEM196抑制乳腺癌细胞侵袭及迁移的具体分子机制目前尚不清楚,以及TMEM196如何参与调控β-catenin/MMP7信号通路尚不明确,后续需要体外验证、Co-IP等实验进一步深入研究;同时,还可以借助免疫荧光明确TMEM196的亚细胞定位,其亚细胞定位对于理解和探索该基因执行功能的方式至关重要;②本研究初步发现TMEM196可以抑制β-catenin及其下游MMP7的表达,根据以往报道可知,包括c-myc和MMP9在内的β-catenin下游靶基因与乳腺癌远处转移和不良预后显著相关[25],TMEM196与这些靶基因之间的关系尚需进一步研究。
总之,本研究发现TMEM196在乳腺癌中表达下调并且与乳腺癌预后不良有关。同时,TMEM196可以通过β-catenin/MMP7信号通路抑制乳腺癌细胞的增殖、迁移和侵袭。这些发现增加了我们对乳腺癌发生的分子机制的理解,并为癌症的诊断、治疗和预后提供了潜在的靶点。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
SIEGEL R L, MILLER K D, FUCHS H E, et al. Cancer statistics, 2021[J]. CA Cancer J Clin, 2021, 71(1): 7-33. |
| [3] |
MEI J, HAO L Y, LIU X R, et al. Comprehensive analysis of peroxiredoxins expression profiles and prognostic values in breast cancer[J]. Biomark Res, 2019, 7: 16. |
| [4] |
WU S J, GUO X Y, ZHOU J J, et al. High expression of UNC5B enhances tumor proliferation, increases metastasis, and worsens prognosis in breast cancer[J]. Aging, 2020, 12(17): 17079-17098. |
| [5] |
NEUPERGER P, BALOG J Á, TISZLAVICZ L, et al. Analy-sis of the single-cell heterogeneity of adenocarcinoma cell lines and the investigation of intratumor heterogeneity reveals the expression of transmembrane protein 45A (TMEM45A) in lung adenocarcinoma cancer patients[J]. Cancers, 2021, 14(1): 144. |
| [6] |
WU J W, TANG X H, YU X J, et al. TMEM60 promotes the proliferation and migration and inhibits the apoptosis of glioma through modulating AKT signaling[J]. J Oncol, 2022, 2022: 9913700. |
| [7] |
KANG C F, ROSTOKER R, BEN-SHUMEL S, et al. TMEM176B regulates AKT/mTOR signaling and tumor growth in triple-negative breast cancer[J]. Cells, 2021, 10(12): 3430. |
| [8] |
LIU W B, HAN F, HUANG Y S, et al. TMEM196 hyper-methylation as a novel diagnostic and prognostic biomarker for lung cancer[J]. Mol Carcinog, 2019, 58(4): 474-487. |
| [9] |
LIU W B, HAN F, JIANG X, et al. TMEM196 acts as a novel functional tumour suppressor inactivated by DNA methylation and is a potential prognostic biomarker in lung cancer[J]. Oncotarget, 2015, 6(25): 21225-21239. |
| [10] |
但德苗, 郭忠建. 蛋白质核质转运的过程和应用[J]. 中国细胞生物学学报, 2021, 43(9): 1891-1900. DAN D M, GUO Z J. The process and application of nucleocytoplasmic transport of proteins[J]. Chin J Cell Biol, 2021, 43(9): 1891-1900. |
| [11] |
CASSANDRI M, BUTERA A, AMELIO I, et al. ZNF750 represses breast cancer invasion via epigenetic control of prometastatic genes[J]. Oncogene, 2020, 39(22): 4331-4343. |
| [12] |
MARX S, DAL MASO T, CHEN J W, et al. Transmembrane (TMEM) protein family members: poorly characterized even if essential for the metastatic process[J]. Semin Cancer Biol, 2020, 60: 96-106. |
| [13] |
HURT B, SCHULICK R, EDIL B, et al. Cancer-promoting mechanisms of tumor-associated neutrophils[J]. Am J Surg, 2017, 214(5): 938-944. |
| [14] |
SHARMA R, SHARMA R, KHAKET T P, et al. Breast cancer metastasis: putative therapeutic role of vascular cell adhesion molecule-1[J]. Cell Oncol (Dordr), 2017, 40(3): 199-208. |
| [15] |
JIANG H M, CHEN H B, WAN P, et al. Upregulation of TMEM45A promoted the progression of clear cell renal cell carcinoma in vitro[J]. J Inflamm Res, 2021, 14: 6421-6430. |
| [16] |
JIANG X Y, WANG L, LIU Z Y, et al. TMEM48 promotes cell proliferation and invasion in cervical cancer via activation of the Wnt/β-catenin pathway[J]. J Recept Signal Transduct Res, 2021, 41(4): 371-377. |
| [17] |
AO X D, LI X X, CHEN Y X, et al. TMEM98 mRNA promotes proliferation and invasion of gastric cells by directly interacting with NF90 protein[J]. Cell Biol Int, 2020, 44(9): 1820-1830. |
| [18] |
PAREJA F, JEYER F C, MARCHIO C, et al. Triple-negative breast cancer: the importance of molecular and histologic subtyping, and recognition of low-grade variants[J]. NPJ Breast Cancer, 2016, 2: 16036. |
| [19] |
ZHENG K, YAO S, YAO W, et al. Association between RSK2 and clinical indexes of primary breast cancer: a meta-analysis based on mRNA microarray data[J]. Front Genet, 2021, 12: 770134. |
| [20] |
CHEN Y, LI X, XU J, et al. Knockdown of nuclear receptor binding SET domain-containing protein 1 (NSD1) inhibits proliferation and facilitates apoptosis in paclitaxel-resistant breast cancer cells via inactivating the Wnt/β-catenin signaling pathway[J]. Bioengineered, 2022, 13(2): 3526-3536. |
| [21] |
PHAM S H, PRATT K, OKOLICSANYI R K, et al. Syndecan-1 and-4 influence Wnt signaling and cell migration in human breast cancers[J]. Biochimie, 2022: 2022Feb17;S0300-2022Feb17;S9084(22)00024-4. DOI: 10.1016/j.biochi.2022.01.014.
|
| [22] |
ZHANG W, RUAN X H, LI Y S, et al. KDM1A promotes thyroid cancer progression and maintains stemness through the Wnt/β-catenin signaling pathway[J]. Theranostics, 2022, 12(4): 1500-1517. |
| [23] |
LIU L D, WANG L F, LI X J, et al. The roles of HOXB8 through activating Wnt/β-catenin and STAT3 signaling pathways in the growth, migration and invasion of ovarian cancer cells[J]. Cytotechnology, 2022, 74(1): 77-87. |
| [24] |
HAN B C, ZHOU B, QU Y, et al. FOXC1-induced non-canonical WNT5A-MMP7 signaling regulates invasiveness in triple-negative breast cancer[J]. Oncogene, 2018, 37(10): 1399-1408. |
| [25] |
NADANAKA S, KINOUCHI H, KITAGAWA H. Chondroitin sulfate-mediated N-cadherin/β-catenin signaling is associated with basal-like breast cancer cell invasion[J]. J Biol Chem, 2018, 293(2): 444-465. |




