2. 400038 重庆,陆军军医大学(第三军医大学)军事预防医学系复合伤研究所,创伤、烧伤与复合伤国家重点实验室
2. State Key Laboratory of Trauma, Burns and Combined Injuries, Institute of Combined Injury, Faculty of Military Preventive Medicine, Army Medical University (Third Military Medical University), Chongqing, 400038, China
聚乙二醇(polyethylene glycol, PEG)是一种高分子聚合物,具有良好的水溶性、低毒性,并与许多有机物有良好的相容性,主要通过肝脏和肾脏代谢[1]。PEG修饰是指通过化学键合的方式将PEG分子连接到药物分子上的一种技术。PEG修饰能改变免疫原性,改善药物动力学[2],明显提高水溶性差的药物的溶解度,增强母体药物的生物利用度,同时降低药物毒性[3-4]。药物的聚乙二醇结构修饰已经成为目前国内外的研究热点,越来越多经聚乙二醇修饰的药物已进入临床研究阶段,而这其中,抗肿瘤药物居多[5-7]。
本课题组前期发现了一类具有肿瘤靶向及抗肿瘤活性的吲哚花菁小分子,如808-NM2[8],且具有独特的光动力抗肿瘤作用[9]。但因该类分子具有长的七甲川共轭链,使其疏水性强,水溶性差,导致其实际应用受到限制。
鉴于PEG分子量为550时,与各种溶剂(包括水)具有良好的相容性,能发挥增溶作用以及提高亲水性,而其低分子量的PEG修饰,不但合成更容易实现,成本低,也利于目标化合物质量控制[10-11]。因此,本研究拟通过PEG550修饰808-NM2小分子,在保留其肿瘤靶向作用的基础上,期望提高该类吲哚花菁小分子的水溶性、近红外成像特性及肿瘤光动力治疗作用。
1 材料与方法 1.1 细胞、主要试剂与仪器肾小管上皮细胞(HK-2)、肾癌细胞(RENCA)来源于武汉尚恩生物科技有限公司,RPMI Medium 1640培养基、胎牛血清、链霉素/青霉素、线粒体荧光探针、DAPI试剂、单线态氧荧光探针购自赛默飞世尔生物化学制品有限公司,CCK-8试剂购自MedChemExpress,胰蛋白酶购自格来赛生物科技有限公司,活性氧检测试剂盒购自上海碧云天生物技术有限公司,凋亡试剂购自Biolegend。2-硝基咪唑、1, 6-二溴己烷、2, 3, 3-三甲基吲哚、乙腈、二氯甲烷、甲醇、聚乙二醇单甲醚(PEG550)、三溴化磷购自阿达玛斯试剂有限公司,正己烷、乙酸乙酯、甲苯、正丁醇、乙酸钠购自西格玛奥德里奇有限公司,碳酸钾购自上海普迈有限公司,N, N-二甲基甲酰胺购自上海阿拉丁生化科技股份有限公司,无水硫酸钠购自上海沪试化工有限公司,吡啶购自罗恩试剂,盐酸购自成都市科龙化工。烧瓶、油浴锅、色谱柱、超速离心机、流式细胞仪、尼康荧光显微镜、共聚焦显微镜为实验所需主要仪器。
1.2 PEG-808-NM2合成 1.2.1 硝基咪唑溴化物(1a)的合成将2-硝基咪唑、1, 6-二溴己烷和碳酸钾(摩尔比1∶2∶2)溶解于N, N-二甲基甲酰胺中。然后,将混合溶液升温至60 ℃,在氮气保护下回流3 h,薄层色谱法(thin-layer chromatography,TLC)监测反应过程。反应完成后,过滤混合物,滤渣用乙酸乙酯洗涤,再次过滤,反复3次,滤液用蒸馏水萃取3次。浓缩有机层,用无水硫酸钠干燥,过滤。蒸发溶剂,残余物通过柱色谱法(乙酸乙酯/正己烷:1/4)纯化,得到淡黄色固体。
1.2.2 硝基咪唑吲哚季铵盐(1b)的合成将溴化的硝基咪唑和2, 3, 3-三甲基吲哚(摩尔比1∶1.5)加入装有乙腈的圆底烧瓶中,在氮气保护下于120 ℃磁力搅拌反应6 h,TLC监测反应过程。反应完成后,蒸发溶剂并通过柱色谱法(二氯甲烷/甲醇:40/1)纯化,得到吲哚季铵盐,得到吲哚季铵盐。
1.2.3 硝基咪唑吲哚季铵盐半缩合(1c)的合成将硝基咪唑、乙酸钠和缩合剂混合,加入无水乙醇作溶剂,在氮气保护下将混合物升温至70 ℃,回流3 h。反应结束后,旋转蒸发仪除去溶剂,反应物通过柱色谱法(二氯甲烷/甲醇:40/1)纯化,得到红色产物。
1.2.4 PEG550单甲醚溴化物(1d)的合成将吡啶缓慢加入到聚乙二醇单甲醚(PEG550)和三溴化磷(1∶2.5)的混合物中,同时在氮气保护下120 ℃搅拌16 h。反应完成后冷却至室温,向混合物中加入2%盐酸和蒸馏水,再用二氯甲烷洗涤3次,有机层用无水硫酸钠干燥并过滤。真空除去溶剂,得到粗产物,直接用于下一步反应。
1.2.5 PEG550吲哚盐(1e)的合成将溴化的PEG550与2, 3, 3-三甲基吲哚混合于乙腈中,混合液在氮气保护下于110 ℃回流,TLC监测反应过程。反应完成后,蒸发溶剂,残余物通过柱色谱法纯化,用二氯甲烷/甲醇(30/1)混合物洗脱。
1.2.6 PEG-808-NM2(1f)的合成将PEG550吲哚盐和硝基咪唑半缩合产物溶解于甲苯和正丁醇(7∶3)的混合液中,混合液在110 ℃氮气保护下回流反应3 h,TLC监测反应过程。反应完成后,旋转蒸发仪除去溶剂,残余物通过柱色谱法(二氯甲烷/甲醇:10/1) 纯化,得到绿色目标产物。
1.3 染料溶解性与稳定性测定用千分之一天平(准确度d=0.001 g)准确称取PEG-808-NM2、808-NM2,并用DMSO(二甲基亚砜)配置成10 mg/mL的溶液。分别用水溶液稀释配置成10 μg/mL,观察其水溶性和近红外荧光特性。再分别利用相应溶剂(磷酸盐缓冲液PBS、甲醇)稀释配置成5 μg/mL的溶液, 用紫外可见近红外分光光度计(Shimadzu, UV-3600)测其紫外吸收光谱,用荧光光谱仪(Varian, Cary Eclipse)测其荧光发射光谱。
1.4 细胞培养及细胞摄入HK-2细胞与RENCA细胞均培养在RPMI1640完全培养基中(添加10%胎牛血清和1%链霉素/青霉素)中。细胞均在37 ℃、CO2含量为5%的恒温孵育箱中生长,常规传代培养。
HK-2细胞和RENCA细胞分别以1×105/皿接种于共聚焦培养皿中。培养24 h后,PEG-808-NM2以0.5 μg/mL分别加入HK-2细胞和RENCA细胞,再次孵育24 h。之后,用PBS洗3次培养皿,DAPI染色细胞15 min,PBS洗涤5 min × 3次。最后,多聚甲醛固定15 min,甘油固定10 min,通过激光扫描共聚焦显微镜观察结果。
RENCA细胞以2×105/孔接种于6孔板中,CO2孵箱培养24 h后,在不同时间点PEG-808-NM2以0.5 μg/mL加入RENCA细胞,胰酶消化,离心,PBS洗涤2次,得到1、2、4、6、12、24 h不同时间点摄入药物的细胞,通过流式细胞仪进行测量。
1.5 线粒体定位RENCA细胞以1×105/皿接种于共聚焦培养皿中,培养24 h。PEG-808-NM2以0.5 μg/mL加入RENCA细胞,孵育24 h。用无血清培养基洗培养皿,将按照说明书稀释好的线粒体荧光探针(Mito Tracker)装载到细胞中20 min,无血清培养基洗涤3次,PBS洗涤。多聚甲醛固定15 min,甘油固定10 min,通过激光扫描共聚焦显微镜观察结果。
1.6 单线态氧及活性氧检测用甲醇33 μL加入单线态氧荧光探针(SOSG)储备液中,然后,用甲醇将PEG-808-NM2和808-NM2稀释成2 μg/mL,各加入1 μL SOSG稀释液,同时空白组甲醇中也加入1 μL SOSG稀释液。将3组溶液分别置于808 nm激光(2 W/cm2) 照射5 min,用荧光光谱仪测其荧光发射光谱。
RENCA细胞以2×105/孔接种在6孔板上,培养24 h。在其中两孔分别加入0.5 μg/mL PEG-808-NM2,另一孔加入1640完全培养基,孵育12 h。按照1∶1 000用无血清培养基稀释活性氧荧光探针DCFH-DA,使最终浓度为10 μmol/L,去除细胞培养液,加入1 mL稀释好的DCFH-A, 在37 ℃细胞培养箱中孵育30 min,然后用无血清细胞培养基洗涤细胞3次。将3组分别选择1个孔置于808 nm的激光(2 W/cm2) 下照射5 min,在荧光显微镜下观察。最后胰酶消化,离心,PBS重悬,通过流式细胞仪测量。
1.7 近红外激光照射介导的抗肿瘤作用将RENCA细胞以3 000/孔接种在96孔平底板中,孵育过夜。24 h后,将808-NM2和PEG-808-NM2以0~0.5 μg/mL的不同浓度分别加到96孔板的细胞中,再孵育12 h。吸弃旧培养基,加入新培养基,再置于808 nm激光(2 W/cm2) 照射5 min,之后再孵育24 h。在每孔中加入10 μL CCK-8,孵育2 h后通过使用酶标仪测量450 nm处的光密度来确定细胞活力。
RENCA细胞以2×105/孔接种于6孔板中,孵育24 h后,将PEG-808-NM2以0.5 μg/mL的浓度加到6孔板的细胞,再孵育12 h。吸弃旧培养基,加入新培养基,再置于808 nm激光(2 W/cm2) 照射5 min,之后再孵育24 h。吸弃旧培养基,胰酶(不含EDTA)消化5 min,离心,PBS重悬2次,加入100 μL Binding buffur重悬细胞,再加入5 μL Annexin V-FITC和5 μL PI溶液混匀,室温下避光反应10 min,加入400 μL Binding buffur,最后通过流式细胞仪检测。
1.8 统计学分析采用SPSS 26.0统计软件进行分析和制图,数据以x±s表示,采用独立样本t检验,P < 0.05表示差异有统计学意义。
2 结果 2.1 合成与表征PEG-808-NM2的化学合成路线见图 1。以硝基咪唑为原料,经过溴代反应、取代反应、半缩合反应等合成关键中间体1c;同时,以聚乙二醇单甲醚(PEG550)为原料,经过溴代反应、取代反应等合成另一关键中间体1e;关键中间体1c和1e经过聚合反应,最后合成得到目标产物1f。本合成方法共6步,中间产物的化学结构经氢谱确认,最终目标产物的化学结构通过氢谱、质谱确认。1a的共轭氢峰出现在7.2 ppm左右,亚甲基的氢峰出现在1.5~2.0 ppm和3.5~4.5 ppm; 1b的共轭氢峰出现在6.5~7.5 ppm,亚甲基的氢峰出现在3.5~4.0 ppm,甲基的氢峰出现在1.5~2.0 ppm;1c的共轭氢峰出现在7.0~7.8 ppm。因PEG是混合物,故做原料与产物的氢谱对照进行结构确认(图 2A)。聚乙二醇单甲醚的氢谱分裂峰主要出现在3.5~3.7 ppm,硝基咪唑吲哚盐(1b)的氢谱苯环峰主要出现在7.2 ppm左右,在PEG-808-NM2氢谱上7.2 ppm左右能找到特征苯环峰,且发现在PEG-808-NM2氢谱的3.0~5.0 ppm范围内包含了吲哚花菁共轭链和苯环上的14个氢。PEG-808-NM2平均分子量为1 200,通过质谱检测结果(图 2B)发现:最大单元分子量在1 200左右,且符合聚乙二醇质谱的正态分布,每个单元之间分子量相差44。基于上述分析,核磁和质谱结果提示成功合成并获得了PEG-808-NM2。
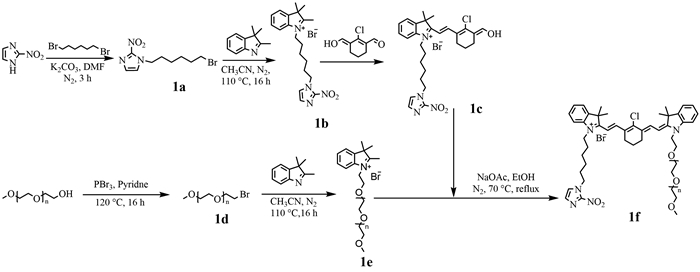
|
| 1a:溴化的硝基咪唑;1b:硝基咪唑吲哚季铵盐;1c:半缩合产物;1d:溴化的PEG550;1e:PEG550吲哚季铵盐;1f:PEG-808-NM2 图 1 PEG-808-NM2化学合成路线 |
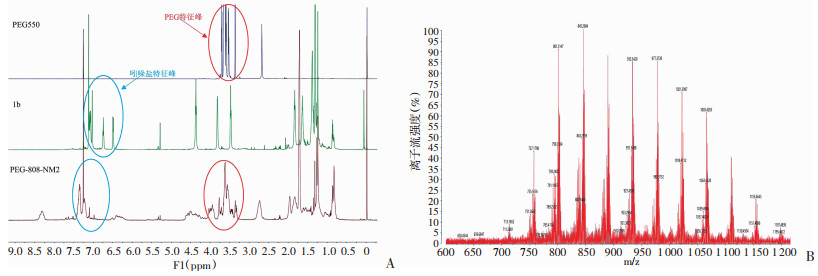
|
| A:PEG-808-NM2及部分中间产物的核磁氢谱;B:PEG-808-NM2质谱 图 2 PEG-808-NM2化学表征 |
2.2 理化性质表征
将PEG-808-NM2和808-NM2(化学结构见图 3A、B) 配成10 μg/mL的甲醇和PBS溶液。在甲醇和PBS中,通过紫外吸收光谱(图 3C、D)、荧光发射光谱(图 3E、F)检测,结果显示:PEG-808-NM2均表现出优异的近红外荧光特性,而808-NM2因水中形成聚集,导致吸收和荧光发射受到严重影响。室温静置30 min后,观察到808-NM2小分子在PBS中有明显沉淀析出,但PEG-808-NM2溶液始终透绿清澈,未见沉淀析出(图 3G),表明PEG修饰后能有效增加其水溶性和稳定性。通过近红外荧光成像,比较PEG-808-NM2和808-NM2在PBS中的荧光差别(图 3H),进一步证明PEG-808-NM2有效增加了水溶性、稳定性和近红外荧光成像特性。
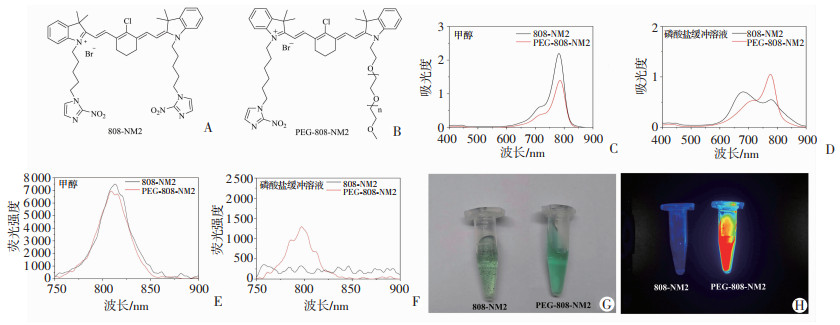
|
| A:808-NM2结构式;B:PEG-808-NM2结构式;C:808-NM2和PEG-808-NM2在甲醇中的紫外吸收光谱;D:808-NM2和PEG-808-NM2在PBS中的紫外吸收光谱;E:808-NM2和PEG-808-NM2在甲醇中的荧光光谱;F:808-NM2和PEG-808-NM2在PBS中的荧光光谱;G:溶解于PBS的808-NM2和PEG-808-NM2;H:溶解于PBS的808-NM2和PEG-808-NM2近红外成像 图 3 PEG-808-NM2的理化性质表征 |
2.3 PEG修饰可促进肿瘤细胞对其摄入
通过共聚焦显微镜比较PEG-808-NM2在HK-2细胞和RENCA细胞的摄入情况,发现RENCA细胞对PEG-808-NM2的摄入量明显高于HK-2细胞(P < 0.001,图 4A、B)。表明PEG-808-NM2优选蓄积于肿瘤细胞,能增加肿瘤细胞对药物的摄入。
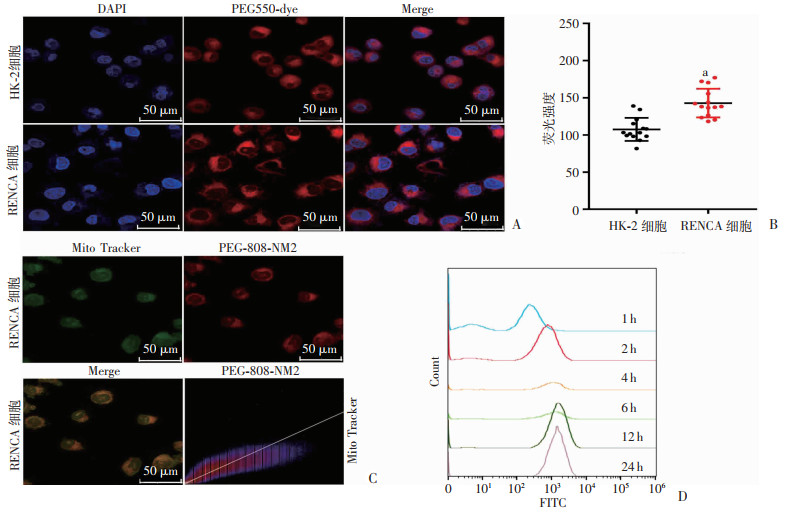
|
| A:HK-2和RENCA细胞对PEG-808-NM2的摄入;B:HK-2和RENCA细胞对PEG-808-NM2摄入的荧光强度分析(n=14) a:P < 0.001,与HK-2细胞比较;C:PEG-808-NM2的线粒体靶向作用及PEG-808-NM2与Mito Tracker的荧光共定位分析 r值: 0.94; 曼德拉斯共定位系数M1: 1.000,M2: 0.822;D:不同时间点的细胞摄入情况 图 4 PEG-808-NM2优先蓄积于肿瘤细胞及其线粒体 |
2.4 PEG-808-NM2具有肿瘤线粒体靶向
为探究PEG-808-NM2的线粒体靶向性,将PEG-808-NM2加入于RENCA细胞,加入线粒体定位探针(mito tracker),在共聚焦显微镜下观察,发现红色荧光信号(PEG-808-NM2)与绿色荧光信号(线粒体定位探针)高度重合(图 4C)。此外,Image J共定位分析表明PEG-808-NM2与线粒体定位探针的相关性(图 4C),皮尔森相关系数r及曼德拉斯(Manders)共定位系数M1、M2分别为0.94、1.000、0.822,表示PEG-808-NM2具有良好的线粒体靶向特性。
2.5 PEG-808-NM2的最佳光照摄入时间通过流式细胞仪测量并比较1、2、4、6、8、12、24 h不同时间点的细胞摄入情况(图 4D),发现RENCA细胞在1 h时便对PEG-808-NM2有摄入,并在12 h有较大摄入,并且保持至24 h,因此,可根据时间点摄入情况,为后续实验选择治疗时间点。
2.6 PEG-808-NM2光动力效应评价 2.6.1 单线态氧及ROS的产生通过单线态氧探针(SOSG)检测808 nm激光照射后PEG-808-NM2的单线态氧(1O2)生成水平。如图 5A所示:与对照组相比,PEG-808-NM2光照后能产生大量的1O2(526 nm最大荧光发射波长的荧光强度),表明PEG-808-NM2具有显著的光动力效应。
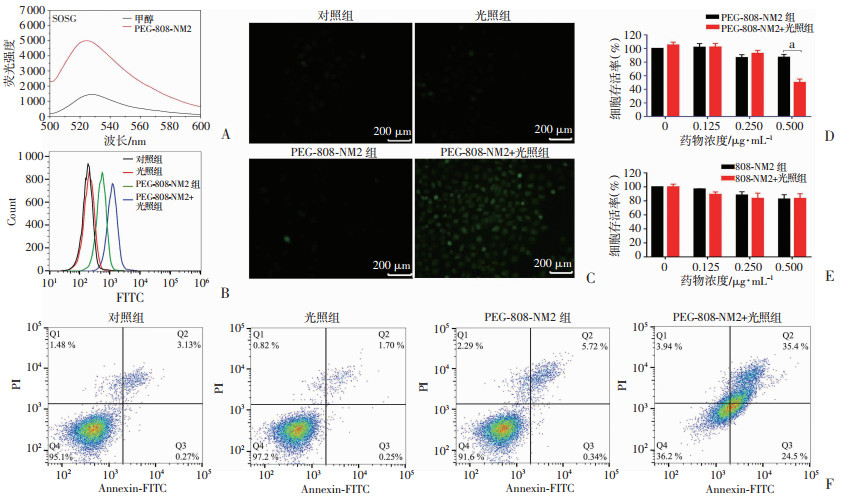
|
| A:PEG-808-NM2的SOSG曲线;B:流式细胞仪检测细胞ROS水平;C:PEG-808-NM2激光照射下诱导RENCA肿瘤细胞产生大量活性氧(绿色);D:PEG-808-NM2的光动力抗肿瘤效应 a:P < 0.001;E:808-NM2的光动力抗肿瘤效应;F:不同处理组的细胞凋亡检测 图 5 PEG-808-NM2的光动力效应 |
此外,通过检测细胞内ROS水平来进一步验证PEG-808-NM2的光动力作用。利用活性氧指示剂DCFH-DA(无荧光)与ROS反应生成具有荧光DCF,通过流式细胞仪定量分析ROS水平(图 5B);同时,以DCF的绿色荧光强度作为ROS水平高低评定标准,荧光显微镜结果见图 5C。两种实验结果趋势一致,即与空白对照组、单纯光照组、单纯PEG-808-NM2药物组比较,PEG-808-NM2仅在光照后显著诱导细胞产生大量ROS。
2.6.2 光动力抗肿瘤作用在同样条件的808 nm近红外激光光照下,通过细胞存活率测试,研究808-NM2和PEG-808-NM2对RENCA细胞的抗肿瘤作用。为了方便比较,两个药物均设置4个浓度梯度,分别是0、0.125、0.250、0.500 μg/mL。CCK-8测试结果表明(图 5D):单纯光照、单纯两种药物(无光照)对肿瘤细胞无明显杀伤作用。然而,当PEG-808-NM2在药物浓度0.500 μg/mL时联合光照,肿瘤细胞存活率下降至50%,表现出显著的肿瘤光动力杀伤作用(P < 0.001)。而808-NM2组,无论光照与否,对肿瘤细胞均无明显光动力治疗作用(图 5E)。进一步通过流式细胞仪检测不同处理组的细胞凋亡程度(图 5F),发现其趋势与CCK-8检测结果一致。
3 讨论光动力疗法(photodynamic therapy,PDT)在临床主要应用于皮肤病[12-14]及肿瘤的治疗[15-17]。PDT主要由光敏剂、光和氧三部分组成,即用特定波长局部照射病灶部位,能选择性使病灶组织的光敏药物活化,导致大量反应活性氧(ROS)的形成。这些ROS对光敏剂积累的细胞具有高度的细胞毒性[18],可引发细胞凋亡甚至坏死,从而发挥治疗病灶的作用。PDT产生的细胞毒性ROS, 也通过作用肿瘤血管和刺激抗肿瘤免疫[19],协同增强了PDT的抗肿瘤作用。然而,由于普遍光敏剂的肿瘤靶向性不理想,严重影响了PDT的临床实际治疗效果。
有研究报道吲哚花菁小分子类光敏剂具有良好的肿瘤靶向性[9],但由于其七甲川长疏水性链,导致其水溶性差,其光动力作用有限。鉴于PEG修饰小分子能有效增加其水溶性,提高在肿瘤组织及细胞中的蓄积能力[20-21],本研究通过PEG修饰合成该类小分子得到PEG-808-NM2,有效改善吲哚花菁小分子的溶解性,有效避免其在水溶液中的团聚,从而被肿瘤细胞高效摄入,增强了吲哚花菁小分子的光学成像特性,增加了对肿瘤细胞的选择性摄入,展现出显著的光动力治疗效应。更重要的是,PEG-808-NM2通过靶向蓄积肿瘤细胞线粒体发挥光动力治疗作用。由于线粒体是细胞能源工厂,是介导凋亡、自噬等决定细胞生死的重要细胞器,与肿瘤的发生、发展有着紧密联系[22-23],因此具备线粒体靶向的光敏剂为高效光疗肿瘤提供可能性。线粒体靶向的光敏剂属于目前研究最新的第3代光敏剂——细胞器靶向光敏剂[24]。与其他线粒体靶向光敏剂相比的[9, 25-26],一方面PEG-808-NM2属于近红外光敏剂,对肿瘤组织具有更深的穿透力和光动力治疗作用,另一方面只有在光照下才会产生对肿瘤细胞杀伤的ROS,为肿瘤靶向的局部精确治疗,大大减轻毒副作用提供可能性,其同时具有的肿瘤靶向蓄积与近红外荧光成像作用,为将来应用于成像引导下的局部精确光疗提供可能性。
值得注意的是,光动力疗效严重依赖于细胞内的氧气水平。由于肿瘤固有缺氧微环境以及随着PDT治疗,进一步加剧肿瘤局部缺氧,从而肿瘤细胞会逐渐产生PDT耐受[27]。因此,寻找各种方法提高PDT疗效也一直是本领域的研究热点。本研究中的PEG-808-NM2由缺氧靶向的硝基咪唑化学基团和肿瘤靶向的808-NM2化学结构组成,通过增加缺氧肿瘤微环境中光敏剂的蓄积量,从而提高PDT治疗效果。更多研究发现:硝基咪唑基团、醌、芳族氮氧化物和脂族氮氧化物等乏氧敏感结构,与光敏剂相偶联,光动力反应虽然会加剧肿瘤乏氧,但却显著活化乏氧敏感结构,反而提高了治疗效果[28-31]。另外,PEG-808-NM2属于肿瘤靶向蓄积的硝基咪唑修饰的吲哚花菁小分子,而硝基咪唑类小分子曾经作为临床放疗增敏剂,在抗肿瘤效应方面发挥显著治疗作用[32-33]。因此,后续可以研究PEG-808-NM2在放疗增敏与PDT的联合抗肿瘤作用研究,以进一步提高PDT治疗疗效。
| [1] |
PARK E J, CHOI J, LEE K C, et al. Emerging PEGylated non-biologic drugs[J]. Expert Opin Emerg Drugs, 2019, 24(2): 107-119. |
| [2] |
LI N, LU X Y, FANG M, et al. PEGylated triacontanol substantially enhanced the pharmacokinetics of triacontanol in rats[J]. J Agric Food Chem, 2018, 66(33): 8722-8728. |
| [3] |
YANG X, DING Y P, JI T J, et al. Improvement of the in vitro safety profile and cytoprotective efficacy of amifostine against chemotherapy by PEGylation strategy[J]. Biochem Pharmacol, 2016, 108: 11-21. |
| [4] |
ZHAI B T, WU Q B, WANG W G, et al. Preparation, characterization, pharmacokinetics and anticancer effects of PEGylated β-elemene liposomes[J]. Cancer Biol Med, 2020, 17(1): 60-75. |
| [5] |
HUANG Y Q, YUAN J D, DING H F, et al. Design, synthesis and antitumor activity of a novel PEG-A6-conjugated irinotecan derivative[J]. Bioorg Med Chem Lett, 2020, 30(2): 126847. |
| [6] |
YAN J Y, SONG B, HU W N, et al. Antitumor effect of GO-PEG-DOX complex on EMT-6 mouse breast cancer cells[J]. Cancer Biother Radiopharm, 2018, 33(4): 125-130. |
| [7] |
AL-AMILI M, JIN Z, WANG Z M, et al. Self-assembled micelles of amphiphilic PEGylated drugs for cancer treatment[J]. Curr Drug Targets, 2021, 22(8): 870-881. |
| [8] |
CHEN S, YU S T, DU Z Z, et al. Synthesis of mitochondria-anchored nitroimidazoles with a versatile NIR fluorophore for hypoxic tumor-targeting imaging and chemoradiotherapy[J]. J Med Chem, 2021, 64(6): 3381-3391. |
| [9] |
TAN X, LUO S L, WANG D C, et al. A NIR heptamethine dye with intrinsic cancer targeting, imaging and photosensitizing properties[J]. Biomaterials, 2012, 33(7): 2230-2239. |
| [10] |
PACHARRA S, MCMAHON S, DUFFY P, et al. Cytocompatibility evaluation of a novel series of PEG-functionalized lactide-caprolactone copolymer biomaterials for cardiovascular applications[J]. Front Bioeng Biotechnol, 2020, 8: 991. |
| [11] |
CHEN H, FAN Y J, YU X, et al. Light-gated nano-porous capsules from stereoisomer-directed self-assemblies[J]. ACS Nano, 2021, 15(1): 884-893. |
| [12] |
NGUYEN K, KHACHEMOUNE A. An update on topical photodynamic therapy for clinical dermatologists[J]. J Dermatolog Treat, 2019, 30(8): 732-744. |
| [13] |
MOY L S, FROST D, MOY S. Photodynamic therapy for photodamage, actinic keratosis, and acne in the cosmetic practice[J]. Facial Plast Surg Clin North Am, 2020, 28(1): 135-148. |
| [14] |
宋慈珍, 宋弋洋. 光动力疗法联合手术治疗皮肤基底细胞癌的临床疗效[J]. 浙江创伤外科, 2021, 26(6): 1066-1067. SONG C Z, SONG Y Y. The clinical effect of photodynamic therapy combined with surgery in the treatment of skin basal cell carcinoma[J]. Zhejiang J Trauma Surg, 2021, 26(6): 1066-1067. |
| [15] |
熊超亮, 吴裕文, 钟谷平, 等. 光动力疗法治疗晚期消化道肿瘤的临床研究[J]. 中国医学创新, 2019, 16(33): 1-5. XIONG C L, WU Y W, ZHONG G P, et al. Clinical study on photodynamic therapy in the treatment of advanced gastrointestinal cancer[J]. Med Innov China, 2019, 16(33): 1-5. |
| [16] |
OSUCHOWSKI M, BARTUSIK-AEBISHER D, OSUCHOWSKI F, et al. Photodynamic therapy for prostate cancer: a narrative review[J]. Photodiagnosis Photodyn Ther, 2021, 33: 102158. |
| [17] |
来嘉伟, 周建成, 尹健, 等. BT-ESD联合光动力治疗高危膀胱癌1例[J]. 现代肿瘤医学, 2021, 29(23): 4218-4220. LAI J W, ZHOU J C, YIN J, et al. The combination of BT-ESD and photodynamic therapy treats high-risk bladder cancer: a case[J]. J Mod Oncol, 2021, 29(23): 4218-4220. |
| [18] |
DONOHOE C, SENGE M O, ARNAUT L G, et al. Cell death in photodynamic therapy: from oxidative stress to anti-tumor immunity[J]. Biochim Biophys Acta Rev Cancer, 2019, 1872(2): 188308. |
| [19] |
HAMBLIN M R, ABRAHAMSE H. Factors affecting photodynamic therapy and anti-tumor immune response[J]. Anticancer Agents Med Chem, 2021, 21(2): 123-136. |
| [20] |
TSUJIMOTO A, UEHARA H, YOSHIDA H, et al. Different hydration states and passive tumor targeting ability of polyethylene glycol-modified dendrimers with high and low PEG density[J]. Mater Sci Eng C Mater Biol Appl, 2021, 126: 112159. |
| [21] |
ELSEWEDY H S, DHUBIAB B, MAHDY M A, et al. Development, optimization, and evaluation of PEGylated brucine-loaded PLGA nanoparticles[J]. Drug Deliv, 2020, 27(1): 1134-1146. |
| [22] |
VASAN K, WERNER M, CHANDEL N S. Mitochondrial metabolism as a target for cancer therapy[J]. Cell Metab, 2020, 32(3): 341-352. |
| [23] |
KALYANARAMAN B, CHENG G, HARDY M, et al. A review of the basics of mitochondrial bioenergetics, metabolism, and related signaling pathways in cancer cells: therapeutic targeting of tumor mitochondria with lipophilic cationic compounds[J]. Redox Biol, 2018, 14: 316-327. |
| [24] |
WANG R, LI X S, YOON J. Organelle-targeted photosensitizers for precision photodynamic therapy[J]. ACS Appl Mater Interfaces, 2021, 13(17): 19543-19571. |
| [25] |
WU C H, WANG L H, TIAN Y, et al. "Triple-punch" anticancer strategy mediated by near-infrared photosensitizer/CpG oligonucleotides dual-dressed and mitochondria-targeted nanographene[J]. ACS Appl Mater Interfaces, 2018, 10(8): 6942-6955. |
| [26] |
ZHENG Z, ZHANG T F, LIU H X, et al. Bright near-infrared aggregation-induced emission luminogens with strong two-photon absorption, excellent organelle specificity, and efficient photodynamic therapy potential[J]. ACS Nano, 2018, 12(8): 8145-8159. |
| [27] |
PUCELIK B, SUŁEK A, BARZOWSKA A, et al. Recent advances in strategies for overcoming hypoxia in photodynamic therapy of cancer[J]. Cancer Lett, 2020, 492: 116-135. |
| [28] |
TAKAHASHI J, MISAWA M, IWAHASHI H. Transcriptome analysis of porphyrin-accumulated and X-ray-irradiated cell cultures under limited proliferation and non-lethal conditions[J]. Microarrays(Basel), 2015, 4(1): 25-40. |
| [29] |
GHOODARZI R, CHANGIZI V, MONTAZERABADI A R, et al. Assessing of integration of ionizing radiation with Radachlorin-PDT on MCF-7 breast cancer cell treatment[J]. Lasers Med Sci, 2016, 31(2): 213-219. |
| [30] |
QIAN C G, YU J C, CHEN Y L, et al. Light-activated hypoxia-responsive nanocarriers for enhanced anticancer therapy[J]. Adv Mater, 2016, 28(17): 3313-3320. |
| [31] |
WANG W L, LIN L, MA X J, et al. Light-induced hypoxia-triggered living nanocarriers for synergistic cancer therapy[J]. ACS Appl Mater Interfaces, 2018, 10(23): 19398-19407. |
| [32] |
BONNET M, HONG C R, WONG W W, et al. Next-generation hypoxic cell radiosensitizers: nitroimidazole alkylsulfonamides[J]. J Med Chem, 2018, 61(3): 1241-1254. |
| [33] |
LU J, ZHANG C, YANG X, et al. Synthesis and preliminary evaluation of a novel 18F-labeled 2-nitroimidazole derivative for hypoxia imaging[J]. Front Oncol, 2021, 10: 572097. |




